Similar presentations:
Комплексные соединения. Лекция № 3
1.
Лекция № 3Комплексные соединения
Преподаватель Струкова Л.В
2.
План:1. Понятие о комплексных соединениях
2. Основные положения координационной теории
3. Реакции комплексообразования.
Виды химической связи в комплексных соединениях.
4. Классификация комплексных соединений
5. Номенклатура комплексных соединений
6. Химические свойства комплексных соединений
3.
1. Понятие о комплексных соединенияхКомплексные соединения - определённые химические соединения,
образованные сочетанием отдельных компонентов и представляющие
собой сложные ионы или молекулы, способные существовать как в
кристаллическом, так и в растворённом состоянии.
Швейцарский химик,
профессор медицинского института в Цюрихе.
Основоположник химии комплексных (координационных)
соединений. Выдвинул и развил (1891-1893г.г.)
координационную теорию строения комплексных соединений.
Лауреат Нобелевской премии, 1913г.
Альфред Вернер (12.XII.1866 – 15.XI.1919)
4.
2. Основные положения координационной теории1. Комплексные
соединения
состоят из внутренней и внешней
сферы.
2. Во внутреннюю сферу входит центральный ионкомплексообразователь, окруженный связанными с ним
лигандами. Внутреннюю сферу обозначают квадратными
скобками.
* Ионами-комплексообразователями чаще всего являются ионы
металлов (преимущественно d – элементов)
5.
Основные положения координационной теории3. Вокруг центрального иона-комплексообразователя находятся
противоположно заряженные ионы или нейтральные молекулы,
которые называются лигандами ( от лат. liqo- связываю) или
аддендами.
Важнейшие лиганды
анионы
I- - иодо
Cl- - хлоро
Br- - бромо
CN- - циано
OH- - гидроксо
NO2- – нитро
SO4 –сульфато
нейтральные молекулы
NH30 – аммин
H2O0 – аква
СО0 – карбонил
NO0 - нитрозил
6.
Основные положения координационной теории4. Число лигандов (аддендов), которые координируются вокруг
центрального иона-комплексообразователя, называется
координационным числом.
* Координационное число зависит от заряда центрального иона, и, как правило, в
2 раза больше него
Координационное
число
Ионы-комплексообразователи
2
Cu+ , Ag+ , Au+
4
Cu2+, Co2+ , Zn2+ , Pb2+ , Pt2+ , Al3+ , Au3+
6
Fe2+ , Fe3+ , Co3+ , Ni2+ , Al3+ , Cr3+ , Pt4+ , Pb4+
7.
Основные положения координационной теории5. Заряд внутренней сферы (комплексного иона) равен
алгебраической сумме зарядов иона-комплексообразователя
и лигандов.
6. Ионы, не вошедшие во внутреннюю сферу, образуют
внешнюю сферу. Заряд внешней сферы численно равен заряду
внутренней сферы, но противоположен по знаку.
+ 3+
-
Na[Al(OH)4]
внешняя сфера
-
внутренняя сфера
(комплексный ион)
Al3+ - ион-комплексообразователь
OH- - лиганды
4
- координационное число
8. 3. Реакции комплексообразования. Виды химической связи в комплексных соединениях
Большое значение имеют реакции образования комплексныхсоединений в водных растворах.
Для их протекания необходимо наличие в растворе соединения,
содержащего атом-комплексообразователь, и ионов или молекул,
которые могут выступать в качестве лигандов.
Al(OH)3 + NaOH = Na[Al(OН)4]
СuSO4 + 4NН3 = [Сu(NНЗ)4]SO4
FeSО4 +6KCN = K4[Fe(CN)6] + K2SО4
9.
С точки зрения современных представлений о строении атомаобразование комплексного иона можно объяснить наличием у ионов
комплексообразователя свободных электронных ячеек
на p- , d-подуровне (редко s-)
Рассмотрим на примере хлорида гексааммин кобальта (III) [Co(NH3)6]Cl3
Co3+
Для образования прочных связей внутри комплексного соединения
энергетически выгодно освободить две орбитали спариванием электронов.
10.
Молекула аммиака имеет свободную неподеленную электронную пару:NH3
Свободные электронные ячейки Co3+ являются вакансиями
для неподеленной электронной пары азота в молекуле аммиака
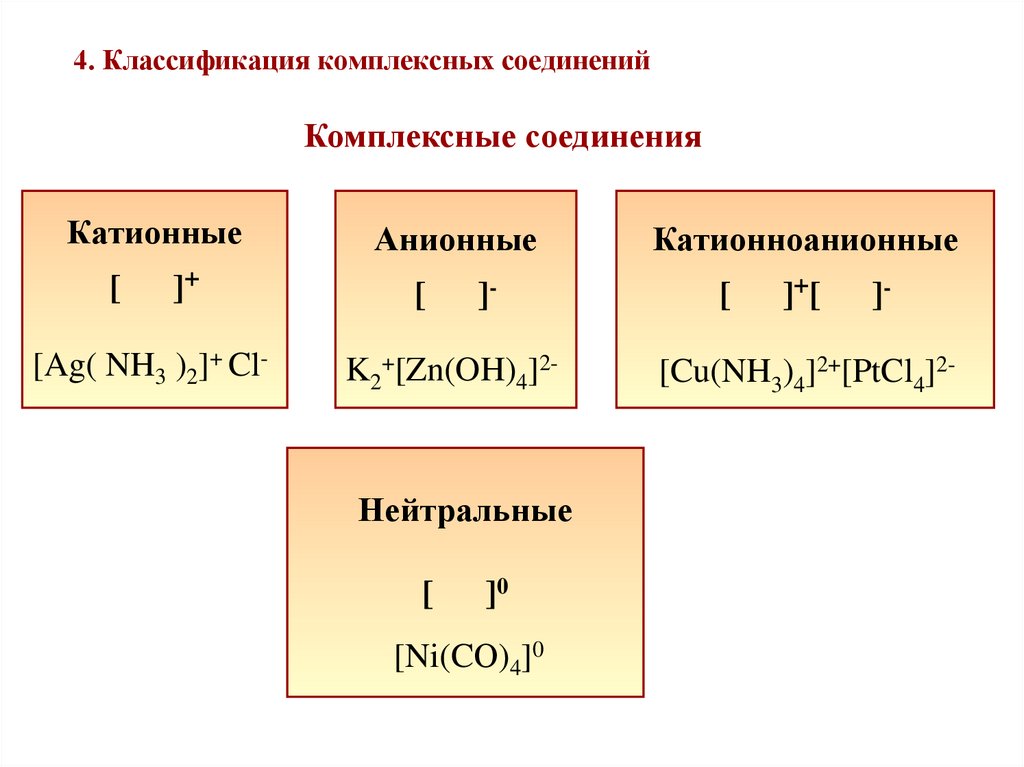
11. 4. Классификация комплексных соединений
Комплексные соединенияКатионные
[
]+
[Ag( NH3 )2]+ Cl-
Анионные
[
]-
K2+[Zn(OH)4]2-
Нейтральные
[
]0
[Ni(CО)4]0
Катионноанионные
[
] +[
]-
[Cu(NH3)4]2+[PtCl4]2-
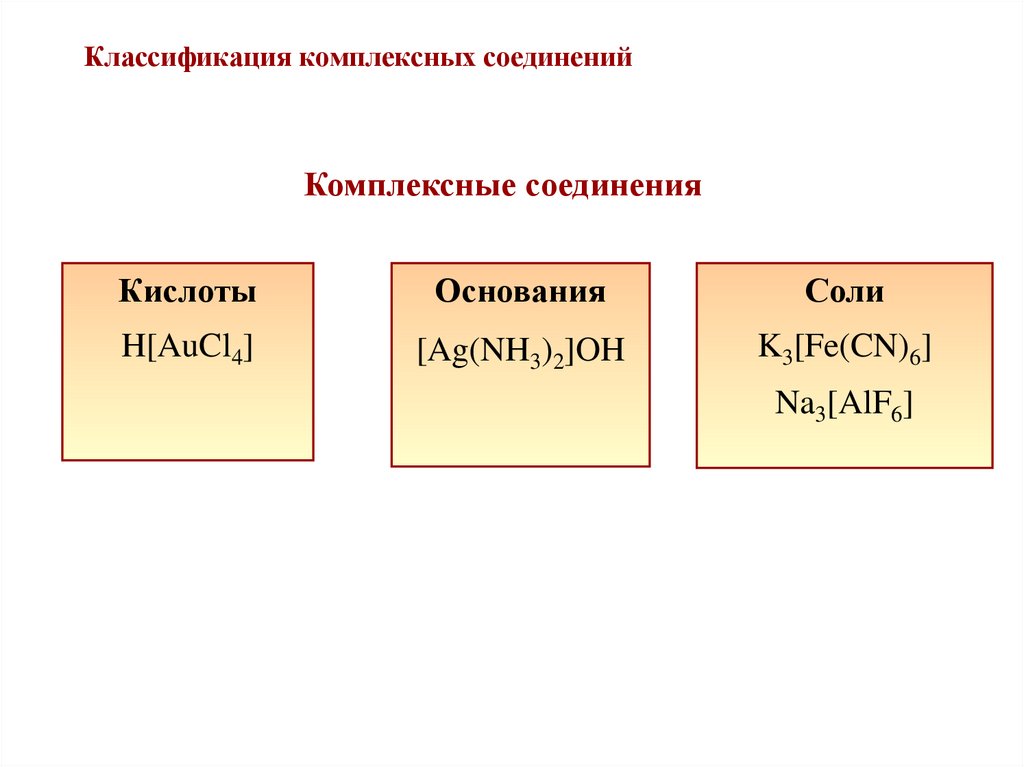
12. Классификация комплексных соединений
Комплексные соединенияКислоты
Основания
Соли
H[AuCl4]
[Ag(NH3)2]OH
K3[Fe(CN)6]
Na3[AlF6]
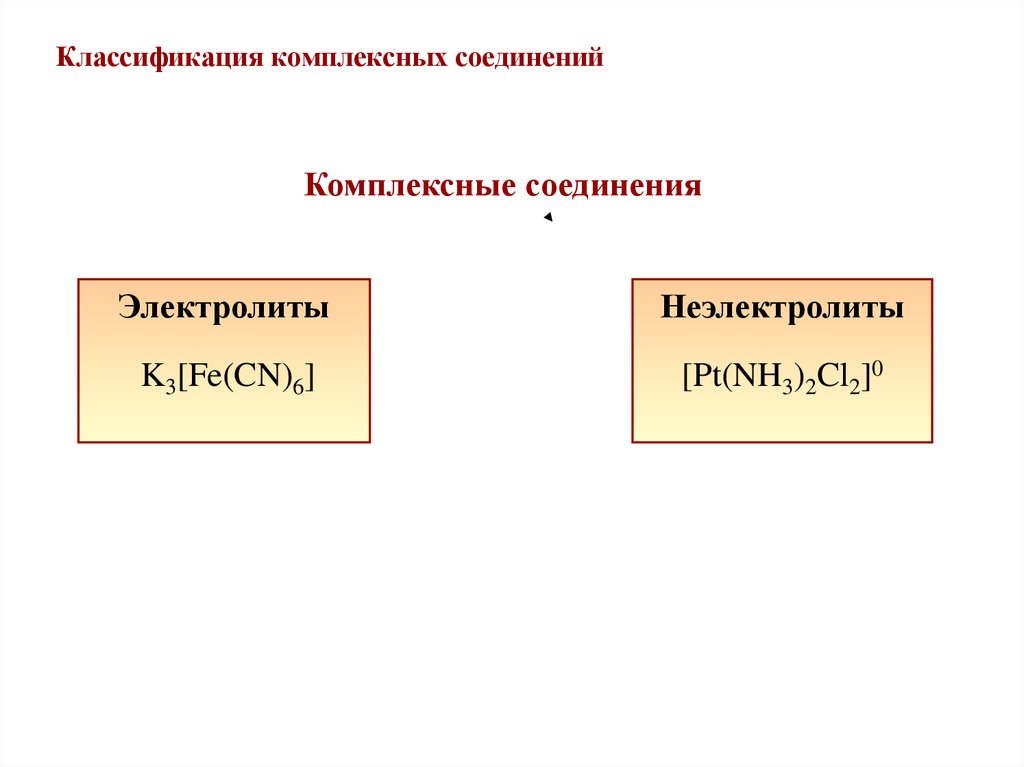
13. Классификация комплексных соединений
Комплексные соединенияЭлектролиты
Неэлектролиты
K3[Fe(CN)6]
[Pt(NH3)2Cl2]0
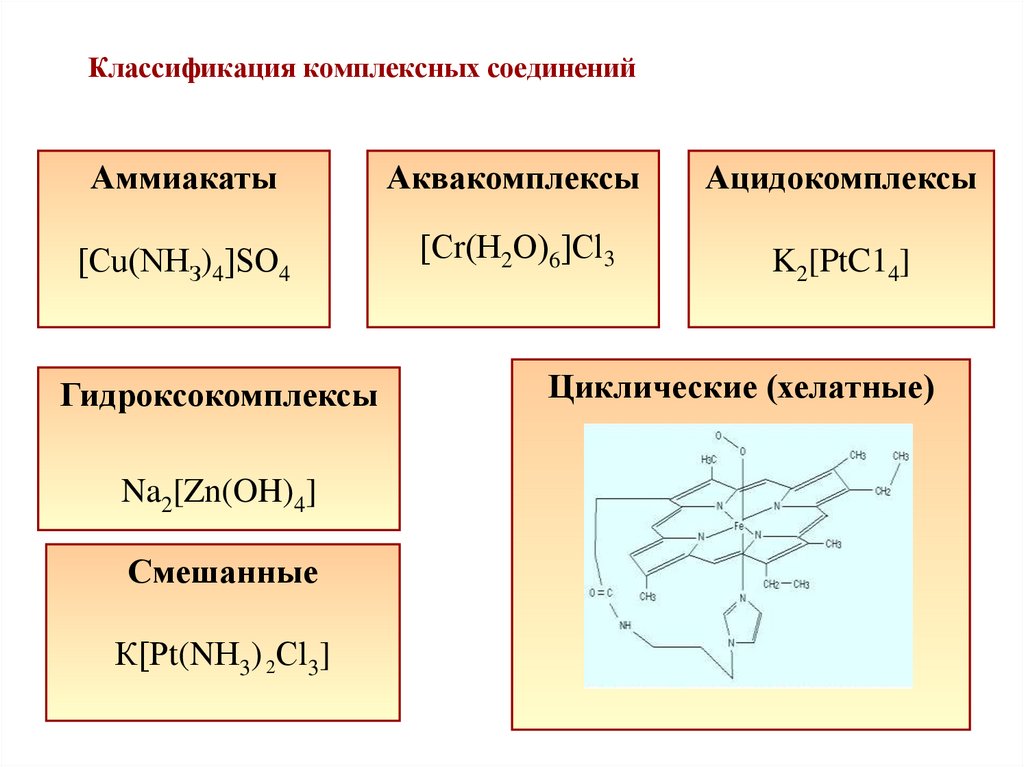
14. Классификация комплексных соединений
АммиакатыАквакомплексы
Ацидокомплексы
[Сu(NНЗ)4]SО4
[Сr(Н2О)6]Сl3
K2[PtC14]
Гидроксокомплексы
Na2[Zn(OH)4]
Смешанные
К[Рt(NН3) 2Сl3]
Циклические (хелатные)
15.
5. Номенклатура комплексных соединенийСоль содержит комплексный катион [ Kat ]+AnНазывают:
1. анион соли (сульфат, фосфат, хлорид и т.д.)
входящие во внутреннюю сферу лиганды:
2.
*
сначала анионы с окончанием на «о» ,
затем лиганды, представляющие собой нейтральные молекулы.
Если одинаковых лигандов во внутренней сфере больше одного, то их количество
указывают греческими числительными (2 - ди, 3 – три, 4 – тетра, 5 - пента, 6 - гекса и т.
д.)
3. центральный ион – комплексообразователь в русской транскрипции в
родительном падеже.
*
Если центральный атом имеет переменную валентность, её указывают римской цифрой в
скобках после названия комплексообразователя.
16.
Номенклатура комплексных соединений[Ag+(NH3)2]Cl
3+
[Co(NH3)40 Cl2-]+Cl-
х + 0 +(-2) = +1
х = +3
хлорид диаммин серебра (I)
хлорид дихлоротетрааммин кобальта (III)
17.
Номенклатура комплексных соединенийСоль содержит комплексный анион Kat +[An]-
Называют
1. входящие во внутреннюю сферу
сначала анионы с окончанием на «о» ,
затем лиганды, представляющие собой нейтральные молекулы
* Если одинаковых лигандов во внутренней сфере больше одного, то их количество
указывают греческими числительными (2 - ди, 3 – три, 4 – тетра, 5- пента, 6- гекса и т. д.)
2. центральный ион – комплексообразователь в латинской транскрипции с
прибавлением суффикса – «ат»
Fe –феррат,
Hg – меркурат,
Cu – купрат,
Co – кобальтат,
Ag – аргентат,
Zn – цинкат,
Cr – хромат и т.д.
* Если центральный атом имеет переменную валентность, её указывают римской цифрой в
скобках после названия комплексообразователя.
18.
Номенклатура комплексных соединений3. катион внешней сферы русским названием в родительном
падеже
K4[Fe2+(CN)6]
Na[Al(OH)4 ]
гексацианоферрат (II) калия
тетрагидроксоалюминат натрия
19.
6. Химические свойства комплексных соединений1.
Диссоциация
[Cu(NH3)4]SO4 ↔ [Cu(NH3)4]2+ + SO42Сульфат тетрааммин меди (II)
2. Реакции по внешней сфере
3+
+
4-
3+
4-
4FeCl3 + 3 K4[Fe(CN)6] →12KCl + Fe4 [Fe(CN)6] 3 ↓
гексацианоферрат (II) железа (III)
темно-синий осадок, «берлинская лазурь»
2+
2-
-
2+ -
[Cu(NH3)4]SO4 + BaCl2→ [Cu(NH3)4]Cl 2 + BaSO4↓
хлорид тетрааммин меди (II)
20.
Химические свойства комплексных соединений3. Реакции с участием лигандов
[Cu(NH3)4]SO4 + 4HCl→ 4NH4Cl + CuSO4
4. Реакции по центральному иону
▪ обменные
[Ag(NH3)2]Cl + KI → AgI↓ + KCl + 2NH3
▪ окислительно-восстановительные
2[Ag(NH3)2]OH + R – COH → 2Ag↓ + RCOONH4 + H2O + 3NH3
21.
Контрольные вопросы для закрепления1. Назвать комплексные соли и рассмотреть их строение:
K2[Cu(CN)4]
[Cо(NН3)5SO4]NO3
[Ni(NН3)6]Cl2
2. Закончите реакцию комплексообразования, назовите полученное
комплексное соединение:
AgCl + NH3 →
к.ч = 2
22.
Рекомендуемая литератураОбязательная
Пустовалова Л.М., Никанорова И.Е.Неорганическая химия.
Ростов-на-Дону. Феникс. 2005. –352с., гл.1.4. с.98-104.
Дополнительная
Ахметов Н.С. Общая и неорганическая химия. М.:Высшая школа, 2009.- 368с.
Глинка Н.Л. Общая химия. КноРус, 2009.-436 с.
Ерохин Ю.М. Химия. Учебник для студ. Сред проф.образ.-М.: Академия, 2006.- 384с.


















 chemistry
chemistry








