Similar presentations:
Химическая кинетика. Основные понятия. Основы формальной кинетики
1.
ХИМИЧЕСКАЯ КИНЕТИКАОСНОВНЫЕ ПОНЯТИЯ
ОСНОВЫ ФОРМАЛЬНОЙ КИНЕТИКИ
Кинетика реакций :
нулевого порядка
2.
Рассмотрим реакциюнулевого порядка.
Пусть при неизменной температуре (T =
const) протекает реакция вида
A B
(6)
В соответствии с законом действующих масс
для скорости химической реакции нулевого
порядка (n = 0) получим следующее
дифференциальное уравнение
dC
0
υ
k C k
dt
(7)
3.
Для определения кинетических параметров уравнение(7) необходимо проинтегрировать.
Перед интегрированием разделим переменные
dC k dt
(8)
и возьмём определённый интеграл от правой части выражения (8) в
пределах от t0 до t, а от левой - от C0 до С:
C
t
dC k dt
C0
t0
(9)
4.
Из выражения (9) после интегрированияполучим
-(С С0) = k (t t0) ,
раскрыв скобки, учитывая, что t0 = 0, получим кинетическое уравнение
для реакции нулевого порядка в интегральной форме
С = С0 k t
Полученное выражение позволяет определить константу скорости
химической реакции нулевого порядка
k = (С0 С) / t
(10)
(11)
и период полупревращения t1/2, который равен времени t, за которое
исходная концентрация С0 уменьшится в 2 раза, т.е. при t = t1/2
текущее значение концентрации C = С0 /2.
5.
Тогда согласно (10)С0 /2 = С0 k · t1/2
откуда
t1/2 = С0 /(2 k)
(12)
6.
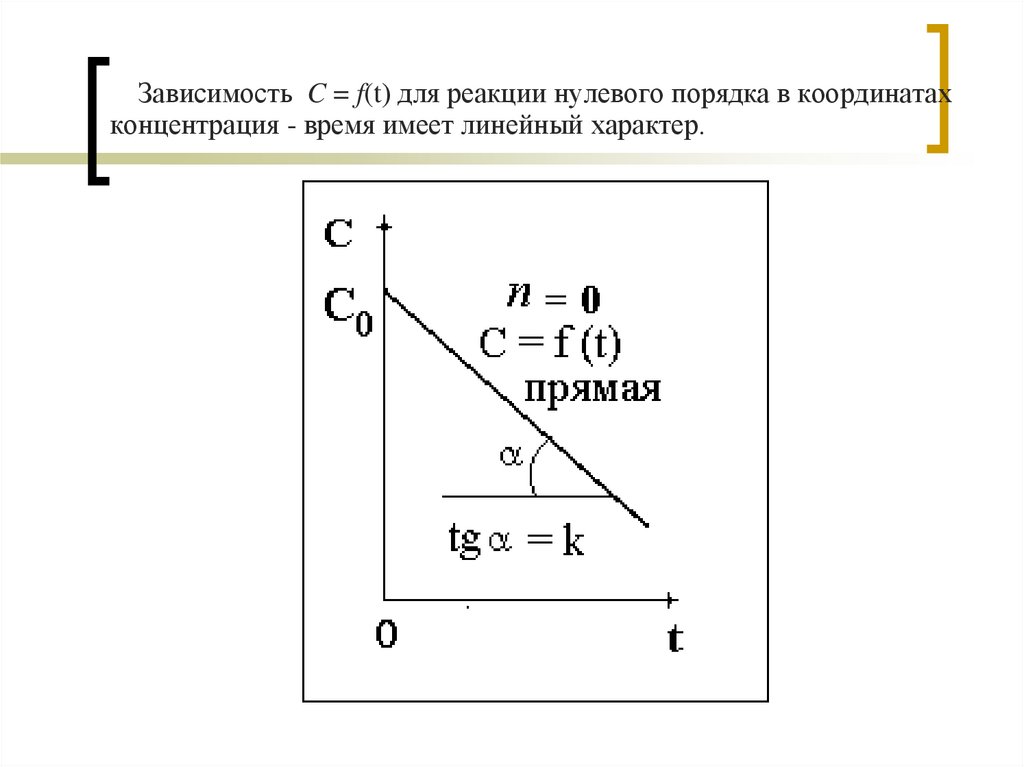
Зависимость C = f(t) для реакции нулевого порядка в координатахконцентрация - время имеет линейный характер.





 chemistry
chemistry








