Similar presentations:
Аминокислоты. Понятие аминокислот
1. Аминокислоты
ФГБОУ ВО «Вятский государственный университет»Институт химии и экологии
Кафедра фундаментальной химии и методики обучения химии
Аминокислоты
Подготовила: Вершинина Алина ХМб-45
Преподаватель: Зайцев М. А.
Киров
2020
1
2.
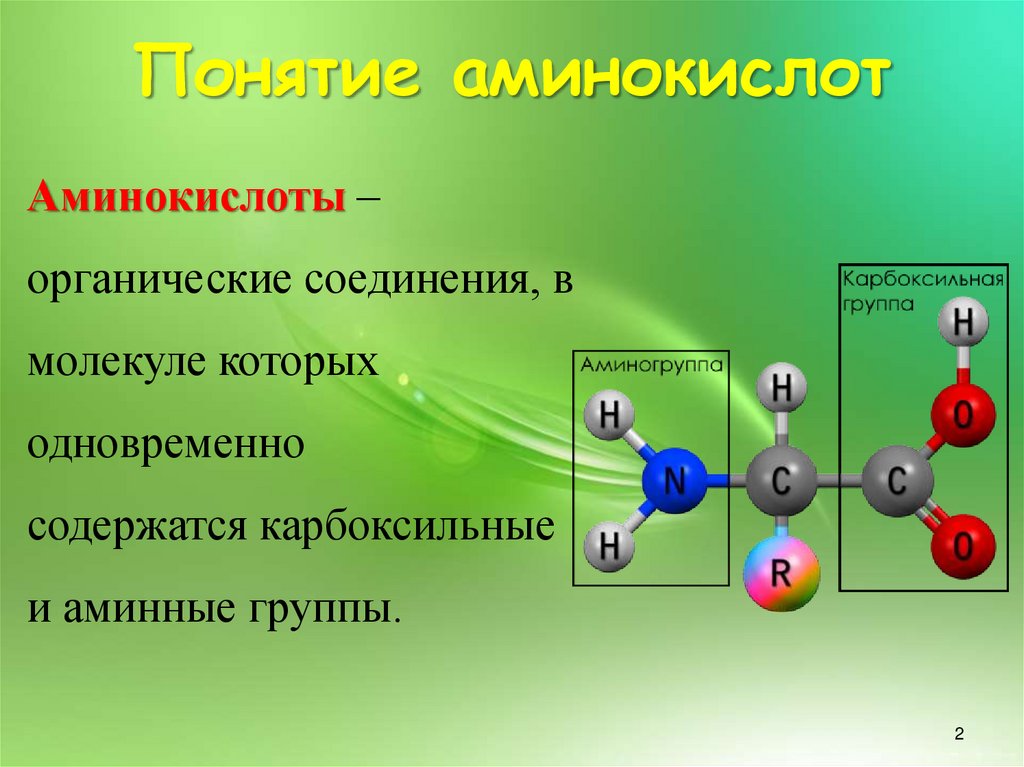
Понятие аминокислотАминокислоты –
органические соединения, в
молекуле которых
одновременно
содержатся карбоксильные
и аминные группы.
2
3.
Понятие аминокислотОсновные химические элементы
аминокислот —
это углерод (C), водород
(H), кислород (O), и азот (N), хотя
другие элементы также встречаются в
ОБЩАЯ ФОРМУЛА
R
CH
COOH
NH2
радикале определенных аминокислот.
Известны около 500 встречающихся в
природе аминокислот.
3
4. Классификация аминокислот
Для аминокислот существует несколько классификаций взависимости от того, какой признак положен в основу.
По химической природе углеводородного радикала:
а) алифатические: глицин, аланин, валин, лейцин,
изолейцин
содержащие ОН- группу: серин, треонин
содержащие СООН – группу: аспарагиновая,
глутаминовая
содержащие NH2CO – группу: аспарагин, глутамин
содержащие NH2 – группу: лизин, аргинин
серосодержащие: цистеин, цистин, метионин
б) ароматические: фенилаланин, тирозин
в) гетероциклические: триптофан, гистидин
г) иминокислоты: пролин
4
5.
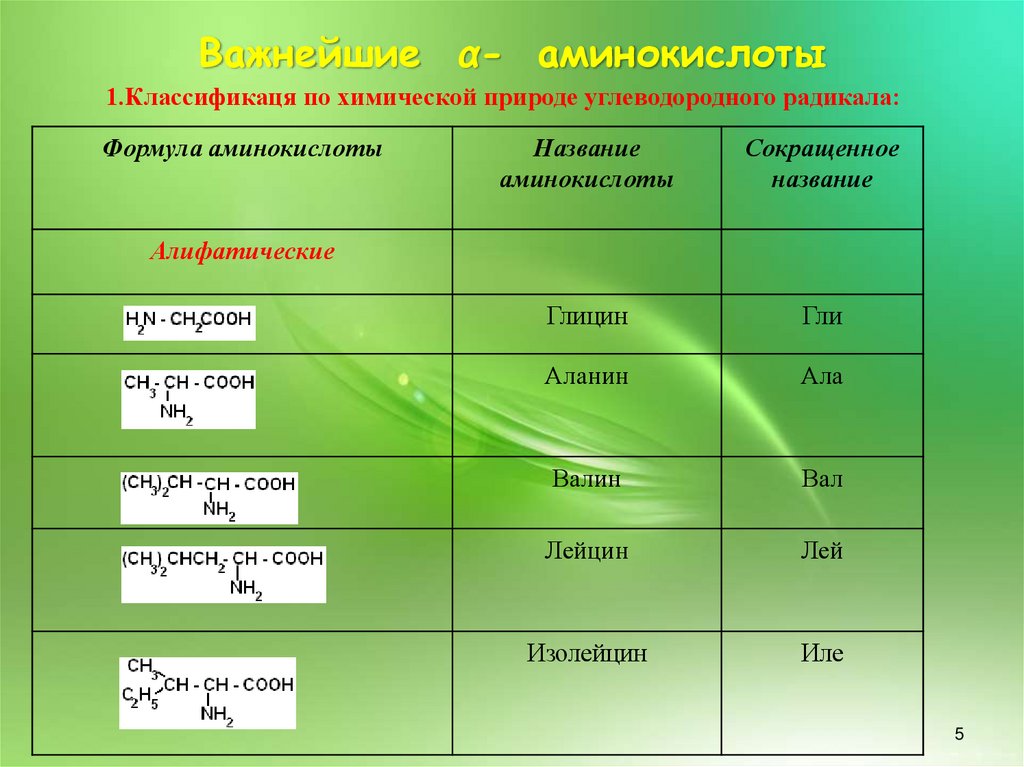
Важнейшие α- аминокислоты1.Классификаця по химической природе углеводородного радикала:
Формула аминокислоты
Название
аминокислоты
Сокращенное
название
Глицин
Гли
Аланин
Ала
Валин
Вал
Лейцин
Лей
Изолейцин
Иле
Алифатические
5
6.
Формула аминокислотыНазвание аминокислоты Сокращенное название
Содержащие ОН группу
Серин
Сер
Треонин2
Тре
Аспарагиновая
Асп
Глутаминовая
Глу
Аспарагин
Асн
Глутамин
Глн
Содержащие СООН
Содержащие СОNН2
6
7.
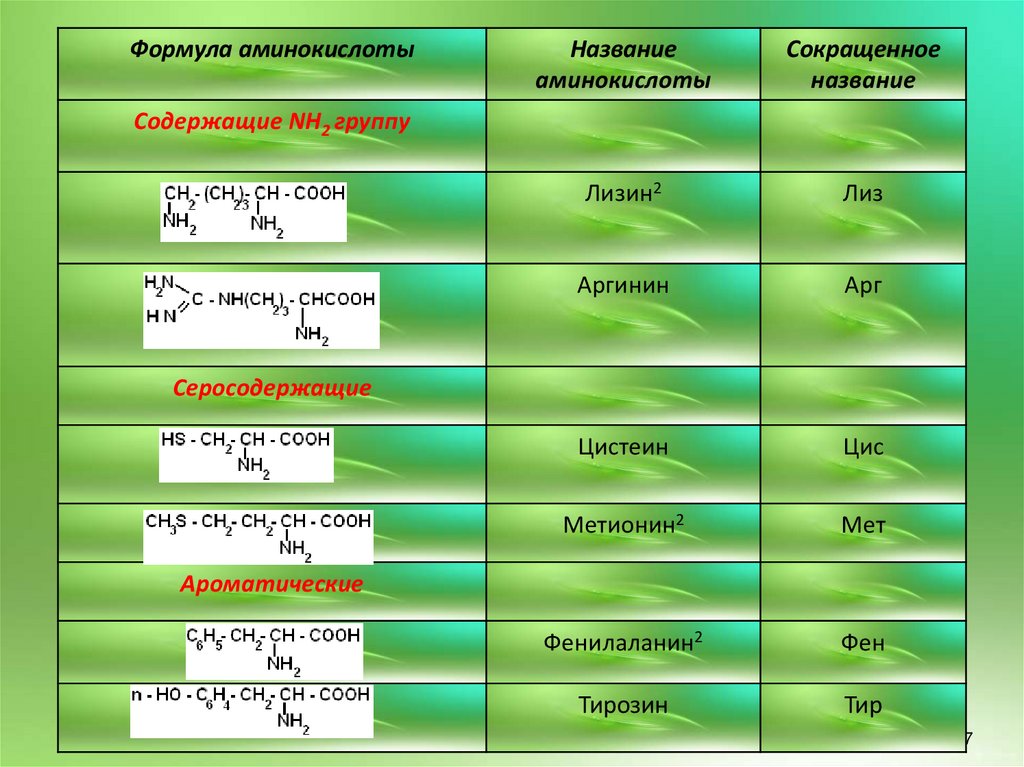
Формула аминокислотыНазвание
аминокислоты
Сокращенное
название
Лизин2
Лиз
Аргинин
Арг
Цистеин
Цис
Метионин2
Мет
Фенилаланин2
Фен
Тирозин
Тир
Содержащие NH2 группу
Серосодержащие
Ароматические
7
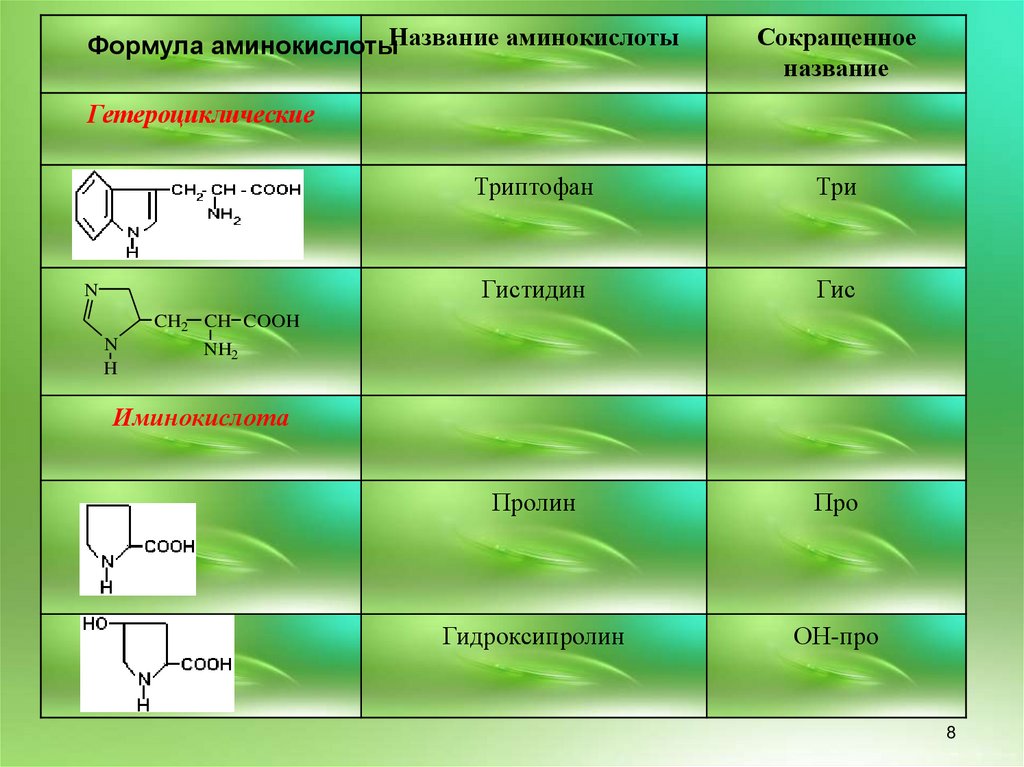
8.
Формула аминокислотыНазвание аминокислотыСокращенное
название
Гетероциклические
N
Триптофан
Три
Гистидин
Гис
Пролин
Про
Гидроксипролин
ОН-про
CH2 CH COOH
N
H
NH2
Иминокислота
8
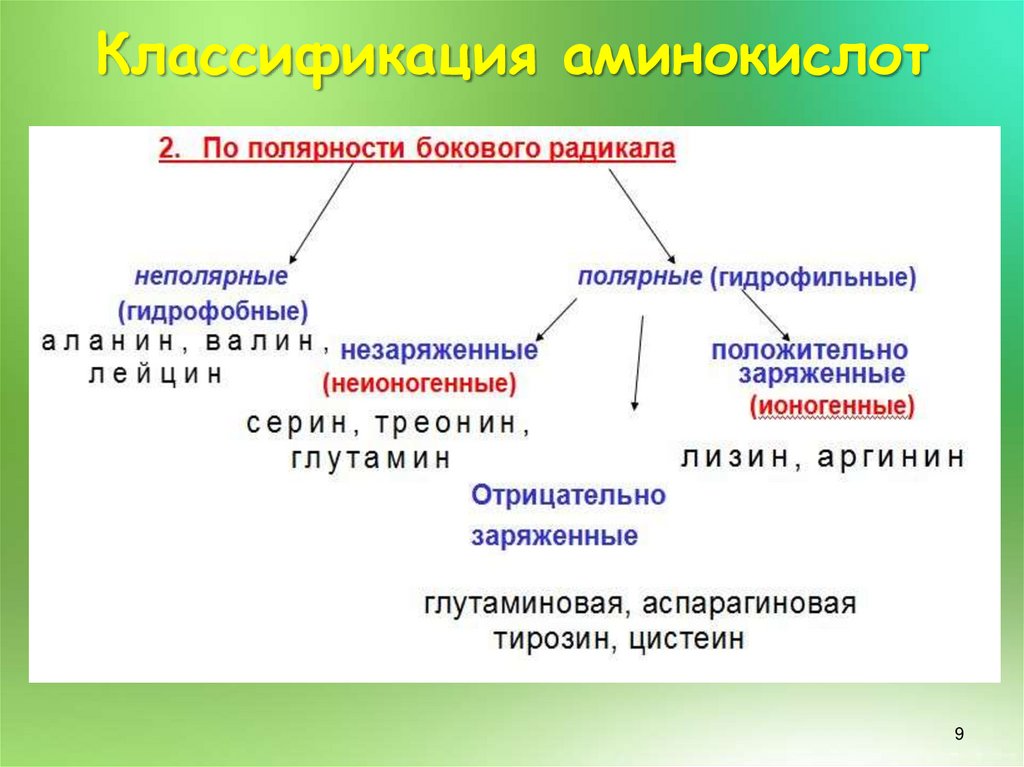
9. Классификация аминокислот
910.
Классификация аминокислот3. По количеству амино - и карбоксильных групп :
1 амино- и 1 карбоксильная группа – нейтральные
1 амино- 2 карбоксильные группы – кислые
2 амино- 1 карбоксильная группа – основные
В водных растворах молекулы аминокислот заряжаются поразному, приобретая положительные или отрицательные
заряды ,в зависимости от состава.
10
11.
ИзомерияДля аминокислот известны два вида изомерии:
структурная и пространственная (оптическая изомерия).
Структурная изомерия
Структурная изомерия связана с особенностями строения
углеродного скелета и взаимным расположением функциональных
групп.
1. Изомерия углеродного скелета:
11
12.
Изомерия2. Изомерия положения аминогруппы:
12
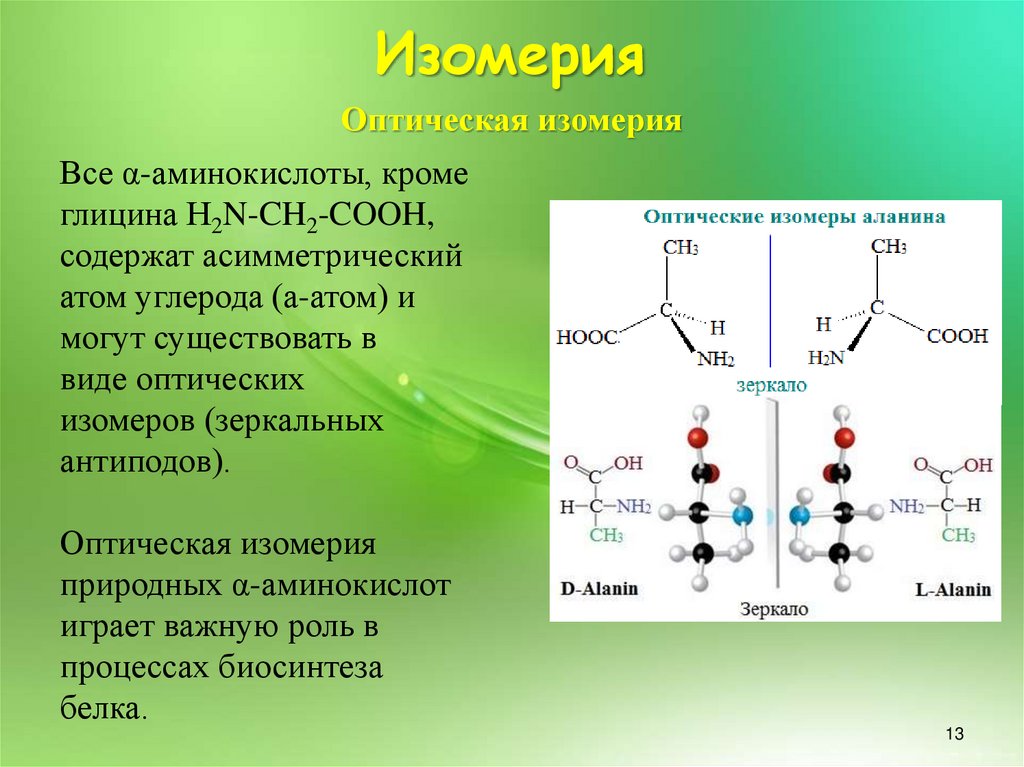
13.
ИзомерияОптическая изомерия
Все α-аминокислоты, кроме
глицина H2N-CH2-COOH,
содержат асимметрический
атом углерода (a-атом) и
могут существовать в
виде оптических
изомеров (зеркальных
антиподов).
Оптическая изомерия
природных α-аминокислот
играет важную роль в
процессах биосинтеза
белка.
13
14. Номенклатура аминокислот
Для названия аминокислот используют три типа номенклатуры–тривиальную, рациональнцю и IUPAC.
• По систематической номенклатуре (IUPAC) названия
аминокислот образуются из названий соответствующих
кислот прибавлением приставки амино и указанием места
расположения аминогруппы по отношению к карбоксильной
группе.
• Нумерация углеродной
цепи начинается с атома
углерода карбоксильной
группы.
14
15. Номенклатура аминокислот
По рациональной номенклатуре к тривиальному названиюкарбоновой кислоты добавляется приставка амино- с
указанием положения аминогруппы буквой греческого
алфавита.
15
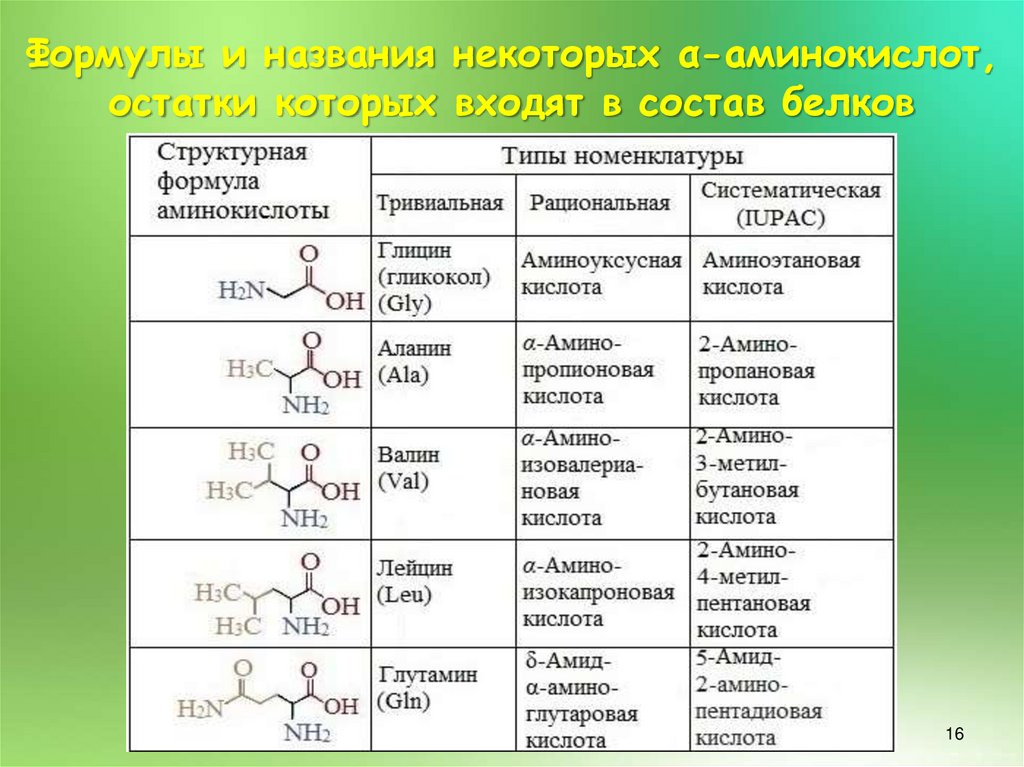
16.
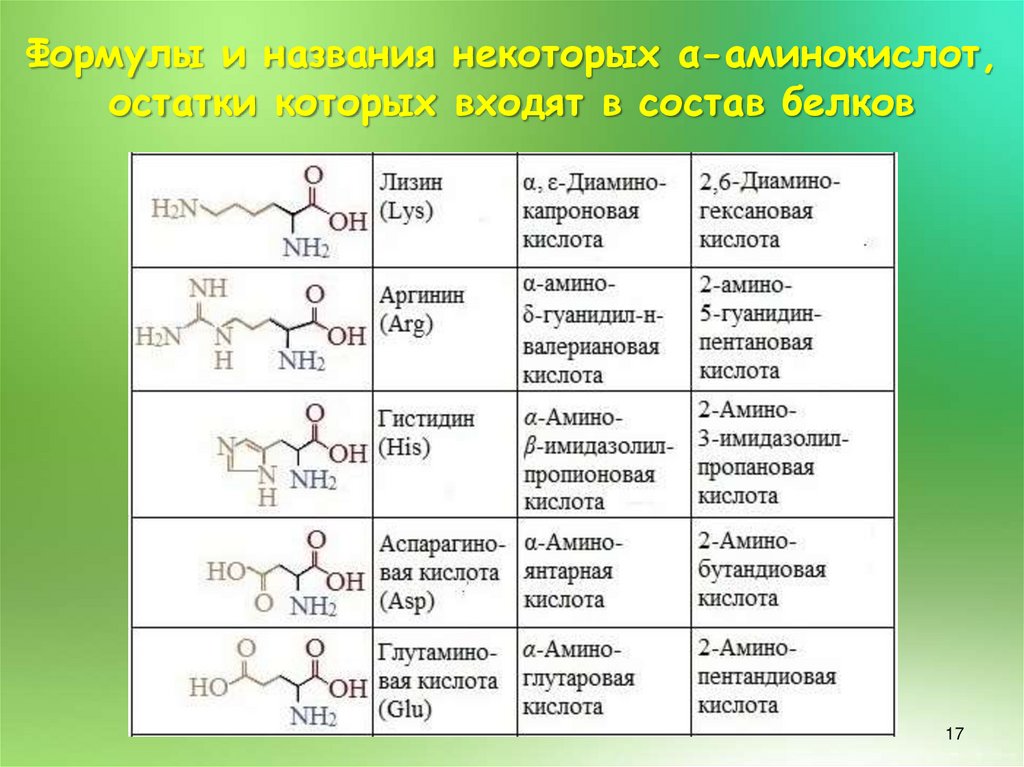
Формулы и названия некоторых α-аминокислот,остатки которых входят в состав белков
16
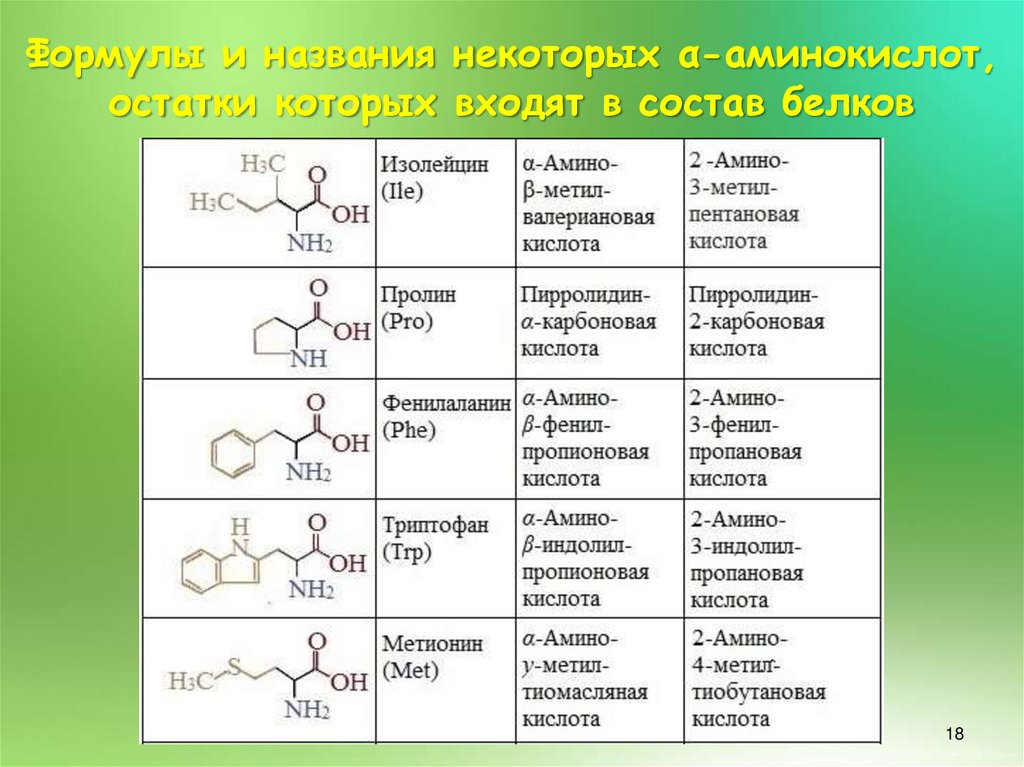
17.
Формулы и названия некоторых α-аминокислот,остатки которых входят в состав белков
17
18.
Формулы и названия некоторых α-аминокислот,остатки которых входят в состав белков
18
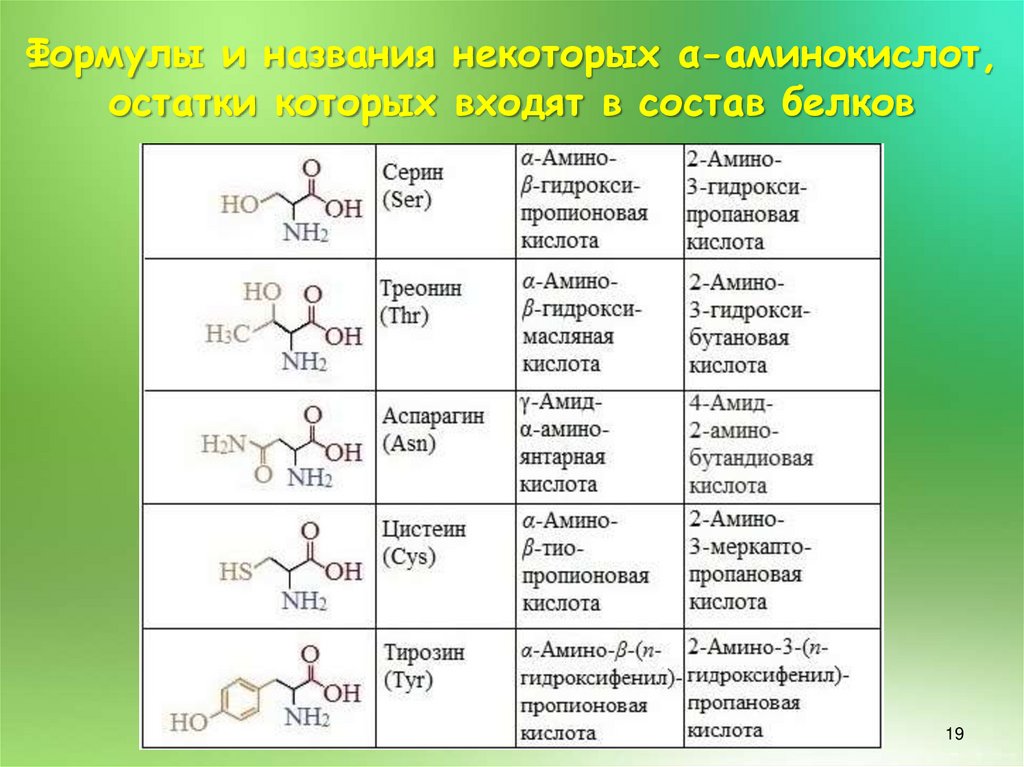
19.
Формулы и названия некоторых α-аминокислот,остатки которых входят в состав белков
19
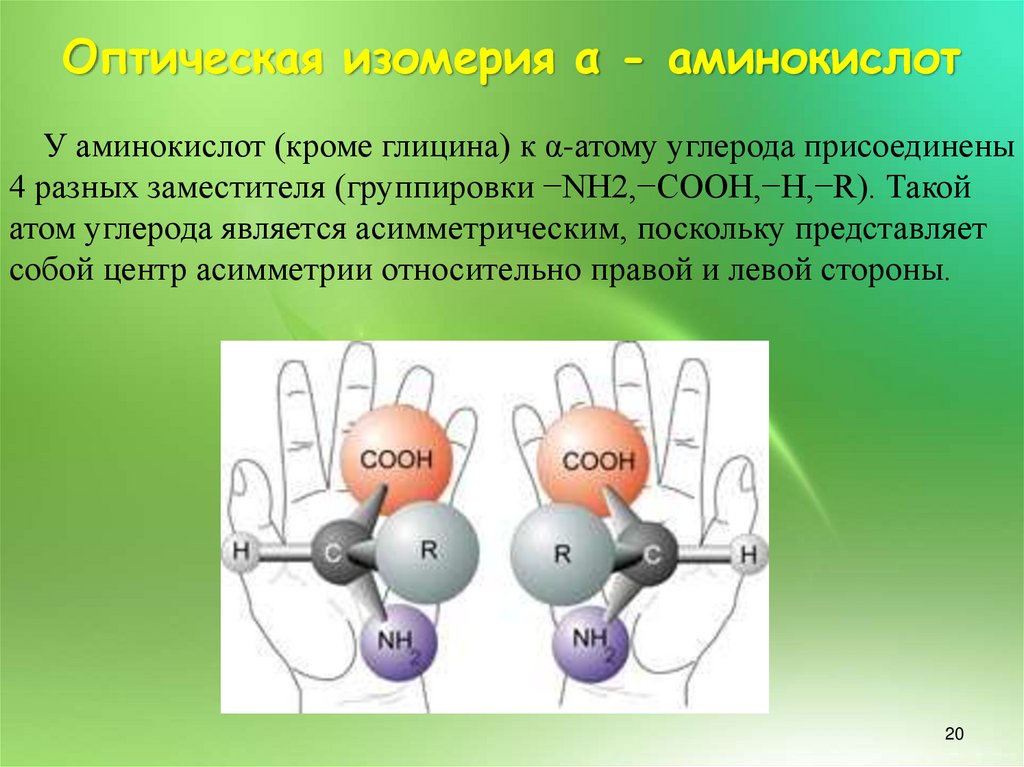
20.
Оптическая изомерия α - аминокислотУ аминокислот (кроме глицина) к α-атому углерода присоединены
4 разных заместителя (группировки −NH2,−COOH,−H,−R). Такой
атом углерода является асимметрическим, поскольку представляет
собой центр асимметрии относительно правой и левой стороны.
20
21.
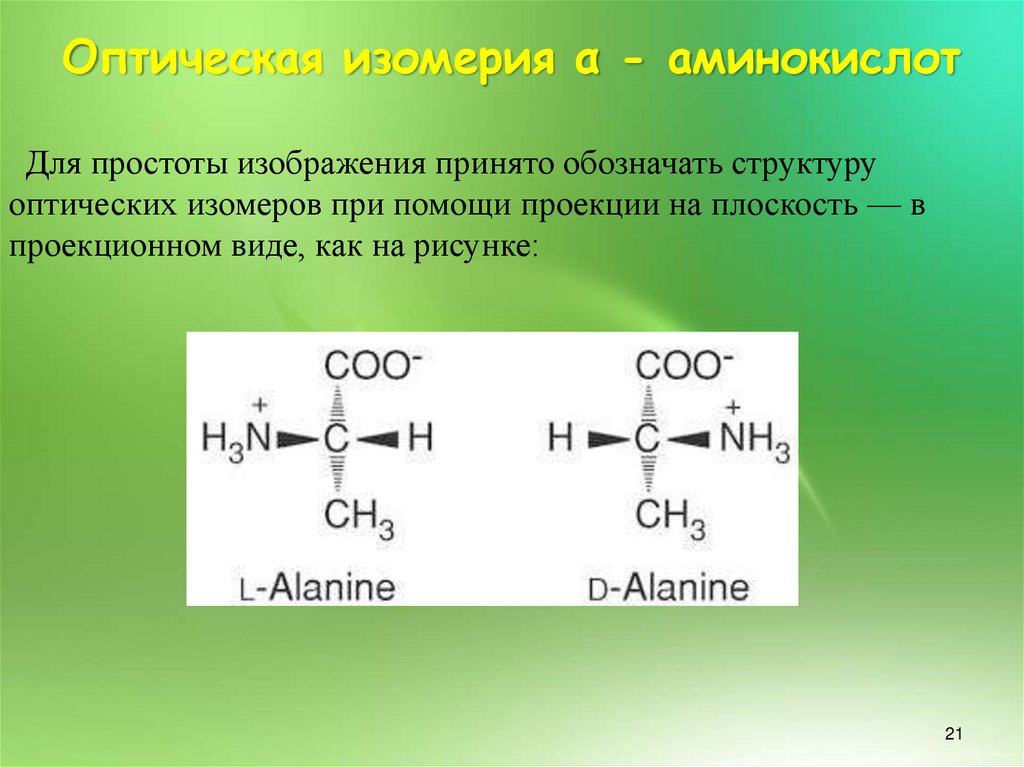
Оптическая изомерия α - аминокислотДля простоты изображения принято обозначать структуру
оптических изомеров при помощи проекции на плоскость — в
проекционном виде, как на рисунке:
21
22.
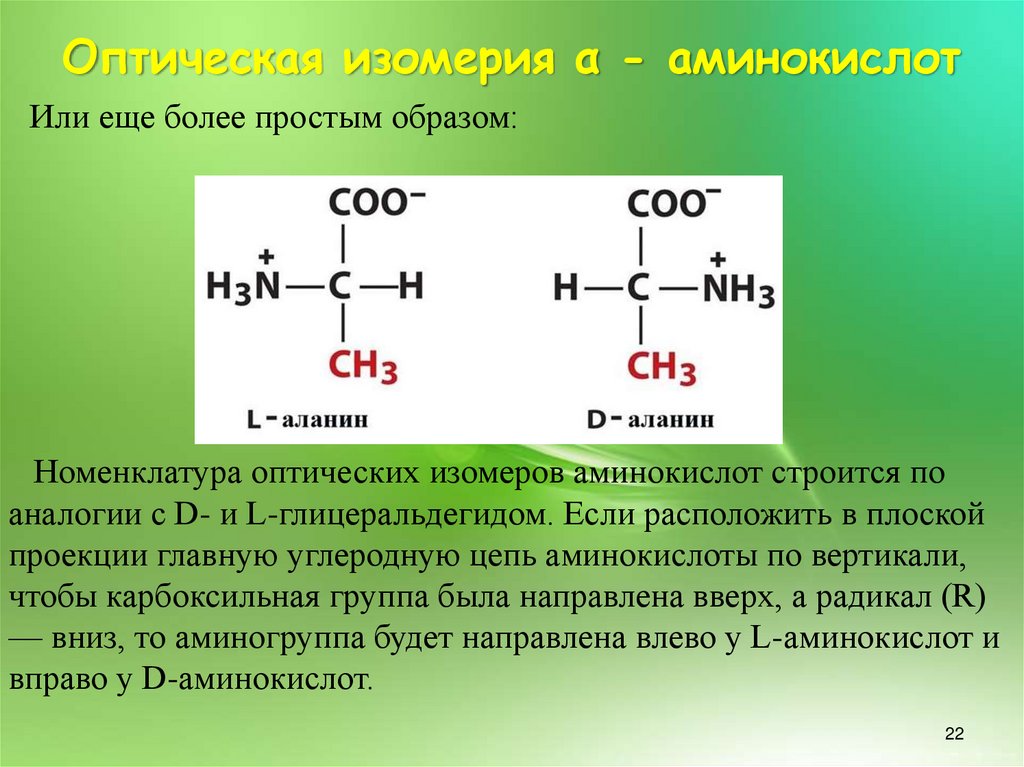
Оптическая изомерия α - аминокислотИли еще более простым образом:
Номенклатура оптических изомеров аминокислот строится по
аналогии с D- и L-глицеральдегидом. Если расположить в плоской
проекции главную углеродную цепь аминокислоты по вертикали,
чтобы карбоксильная группа была направлена вверх, а радикал (R)
— вниз, то аминогруппа будет направлена влево у L-аминокислот и
вправо у D-аминокислот.
22
23. Получение аминокислот
.23
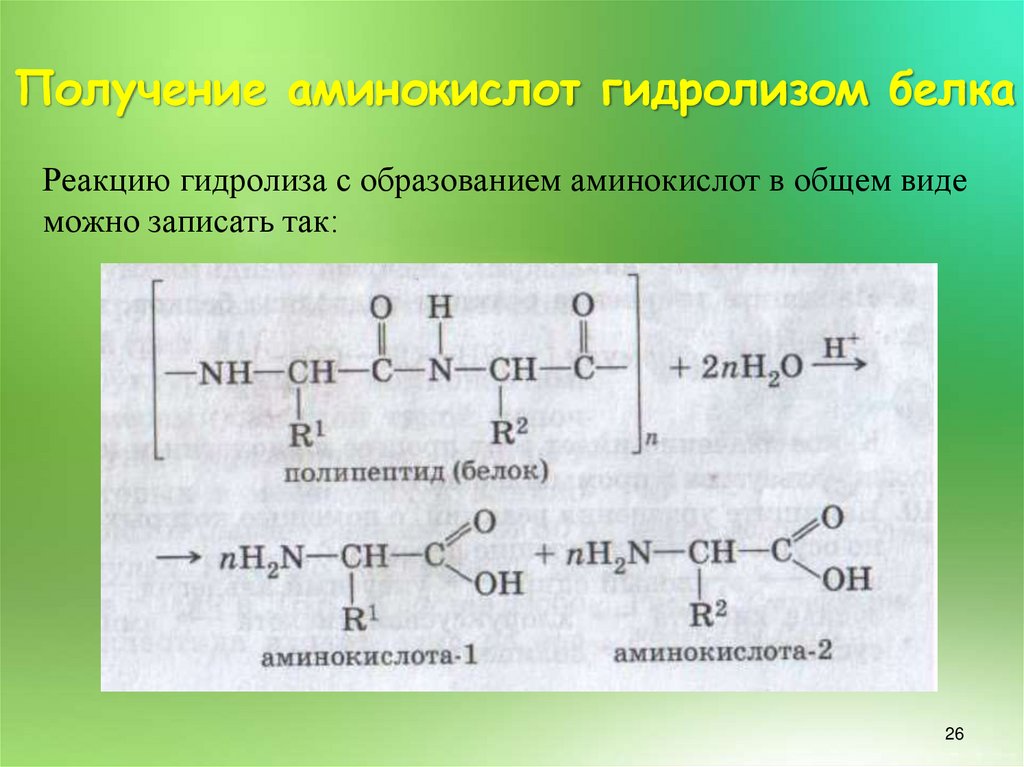
24. Получение аминокислот гидролизом белка
• При гидролизе белоксодержащеесырье (отходы пищевой и
молочной промышленности)
нагревают с растворами кислот или
щелочей при температуре 100 –
105 °С в течение 20 – 48 ч.
• Чаще всего используют 20 %-й
раствор соляной кислоты,
обеспечивающий глубокий
гидролиз белка. Кроме того, для
ускорения реакции гидролиза
белков используют
иммобилизованные
протеолитические ферменты и
ионообменные смолы.
24
25. Получение аминокислот гидролизом белка
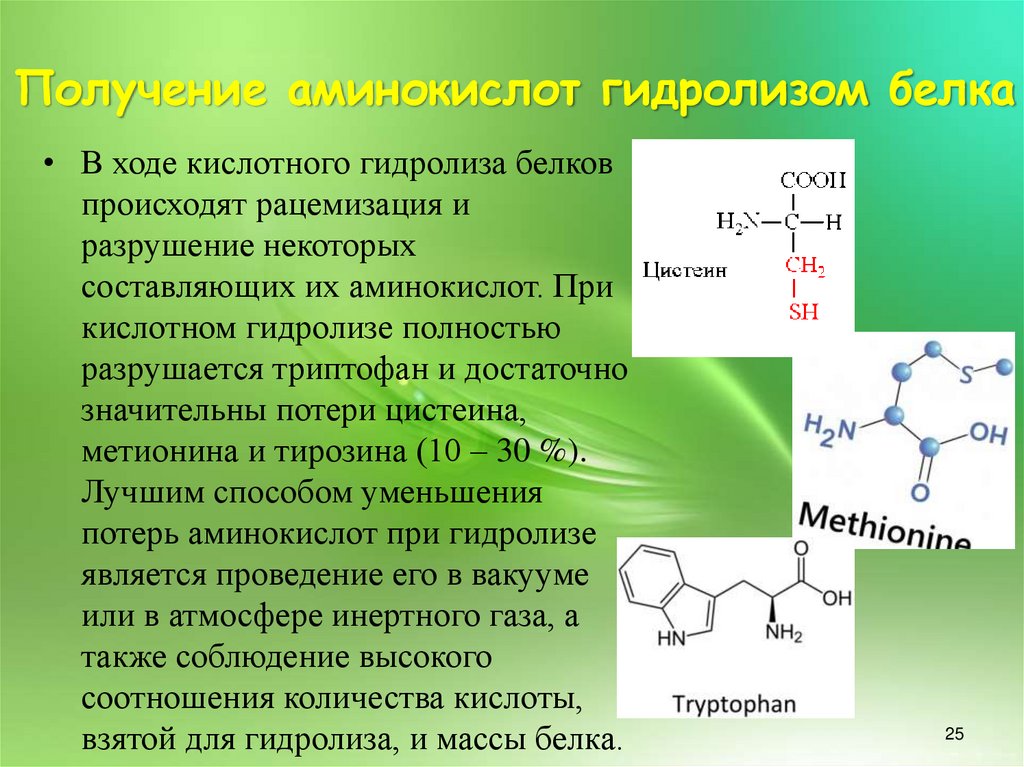
• В ходе кислотного гидролиза белковпроисходят рацемизация и
разрушение некоторых
составляющих их аминокислот. При
кислотном гидролизе полностью
разрушается триптофан и достаточно
значительны потери цистеина,
метионина и тирозина (10 – 30 %).
Лучшим способом уменьшения
потерь аминокислот при гидролизе
является проведение его в вакууме
или в атмосфере инертного газа, а
также соблюдение высокого
соотношения количества кислоты,
взятой для гидролиза, и массы белка.
25
26. Получение аминокислот гидролизом белка
Реакцию гидролиза с образованием аминокислот в общем видеможно записать так:
26
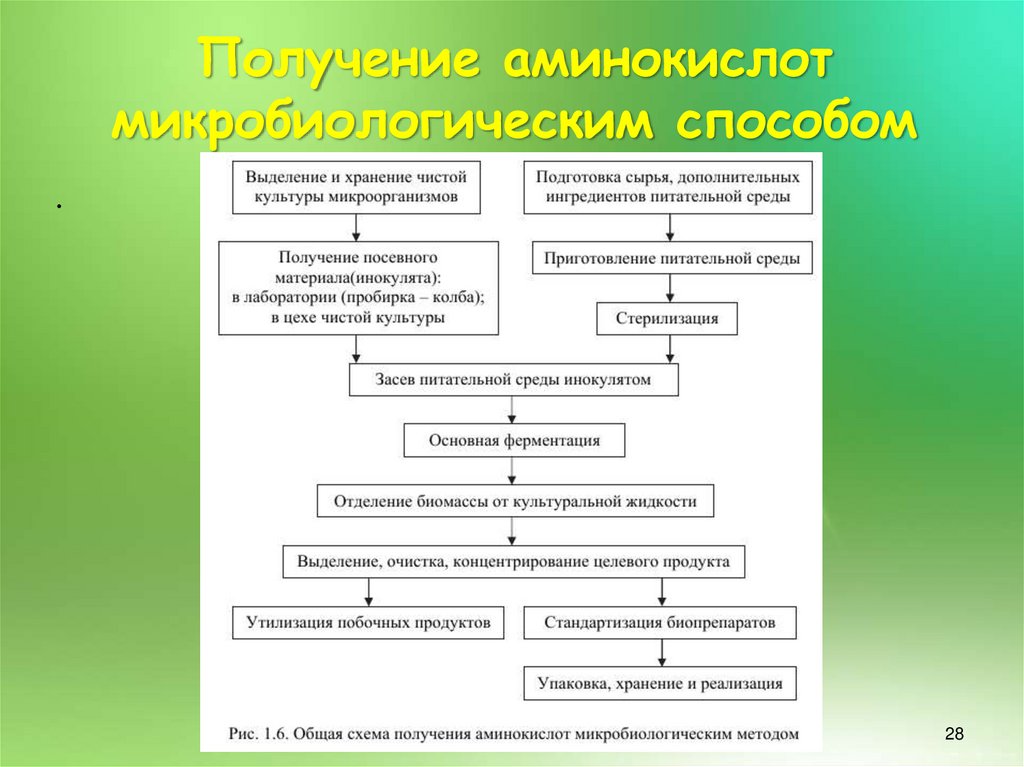
27. Получение аминокислот микробиологическим способом
.Наиболее перспективен и экономически выгоден
микробиологический синтез аминокислот. Более
60 % всех производимых в настоящее время
промышленностью высокоочищенных препаратов
белковых аминокислот получают именно этим
способом, главное преимущество которого в
сравнении с методами химического синтеза состоит
в возможности получения L-аминокислот на основе
возобновляемого сырья (рис. 1.6)
27
28. Получение аминокислот микробиологическим способом
.28
29. Получение аминокислот микробиологическим способом
П. роцесс получения аминокислот химико-ферментативным
методом заключается в химическом синтезе
предшественника аминокислоты и последующей его
трансформации в целевую аминокислоту с использованием
микроорганизмов, лизатов клеток или индивидуальных
ферментов (табл. 1.2).
29
30. Получение аминокислот микробиологическим способом
Процесс получения аминокислотферментационным методом основан на
способности некоторых микроорганизмов
синтезировать L-аминокислоты, а в определенных
условиях – обеспечивать их сверх-синтез.
Основное отличие микробиологической
ферментации от химико-ферментативного метода
заключается в отсутствии стадии химического
синтеза предшественника, а также в использовании
живых клеток микроорганизмов.
30
31. Получение аминокислот: аминирование α-галогенкарбоновых кислот (У. Перкин)
Аминирование α-галогенокарбоновых кислот – первыйсинтетический метод получения аминокислот (У. Перкин, 1858 г.).
При непосредственном аминировании
а-галогенокарбоновых кислот или их эфиров избытком аммиака
(для предупреждения образования вторичных и третичных
аминов) образуются аминокислоты:
31
32. Получение аминокислот: из карбонильных соединений (Штреккер, Н.Д. Зелинский)
Синтез а-аминокислот по Штреккеру сводится к реакциикарбонильного соединения со смесью хлорида аммония
и цианистого натрия. В результате реакции этих неорганических
веществ образуются аммиак и цианистый водород — активные
компоненты процесса.
32
33. Получение аминокислот: из карбонильных соединений (Штреккер, Н.Д. Зелинский)
Реакции присоединения — отщепления с участием аммиакаи карбонильного соединения дают имин, который реагирует
с цианистым водородом, образуя а-аминонитрил. После его
гидролиза получается соответствующая а-аминокислота.
33
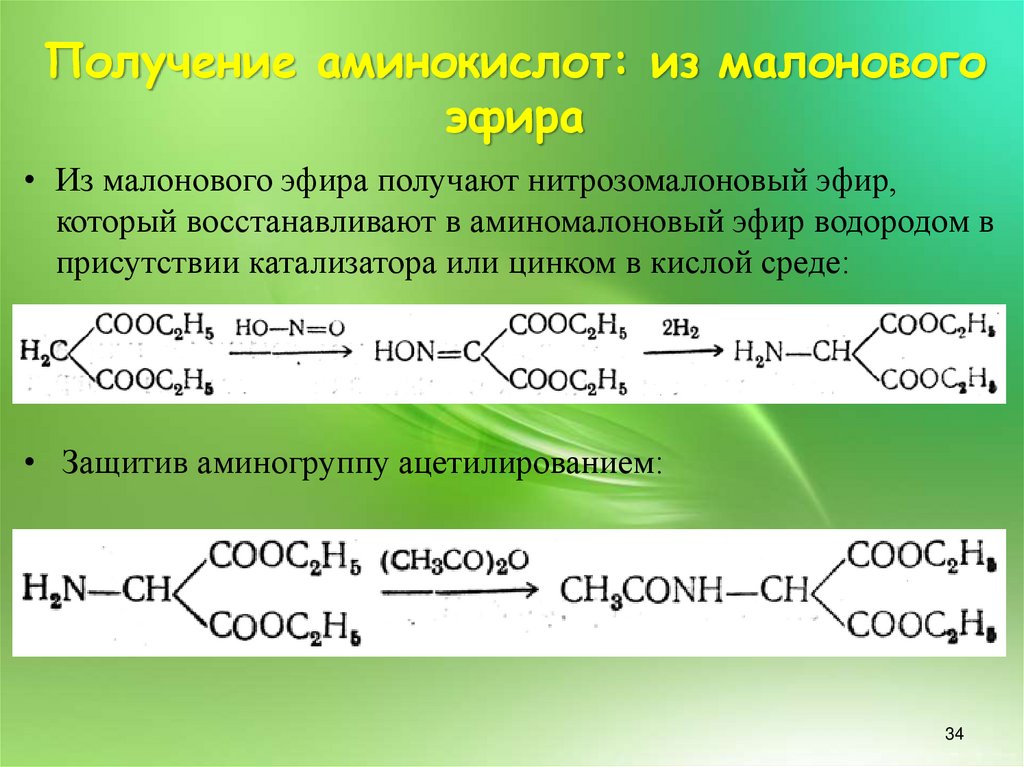
34. Получение аминокислот: из малонового эфира
• Из малонового эфира получают нитрозомалоновый эфир,который восстанавливают в аминомалоновый эфир водородом в
присутствии катализатора или цинком в кислой среде:
• Защитив аминогруппу ацетилированием:
34
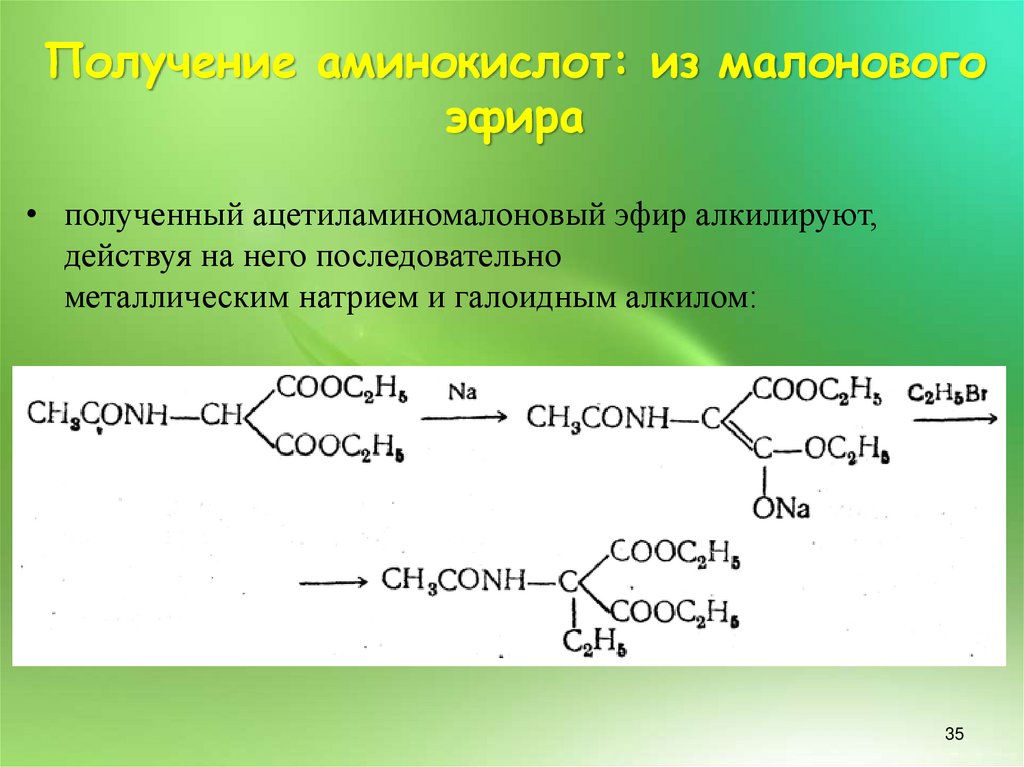
35. Получение аминокислот: из малонового эфира
• полученный ацетиламиномалоновый эфир алкилируют,действуя на него последовательно
металлическим натрием и галоидным алкилом:
35
36. Получение аминокислот: из малонового эфира
• После омыления и декарбоксилирования получается αаминокислота:36
37. Получение аминокислот: из малонового эфира
• Синтез аминокислот с использованием эфиров нитроуксуснойкислоты:
37
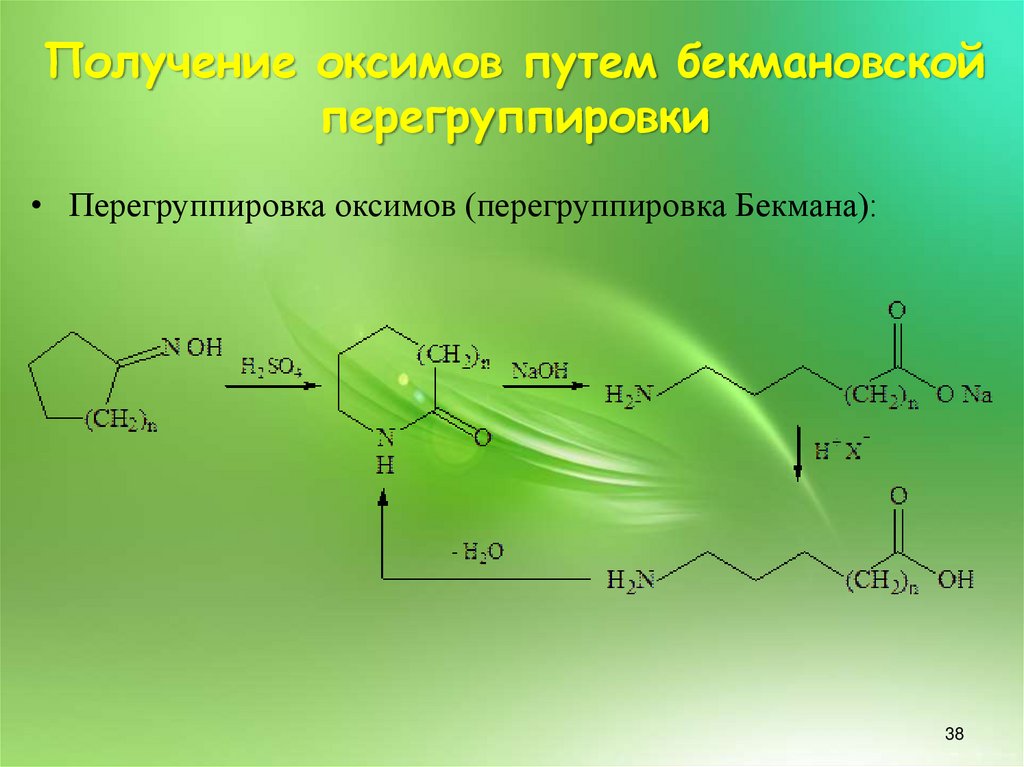
38. Получение оксимов путем бекмановской перегруппировки
• Перегруппировка оксимов (перегруппировка Бекмана):38
39. Получение аминокислот теломеризацией этилена и четыреххлористого углерода
• Присоединение аммиака к продуктам теломеризации,(оборванная цепная полимеризация с участием других
соединений, образуется смесь продуктов различной массы)
этилена и ССl4:
39
40.
Химические свойства аминокислоткислотно-основные свойства, то есть амфотерные
свойства
карбоксильной
группы
(образование
функциональных производных – реакции SN).
свойства аминогруппы (ацилирование, алкилирование и
др.)
специфические свойства, обусловленные взаимным
влиянием функциональных групп друг на друга
(декарбоксилирование, дезаминирование)
40
41.
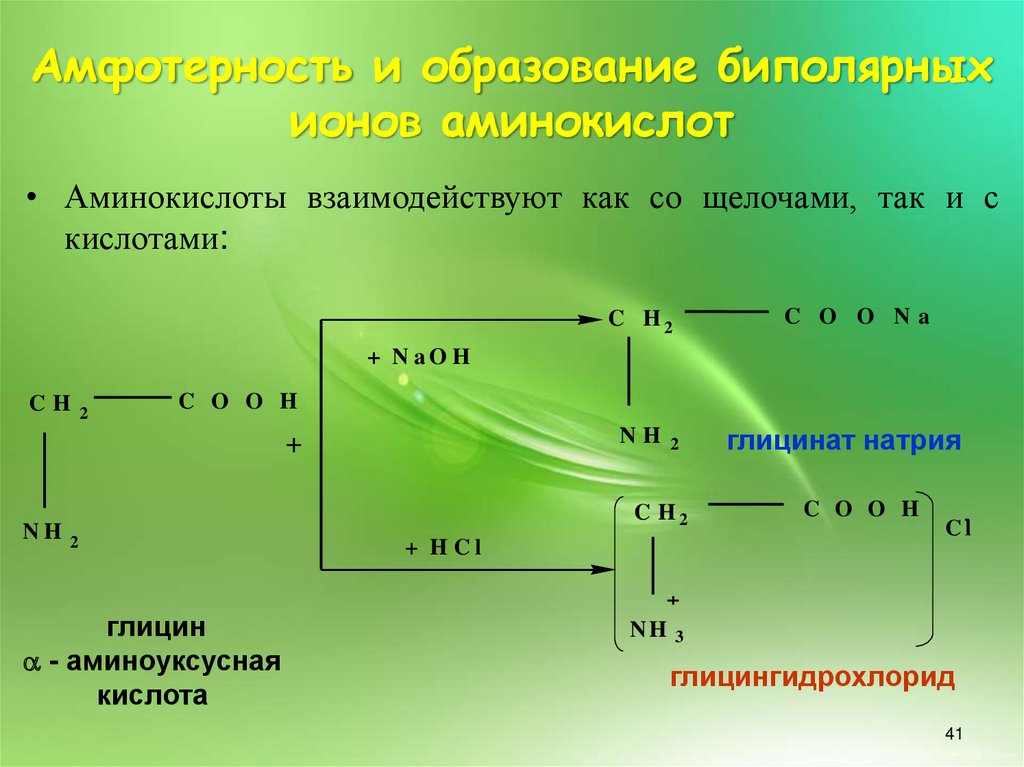
Амфотерность и образование биполярныхионов аминокислот
• Аминокислоты взаимодействуют как со щелочами, так и с
кислотами:
C O O Na
C H2
+ N aO H
CH
2
C O O H
NH
+
NH
2
C H2
2
глицин
- аминоуксусная
кислота
+ HCl
NH
глицинат натрия
C O O H
-
Cl
3
глицингидрохлорид
41
42.
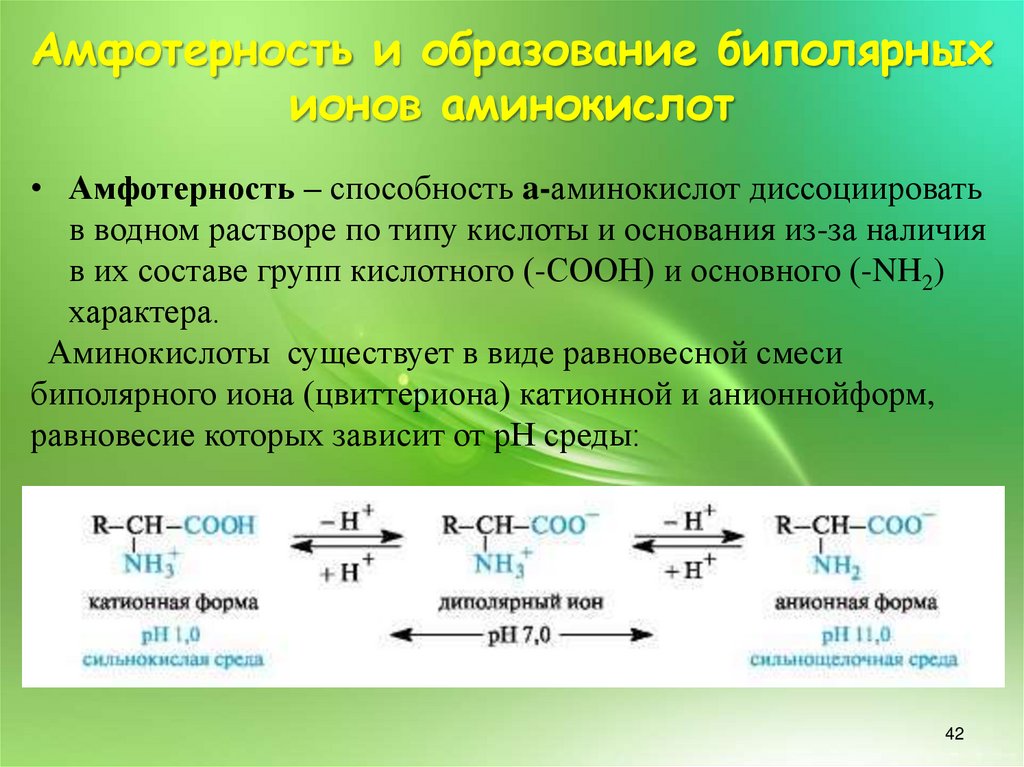
Амфотерность и образование биполярныхионов аминокислот
• Амфотерность – способность a-аминокислот диссоциировать
в водном растворе по типу кислоты и основания из-за наличия
в их составе групп кислотного (-СООН) и основного (-NH2)
характера.
Аминокислоты существует в виде равновесной смеси
биполярного иона (цвиттериона) катионной и анионнойформ,
равновесие которых зависит от рН среды:
42
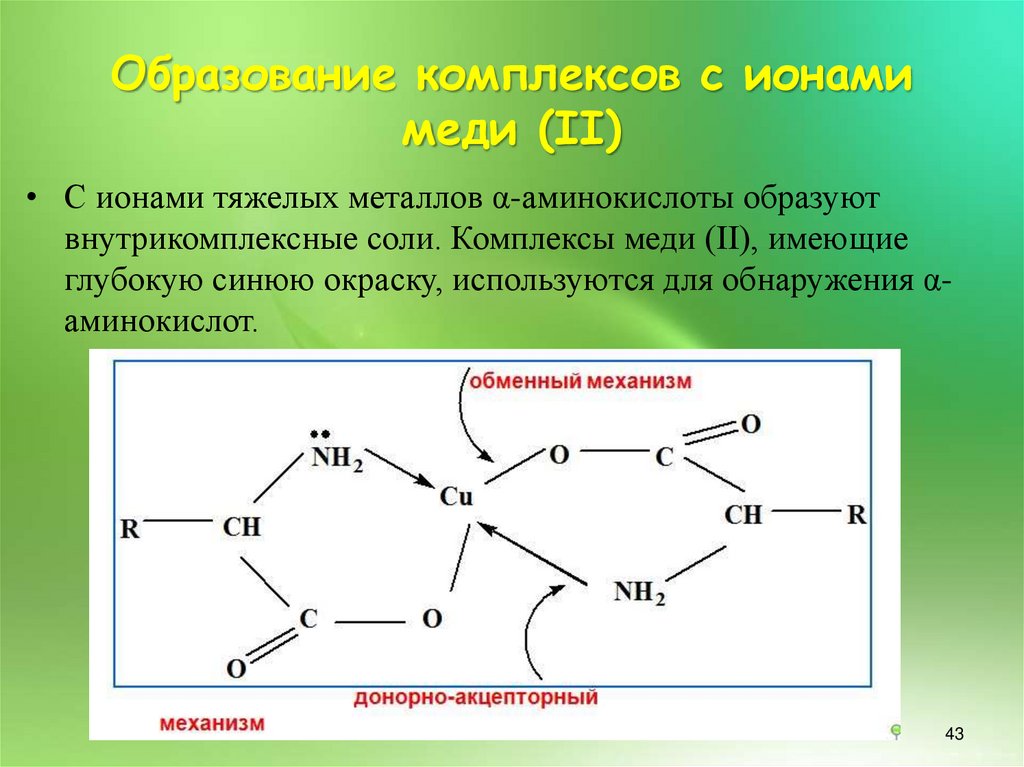
43.
Образование комплексов с ионамимеди (II)
• С ионами тяжелых металлов α-аминокислоты образуют
внутрикомплексные соли. Комплексы меди (II), имеющие
глубокую синюю окраску, используются для обнаружения αаминокислот.
43
44.
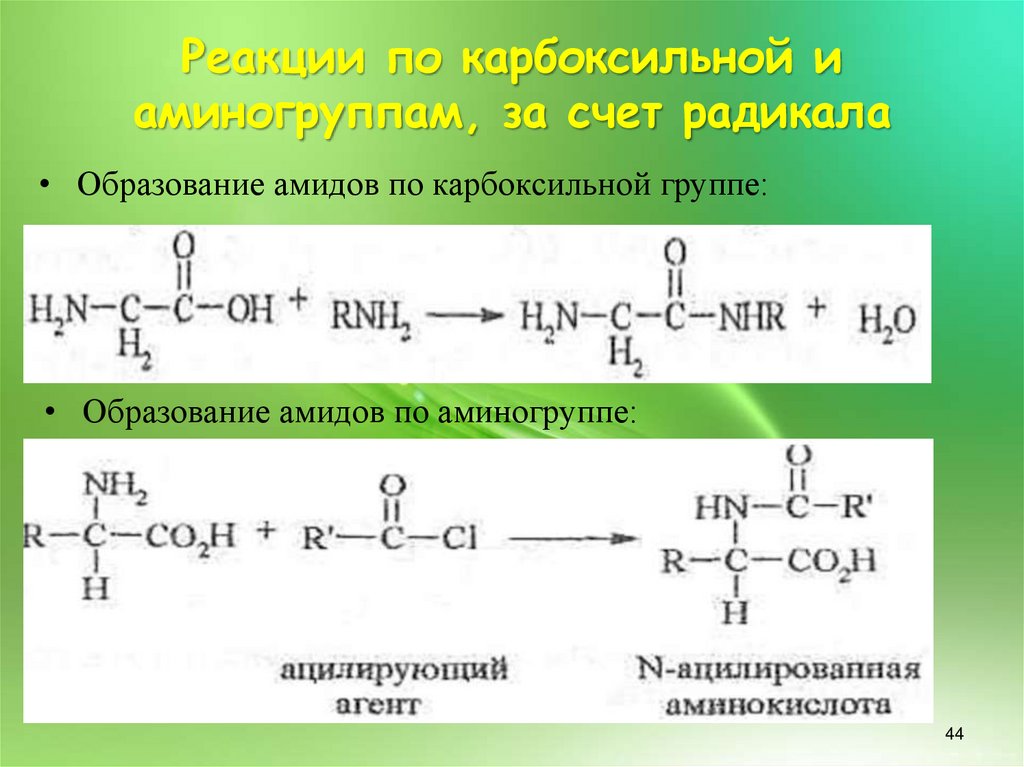
Реакции по карбоксильной иаминогруппам, за счет радикала
• Образование амидов по карбоксильной группе:
• Образование амидов по аминогруппе:
44
45.
Дезаминирование α- аминокислот• Дезаминирование АК — реакция отщепления αаминогруппы от АК, в результате чего образуется
соответствующая α-кетокислота и выделяется
молекула аммиака.
• Дезаминирование бывает прямым и непрямым.
45
46.
Дезаминирование α- аминокислотПрямое дезаминирование – это дезаминирование,
которое происходит в 1 стадию с участием одного
фермента.
Прямому дезаминированию повергаются глу, гис, сер,
тре, цис.
Существует 5 видов прямого дезаминирования АК:
• окислительное;
• неокислительное;
• внутримолекулярное;
• восстановительное;
• гидролитическое;
46
47.
Окислительное дезаминированиеОкислительное дезаминирование – самый активный вид
прямого дезаминирования АК.
• Глутаматдегидрогеназа (глу-ДГ) – олигомер, состоящий из 6
субъединиц (молекулярная масса 312 кД), содержит
кофермент НАД+. Глу-ДГ катализирует обратимое
дезаминирование глу, очень активна в митохондриях клеток
практически всех органов, кроме мышц. ГлуДГ аллостерически ингибируют АТФ, ГТФ, НАДH2,
активирует избыток АДФ. Индуцируется Глу-ДГ
стероидными гормонами (кортизолом).
47
48.
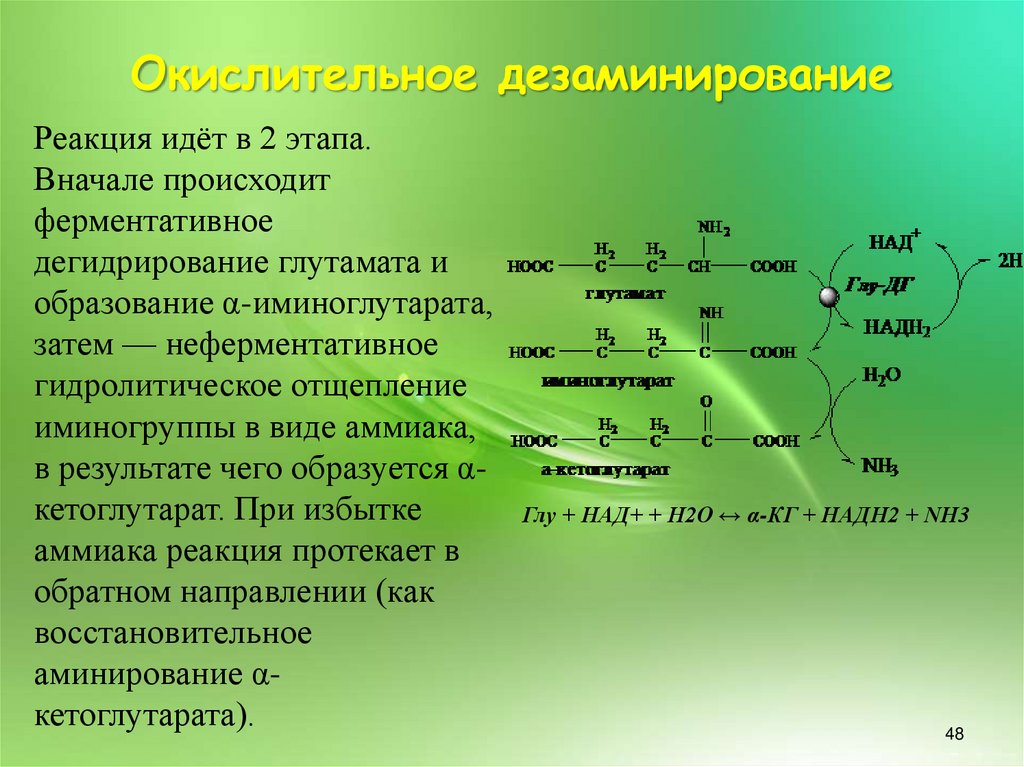
Окислительное дезаминированиеРеакция идёт в 2 этапа.
Вначале происходит
ферментативное
дегидрирование глутамата и
образование α-иминоглутарата,
затем — неферментативное
гидролитическое отщепление
иминогруппы в виде аммиака,
в результате чего образуется αкетоглутарат. При избытке
аммиака реакция протекает в
обратном направлении (как
восстановительное
аминирование αкетоглутарата).
Глу + НАД+ + Н2О ↔ α-КГ + НАДН2 + NH3
48
49.
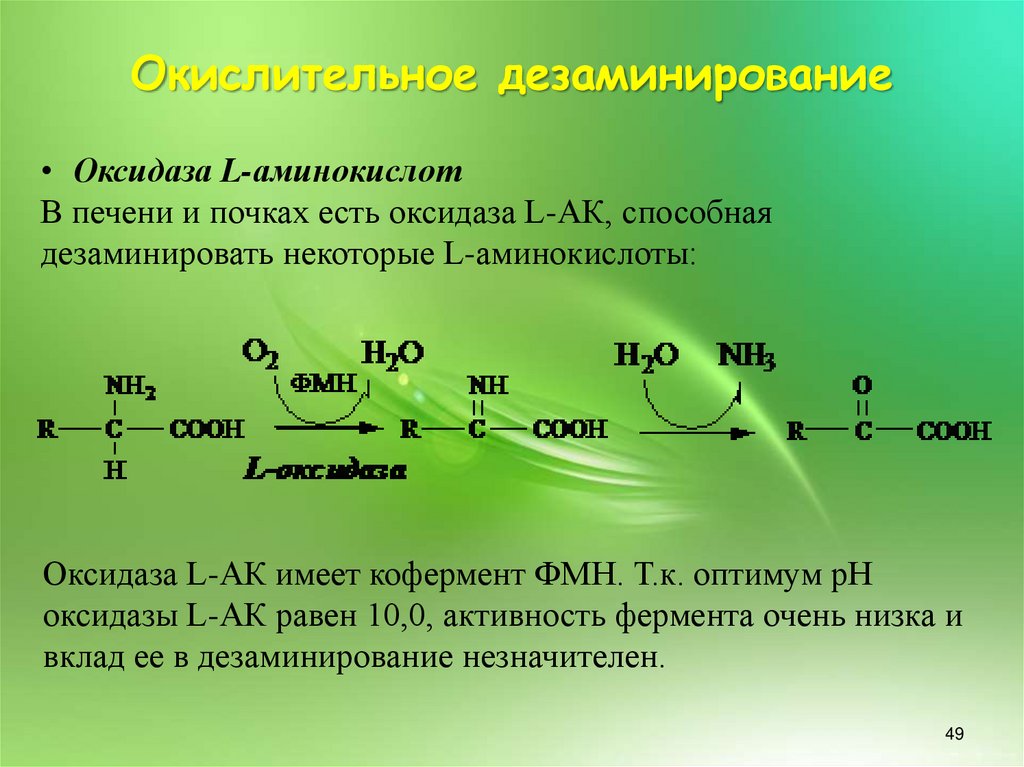
Окислительное дезаминирование• Оксидаза L-аминокислот
В печени и почках есть оксидаза L-АК, способная
дезаминировать некоторые L-аминокислоты:
Оксидаза L-АК имеет кофермент ФМН. Т.к. оптимум рН
оксидазы L-АК равен 10,0, активность фермента очень низка и
вклад ее в дезаминирование незначителен.
49
50.
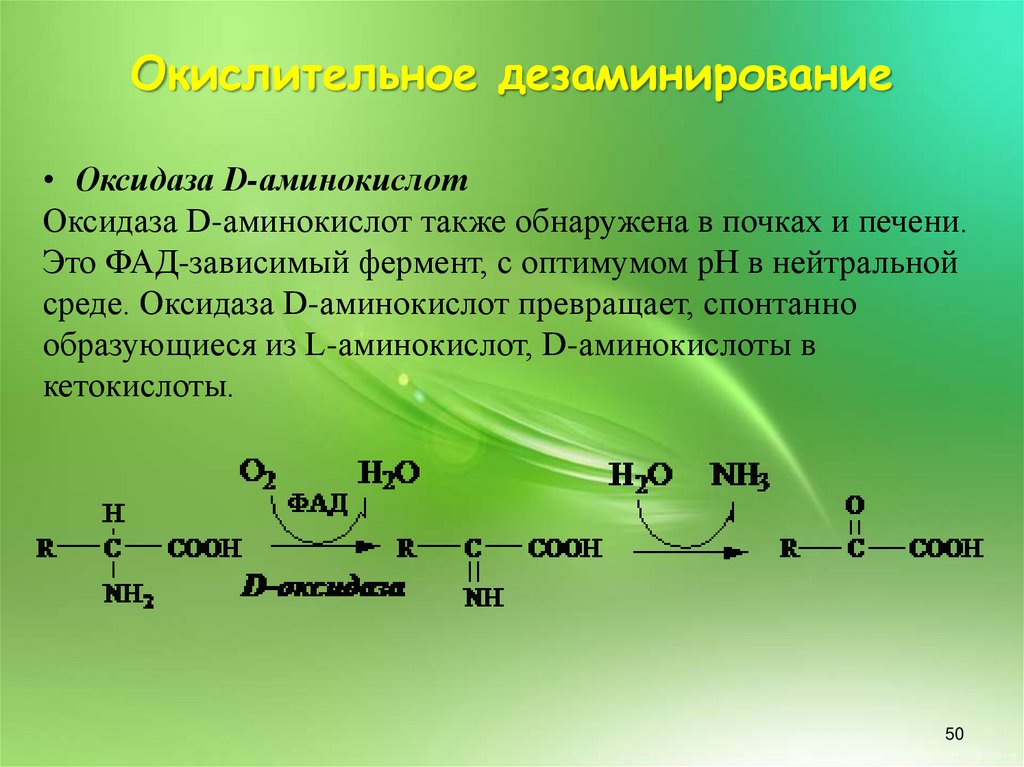
Окислительное дезаминирование• Оксидаза D-аминокислот
Оксидаза D-аминокислот также обнаружена в почках и печени.
Это ФАД-зависимый фермент, с оптимумом рН в нейтральной
среде. Оксидаза D-аминокислот превращает, спонтанно
образующиеся из L-аминокислот, D-аминокислоты в
кетокислоты.
50
51.
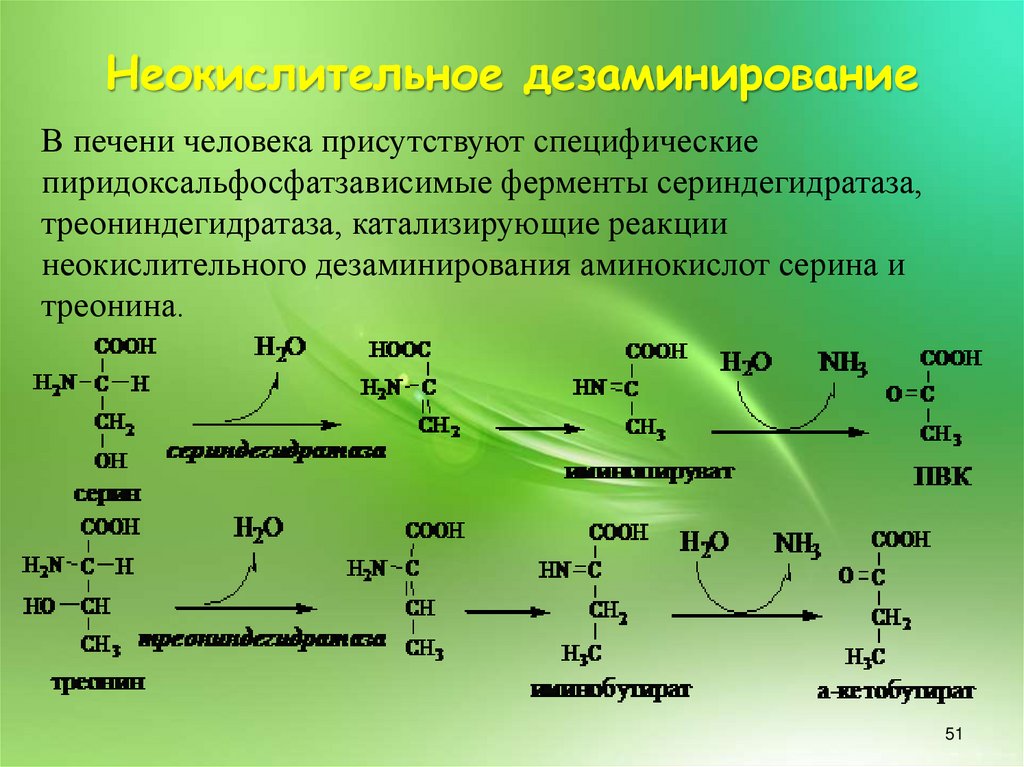
Неокислительное дезаминированиеВ печени человека присутствуют специфические
пиридоксальфосфатзависимые ферменты сериндегидратаза,
треониндегидратаза, катализирующие реакции
неокислительного дезаминирования аминокислот серина и
треонина.
51
52.
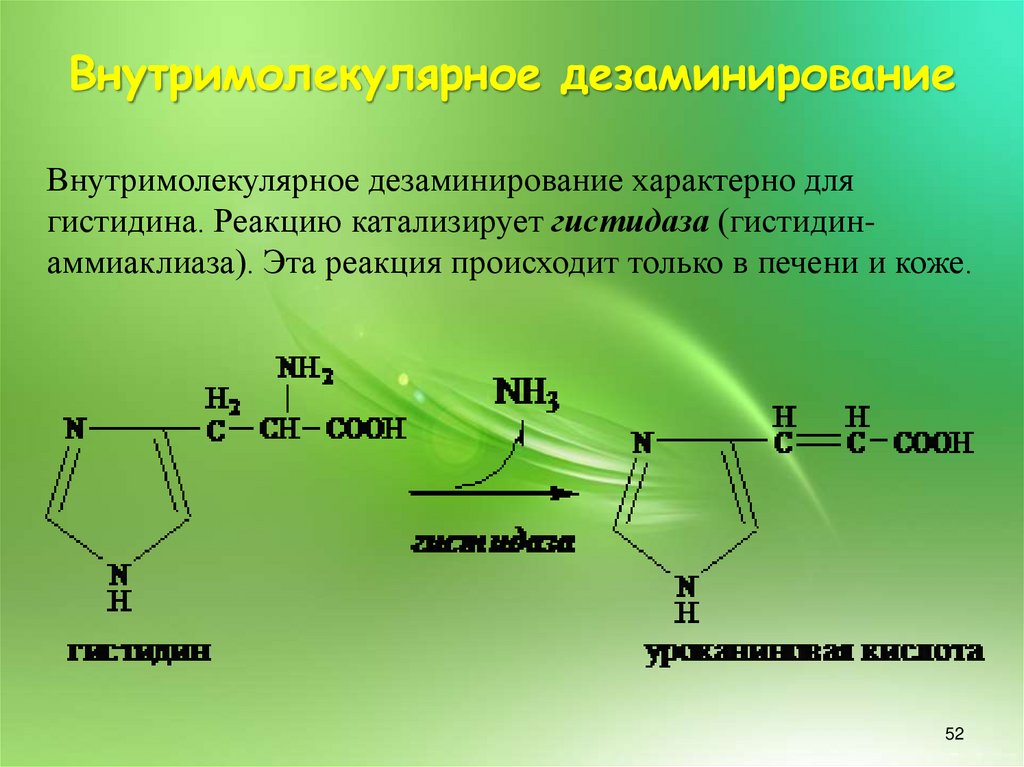
Внутримолекулярное дезаминированиеВнутримолекулярное дезаминирование характерно для
гистидина. Реакцию катализирует гистидаза (гистидинаммиаклиаза). Эта реакция происходит только в печени и коже.
52
53.
Отношение к нагреваниюα-, β-, γ- аминокислот
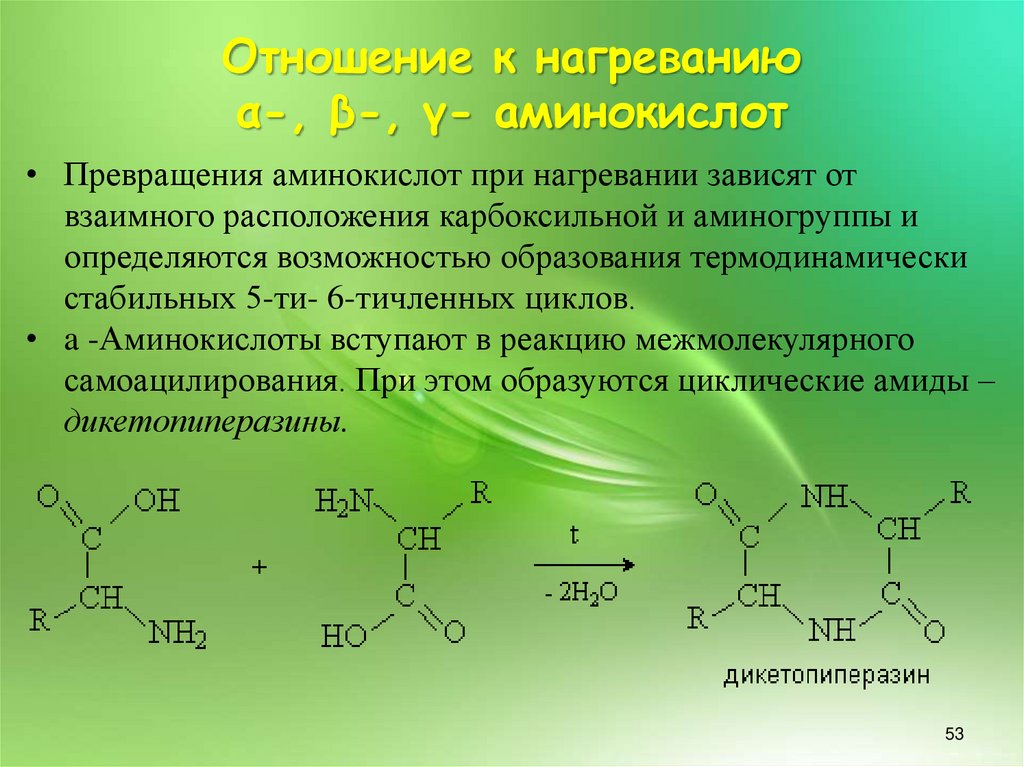
• Превращения аминокислот при нагревании зависят от
взаимного расположения карбоксильной и аминогруппы и
определяются возможностью образования термодинамически
стабильных 5-ти- 6-тичленных циклов.
• a -Аминокислоты вступают в реакцию межмолекулярного
самоацилирования. При этом образуются циклические амиды –
дикетопиперазины.
53
54.
Отношение к нагреваниюα-, β-, γ- аминокислот
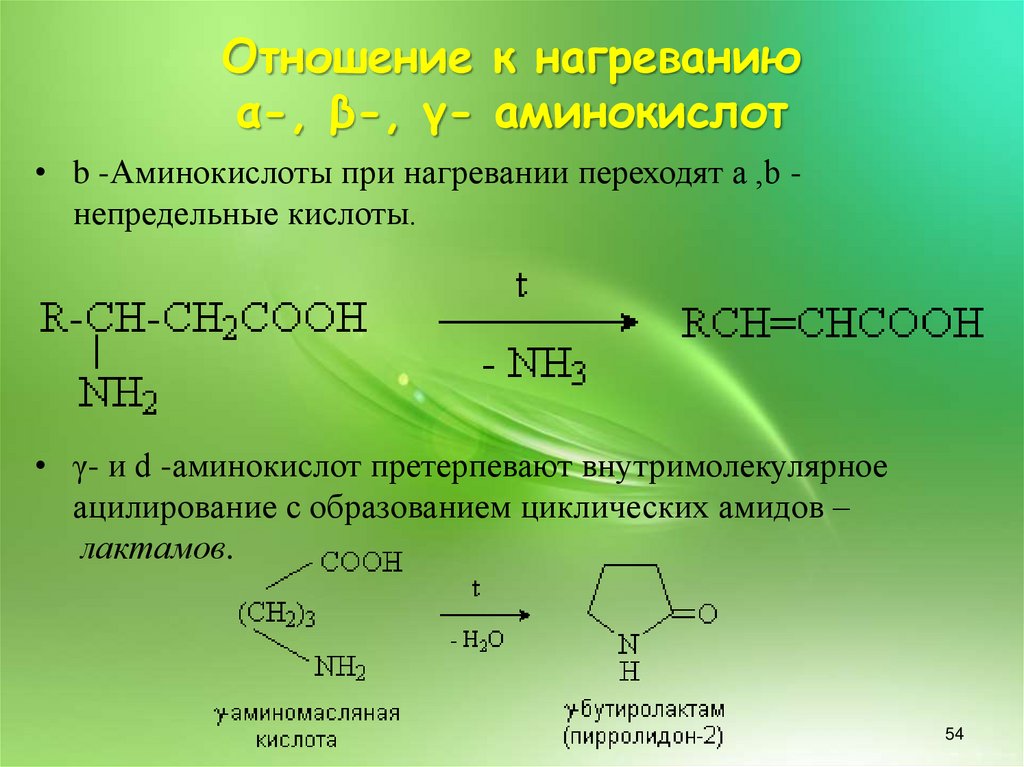
• b -Аминокислоты при нагревании переходят a ,b непредельные кислоты.
• γ- и d -аминокислот претерпевают внутримолекулярное
ацилирование с образованием циклических амидов –
лактамов.
54
55.
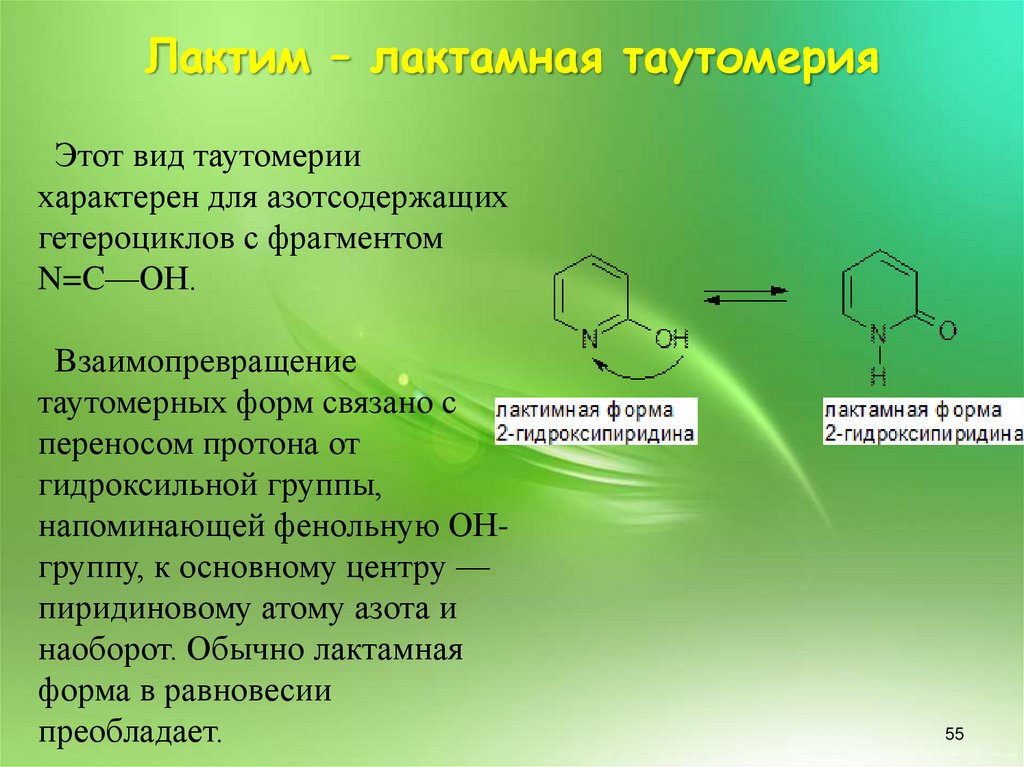
Лактим – лактамная таутомерияЭтот вид таутомерии
характерен для азотсодержащих
гетероциклов с фрагментом
N=C—ОН.
Взаимопревращение
таутомерных форм связано с
переносом протона от
гидроксильной группы,
напоминающей фенольную ОНгруппу, к основному центру —
пиридиновому атому азота и
наоборот. Обычно лактамная
форма в равновесии
преобладает.
55
56.
Полиамидные волокна: капрон• Капрон (поли-ε-капроамид, найлон-6,
полиамид 6) —
синтетическое полиамидное волокно,
получаемое из нефти, продукт
поликонденсации капролактама.
Формула полимера имеет вид:
[—HN(CH2)5CO—]n.
56
57.
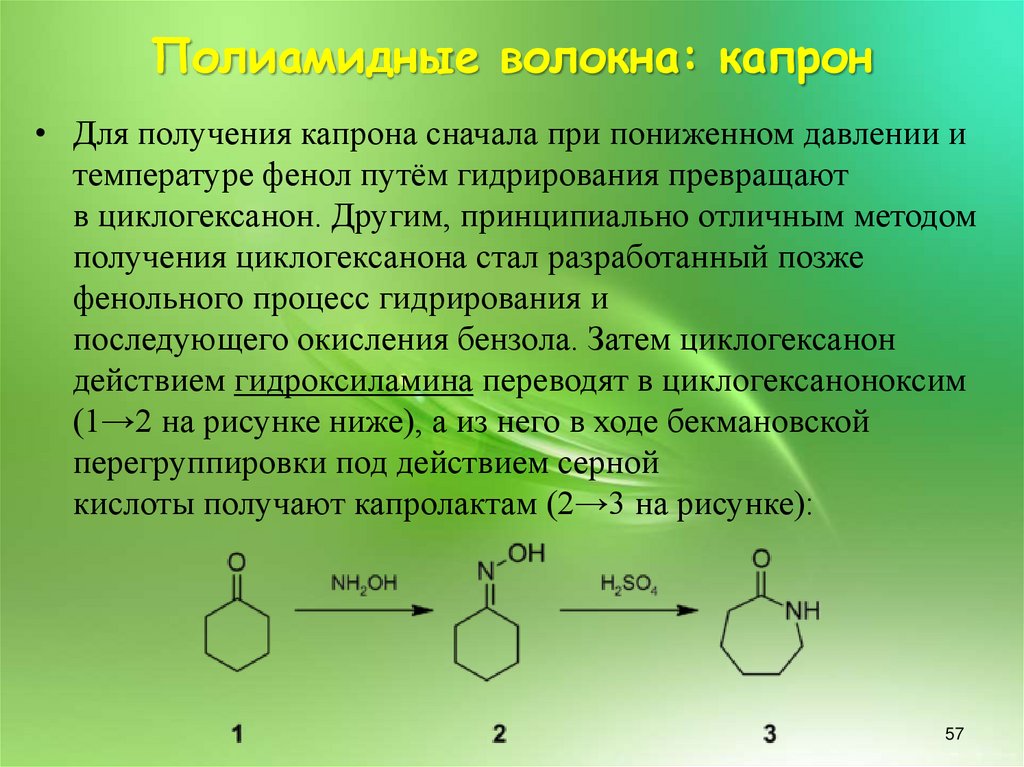
Полиамидные волокна: капрон• Для получения капрона сначала при пониженном давлении и
температуре фенол путём гидрирования превращают
в циклогексанон. Другим, принципиально отличным методом
получения циклогексанона стал разработанный позже
фенольного процесс гидрирования и
последующего окисления бензола. Затем циклогексанон
действием гидроксиламина переводят в циклогексаноноксим
(1→2 на рисунке ниже), а из него в ходе бекмановской
перегруппировки под действием серной
кислоты получают капролактам (2→3 на рисунке):
57
58.
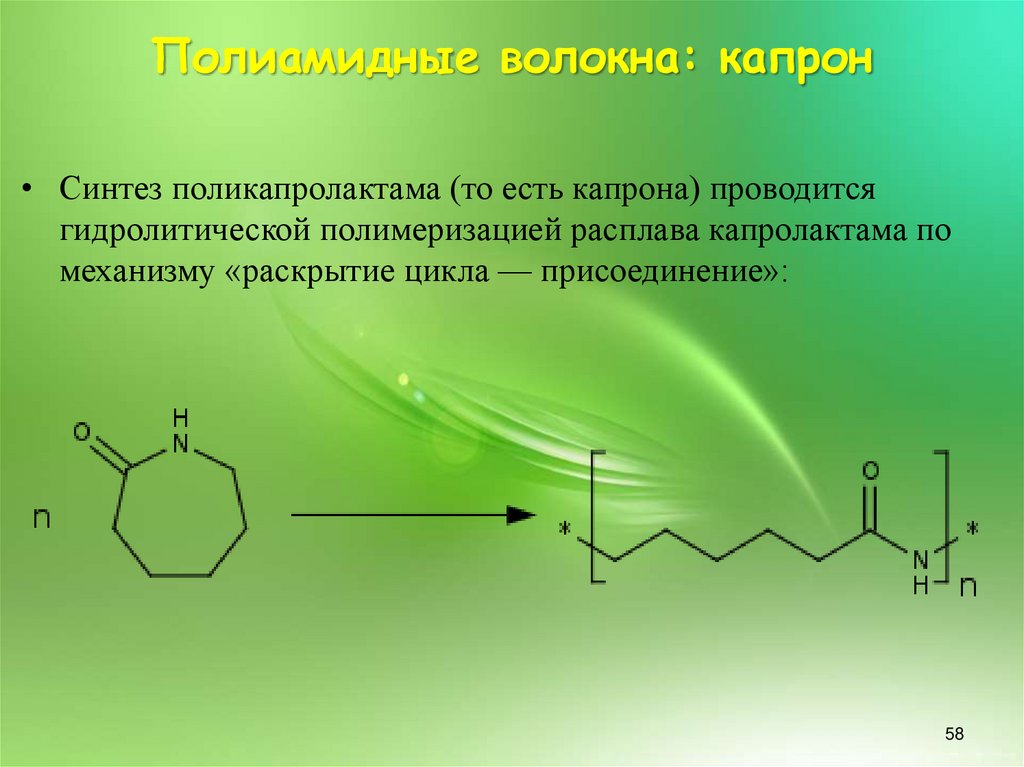
Полиамидные волокна: капрон• Синтез поликапролактама (то есть капрона) проводится
гидролитической полимеризацией расплава капролактама по
механизму «раскрытие цикла — присоединение»:
58
59.
Полиамидные волокна: капрон• Из капрона изготавливают канаты, рыболовные сети, леску,
гитарные струны, фильтровальные материалы, кордную ткань
(например, для автомобильных шин), а также
штапельные ткани, чулки и другие бытовые товары.
• Изделия из капрона, и в сочетании с капроном, широко
используются в быту. Из капроновых нитей шьют одежду, которая
стоит намного дешевле, чем одежда из натуральных природных
материалов. Из кордной ткани делают каркасы авто- и
авиапокрышек.
59
60.
Полиамидные волокна: капрон• Широкое применение
капрон получил в
изготовлении парашютов.
Он пришёл на смену
натуральному шёлку. В
отличие от шёлка, капрон
не слёживается (не
склонен к «запоминанию»
формы), не гниёт, обладает
большей прочностью, что
при той же требуемой
прочности купола,
позволяет сделать ткань
тоньше и существенно
снизить массу.
60
61.
Полиамидные волокна: найлон• Найлон (анид, полиамид-6,6); [-СО-(СН2)4-СО-NН-(СН2)6NН-]n.
Получают поликонденсацией двух мономеров:
• адипиновой кислоты HOOC- (CH2)4-COOH;
• гексаметилендиамина H2N- (CH2)6-NH2;
61
62.
Полиамидные волокна: найлон• Найлон вырабатывается в
ограниченном
количестве. Области
применения найлона, как
и других полиамидов –
это получение
синтетического волокна, а
также конструкционных
материалов в
производстве
деталей приборов и
машин, которые должны
обладать длительным
сопротивлением
истиранию.
62
63.
Полиамидные волокна: анидВолокно анид — производное гексаметилендиамина и
адипиновой кислоты.
Волокно отличается высокой прочностью
на разрыв. Это объясняется следующим.
Между макромолекулами полимера
действуют не только обычные
межмолекулярные силы сцепления (вандер-ваальсовы силы). Здесь возникают
еще дополнительные водородные
мостики, которые действуют между
атомами водорода, входящими в ЫНгруппу одной макромолекулы, и атомами
кислорода, входящими в СО-группу
другой (рис. Х-4).
63
64.
Полиамидные волокна: анид• Наличие этих связей, являющихся
дополнительным скреплением
макромолекулярных цепей между
собой, и обусловливает
отмеченную выше прочность
волокна.
• Анид широко применяется для
выработки разнообразных тканей,
верхнего и бельевого трикотажа,
мужских трикотажных сорочек,
перчаток и чулочно-носочных
изделий. Кроме того, это волокно
используется в производстве
искусственного меха, швейных
ниток и т. д.
64
65.
Полиамидные волокна: энант• Производство волокна энант. Сырьем для
выработки волокна энант служит
аминоэнантовая кислота, полученная
синтезом из этилена и четыреххлористого
углерода. Путем поликонденсации кислоты
образуется полимер — смола энант.
• В отличие от капрона волокно энант не
повышает жесткость шерстяных
трикотажных изделий и в большей степени
увеличивает их носкость.
• Применяется волокно энант главным
образом для технических целей, в
частности для выработки кордных тканей.
Волокно может быть использовано и в
производстве товаров народного
потребления.
65
66.
Биологическое значение α-аминокислотИзвестно около 500 природных аминокислот, но только 20 из них
играют важнейшую роль в жизни человека.
Эти аминокислоты называют протеиногенными — строящими
белки.
Аминокислоты являются наиболее важной составной частью
организма.
Аминокислоты – строительные блоки, из которых строятся
белковые структуры, мышечные волокна. Организм использует их
для собственного роста, восстановления, укрепления и выработки
различных гормонов, антител и ферментов.
Аминокислоты участвуют в обмене белков и углеводов, в образовании
важных для организмов соединений (например, пуриновых и
пиримидиновых оснований, являющихся неотъемлемой частью
нуклеиновых кислот), входят в состав гормонов, витаминов, алкалоидов,
пигментов, токсинов, антибиотиков и т. д.
66
67.
Биологическое значение α-аминокислотАминокислоты обеспечивают:
— основные метаболические процессы: синтез и утилизация витаминов,
липотропное (жиромобилизующее) действие, гликолиз и гликонеогенез;
— процессы детоксикации организма, в том числе при токсикозе
беременных; — формирование иммунной системы организма;
— энергетические потребности клеток и, прежде всего, мозга, участвуют в
образовании нейромедиаторов, обладают антидепрессантной
активностью, улучшают память;
— метаболизм углеводов, участвуют в образовании и накоплении
гликогена в мышцах и печени, обеспечивают наращивание мышечной
массы, cнижают утомляемость, улучшают работоспособность;
— стимулируют работу гипофиза, увеличивают выработку гормона роста,
гормонов щитовидной железы, надпочечников;
— участвуют в образовании коллагена и эластина, способствуют
восстановлению кожи и костной ткани, а также заживлению ран;
— принимают участие в кроветворении, и, прежде всего, в выработке
67
гемоглобина.
68.
Биологическое значение α-аминокислотПризнаки недостаточности аминокислот в организме:
При недостаточном количестве аминокислотных соединений в
организме формируется дисбаланс белкового обмена, в результате
которого недостающие элементы «извлекаются» из соединительной
ткани, мышц, крови и печени.
В первую очередь высвобожденные белки используются для
питания мозга и обеспечения работы сердечно-сосудистой системы.
Расходуя собственные аминокислоты и не получая их с пищей,
организм начинает слабеть и истощаться, это приводит к
сонливости, выпадению волос, анемии, потере аппетита,
ухудшению состояния кожи, задержке роста и умственному
развитию.
68
69.
Применение аминокислот в медицине• Аминокислоты широко
применяются
в медицинской практике в
качестве лекарственных
средств.
• Аминокислоты
прописываются при
сильном истощении, после
тяжелых операций, их
используют для питания
больных.
• Из полиаминокислот
получают хороший
материал для хирургии.
69
70.
Применение аминокислот в сельскомхозяйстве
• Аминокислоты в сельском
хозяйстве применяются
преимущественно в качестве
кормовых добавок. Многие
растительные белки содержат
недостаточное количество белков.
Лизин, лейцин, метионин, треонин,
триптофан добавляют в корма
сельскохозяйственных животных.
• Аминокислоты метионин,
глутаминовая кислота и валин
применяются для защиты растений
от болезней, а аланин и глицин,
обладающий гербицидным
действием, используется для
борьбы с сорняками.
70
71.
Применение аминокислот в пищевойпромышленности
• В пищевой
промышленности аминокислоты
применяются в качестве вкусовых
добавок.
• Аминокислоты также являются
компонентами спортивного
питания (в изготовлении
которого применяется, как
правило, валин, лейцин,
изолейцин, аланин, лизин,
аргинин и глутамин),
использующегося спортсменами, а
также людьми, занимающимися
бодибилдингом, фитнесом.
71
72.
Применение аминокислот в пищевойпромышленности
• В химической
промышленности введение в
такие аминокислоты, как
глутаминовая или
аспарагиновая кислоты,
гидрофобных группировок
дает возможность получать
поверхностно-активные
вещества (ПАВ), широко
используемые в синтезе
полимеров, а также при
производстве моющих
средств, эмульгаторов,
добавок к моторному топливу.
72
73.
Аминокислоты как лекарственные средстваМетионин, незаменимая кислота, содержит
мобильную метильную группу, которая может
передаваться на другие соединения. Благодаря
этому она участвует в синтезе холина,
фосфолипидов, обмене витаминов В12 и фолиевой
кислоты. В реакциях биосинтеза белка метионин
является инициирующей аминокислотой. Он
участвует в процессах обезвреживания токсинов в
печени.
Метионин ("ациметион") и его активные
производные (как вещество "адеметионин" в
составе препарата "Гептрал") используют для
профилактики и лечения различных заболеваний
печени как липотропный фактор, препятствующий
накоплению жира, при токсических поражениях
печени, при атеросклерозе и в качестве
антидепрессанта для улучшения синтеза
нейромедиаторов.
73
74.
Аминокислоты как лекарственные средстваГлутаминовая кислота – является
предшественником γ-аминомасляной кислоты
(ГАМК), являющейся тормозным медиатором
нервной системы (препараты "Аминалон",
"Пикамилон"). ГАМК также играет
значительную роль в регуляции тонуса
мозговых сосудов кровообращении головного
мозга. Сам глутамат является
нейромедиаторной аминокислотой,
стимулирующей передачу возбуждения в
синапсах ЦНС. Кроме этого, глутамат
участвует в обезвреживании аммиака, синтезе
пуриновых и пиримидиновых оснований,
играет ведущую роль в обмене других
аминокислот. Потребность организма в
глутаминовой кислоте выше всех остальных
аминокислот.
74
75.
Аминокислоты как лекарственные средстваГлицин является медиатором ЦНС
тормозного действия. Улучшает
метаболизм в тканях мозга.
Оказывает успокаивающее
действие. Нормализует сон,
уменьшает повышенную
раздражительность, депрессивные
состояния.
75
76.
Аминокислоты как лекарственные средстваЦистеин участвует в
метаболизме хрусталика глаза.
Зачастую нарушения
хрусталика связаны с
недостатком цистеина, поэтому
цистеин применяют на
начальных стадиях катаракты.
Комплексный препарат
глутаминовой кислоты,
цистеина и глицина
"Вицеин" используют в виде
глазных капель.
76
77.
Аминокислоты как лекарственные средстваГистидин – условно
незаменимая аминокислота.
Используется при лечении
гепатитов, язв желудка и
двенадцатиперстной кишки.
77
78.
Аминокислоты как лекарственные средстваЦеребролизин – гидролизат
вещества мозга свиньи,
содержащий низкомолекулярные
пептиды (15%) и аминокислоты
(85%). Используется при
нарушениях функций ЦНС,
мозговых травмах,
кровоизлияниях, вегетативных
дистониях и т.п.
78
79.
Аминокислоты как лекарственные средстваПрепараты для парентерального
питания: полиамин (набор 13
аминокислот), вамин (набор 18
аминокислот), ваминолакт (набор 18 аминокислот,
соответствующих составу грудного
молока), гидролизин (гидролизат белков крови крупного
рогатого скота), аминотроф (гидролизат
казеина), аминосол (смесь 15
аминокислот), фибриносол (гидролизат фибрина крови).
79
80.
Спасибо за внимание!80












































 chemistry
chemistry