Similar presentations:
Электролитическая диссоциация
1.
2.
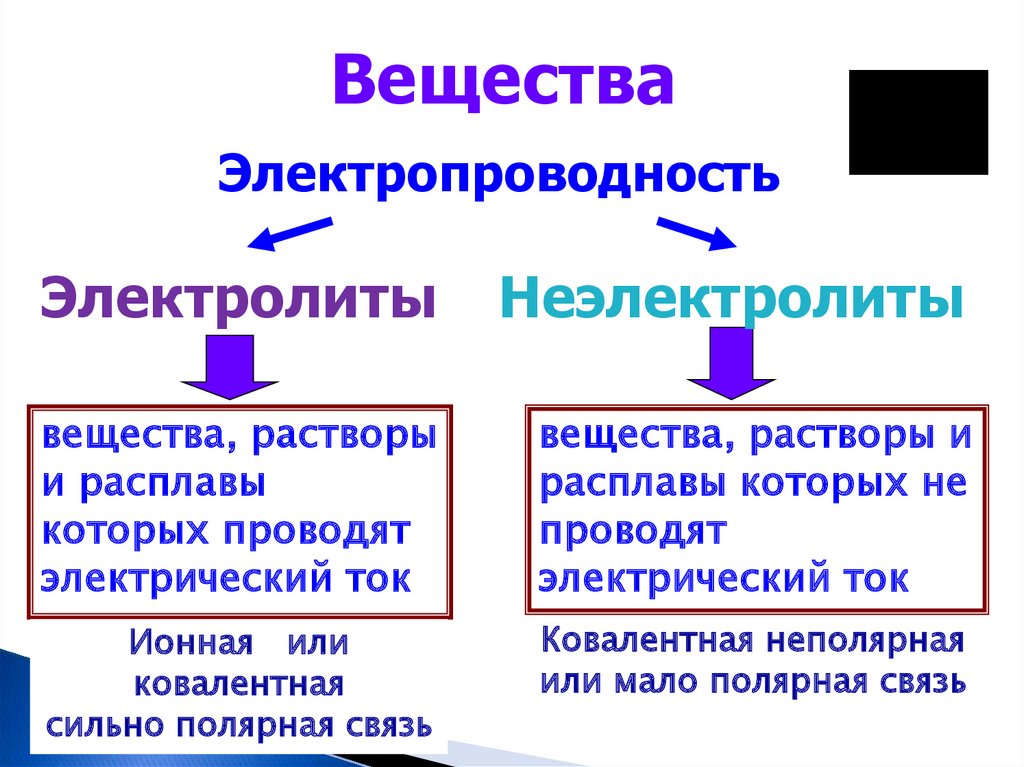
ВеществаЭлектропроводность
Электролиты
Неэлектролиты
вещества, растворы
и расплавы
которых проводят
электрический ток
вещества, растворы и
расплавы которых не
проводят
электрический ток
Ионная или
ковалентная
сильно полярная связь
Ковалентная неполярная
или мало полярная связь
3.
1) При растворении в воде эл-тыдиссоциируют (распадаются) на ⊕ и ⊖
ионы. Процесс распада эл-та на ионы
называют электролитической
диссоциацией (ЭД).
4.
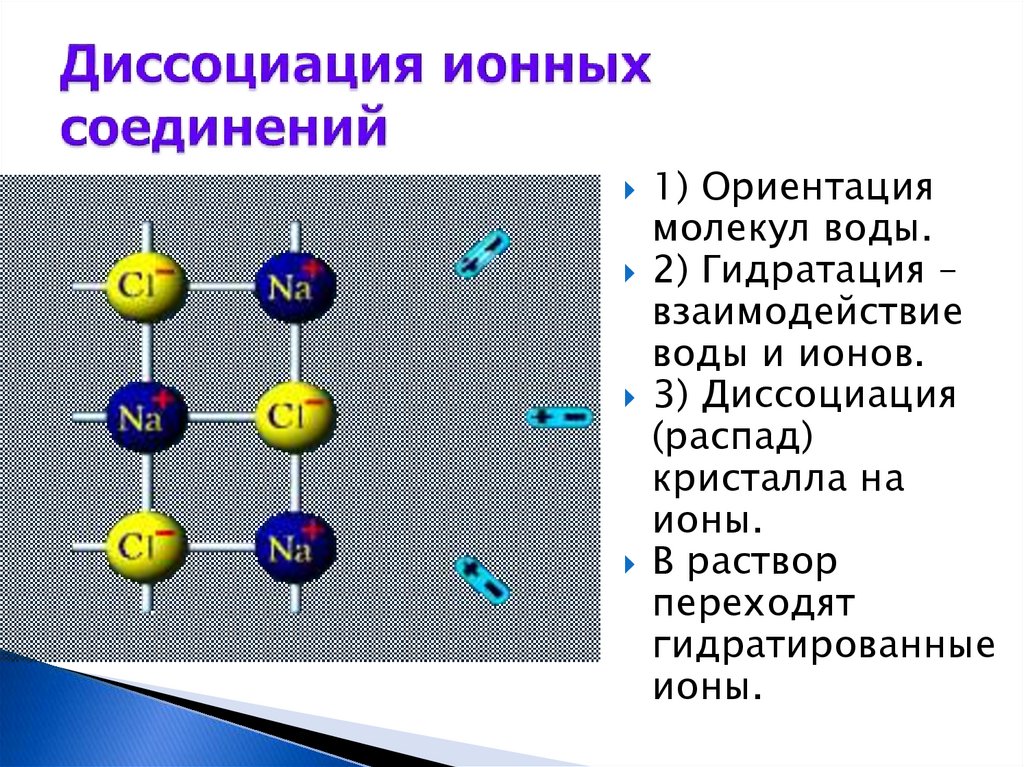
1) Ориентациямолекул воды.
2) Гидратация –
взаимодействие
воды и ионов.
3) Диссоциация
(распад)
кристалла на
ионы.
В раствор
переходят
гидратированные
ионы.
5.
1)Ориентация
молекул воды вокруг
полюсов эл-та.
2) Гидратация –
взаимодействие воды
молекулы эл-та.
3) Ионизация
молекулы эл-та.
4) Диссоциация
(распад) молекулы элта на ионы.
В раствор переходят
гидратированные
ионы.
6.
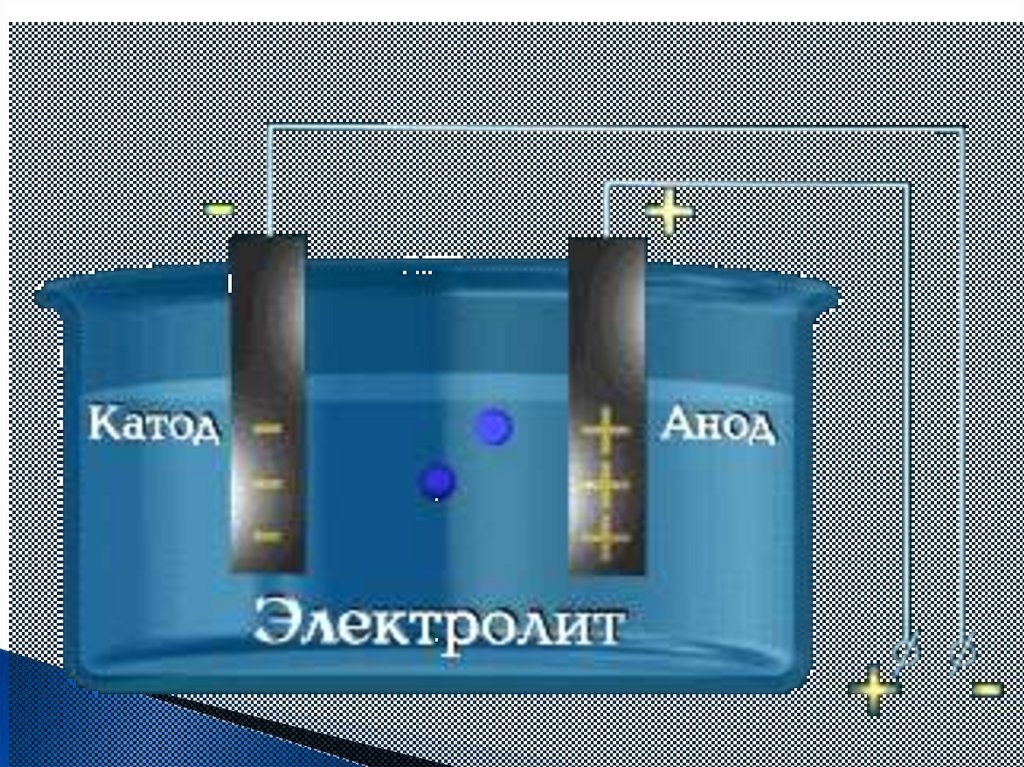
2. Под действием электрического тока ⊕заряженные ионы движутся к ⊖
заряженному полюсу – катоду, поэтому
называют катионами, ⊖ заряженные ионы
движутся к ⊕ заряженному полюсу – аноду,
поэтому называются анионами.
7.
8.
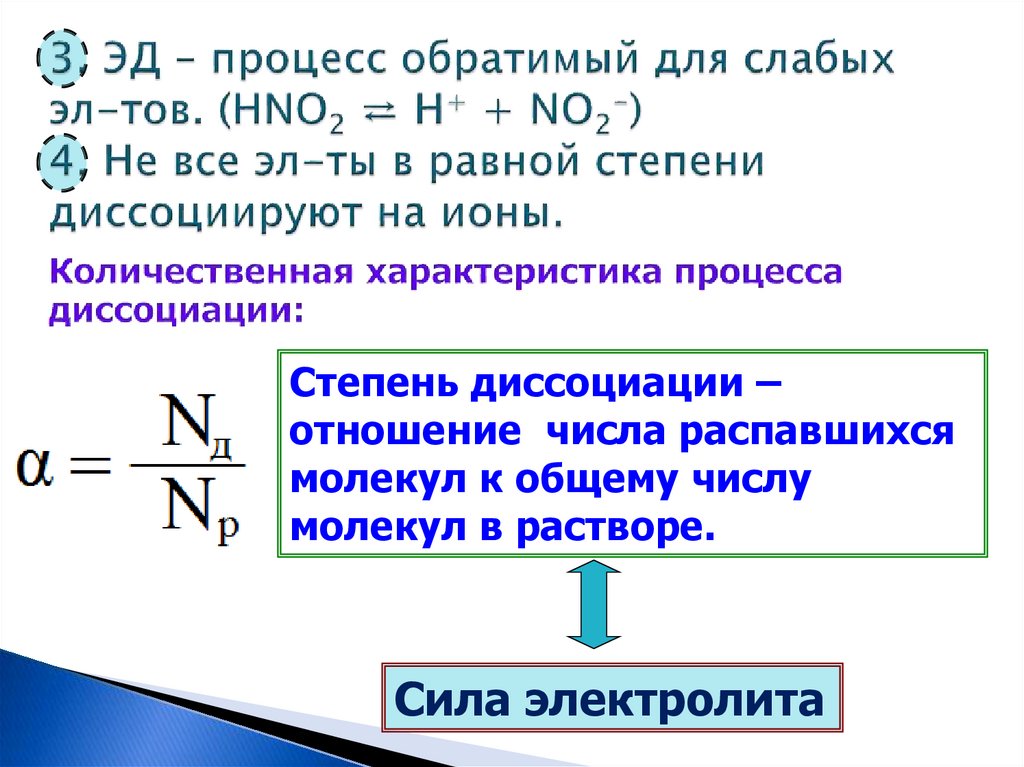
Степень диссоциации –отношение числа распавшихся
молекул к общему числу
молекул в растворе.
Сила электролита
9.
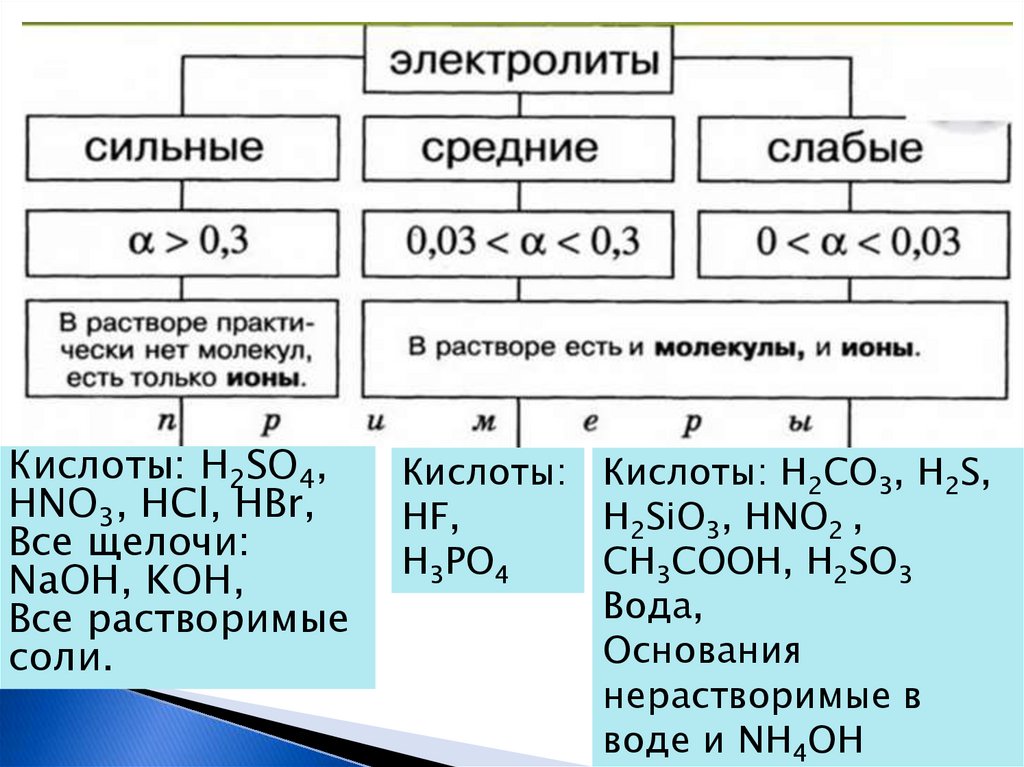
Кислоты: H2SO4,HNO3, HCl, HBr,
Все щелочи:
NaOH, KOH,
Все растворимые
соли.
Кислоты: Кислоты: H2CO3, H2S,
HF,
H2SiO3, HNO2 ,
H3PO4
CH3COOH, H2SO3
Вода,
Основания
нерастворимые в
воде и NH4OH
10.
∗ Кислотами называют эл-ты, которые придис-ции образуют катионы водорода и
анионы кислотного остатка:
HCl → H+ + Cl Многоосновные кислоты диссоциируют
ступенчато:
I H3PO4 ⇄ H+ + H2PO4 II H2PO4- ⇄ H+ + HPO42 По второй ступени дис-ция происходит
слабее, по третьей при обычных условиях
не происходит.
11.
NaOH → Na+ + OHCa(OH)2 → Ca2+ + 2OH∗ Солями называют эл-ты, которые придис-ции образуют катионы металла (или
аммония NH4+) и анионы кислотного
остатка. В отличие от кислот средние
соли диссоциируют полностью и не
ступенчато:
(NH4)3PO4 → 3(NH4)+ + PO43NaCl → Na+ + Cl-






 chemistry
chemistry








