Similar presentations:
Титрування. Хімічний посуд в титриметричному аналізі
1. Реферат на тему “Титрування. Хімічний посуд в титриметричному аналізі” Вищий державний навчальний заклад “УМСА”
Підготувала студенткаІІ курсу 21/9 групи
фармацевтичного відділення
Стеценко Катерина
Полтава 2016
2. План
Титриметричний метод аналізу: суть, основніпоняття та класифікація.
Хімічний посуд в титриметричному аналізі.
Способи приготування титрованих розчинів.
Класифікація методів титреметричного аналізу.
Розрахунки в титриметрії.
3. Основні поняття і їх суть:
Титриметричний методаналізу – метод кількісного
аналізу, заснований на
точному вимірюванні кількості
реагенту (обсяг, маса),
витраченого на реакцію з
обумовленою речовиною.
Титрування - повільне збільшення
(невеликими порціями) титрованного
(стандартного, титранта, робочого)
розчину до аналізованому розчину до
досягнення точки еквівалентності кінця реакції.
4.
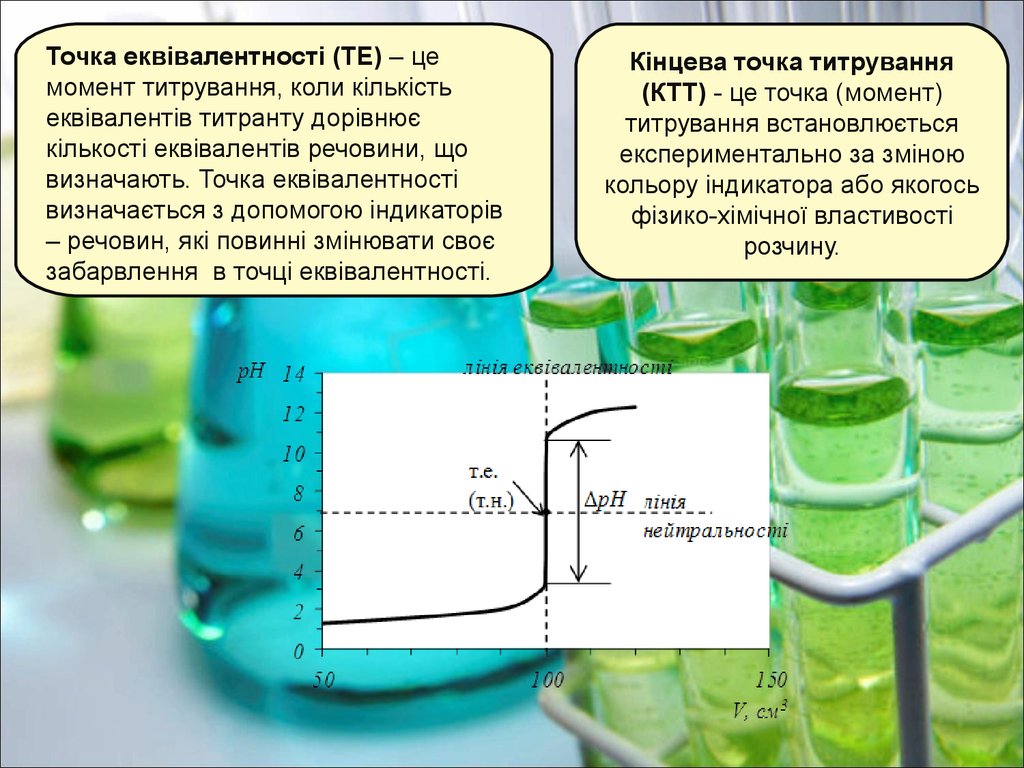
Точка еквівалентності (ТЕ) – цемомент титрування, коли кількість
еквівалентів титранту дорівнює
кількості еквівалентів речовини, що
визначають. Точка еквівалентності
визначається з допомогою індикаторів
– речовин, які повинні змінювати своє
забарвлення в точці еквівалентності.
Кінцева точка титрування
(КТТ) - це точка (момент)
титрування встановлюється
експериментально за зміною
кольору індикатора або якогось
фізико-хімічної властивості
розчину.
5.
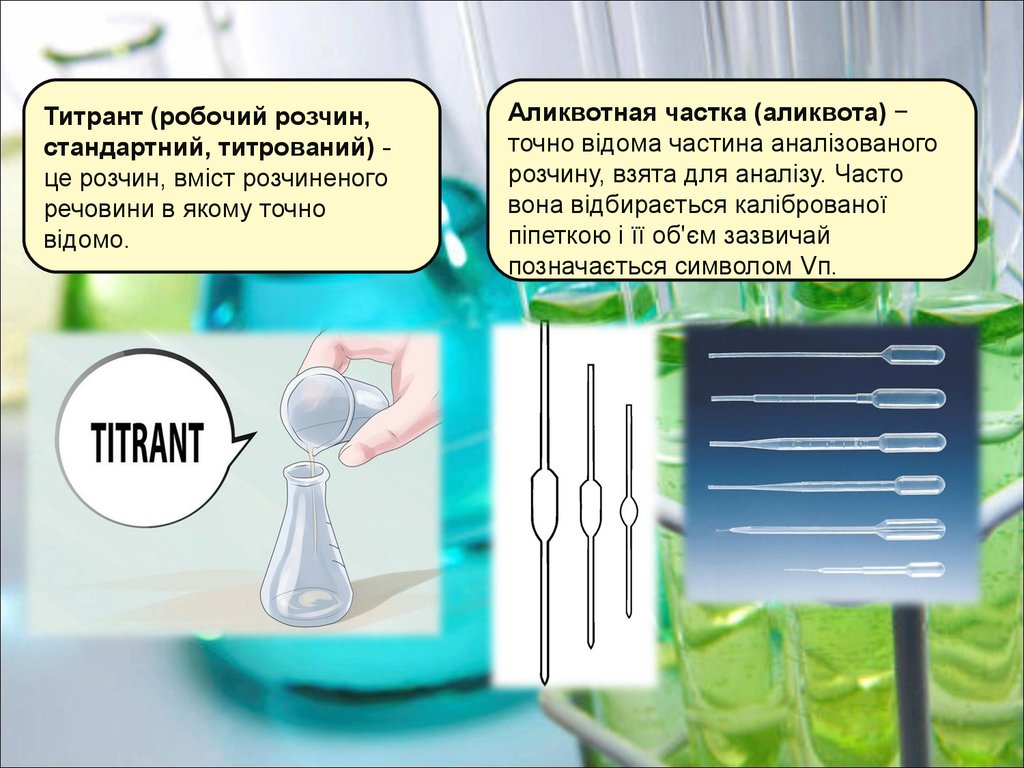
Титрант (робочий розчин,стандартний, титрований) це розчин, вміст розчиненого
речовини в якому точно
відомо.
Аликвотная частка (аликвота) −
точно відома частина аналізованого
розчину, взята для аналізу. Часто
вона відбирається каліброваної
піпеткою і її об'єм зазвичай
позначається символом Vп.
6. Хімічний посуд в титриметричному аналізі
Виконання титриметричного аналізу передбачає застосуванняспеціального мірного посуду, який має певні функції і особливості в
роботі.
У титриметрії використовують бюретки, піпетки, мірні та конічні колби.
7.
З’єднання бюретки з бутлями ізстандартними розчинами
8.
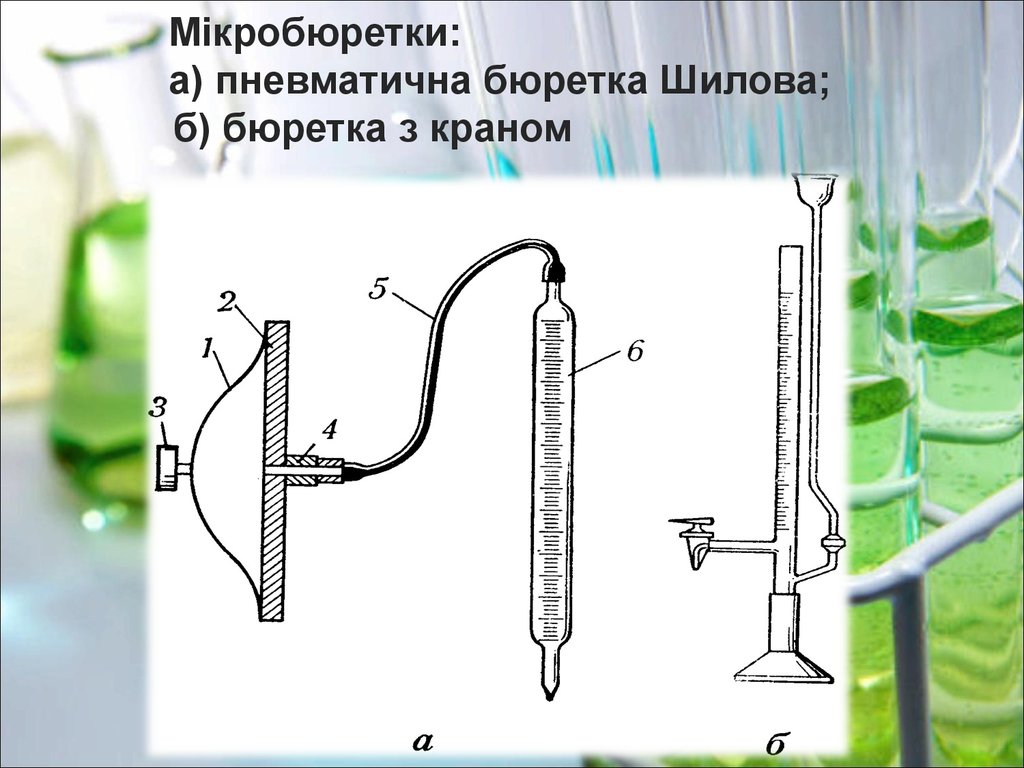
Мікробюретки:а) пневматична бюретка Шилова;
б) бюретка з краном
9. способи приготування титрованих розчинів
За первиннимстандартом
За вторинним
стандартом
10. Первинний стандартний розчин
Знаючи масу (m) розчиненої у воді хімічночистої речовини і об’єм (V) отриманого
розчину легко розрахувати концентрацію
виготовленого розчину:
m
C
M V
M
m
C
E V
H
m
T m/V
11. вторинний стандарт або розчин із встановленим титром
Готується розчин приблизно необхідноїконцентрації, точна його концентрація
встановлюється.
C V
C
V
H1
1
H2
2
12. Класифікація методів титриметричного аналізу
Залежно від типу реакціїміж титрантом і визначаємою речовиною
методи титриметричного аналізу поділяють на:
Метод кислотно-лужної
взаємодії (метод
нейтралізації).
В основі методу лежить
реакція нейтралізації між
кислотами та основами.
Метод окисно-відновного
титрування (редоксметрія).
В основі методу лежать окисновідновні реакції.
Метод комплексоутворення.
В основі методу лежать реакції
утворення комплексних
сполук.
Метод осадження.
В основі методу лежать реакції
утворення осадів.
13. Правила при приготуванні титрованих розчинів і визначенні їх титрів.
Вихідна речовина, яка застосовується для виготовленнястандартного розчину повинна бути хімічно чистою.
Вихідна речовина повинна легко і швидко реагувати з титрованими
речовинами.
Розчин вихідної речовини повинен зберігатися довший час без змін.
Реакції, які проходять між вихідною і визначуваною речовиною,
повинні проводитись по можливості методами прямого титрування.
Процес титрування повинен закінчуватися швидко і чітко. Кінцева
точка титрування повинна визначатися легко і точно.
Встановлювати титри бажано або методом окремих наважок або
розчиненням наважки вихідної речовини у певному об’ємі.
14. Розрахунки в титриметрії
В основі усіх розрахунків у титриметричному аналізілежить закон еквівалентів.
Хімічні елементи і речовини реагують між
собою у масових кількостях, пропорційних
їхнім еквівалентам.
15.
Еквівалент елемента простої чи складної речовини – це така йогокількість, яка приєднує або заміщує у хімічних реакціях один моль
атомів водню, або взаємодіє з одним еквівалентом будь-якої речовини.
Масу одного еквівалента елемента або речовини називають молярною
масою еквівалента або еквівалентною масою (одиниці вимірювання
г/моль)
Еквівалентну масу оксиду розраховують за формулою:
солі:
кислоти:
основи:
16. способи вираження концентрацій розчинів
Молярна концентрація речовини у
розчині С — це відношення
кількості розчиненої речовин
и в
молях, що міститься у розчин
і, до об'єму цього розчину.
Молярна концентрація
речовини еквівалента у
розчині— це відношення
кількості речовини
еквівалента у розчині до
об'єму цього розчину














 chemistry
chemistry








