Similar presentations:
Кислотно-основні рівноваги в біосистемах. Колігативні властивості біологічних рідин
1.
Лекція №3Кислотно-основні рівноваги в біосистемах.
Колігативні властивості біологічних рідин
Лектор: доцент Чорноус В.О.
Буковинський державний медичний університет
2.
План1. Основні поняття теорії розчинів
2. Кількісні характеристики розчинів
3. Фактори, що впливають на розчинність речовин
4. Основні положення теорії електролітів
5. Гідроліз солей. Буферні розчини
6. Колігативні властивості розчинів
Буковинський державний медичний університет
3.
Основні поняття теорії розчинівРозчин – гомогенна, термодинамічно стійка система,
що складається з двох і більше компонентів
Розчинник – компонент, якого в розчині більше, або який
має такий же агрегатний стан, що й розчин
(всі інші компоненти – розчинені речовини)
Розчинність (Р) - здатність речовини розчинятися
у розчиннику
Кількісно визначається:
Маса речовини, що розчиняється в 100гр розчинника
при певній температурі.
Буковинський державний медичний університет
4.
Способи вираження концентрації розчинів1. Масова частка (ω)
m( x) 100%
m( x) 100%
m( x) 100%
( x)
m( ð íó )
( ð íó ) V ( ð íó ) m( x) m( ð êà)
2. Молярна концентрація (С)
( x)
m( x) 1000
C ( x)
[ ìîëü / ë]
V ( ð íó , ë) M ( x) V ( ð íó , ìë )
Буковинський державний медичний університет
5.
3. Молярна концентрація еквівалента,нормальна концентрація (N)
åêâ ( x)
m( x) 1000
N ( x)
[ ìîëü .åêâ / ë]
V ( ð íó , ë) E ( x) V ( ð íó , ìë )
4. Моляльна концентрація (b)
( x)
m( x) 1000
b( x )
[ ìîëü , êã]
m( ð êà, êã) M ( x) m( ð êà, ã)
5. Масова концентрація (титр) (Т)
m( x )
T ( x)
V ( р ну )
Буковинський державний медичний університет
6.
7. Об’ємна частка (φ)V ( x) 100%
( x)
V ( р ну )
8. Масово-об’ємна частка (ωφ)
m( x) 100%
( x)
V ( ð íó )
Буковинський державний медичний університет
7.
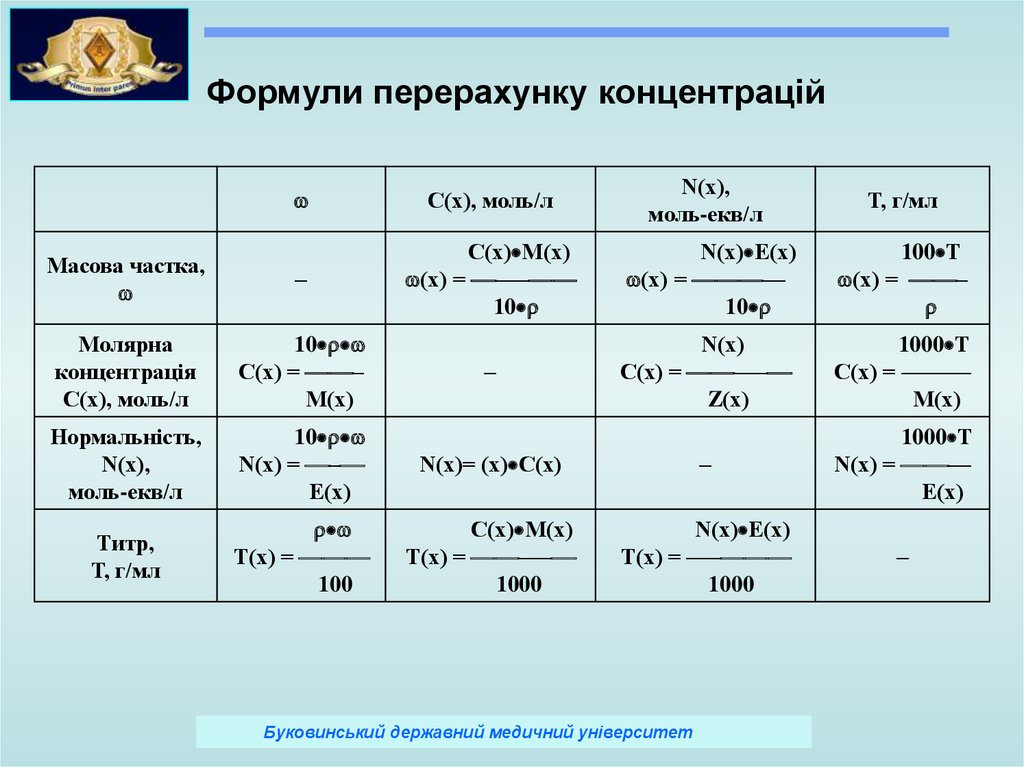
Формули перерахунку концентраційС(х), моль/л
N(х),
моль-екв/л
Т, г/мл
Масова частка,
–
С(х) М(х)
(х) = –––
10
N(х) Е(х)
(х) = ––
10
100 Т
(х) = –
Молярна
концентрація
С(х), моль/л
10
С(х) = –
М(х)
–
N(х)
С(х) = –––
Z(х)
1000 Т
С(х) = ––––––
М(х)
Нормальність,
N(х),
моль-екв/л
10
N(х) = –
Е(х)
N(х)= (х) С(х)
–
1000 Т
N(х) = ––
Е(х)
Титр,
Т, г/мл
Т(х) =
100
С(х) М(х)
Т(х) = –––
1000
N(х) Е(х)
Т(х) = –––
1000
–
Буковинський державний медичний університет
8.
Теорії розчинівФізична теорія розчинів (Я. Вант-Гофф, С. Арреніус)
Розчинення - фізичний розподіл однієї речовини у іншій
без будь-якої взаємодії між розчиненою речовиною і розчинником.
Хімічна теорія розчинів (Д.І. Менделеєв, Курнаков)
Розчинення – фізико-хімічний процес, що супроводжується
хімічною взаємодією між молекулами розчинника і
розчиненої речовини з утворенням сольватів (гідратів).
Буковинський державний медичний університет
9.
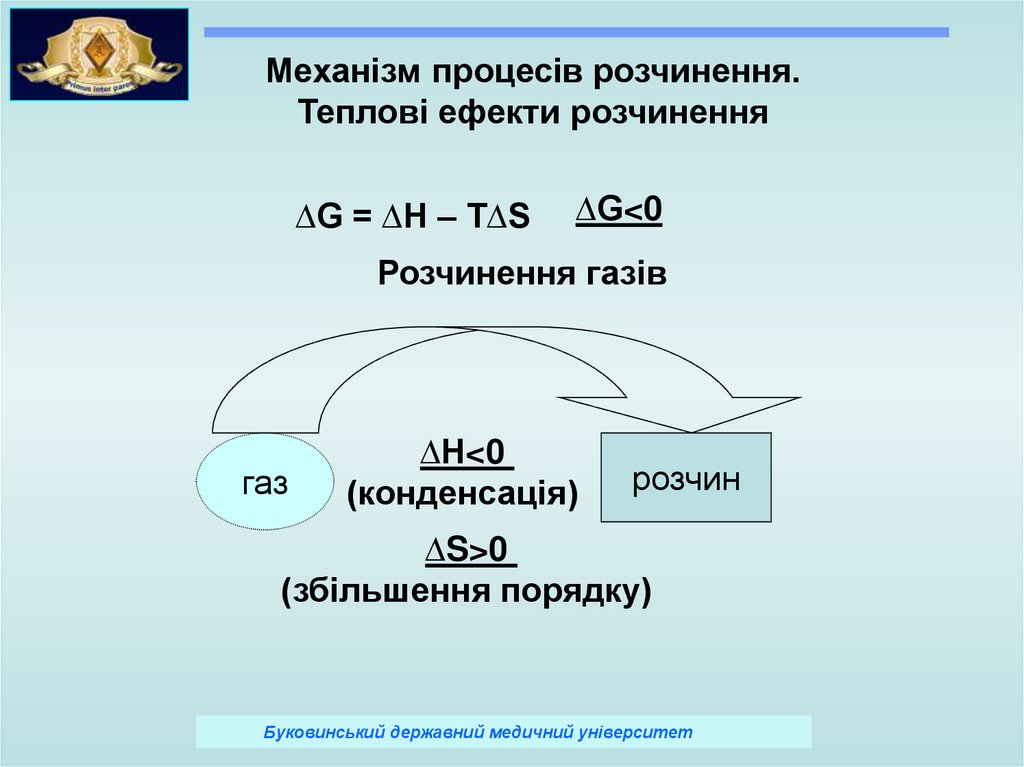
Механізм процесів розчинення.Теплові ефекти розчинення
∆G = ∆Н – Т∆S
∆G<0
Розчинення газів
газ
∆Н<0
(конденсація)
розчин
∆S>0
(збільшення порядку)
Буковинський державний медичний університет
10.
Механізм процесів розчинення.Теплові ефекти розчинення
∆S<0
(зменшення порядку)
Na+
Cl-
Na+
Cl-
Cl-
Na+
Cl-
Na+
+ -
Na+
Cl-
Na+
Cl-
+
∆Н2>0
(гідратація)
∆Н1 > ∆Н2 – процес екзотермічний
+-
+
-
-
-
+
-
+
+
- +
Cl-
+
-+
Na+
-
-+
+
+
-
+
-
+ + -
∆Н1 < ∆Н2 – процес ендотермічний
Речовина
ΔН
ΔS
ΔG
NаСl
+27,1
+43,5
-9,2
КОН
-55,6
+31,5
-65,0
СаСl2
-76,8
+475
-218,3
С6Н12О6
+9,4
-
-
Буковинський державний медичний університет
11.
Класифікація розчинів1. За агрегатним станом:
- газоподібні (повітря)
- рідкі (водний розчин цукру)
- тверді (чавун, мельхіор)
2. За типом розчинника:
- водні (розчинник вода)
- неводні (розчинник спирт, бензол, та ін.)
3. За кількістю розчиненої речовини:
- насичені (макс. кі-сть р.р. при даній Т.)
- ненасичені (менше макс.кі-сті р.р. при даній Т.)
- пересичені (більше макс.кі-сті р.р. при даній Т.)
(термодинамічно нестійкі)
Буковинський державний медичний університет
12.
Фактори, що впливають на розчинність1. Природа розчинника і речовини, що розчиняється
Емпіричне правило:
“Подібне розчиняється в подібному”
(полярні речовини – в полярних розчинниках
неполярні – в неполярних)
Закон Нернста
У стані рівноваги співвідношення концентрацій
третього компонента у двох рідинах, що
не змішуються є величиною сталою
Буковинський державний медичний університет
13.
Фактори, що впливають на розчинність2. Концентрація розчиненої речовини
Всі речовини розчиняються до утворення
насиченого розчину при даній температурі
Насиченим називається розчин для якого швидкість
розчинення дорівнює швидкості зворотного процесу кристалізації
Насичені - розчини з меншою концентрацією
Концентровані – розчини з близькою до насиченості
концентрацією
Розведені – розчини із значно меншою ніж у
насиченому концентрацією
Пересичені – розчини з більшою ніж у насиченому
концентрацією (термодинамічно нестійкі)
Буковинський державний медичний університет
14.
3. ТемператураДля твердих речовин і рідин при збільшенні
температури розчинність зростає
P
(г/100г води)
100
KNO3
75
Na2SO4
50
NaCl
25
20
40
60
80
100
Буковинський державний медичний університет
t0C
15.
3. ТемператураДля газоподібних речовин із збільшенням температури
розчинність зменшується
Рівняння ізобари розчинності
lg m = а – (b/Т)
Буковинський державний медичний університет
16.
4. ТискЗакон Генрі-Дальтона
Розчинність газу в рідинах при сталій температурі
прямопропорційна парціальному тиску
С(х) = К∙Р(х)
Біологічне значення закону Генрі–Дальтона
(кесонна хвороба, газова емболія)
Буковинський державний медичний університет
17.
5. Присутність інших компонентів у розчині(закон Сеченова)
Розчинність газів у розчинах електролітів
порівняно з чистим розчинником зменшується
Буковинський державний медичний університет
18.
Теорії розчинівФізична теорія розчинів (Я. Вант-Гофф, С. Арреніус)
Розчинення - фізичний розподіл однієї речовини у іншій
без будь-якої взаємодії між розчиненою речовиною
і розчинником.
Хімічна теорія розчинів (Д.І. Менделеєв, Курнаков)
Розчинення – фізико-хімічний процес, що супроводжується хімічною взаємодією між молекулами розчинника і розчиненої речовини з утворенням сольватів
(гідратів).
Буковинський державний медичний університет
19.
Електроліти та неелектроліти.Теорія електролітичної дисоціації
Електроліти – речовини, водні розчини або розплави яких
проводять електричний струм
Основні положення електролітичної дисоціації
(1887р, Арреніус)
1. При розчиненні у воді електроліти дисоціюють з
утворенням додатньо заряджених катіонів і від’ємно
заряджених аніонів.
2. Сума додатніх зарядів дорівнює сумі від’ємних зарядів.
3. При пропусканні електричного струму через розчин
катіони рухаються до катоду, а аніони – до аноду.
Буковинський державний медичний університет
20.
Механізм дисоціаціїNa+
Cl-
Na+
Cl-
Na+
Cl-
Na+
Cl-
+
+ -
Na+
+
+
-
+
+
-
-
+
+
-
+
-
-
+
- +
-+
+
+
+
+ -
+
-
-
-
+
+
-
+
+
Буковинський державний медичний університет
-
+
-
+ -
Cl-
-+
+
H+
-
+
-
Na+
+
+
+ H-Cl _
-
+ -
-
-
+
-
+ -
+ + + + + -
+
+
+ -
+
+ - + - +
+
Cl
-
-
+
+
-
21.
Фактори, що впливають на електролітичну дисоціацію1. Природа речовини
2. Природа розчинника
3. Температура
4. Концентрація
Буковинський державний медичний університет
22.
Ступінь дисоціації (α) – відношення числа дисоційованихмолекул до загальної кількості молекул
N1
N
i 1
n 1
і – ізотонічний коефіцієнт
n – теоретично розрахована
кількість іонів при дисоціації
Буковинський державний медичний університет
23.
Класифікація електролітівα = (0,3–1) – сильні електроліти
(розчинні солі, сильні кислоти, луги, комплексні сполуки)
α = (0,3–0,03) –електроліти середньої сили
(фосфатні кислоти, сірчиста кислота)
α = (0,03–0) – слабкі електроліти
(органічні кислоти і основи, слабкі кислоти,
гідроксиди, комплексні іони)
Буковинський державний медичний університет
24.
Слабкі електролітиАВ
[АВ] = С,
K дис
А– + В+
[А–] = [В+] = αС
[A ] [B ] C C
[AB]
(1 - )C
2C
K дис
(1 - )
K дис
C
Закон розведення Оствальда
Буковинський державний медичний університет
25.
ПрикладиСН3СООН
K дис
СН3СОО– + Н+
[CH 3COO ] [H ]
[CH 3COOH]
Н2СО3
НСО3–
2
[CO3 ] [H ]
K1
[HCO3 ]
Н+ + НСО3–К1
Н+ + СО32–
[HCO 3 ] [H ]
K1
[H 2 CO3 ]
2
K заг
[CO3 ] [H ]2
[H 2 CO3 ]
Кзаг = К1·К2
Буковинський державний медичний університет
К2
26.
Основні положення теорії сильних електролітів• У водних розчинах сильні електроліти повністю
дисоціюють
• Кількість іонів у розчинах сильних електролітів завжди
менша теоретично розрахованої
+ + +
+
-
-
+-
+ + +
+
-+
+
+
-
-
+
+
-+
Na+
-
+
- +
-+
Na+
-
-
-
+
-
+
- +
-+
+
Cl+
-
+
Cl+
-
-
+
+ + -
+
-
+ + -
іонна пара
Буковинський державний медичний університет
-
+
- +
Cl-
-+
+ + +
+
+
-
+
+ + -
+
-
-
+
+
-+
Na+
-
-
-
+
27.
Основні положення теорії сильних електролітіва = f∙С
f – коефіцієнт активності,
С – розрахована концентрація
Іонна сила розчину - півсума добутків концентрації
кожного іону на квадрат його заряду.
1
1
2
2
2
2
I (Ca Z a Cb Z b Cc Z c ...) Ci Z i
2
2 i
lg f 0,5 Z
2
I
Формула Дебая-Хюккеля
Буковинський державний медичний університет
28.
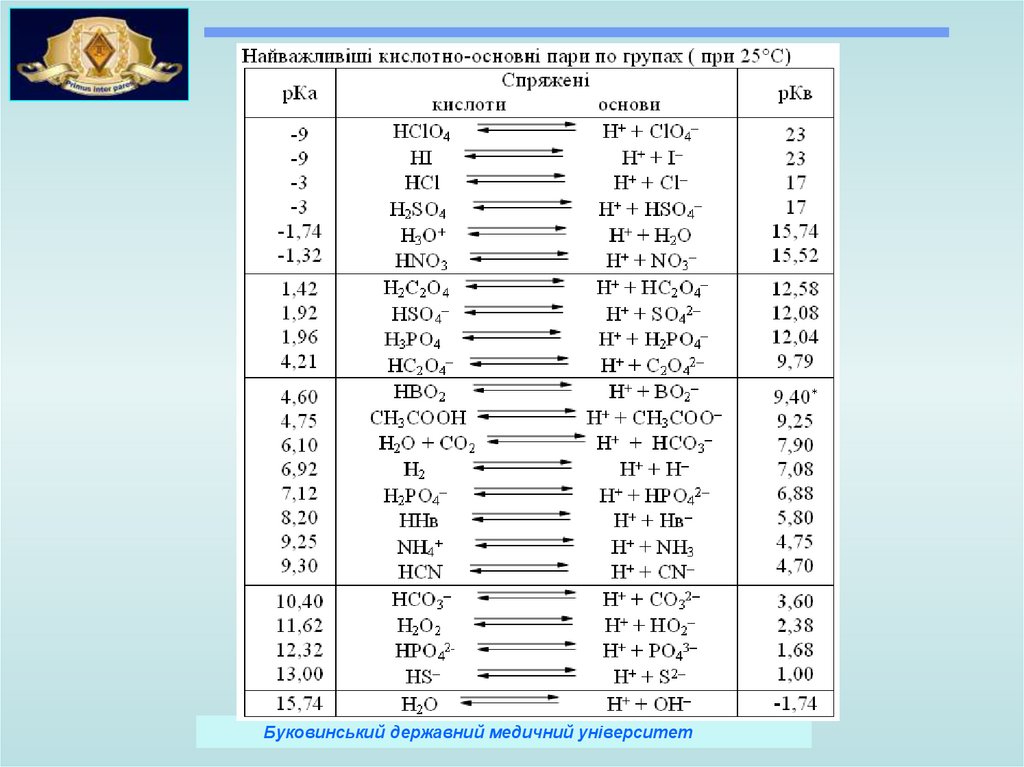
Теорії кислот і основПротолітична теорія кислот та основ Бренстеда-Лоурі
Кислотами називаються речовини, молекули або іони яких
можуть відщеплювати протони. Кислоти - донори протонів
Основами називаються речовини, молекули або іони яких
здатні приєднувати протони. Основи - акцептори протонів
Буковинський державний медичний університет
29.
Реакції, які супроводжуються переносом протонівназиваються протолізом або
протолітичними реакціями.
До протолітичних відносяться реакції:
-нейтралізації (взаємодія кислоти і основи з
утворенням солі і води),
-гідролізу (взаємодія солі і води з утворенням
кислоти і основи)
- дисоціації кислот і основ.
Буковинський державний медичний університет
30.
Теорії кислот і основіонізація
кислота
Н+ + основа
моля ризація
Кислоти і основи, зв'язані між собою приведеним співвідношенням, утворюють кислотно-основну пару або спряжену
систему і називаються спряженими
Буковинський державний медичний університет
31.
НаприкладCH3COOH
NH4+
H2PO4- -
H+ +
CH3COO H+ + NH3
H+ + HPO42 -
Кислота проявляє кислотні властивості лише в присутності
основи, здатної прийняти протон
СН3СООН + NН3 СН3СОО– + NН4+
кислота1
основа1
основа2 кислота2
Буковинський державний медичний університет
32.
У водних розчинахCH3COOH
+
H2O
Н3O+ + CH3COO-
[H3O ] [CH3COO ]
Kc
[H 2O] [CH3COOH]
[H3O ] [CH3COO ]
Kc [H 2O] Ka
[CH3COOH]
Ка - константа іонізації кислоти (константа кислотності)
кількісна міра відносної сили кислоти
рКа - показник константи кислотності, дорівнює від'ємному
десятковому логарифму константи кислотності
рКа = -lgКа
Для основ - константа основності Кв ( рКв = -lg Кв )
Буковинський державний медичний університет
33.
Буковинський державний медичний університет34.
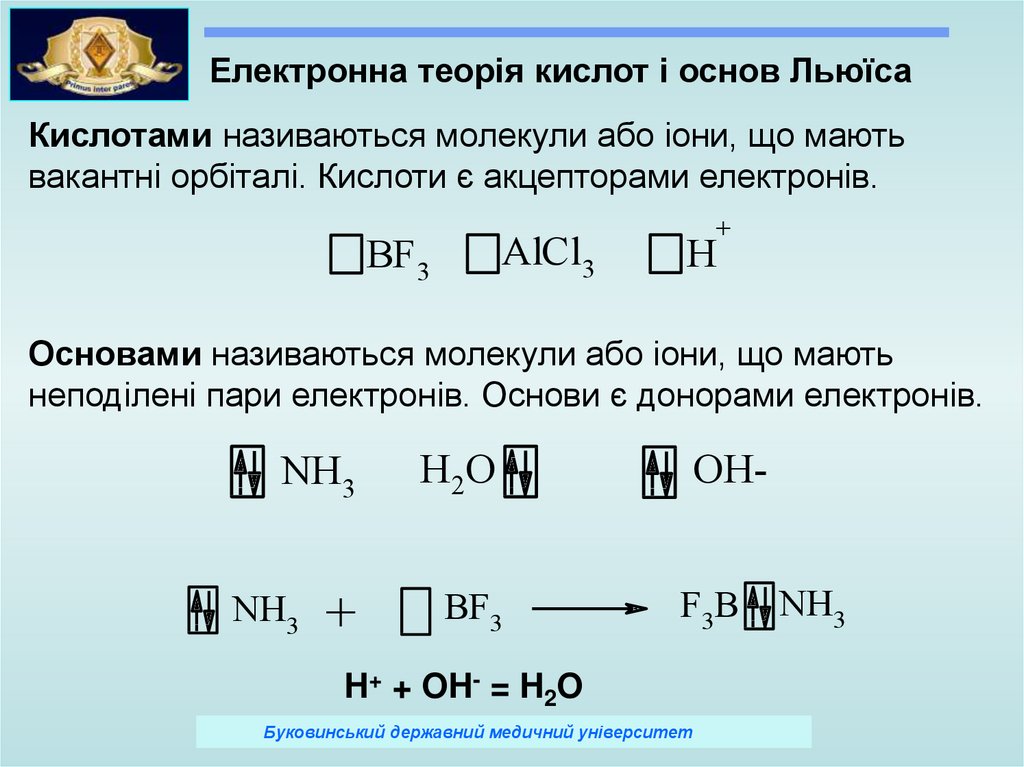
Електронна теорія кислот і основ ЛьюїсаКислотами називаються молекули або іони, що мають
вакантні орбіталі. Кислоти є акцепторами електронів.
AlCl3
BF3
+
H
Основами називаються молекули або іони, що мають
неподілені пари електронів. Основи є донорами електронів.
NH3
H2 O
+
BF3
NH3
OHF3B
H+ + OH- = H2O
Буковинський державний медичний університет
NH3
35.
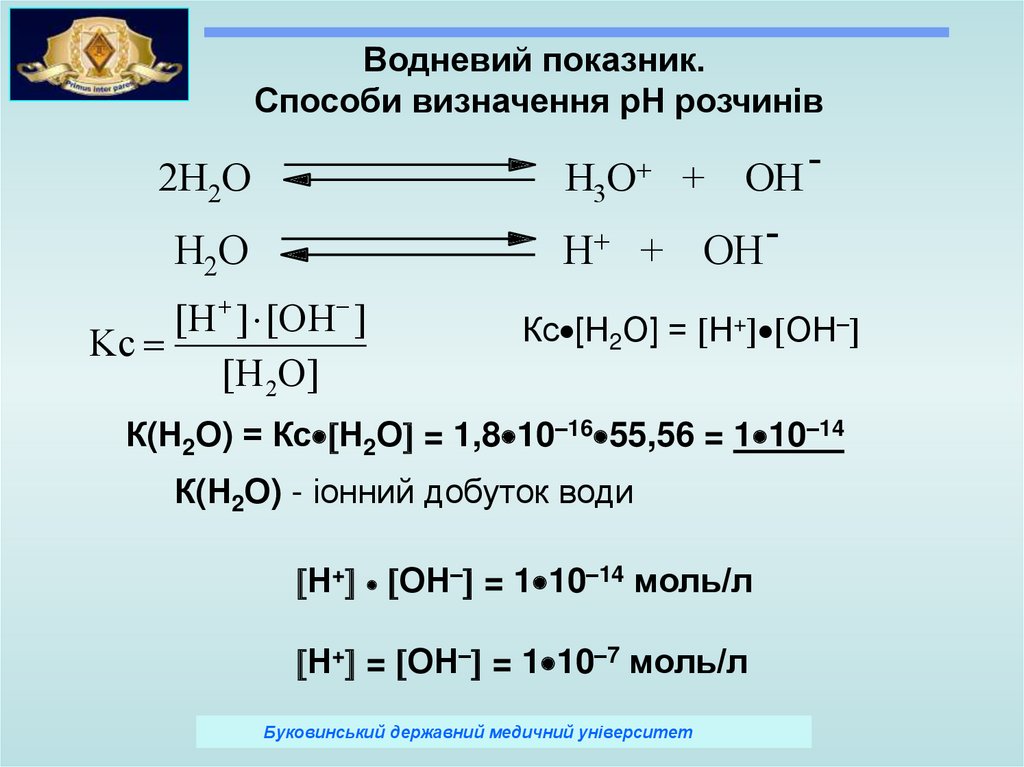
Водневий показник.Способи визначення рН розчинів
2H2O
Н3O+ + OH
-
Н+ + OH -
H2O
[H ] [OH ]
Kc
[ H 2 O]
Кс [Н2О] = Н+ ОН–
К(Н2О) = Кс Н2О = 1,8 10–16 55,56 = 1 10–14
К(Н2О) - іонний добуток води
Н+ ОН– = 1 10–14 моль/л
Н+ = ОН– = 1 10–7 моль/л
Буковинський державний медичний університет
36.
Для чистої водиН+ = ОН– = 1 10–7 моль/л
Н+ = ОН– = 1 10–7 моль/л - реакція середовища нейтральна
Н+ > 1 10–7 моль/л - реакція середовища кисла
Н+ < 1 10–7 моль/л - реакція середовища лужна
Буковинський державний медичний університет
37.
Водневий показник (рН) - величина, що дорівнює від'ємномудесятковому логарифму молярної концентрації іонів водню
рН = -lg Н+
рОН = -lg ОН–
і відповідно
рН + рОН = 14 (при 25°С)
Н+ ,
моль/л
Від 10–1 до 10–3
Від 10–3 до 10–7
10–7
Від 10–7 до 10–11
Від 10–11 до 10–
14
рН
реакція
середовища
1-3
3-7
7
7-11
11-14
сильнокисла
слабокисла
нейтральна
слабколужна
сильнолужна
Буковинський державний медичний університет
38.
Способи визначення рН розчинів кислот і основ1. Розрахунковий
Для розчинів кислот
Н+ = Са в
Для розчинів основ
ОН– = Св в
рН = -lg Н+
рОН = -lg ОН–
рН + рОН = 14 (при 25°С)
Буковинський державний медичний університет
39.
Способи визначення рН розчинів кислот і основ2. З допомогою кислотно-основних індикаторів
Інтервал переходу – діапазон значень рН, при якому відбувається
зміна кольору індикатора
Буковинський державний медичний університет
40.
Способи визначення рН розчинів кислот і основ3. З допомогою рН-метрів
Буковинський державний медичний університет
41.
Основи титриметричного аналізуМетод кількісного аналізу, в якому кількісний вміст речовини визначають
за об’ємом реактиву точної концентрації, що йде на титрування певного об’єму
розчину досліджуваної речовини, називають титриметричним аналізом.
Робочий розчин (титрант або стандартний) – це розчин реактиву відомої
концентрації, який використовують для знаходження концентрації розчинів
досліджуваних речовин.
Титрування –процес поступового повільного приливання до розчину однієї
речовини невеликих порцій розчину реагенту до точки еквівалентності
(завершення хімічної реакції)
Буковинський державний медичний університет
42.
Закон еквівалентівN р. р. V р. р. N д. р. Vд. р.
N р. р. V р. р.
1000
mд. р.
Eд . р .
де, Nр.р., Vр.р. - нормальність та об’єм робочого розчину, що пішов на
титрування, Nд.р., Vд.р., mд.р., Ед.р. - нормальність, об’єм досліджуваного
розчину або маса та молярна маса еквіваленту досліджуваної речовини.
Буковинський державний медичний університет
43.
Класифікація титриметричних методівЗа хімічною реакцією:
•кислотно-основні
•окисно-відновні
•осаджувальні
За методикою виконання:
•хімічні
•фізико-хімічні
Буковинський державний медичний університет
44.
Метод нейтралізації – метод титриметричного аналізув основі якого лежить реакція:
Н+ + ОН- = Н2О.
Алкаліметрія - робочим розчином є сильна основа;
визначають кислоти та солі слабких основ
Ацидиметрія - робочим розчином є сильна кислота;
визначають основи та солі слабких кислот
Буковинський державний медичний університет
45.
Алкаліметрія використовується для визначення рН шлункового сокуТитриметрична одиниця – кількість мл 0,1 н розчину NaOH, що
витрачається на 100 мл чистого (профільтрованого) шлункового соку.
• нормальна кислотність - 40-60 мл 0,1 н NaOH;
• знижена кислотність– менше 40 мл 0,1 н NaOH;
• підвищена кислотність – більше 60 мл 0,1 н NaOH.
Вільна кислотність шлункового соку зумовлена наявністю вільної
хлоридної кислоти,
Зв’язана кислотність зумовлена фосфатами, хлоридами білків та
інших основ, куди входить зв’язана хлоридна кислота і кислотний залишок
Загальна кислотність дорівнює сумі зв’язаної і вільної кислотності.
Буковинський державний медичний університет
46.
Посуд для виконання титриметричного аналізуКолба Ерленмеєра
Піпетка 20мл
Ручна мікропіпетка
Бюретка для титрування
(з краном)
Буковинський державний медичний університет
47.
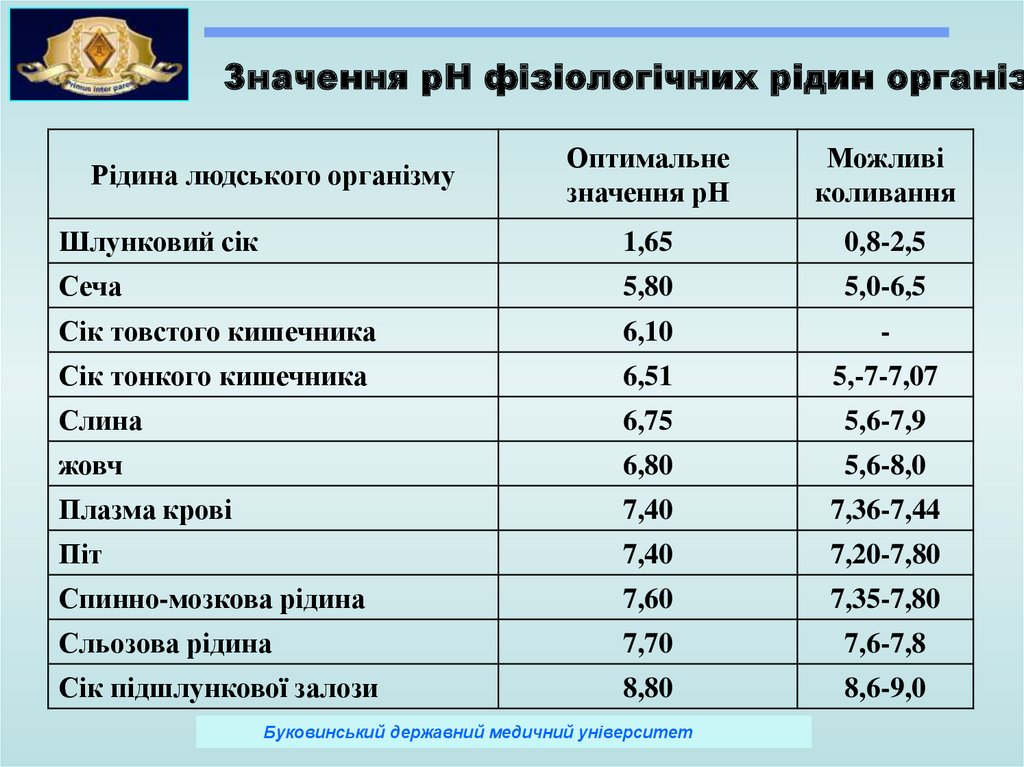
Значення рН фізіологічних рідин організОптимальне
значення рН
Можливі
коливання
Шлунковий сік
1,65
0,8-2,5
Сеча
5,80
5,0-6,5
Сік товстого кишечника
6,10
-
Сік тонкого кишечника
6,51
5,-7-7,07
Слина
6,75
5,6-7,9
жовч
6,80
5,6-8,0
Плазма крові
7,40
7,36-7,44
Піт
7,40
7,20-7,80
Спинно-мозкова рідина
7,60
7,35-7,80
Сльозова рідина
7,70
7,6-7,8
Сік підшлункової залози
8,80
8,6-9,0
Рідина людського організму
Буковинський державний медичний університет
48.
Буферні розчиниБуферними системами називаються розчини, здатні
підтримувати рН при додаванні невеликої кількості
кислоти або лугу, а також при розбавленні.
Буковинський державний медичний університет
49.
Буферні розчиниЗа складом буферні системи бувають двох типів:
1. Основні буферні системи - суміш слабкої основи
та її солі, утвореної сильною кислотою
(аміачний буфер NН4ОН + NН4Сl).
2. Кислотні буферні системи - суміш слабкої кислоти
та її солі, утвореної сильною основою
(ацетатний буфер СН3СООН + СН3СООNа,
бікарбонатний Н2СО3 + NаНСО3 та ін.)
3. Солі багатоосновних кислот
наприклад фосфатний буфер NаН2РО4 + Nа2НРО4.
Буковинський державний медичний університет
50.
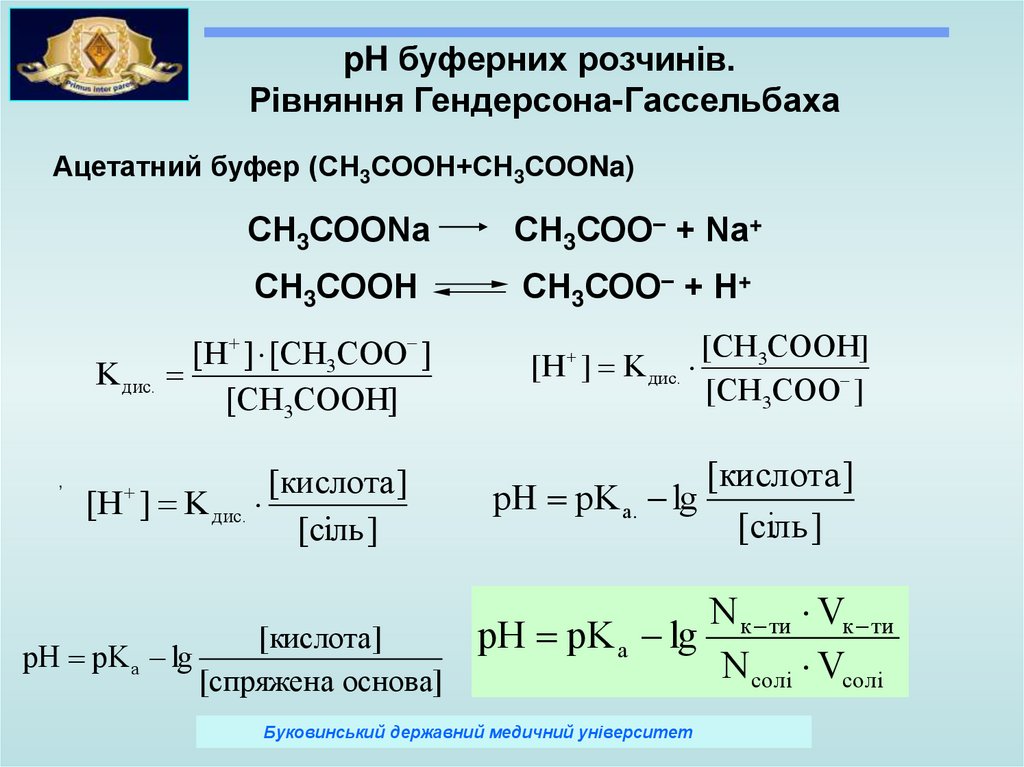
pH буферних розчинів.Рівняння Гендерсона-Гассельбаха
Ацетатний буфер (СН3СООН+СН3СООNa)
K дис.
,
СН3СООNа
СН3СОО– + Nа+
СН3СООН
СН3СОО– + Н+
[H ] [CH3COO ]
[CH3COOH]
[кислота ]
[H ] K дис.
[сіль ]
[кислота ]
pH рK а lg
[спряжена основа]
[CH3COOH]
[H ] K дис.
[CH3COO ]
[кислота ]
pH рK а . lg
[сіль ]
N к ти Vк ти
pH рK а lg
N солі Vсолі
Буковинський державний медичний університет
51.
Механізм дії буферних розчинівАцетатний буфер (СН3СООН+СН3СООNa)
СН3СООNа
СН3СОО– + Nа+
СН3СООН
СН3СОО– + Н+
Додавання сильної кислоти
СН3СООNа + НСl = CH3COOH + NaCl
pH рK а lg
N к ти Vк ти N HCl VHCl
N солі Vсолі N HCl VHCl
Додавання сильної основи
СН3СООН + NаОН = CH3COONa + H2O
N к ти Vк ти N NaOH VNaOH
pH рK а lg
N солі Vсолі N NaOH VNaOH
Буковинський державний медичний університет
52.
Буферна ємністьЗдатність буферних систем протидіяти зміні рН вимірюється буферною ємністю
Буферна ємність - це кількість моль-еквівалентів сильної кислоти
або лугу, які необхідно додати до 1 л буферного розчину, щоб
змістити рН на одиницю
C
B
pH pH 0
,
N к Vк
Bк
Vб (pH 0 pH)
N л Vл
Bл
Vб (pH pH 0 )
Буковинський державний медичний університет
53.
Біологічне значення буферних розчинівРегуляторні системи забезпечення сталості рН крові:
1) Буферні системи:
1. бікарбонатна – Н2СО3 + NаНСО3
2. фосфатна - NаН2РО4 +Nа2НРО4
3. білкова - РrоtСООН + РrоtОООNа,
4. гемоглобінова - ННв + КНв
5. оксигемоглобінова – ННвО2 + КНвО2
2) Діяльність легень.
3) Видільна функція нирок.
Ефективність дії :
~ 20 год - нирки
~1-3 хв - легені
~ 30 сек - буферні системи
Буковинський державний медичний університет
54.
Біологічне значення буферних розчинівГідрокарбонатний - найважливіший позаклітинний буфер
( 35% буферної дії плазми і 18% буферної дії еритроцитів.
Співвідношення компонентів Н2СО3/НСО3 - 1/20
(при рН плазми крові 7,40)
Лужний резерв організму.
Пониження до 46% - компенсований ацидоз,
Підвищення до 75% - компенсований алкалоз.
Перевищення - некомпенсований ацидоз і алкалоз.
Буковинський державний медичний університет
55.
Біологічне значення буферних розчинівІнші буферні системи:
Білкові буферні системи :
При рН = 7,40 білки плазми здатні зв'язати 18 ммоль
основ на 1 г плазми.
(ННв + КНв) – гемоглобінова буферна система;
(ННвО2 + КНвО2) – оксигемоглобінова буферна система.
(75% дії).
Гідрокарбонатна, гемоглобінова і оксигемоглобінова
буферні системи пов'язані з дихальною функцією крові.
Буковинський державний медичний університет
56.
Гідроліз солейГідролізом солей називається реакція солі з водою,
в результаті якої утворюються малодисоційовані або
малорозчинні електроліти
Константа гідролізу (Кгідр) – величина,
що характеризує гідроліз
Буковинський державний медичний університет
57.
Гідроліз за катіоном( солі, утворені слабкими основами і сильними кислотами)
NН4Сl + Н2О
NН4+ + Н2О
NН4ОН + НСl
NН4ОН + Н+
реакція середовища слабокисла
K ã³äð.
K H 2O
K ñëàáê.îñíîâè
Буковинський державний медичний університет
58.
Гідроліз за аніоном(солі, утворені слабкими кислотами і сильними основами)
КСN + Н2О
НСN + КОН
СN– + Н2О
НСN + ОН–
реакція середовища слаболужна
K гідр.
K H 2O
K слабк.к ти
Буковинський державний медичний університет
59.
Гідроліз за катіоном і аніоном(солі, утворені слабкими кислотами і основами)
NН4СN + Н2О
НСN + NН4ОН
реакція середовища нейтральна
K гідр.
K H 2O
K слабк.к ти K слабк.основи
Буковинський державний медичний університет
60.
Ступінь гідролізу - це відношення числа молекул солі,які прогідролізували, до загального числа молекул солі
в розчині
гідр.
К гідр.
Ссолі
Буковинський державний медичний університет
61.
Фактори, що впливають ступінь гідролізу :Природа солі. Чим слабша кислота або основа утворюють
сіль, тим більший ступінь гідролізу солі.
Концентрація солі. З розведенням розчину ступінь гідролізу
збільшується
Температура. З підвищенням температури ступінь гідролізу
збільшується.
Присутність в розчині солі інших електролітів.
Буковинський державний медичний університет
62.
Колігативні властивості розчинів неелектролітівКолігативними називаються властивості розчинів,
які не залежать від природи розчиненої речовини,
а визначаються лише кількістю частинок у розчині
(концентрацією розчину),
До них відносяться:
-зниження тиску пари розчинника над розчином,
- зниження температури замерзання та підвищення
температури кипіння розчину,
-осмотичний тиск.
Буковинський державний медичний університет
63.
Перший закон РауляТиск пари розчинника над розведеним розчином
нелеткої речовини прямо пропорційний концентрації
розчинника у розчині
Р = Р0 Х1
P
P0
Зниження тиску пари розчинника над розчином
дорівнює мольній долі розчиненої речовини
Р = Р0 Х2
Р0 - тиск насиченої пари над чистим розчинником;
Х1 - мольна доля розчинника;
Х2 - мольна доля розчиненої речовини
Буковинський державний медичний університет
64.
Другий закон РауляЗниження температури замерзання та підвищення
температури кипіння розведених розчинів неелектролітів
прямо пропорційне моляльній концентрації розчиненої
речовини
m( x) 1000
tЗ. = К В(Х) = К
M ( x) m( р ка , г )
К - кріоскопічна постійна,
для води = 1,86
m( x) 1000
Е - ебуліоскопічна постійна,
tк. = Е В(Х) = Е
M ( x) m( р ка , г ) для води = 0,62
Метод визначення молекулярної маси розчиненої речовини,
що ґрунтується на вимірюванні зниження температур замерзання
Або кипіння розчинів називається відповідно кріоскопією або ебуліоскопією
Буковинський державний медичний університет
65.
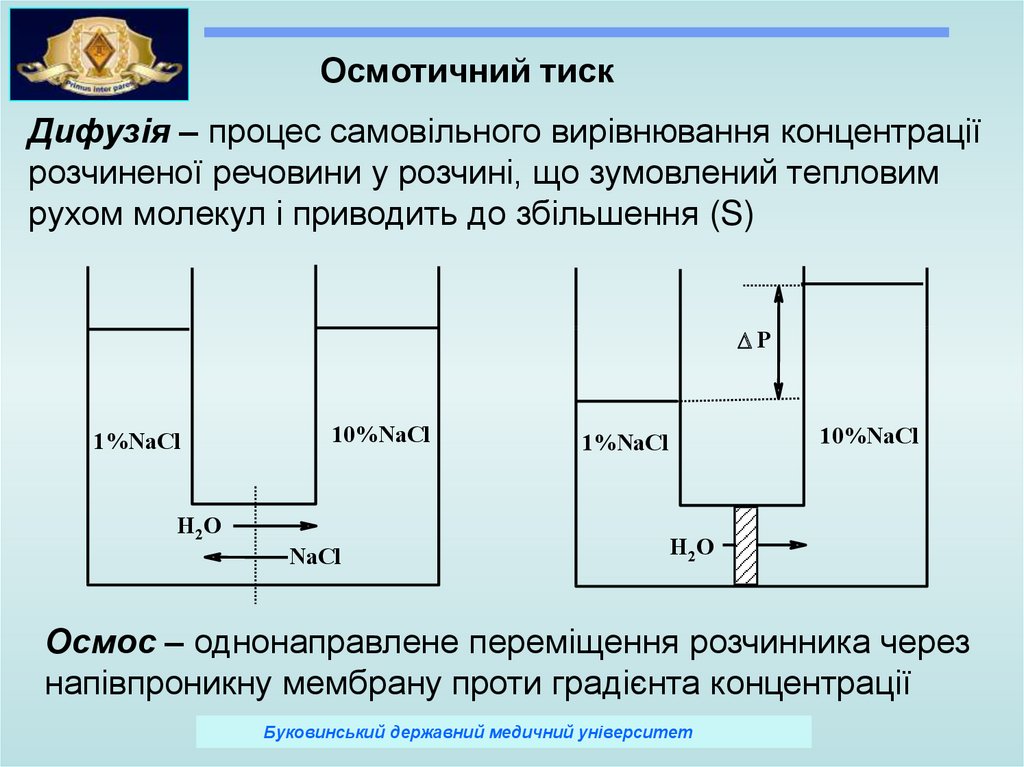
Осмотичний тискДифузія – процес самовільного вирівнювання концентрації
розчиненої речовини у розчині, що зумовлений тепловим
рухом молекул і приводить до збільшення (S)
P
1%NaCl
10%NaCl
H2 O
NaCl
10%NaCl
1%NaCl
H2 O
Осмос – однонаправлене переміщення розчинника через
напівпроникну мембрану проти градієнта концентрації
Буковинський державний медичний університет
66.
Осмотичний тиск - тиск, необхідний, щоб зупинити осмосЗакон Вант-Гоффа (1886 р.)
Осмотичний тиск прямопропорційний молярній
концентрації і абсолютній температурі розчину
= СRТ
m( x ) 1000
RT
M( x ) Vрозчину
Метод визначення молекулярних мас речовин за величиною
осмотичного тиску їх розчинів називається осмометрією.
Буковинський державний медичний університет
67.
Ізотонічний коефіцієнт (і) – коефіцієнт, що показуєреальну кількість частинок у розчині
tк. = і Е В(Х) ;
tЗ. = і К В(Х) ;
Буковинський державний медичний університет
= і СRТ
68.
Значення осмотичного тискудля біологічних систем
Осмотичний тиск крові людини при 37ОС - 7,4-7,7 атм.
700-800 кПа
Онкотичний тиск – осмотичний тиск, зумовлений розчиненими у крові
Високомолекулярними речовинами
Осмомолярність – загальна концентрація низькомолекулярних і
високомолекулярних речовин у крові, що створюють осмотичний
тиск (в організмі людини 0,303моль/л )
Буковинський державний медичний університет
69.
Значення осмотичного тискудля біологічних систем
Ізотонічні - розчини, що мають осмотичний тиск, рівний
осмотичному тиску крові
Гіпотонічні - розчини, що мають осмотичний тиск,
менший ніж осмотичний тиск крові
Гіпертонічні - розчини, що мають осмотичний тиск,
менший ніж осмотичний тиск крові
Буковинський державний медичний університет
70.
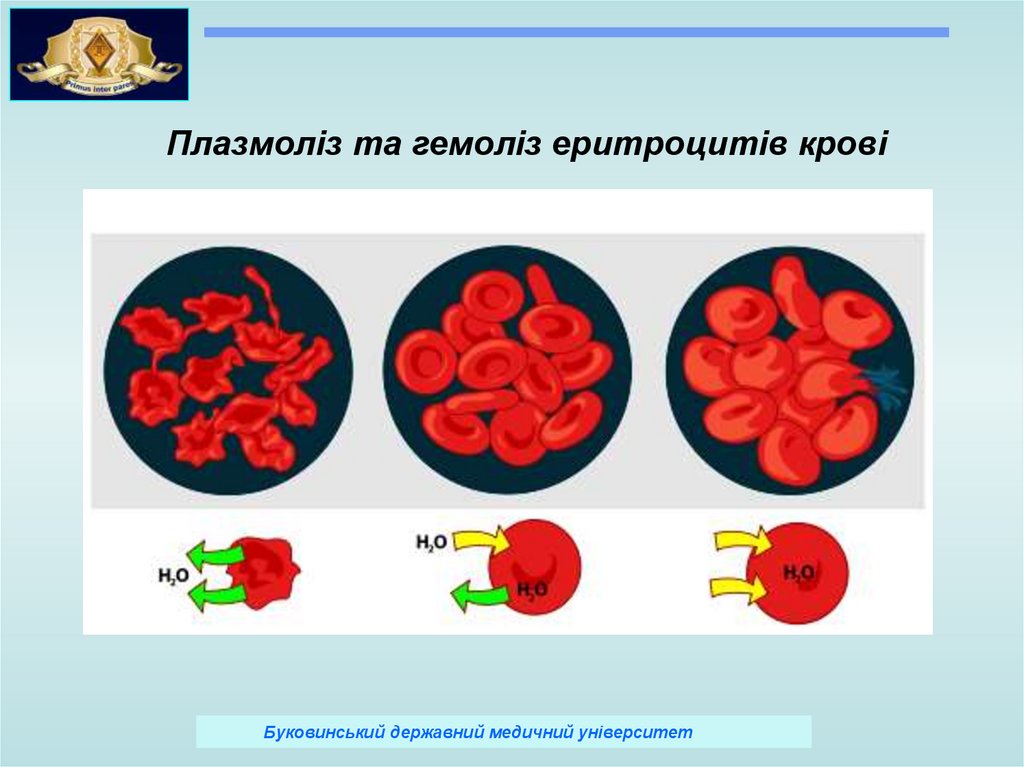
Плазмоліз та гемоліз еритроцитів кровіБуковинський державний медичний університет
71.
Значення осмотичного тискудля біологічних систем
0,9% розчин NaCl – ізотонічний розчин, фізрозчин –
кровозамінник, розчинник для інтравенозного введення ліків
5% розчин глюкози – ізотонічний розчин – кровозамінник,
при загальному ослабленні організму
5-10% розчини NaCl – гіпертонічні розчини – в хірургії, для
очищення ран
Буковинський державний медичний університет






























































 chemistry
chemistry








