Similar presentations:
Электрический ток в жидкостях
1.
2. Цель урока:
1. Ввести определение понятий:- электролиты;
- электрическая диссоциация;
- степень диссоциации.
2. Рассмотреть явление электролиза.
3. Закон Фарадея.
4. Применение электролиза в технике.
3. Жидкости
• диэлектрики- дистиллированная вода• проводники- растворы и расплавы
электролитов: кислот, щелочей и солей
• полупроводники –расплавленный
селен, расплавы сульфидов
4.
Электролиты – этовещества, растворы и
расплавы которых
обладают ионной
проводимостью.
5. Почему при растворении в воде твердый полярный диэлектрик становится проводником электрического тока? Рассмотрим процесс
растворения в воде CuCl26.
Электрическая диссоциация – распадмолекул электролита на положительные и
отрицательные ионы под действием
эл.поля полярных молекул воды.
Степень диссоциации – доля в растворенном
веществе молекул, распавшихся на ионы.
Зависит от температуры, концентрации
раствора , эл.свойств растворителя.
Рекомбинация – процесс объединения ионов
разных знаков в нейтральные молекулы.
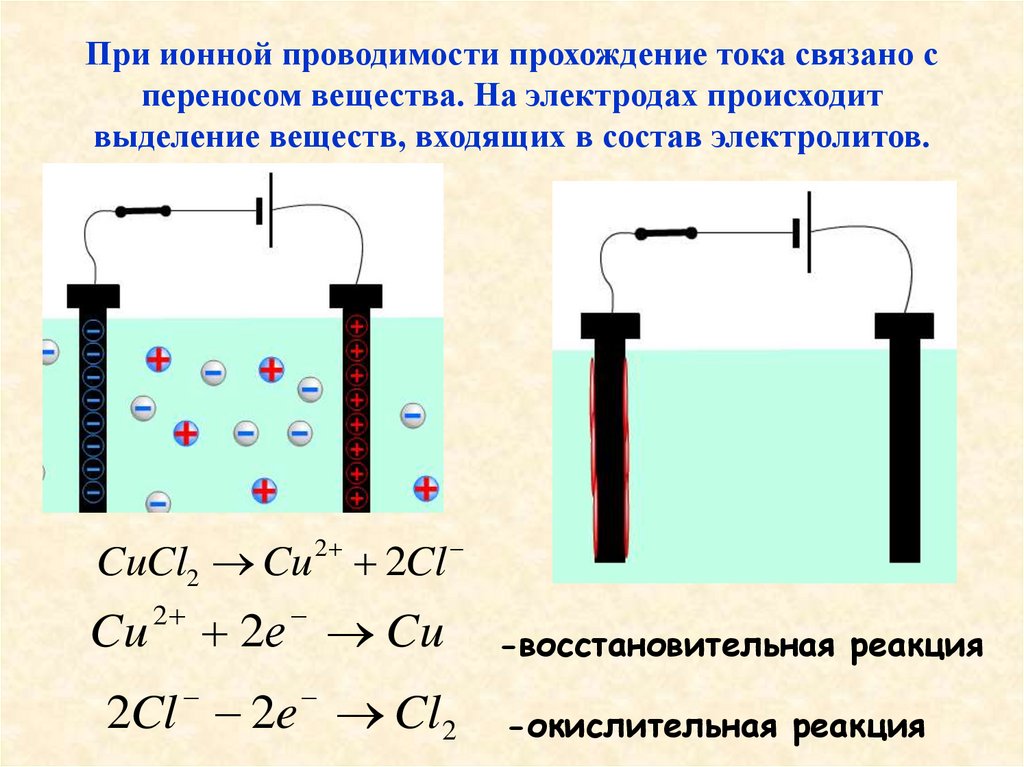
7. При ионной проводимости прохождение тока связано с переносом вещества. На электродах происходит выделение веществ, входящих в
состав электролитов.2
CuCl2 Cu 2Cl
Cu
2
2е Cu
2Cl 2e Cl2
-восстановительная реакция
-окислительная реакция
8.
Процесс выделения на электродахвещества, связанный с окислительновостановительной реакцией –
называется электролизом.
Явление электролиза
было открыто в 1800г
анг. физиками
У.Никольсом и А.Карлейлем.
9. От чего зависит масса вещества, выделившегося на электродах за определённое время? Закон электролиза (Закон Фарадея).
Открыт в 1833 г. анг. физиком Майклом Фарадеем10.
m m 0 i N iM
m0i
Na
q
Ni
q 0i
q0i n e
M I t
m
N a ne
M
m
I t
N a ne
M
k
N a ne
m k I t
m k q
11.
Масса вещест ва,выделившегося на элект роде
за время Δt при прохождении
элект рического т ока,
прямопропорциональна силе
тока и времени
K – элект рохимический
эквивалент вещест ва (зависит
от молярной массы вещест ва
«М» и валент ност и «n»)
Физ. смысл k – численно равен
массе вещест ва,
выделившегося на элект роде
при прохождении через
элект ролит заряда в 1 Кл.
m k I t
1
M
k
Na e n
12.
Na e F- постоянная Фарадея
F= 9,65 *10-4 Кл/моль
Физ.смысл F- численно равна
заряду, который надо пропустить
через раствор электролита, чтобы
выделить на электроде 1 моль
одновалентного вещества.
13.
Применение электролиза в технике:1.
2.
3.
4.
Гальваностегия- декоративное или антикоррозийное покрытие
металлических изделий тонким слоем другого металла
(никелирование, хромирование, омеднение, золочение).
Гальванопластика- электролитическое изготовление
металлических копий, рельефных предметов. Этим способом
были сделаны фигуры для Исаакиевского собора в СанктПетербурге.
Электрометаллургия-получение чистых металлов при
электролизе расплавленных руд (Al, Na, Mg, Be).
Рафинирование металлов- очистка металлов от примесей.
14.
Алмазный инструмент,изготовленный методом
гальваностегии
гальваническое
наращивания тонкого слоя
15.
Венцы, чеканка, камни, золочение16.
Итог урока.Д/з §113, стр.388 № 8,9
Проверочная работа
https://quizizz.com/join?gc=481839



















 physics
physics








