Similar presentations:
Электрический ток в жидкостях
1.
2. Цель занятия:
1. Ввести определение понятий:- электролиты;
- электрическая диссоциация;
- степень диссоциации.
2. Рассмотреть явление электролиза.
3. Закон Фарадея.
4. Применение электролиза в технике.
3. План урока:
1. Электролиты. Электропроводностьрастворов электролитов.
2. Электролиз.
3. Закон Фарадея.
4. Применение электролиза в
технике.
4.
Элект ролит ы – эт овещест ва, раст воры
и расплавы
кот орых обладают
ионной
проводимост ью.
5.
Жидкости,как
и
тв.тела
м/б
проводниками эл.тока. В жидких металлах
носителями эл.тока (заряда) являются
электроны, поэтому говорят, что жидкие
металлы
обладают
электронной
проводимостью.
В растворах и расплавах электролитов
(солей, кислот и щёлочей) перенос
зарядов
под
действием
эл.поля,
осуществляется «+» и «-» ионами,
которые движутся в противоположных
направлениях.
6. Почему при растворении в воде твердый полярный диэлектрик становится проводником электрического тока? Рассмотрим процесс
растворения в воде CuCl2В растворе появляются свободные носители эл.тока +Си и –
Cl, которые окружены полярными молекулами воды.
Данное явление называется электролитической
диссоциацией.
7.
Электрическая диссоциация – расщеплениемолекул электролита на положительные и
отрицательные ионы под действием
растворителя.
Степень диссоциации – отношение числа
молекул, диссоциировавших на ионы, к
общему количеству молекул данного
вещества.
Рекомбинация – процесс объединения ионов
разных знаков в нейтральные молекулы.
8.
Вследствие теплового движения молекул
растворимость зависит от температуры. «+»
и «-» ионы могут возникать и при плавлении
тв.электролитов в результате распада
полярных
молекул
из-за
увеличения
амплитуды тепловых колебаний.
• Наряду
с
процессом
диссоциации
(распада) молекул в электролитах возможен
обратный процесс.
• При сближении ионов разных знаков
возможно их объединение в одну молекулу –
рекомбинация.
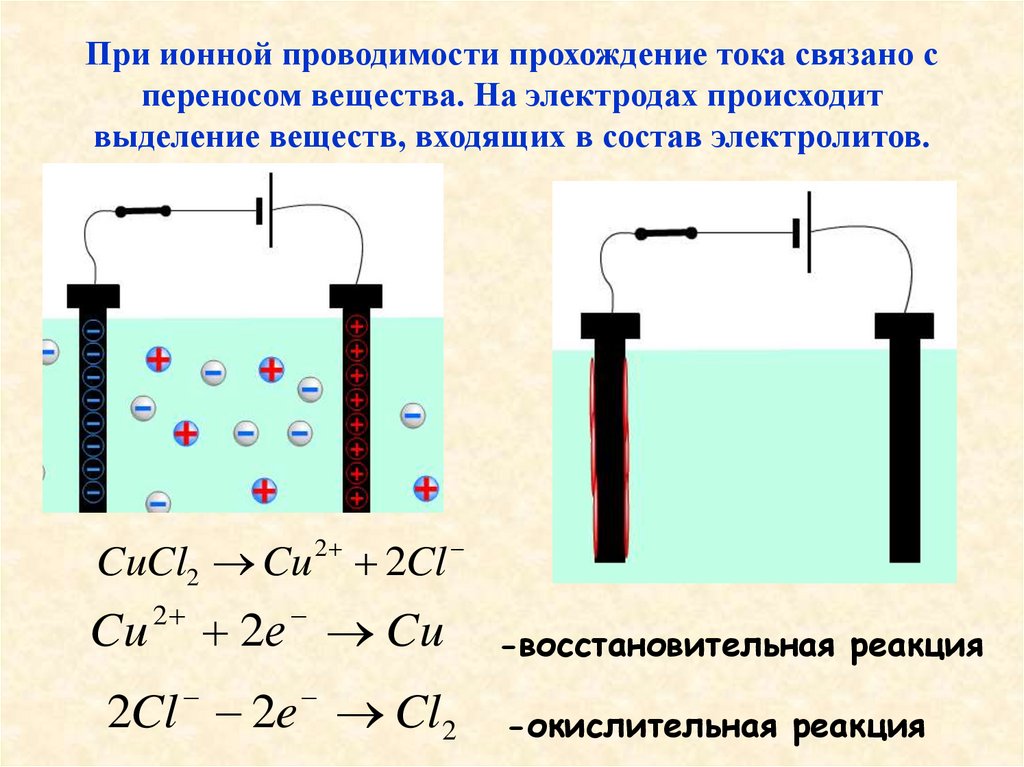
9. При ионной проводимости прохождение тока связано с переносом вещества. На электродах происходит выделение веществ, входящих в
состав электролитов.2
CuCl2 Cu 2Cl
Cu
2
2е Cu
2Cl 2e Cl2
-восстановительная реакция
-окислительная реакция
10.
Процесс выделения на электродахвещества, связанный с окислительновостановительной реакцией –
называется электролизом.
Явление электролиза
было открыто в 1800г
анг. физиками
У.Никольсом и А.Карлейлем.
11. От чего зависит масса вещества, выделившегося на электродах за определённое время? Закон электролиза (Закон Фарадея).
Открыт в 1833 г. анг. физиком Майклом Фарадеем12.
Масса вещест ва,выделившегося на элект роде
за время Δt при прохождении
элект рического т ока,
прямопропорциональна силе
тока и времени
K – элект рохимический
эквивалент вещест ва (зависит
от молярной массы вещест ва
«М» и валент ност и «n»)
Физ. смысл k – численно равен
массе вещест ва,
выделившегося на элект роде
при прохождении через
элект ролит заряда в 1 Кл.
m k I t
m k q
1
M
k
Na e n
13.
Na e F- постоянная Фарадея
F= 9,65 *10+4 Кл/моль
Физ.смысл F- численно равна
заряду, который надо пропустить
через раствор электролита, чтобы
выделить на электроде 1 моль
одновалентного вещества.
14.
Применение электролиза в технике:1.
2.
3.
4.
Гальваностегия- декоративное или антикоррозийное покрытие
металлических изделий тонким слоем другого металла
(никелирование, хромирование, омеднение, золочение).
Гальванопластика- электролитическое изготовление
металлических копий, рельефных предметов. Этим способом
были сделаны фигуры для Исаакиевского собора в СанктПетербурге.
Электрометаллургия-получение чистых металлов при
электролизе расплавленных руд (Al, Na, Mg, Be).
Рафинирование металлов- очистка металлов от примесей.
15.
Алмазный инструмент,изготовленный методом
гальваностегии
гальваническое
наращивания тонкого слоя

















 physics
physics








