Similar presentations:
Азотсодержащие вещества
1. Азотсодержащие вещества
2.
3. Цель и задачи
ОбразовательныеРазвивающие
Воспитательные
4. Образовательные
-сформировать представления у учащихся об аминах, ихклассификации, физических и химических свойствах,
получении и применении
5. Развивающие
-развитие умений работать в команде и использоватьразличные источники получения информации при изучении
данной темы
6. Воспитательные
-воспитание патриотизма и гордости на основе изучениятрудов и жизнедеятельности Н.Н.Зинина,
великого химика-органика
7. Применение
Лакокрасочная Производствопромышленность лекарственных
препаратов
Производство
Полимеров
аминопластов
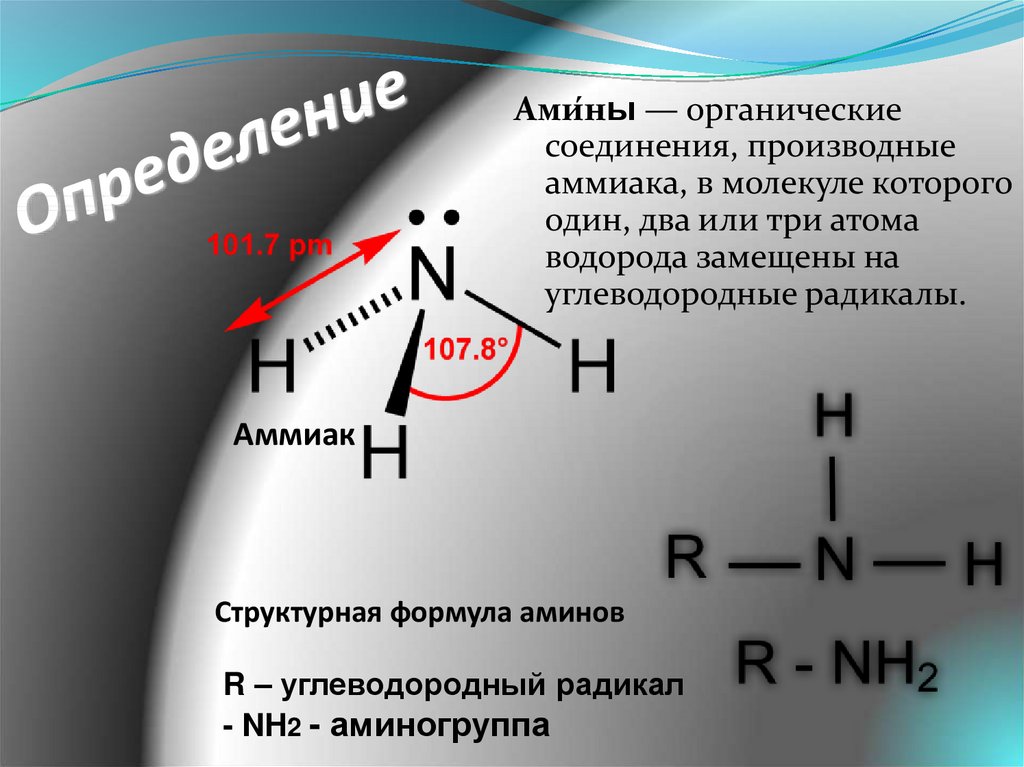
8. Определение
Ами́ны — органическиесоединения, производные
аммиака, в молекуле которого
один, два или три атома
водорода замещены на
углеводородные радикалы.
Аммиак
Структурная формула аминов
R – углеводородный радикал
- NH2 - аминогруппа
9. Классификация
Однозамещённые аминыДвухзамещённые амины
Трёхзамещённые амины
10. Однозамещённые амины
R-NH2CH3 – NH2
C2H5 – NH2
C3H7 – NH2
C4H9 – NH2
Метиламин
Этиламин
Пропиламил
Бутиламин
11. Двухзамещённые амины
HI
CH3 – N – CH3
Диметиламин
H
I
CH3 – N – C2H5
Метилэтиламин
12. Трёхзамещённые амины
CH3I
CH3 – N – CH3
Триметиламин
CH3
I
CH3 – N – C2H5
Диметилэтиламин
13. Химические свойства Аминов
1.Горение:4CH3– NH2+ 9O2 → 4 CO2+10 H2O+2 N2
14.
Химические свойства Аминов2.Взаимодействие с водой:
CH3 – NH2 +HOH→ [CH3-NH3]OH
Метиламин
Гидроксид метиламмония
15.
Химические свойства Аминов3.Взаимодействие с кислотами:
CH3-NH2 + HCl → [CH3NH3]Cl
метиламин
хлорид метиламмония
16. Проверь себя
Напиши уравнения реакций и назовиполученные вещества
CH3-NH2 + H2SO4 →
CH3-NH2 + H3PO4 →
17. Ответы:
o2CH3-NH2 +H2SO4 → [CH3NH3]2SO4
метиламин
o
CH3-NH2 + H2SO4 → [CH3NH3]HSO4
метиламин
o
дигидрофосфат метиламмония
2 CH3–NH2 +H3PO4 → [CH3NH3]2HPO4
метиламин
o
гидросульфат метиламмония
CH3–NH2 + H3PO4 → [CH3NH3]H2PO4
метиламин
o
сульфат метиламмония
гидрофосфат метиламмония
3 CH3–NH2 +H3PO4 → [CH3NH3]3PO4
метиламин
фосфат метиламмония
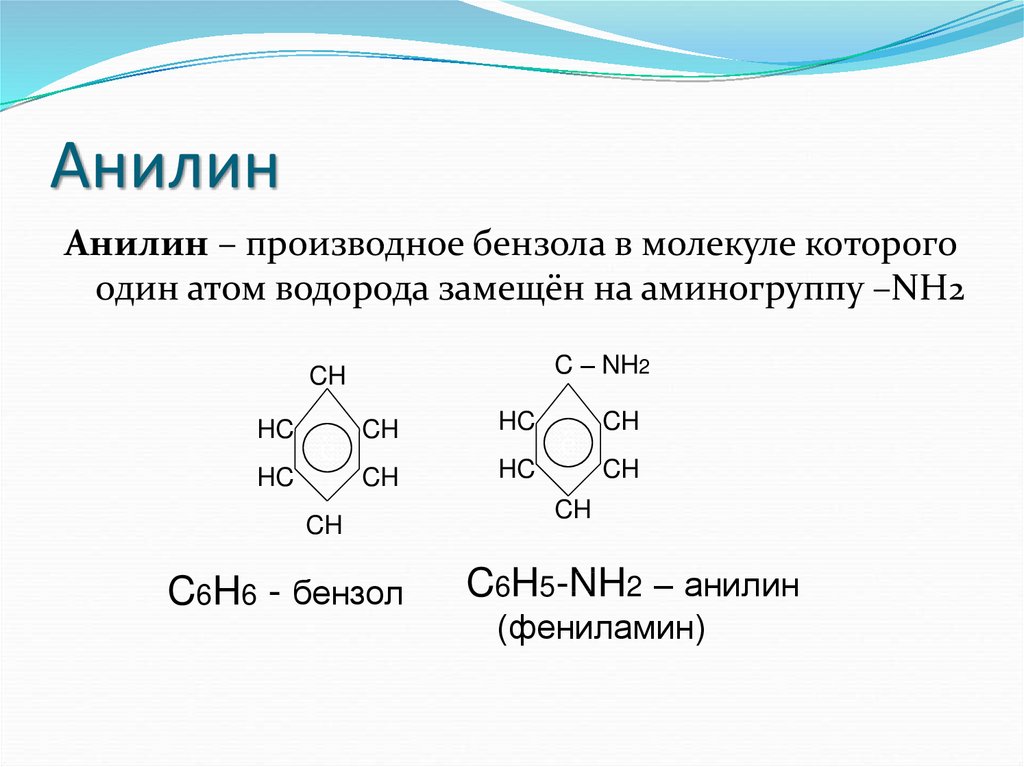
18. Анилин
Анилин – производное бензола в молекуле которогоодин атом водорода замещён на аминогруппу –NH2
C – NH2
CH
HC
HC
ё
CH
HC
CH
HC
CH
C6H6 - бензол
ё
CH
CH
CH
C6H5-NH2 – анилин
(фениламин)
19. Получение анилина
1.Нитрование бензолаt
С6H6 + H O – NO2 → C6H5NO2 + H2O
бензол
H2SO4
нитробензол
2.Реакция Н.Н. Зинина (1842 г.)
t
3
C2H5NO2 + H2 → С6H5NH2 +2H2O
нитробензол
Кат.
анилин
20. Реакция Зинина
Реакция Зинина — метод получения ароматических аминоввосстановлением нитросоединений:
R-NO2+ 6H = R-NH2+2H2O.
Таким путем впервые был получен анилин, 1-нафтиламин. Эту
реакцию впервые осуществил Н. Н. Зинин в 1842 г. Действуя на
нитробензол сульфидом аммония, он получил анилин:
C6H5NO2 + 3(NH4)2S → C6H5NH2 + 6NH3 + 3S + 2H2O
21. Зинин Николай Николаевич
(1812 – 1880)«Если бы Зинин Н.Н. не сделал ничего
более, кроме превращения
нитробензола в анилин, то и тогда его
имя осталось бы написанным
золотыми буквами в истории химии»
22. Научные открытия Н.Н. Зинина
Профессор Казанского университета,затем Медико-хирургической академии
в Петербурге
Основал школу химиков-органиков
Открыл реакцию восстановления
нитробензола в анилин
Синтезировал много новых
органических веществ
23. Физические свойства анилина
Анилин – бесцветная маслянистаяжидкость, малорастворимая в
воде, обычно светло-коричневого
цвета вследствие частичного
окисления на воздухе, сильно
ядовит
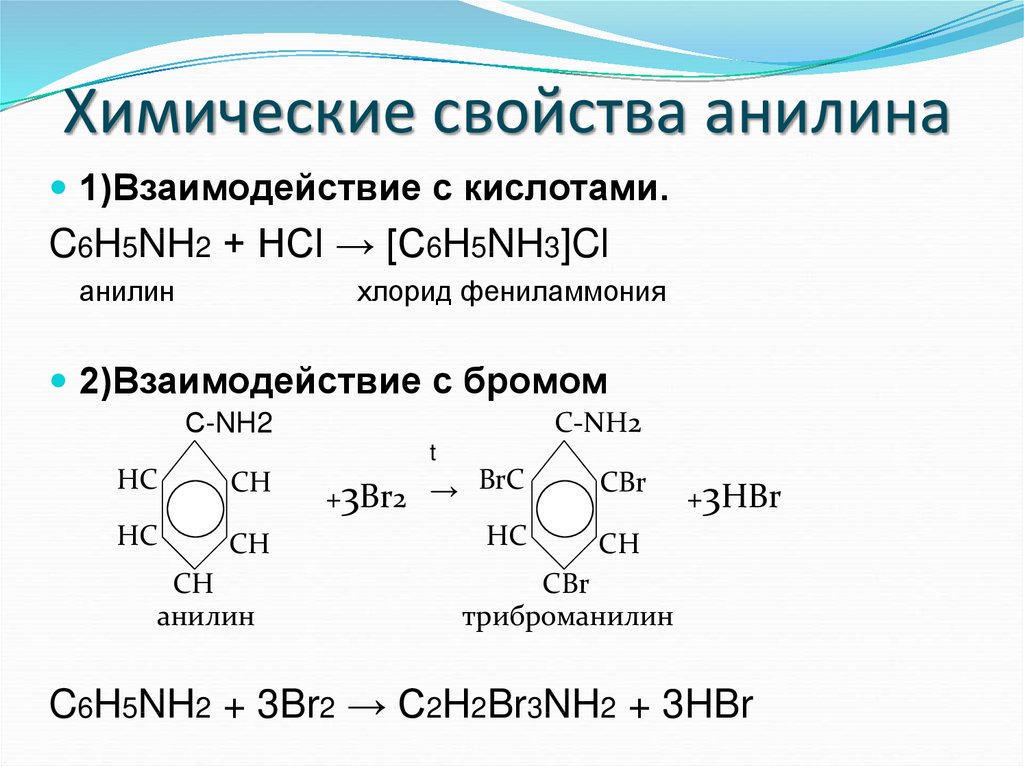
24. Химические свойства анилина
1)Взаимодействие с кислотами.C6H5NH2 + HCl → [С6H5NH3]Cl
анилин
хлорид фениламмония
2)Взаимодействие с бромом
С-NH2
С-NH2
t
HC
CH
HC
CH
CH
анилин
BrC
→
+3Br2
HC
CBr
+3HBr
CH
CBr
триброманилин
C6H5NH2 + 3Br2 → C2H2Br3NH2 + 3HBr
25. Развитие лакокрасочной промышленности
Красочные изображенияна стенах пещерных жилищ
15 000 лет до н.э
26. Первые краски
Чтобы изготовить цветные покрытия, первобытный человексмешивал сажу и земляные пигменты с животными жирами,
перетирая их между камнями до тех пор, пока не
образовывалась пастообразная масса
27.
Использование натуральных красителейИндиго
Красный пурпур
28.
Возникновение лакокрасочнойпромышленности
Современная красочная промышленность создана
сравнительно недавно меньше чем 200 лет назад.
Еще не существовало готовых красок и приходилось
перед употреблением смешивать и перетирать
ингредиенты
29. Современная лакокрасочная промышленность
Производство синтетических красителей на основе анилина30. Проверь себя
Составьте уравнение реакции горения этиламина,считая, что азот при этом выделяется в
свободном виде
Определить массу сульфат фениламмония,
полученного из 150г. анилина, если выход
продукта 70% от теоретически возможного


























 chemistry
chemistry








