Similar presentations:
Окислительно-восстановительные реакции
1.
ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫЕРЕАКЦИИ
2.
Атомы химическихэлементов
изменяют степень
окисления
3.
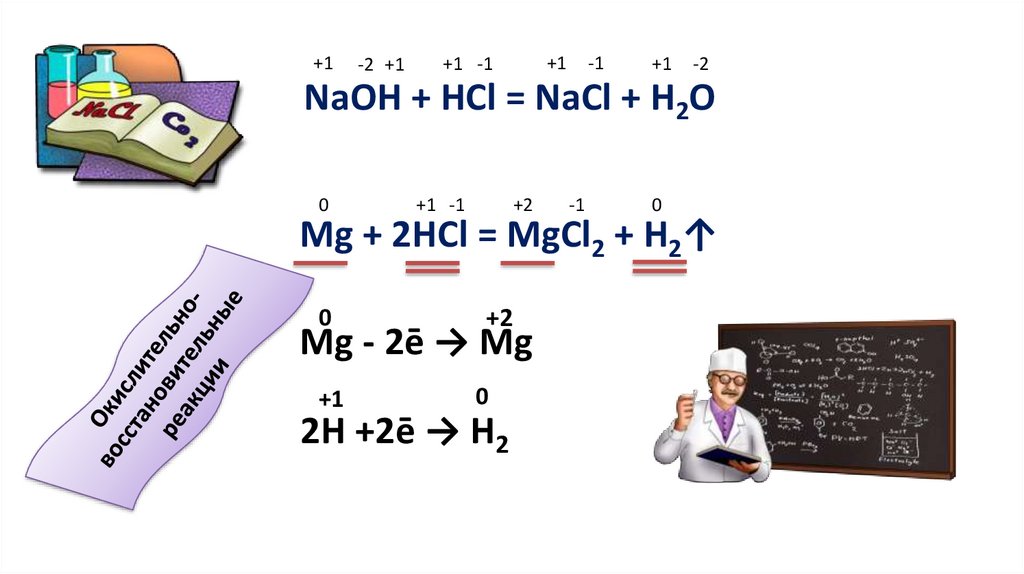
+1-2 +1
+1
+1 -1
-1
+1
-2
NaOH + HCl = NaCl + H2O
0
+1 -1
+2
-1
0
Mg + 2HCl = MgCl2 + H2↑
0
+2
Mg - 2ē → Mg
+1
0
2H +2ē → H2
4.
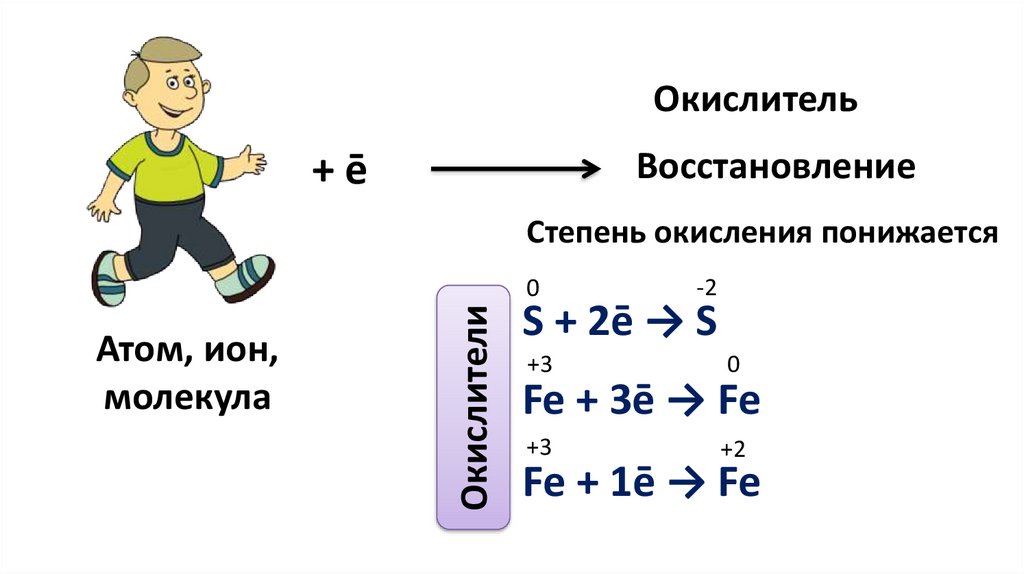
ОкислительВосстановление
+ē
Степень окисления понижается
Атом, ион,
молекула
Окислители
0
-2
S + 2ē → S
+3
0
Fe + 3ē → Fe
+3
+2
Fe + 1ē → Fe
5.
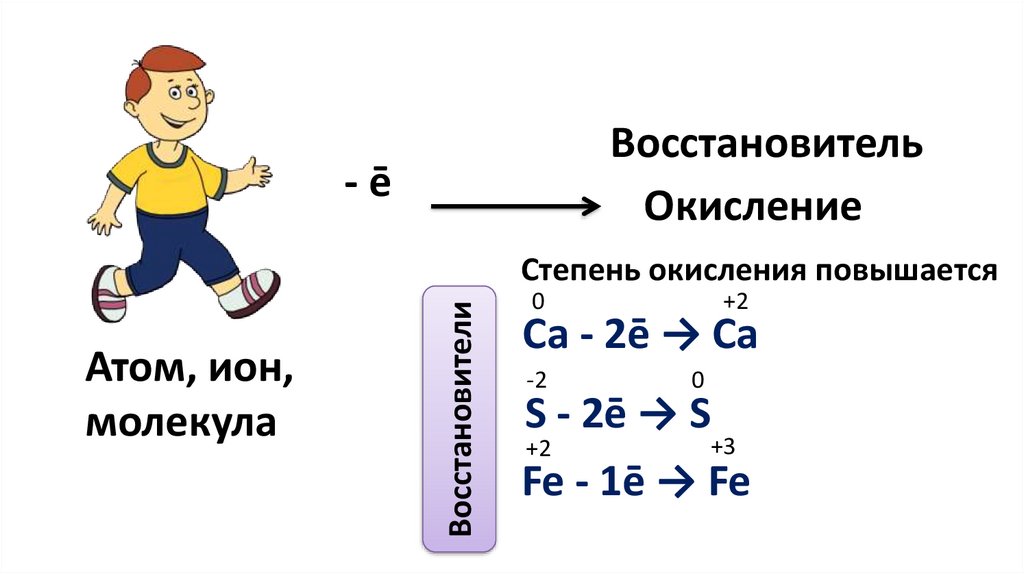
ВосстановительОкисление
-ē
Атом, ион,
молекула
Восстановители
Степень окисления повышается
0
+2
Са - 2ē → Са
-2
0
S - 2ē → S
+3
+2
Fe - 1ē → Fe
6.
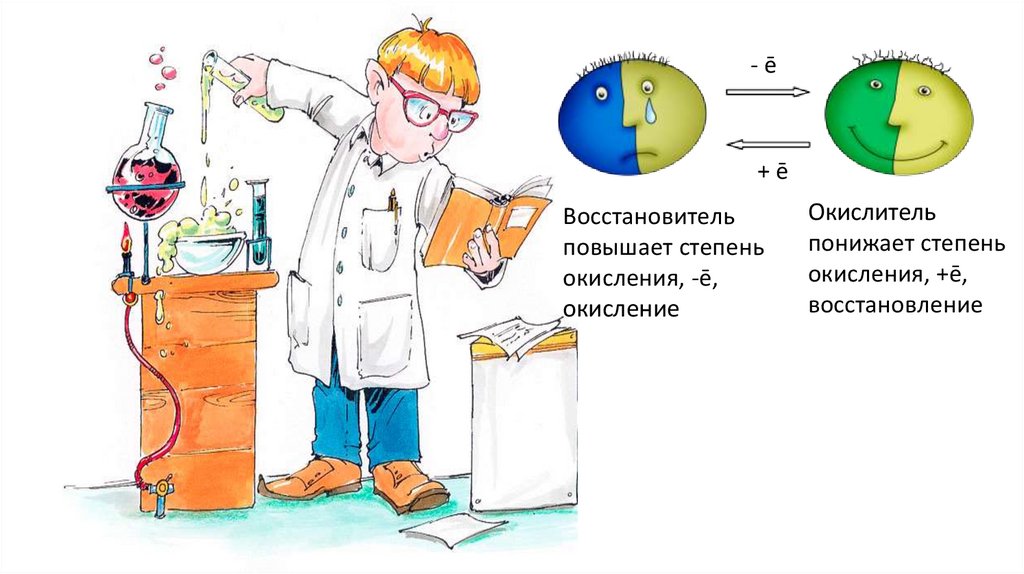
-ē+ē
Восстановитель
повышает степень
окисления, -ē,
окисление
Окислитель
понижает степень
окисления, +ē,
восстановление
7.
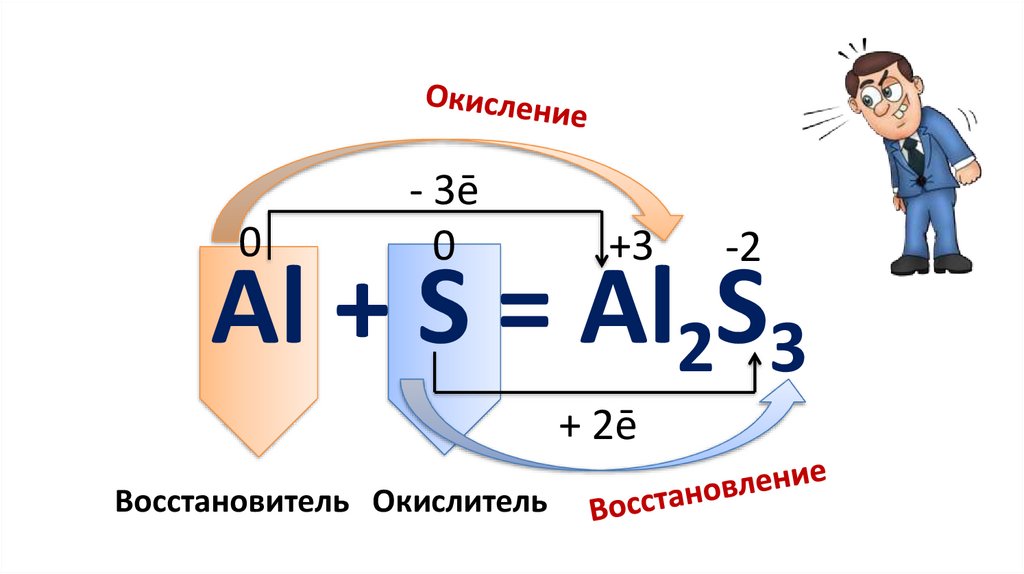
0- 3ē
0
+3
-2
Al + S = Al2S3
+ 2ē
Восстановитель Окислитель
8.
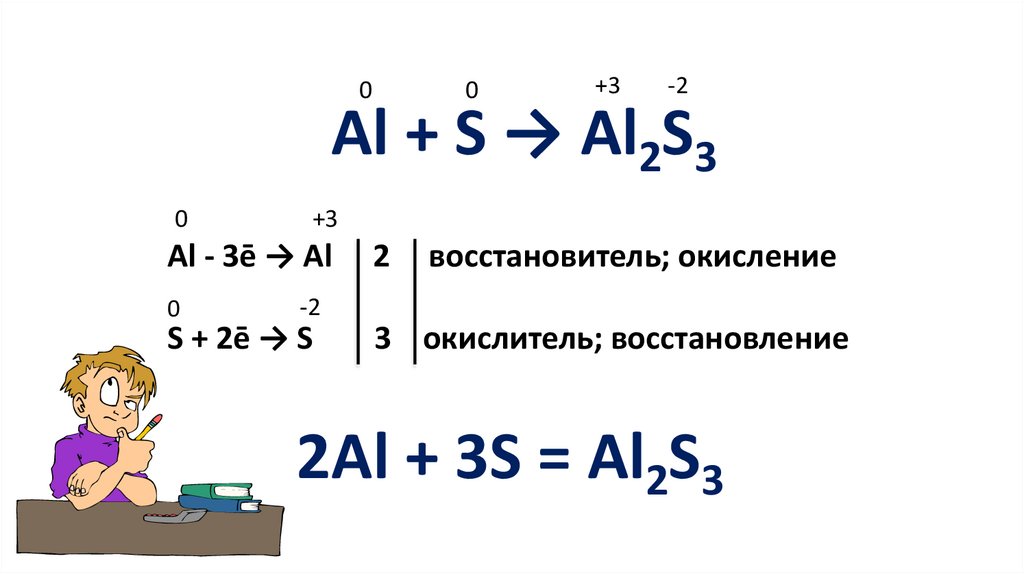
00
+3
-2
Al + S → Al2S3
0
+3
Al - 3ē → Al
0
2
восстановитель; окисление
-2
S + 2ē → S
3 окислитель; восстановление
2Al + 3S = Al2S3
9.
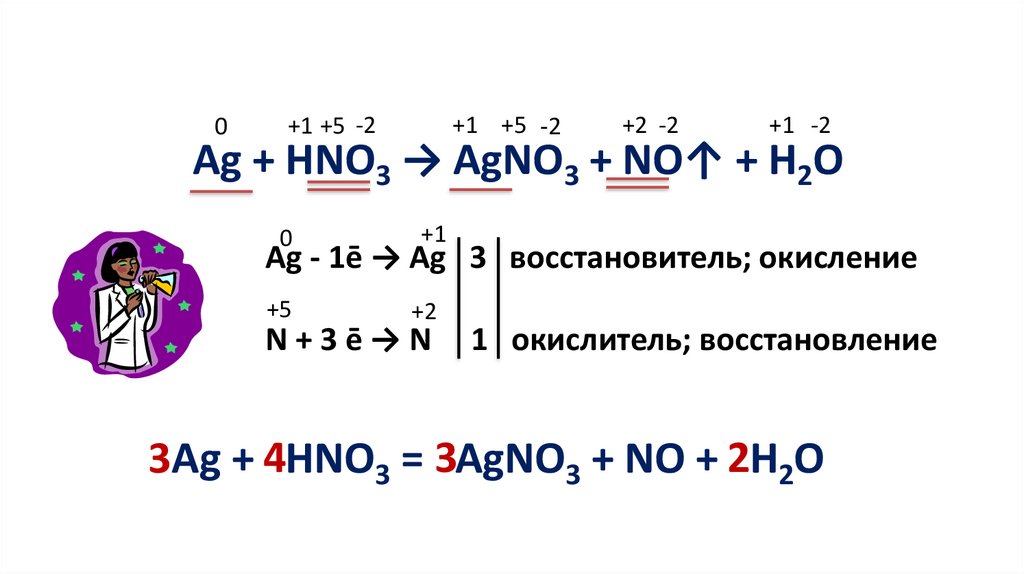
0+1 +5 -2
+1 +5 -2
+2 -2
+1 -2
Ag + HNO3 → AgNO3 + NO↑ + H2O
0
+1
Ag - 1ē → Ag 3 восстановитель; окисление
+5
+2
N+3ē→N
1 окислитель; восстановление
3Ag + 4HNO3 = 3AgNO3 + NO + 2H2O
10.
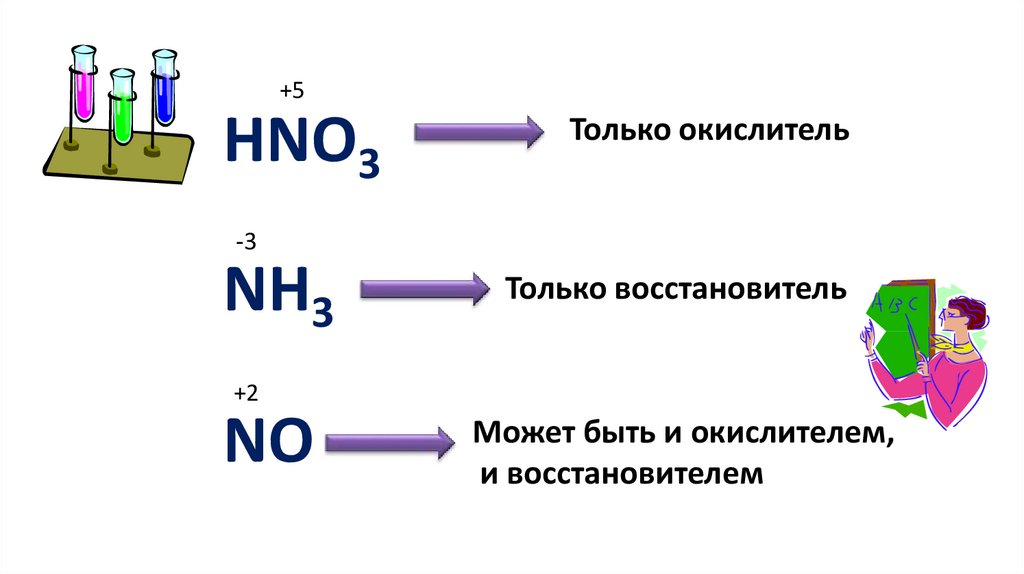
+5HNO3
Только окислитель
-3
NH3
Только восстановитель
+2
NO
Может быть и окислителем,
и восстановителем
11.
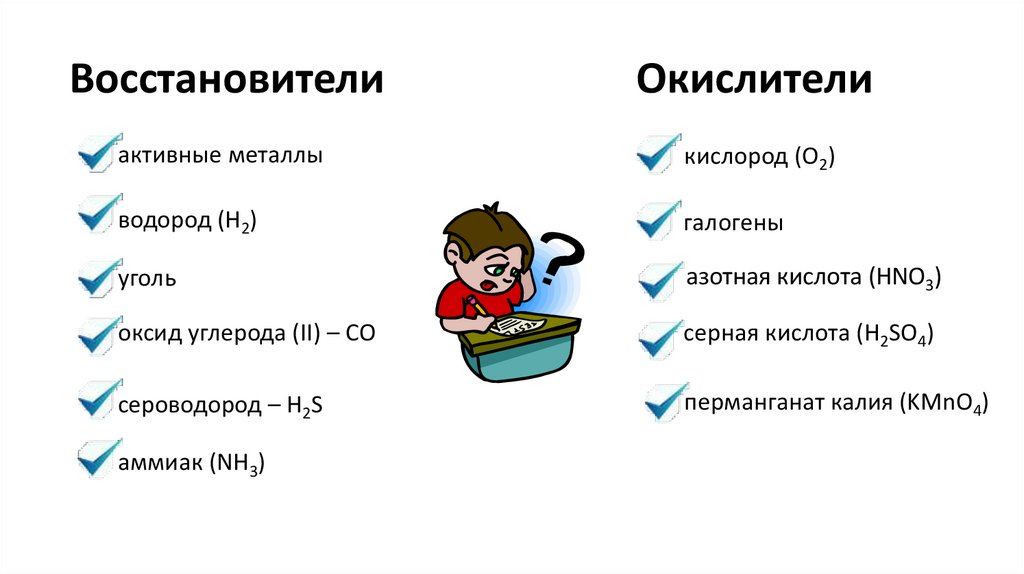
ВосстановителиОкислители
активные металлы
кислород (O2)
водород (H2)
галогены
уголь
азотная кислота (HNO3)
оксид углерода (II) – CO
серная кислота (H2SO4)
сероводород – H2S
перманганат калия (KMnO4)
аммиак (NH3)


 chemistry
chemistry








