Similar presentations:
Важнейшие соединения алюминия
1. Важнейшие соединения алюминия
2. Цель урока:
• Образовательная-Обеспечить в ходе урока усвоения знаний о соединениях алюминия:
оксидах и гидроксидах.
- Продолжить формирование умений составлять уравнения реакций с
участием амфотерных соединений.
- Создать содержательные и организационные условия для
самостоятельного применения школьниками комплекса знаний и
способов деятельности.
- Организовать проверку и оценку знаний и способов деятельности
учащихся.
Развивающая
- Развитие у школьников умение выделять главное, существенное в
изучаемом материале, обобщать сами факты, логически развивать свои
мысли.
- Развивать умения и навыки работы с учебником, тетрадью,
дополнительной литературой.
3.
Структура урока:
I этап – организационный
II этап – актуализация знаний
III этап – добыча новых знаний
IV этап – закрепление
V этап - домашнее задание
VI этап – рефлексия.
4.
5. Добыча новых знаний
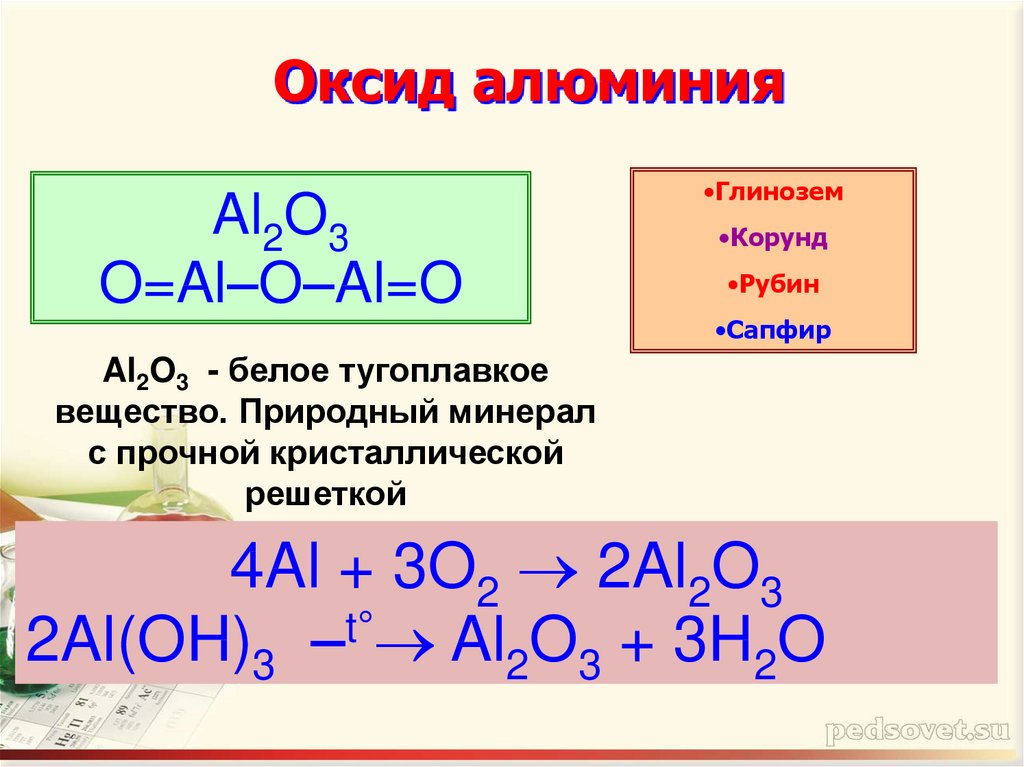
6. Оксид алюминия
Al2O3O=Al–O–Al=O
•Глинозем
•Корунд
•Рубин
•Сапфир
Al2O3 - белое тугоплавкое
вещество. Природный минерал
с прочной кристаллической
решеткой
4Al + 3O2 2Al2O3
2Al(OH)3 –t° Al2O3 + 3H2O
7.
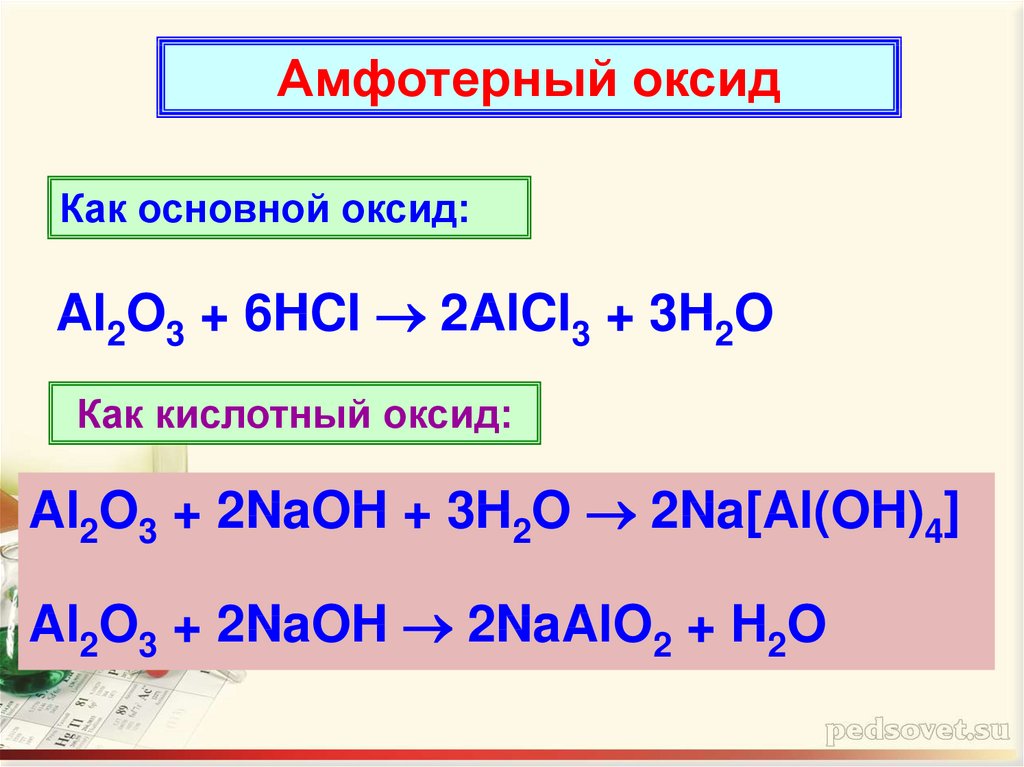
Амфотерный оксидКак основной оксид:
Al2O3 + 6HCl 2AlCl3 + 3H2O
Как кислотный оксид:
Al2O3 + 2NaOH + 3H2O 2Na[Al(OH)4]
Al2O3 + 2NaOH 2NaAlO2 + H2O
8. Гидроксид алюминия
Al(OH)3Гидроксид алюминия Al(OН)3 – белое, кристаллическое вещество, не
растворимое в воде амфотерное основание, которое получается при
взаимодействии соли алюминия и щелочи.
AlCl3 + 3NaOH Al(OH)3 + 3NaCl
9.
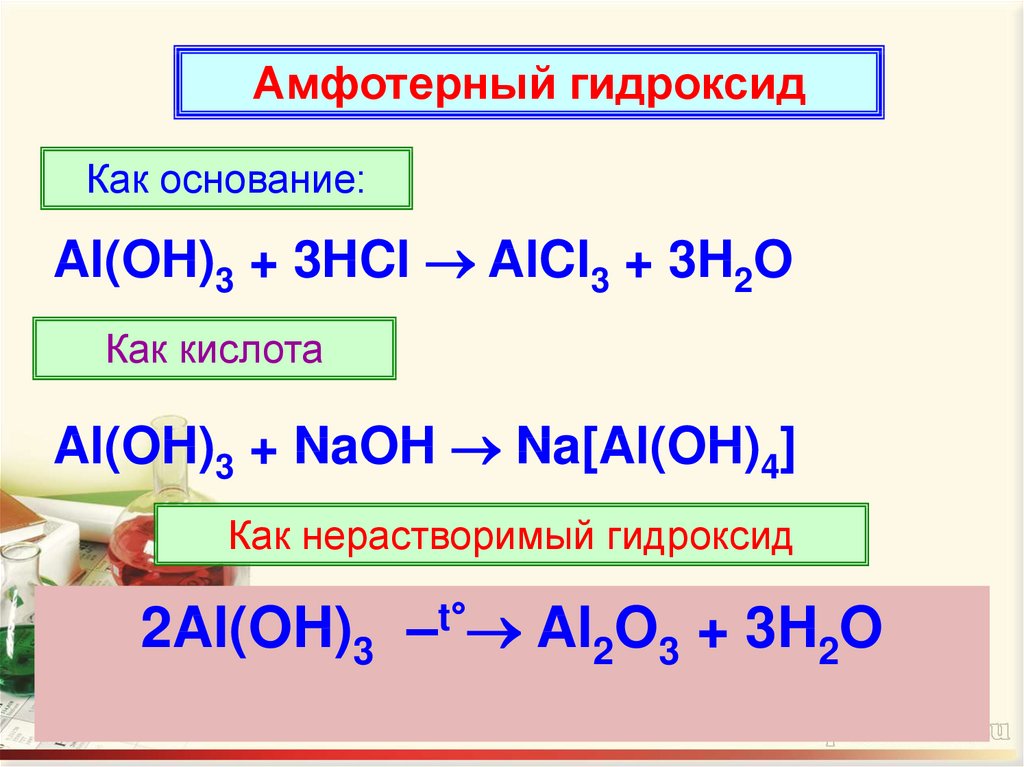
Амфотерный гидроксидКак основание:
Al(OH)3 + 3HCl AlCl3 + 3H2O
Как кислота
Al(OH)3 + NaOH Na[Al(OH)4]
Как нерастворимый гидроксид
2Al(OH)3 –t° Al2O3 + 3H2O
10.
Соли алюминияРастворимы в воде
Соли неустойчивых
алюминиевых кислотортоалюминиевой Н3AlO3 и
метаалюминиевой НAlO2
называют алюминатами
Al2O3 + 6NaOH = 2Na3AlO3 + 3H2O
Нерастворимые в воде:
фосфаты
Разлагаются водой:
сульфиты, сульфиды
Природные алюминаты:
благородная шпинель и
драгоценный хризоберилл
11.
Применение Al и егосоединений
В чистом виде алюминий находит применение изза своей мягкости: из него изготавливают
прокладки для герметизации различных
приборов, провода т. к. этот металл третий по
электропроводности.
Большая часть производимого алюминия идет
для получения легких сплавов.
Дюралюмин по прочности на разрыв близок к
стали, но почти в 3 раза легче её. Его используют
для производства самолетов.
12.
13.
Сплавы алюминия используют встроительстве, т. к. из них легко изготовить
различные профили балок и разные
конструкции
14.
Гель из гидроксида алюминия входит в составлекарств для лечения болезней желудка.
Гидроксид алюминия используется для очистки
воды, т. к. обладает способностью поглощать
различные вещества.
Оксид алюминия в виде корунда используется
как образивный материал для обработки
металлических изделий.
Оксид алюминия в виде рубина широко
используется в лазерной технике.
Оксид алюминия применяется в качестве
катализатора, для разделения веществ в
хроматографии.
Хлорид алюминия AlCl3 – катализатор в
производстве органических веществ.
15.
Применение сапфиров и рубинов16.
Закрепление17.
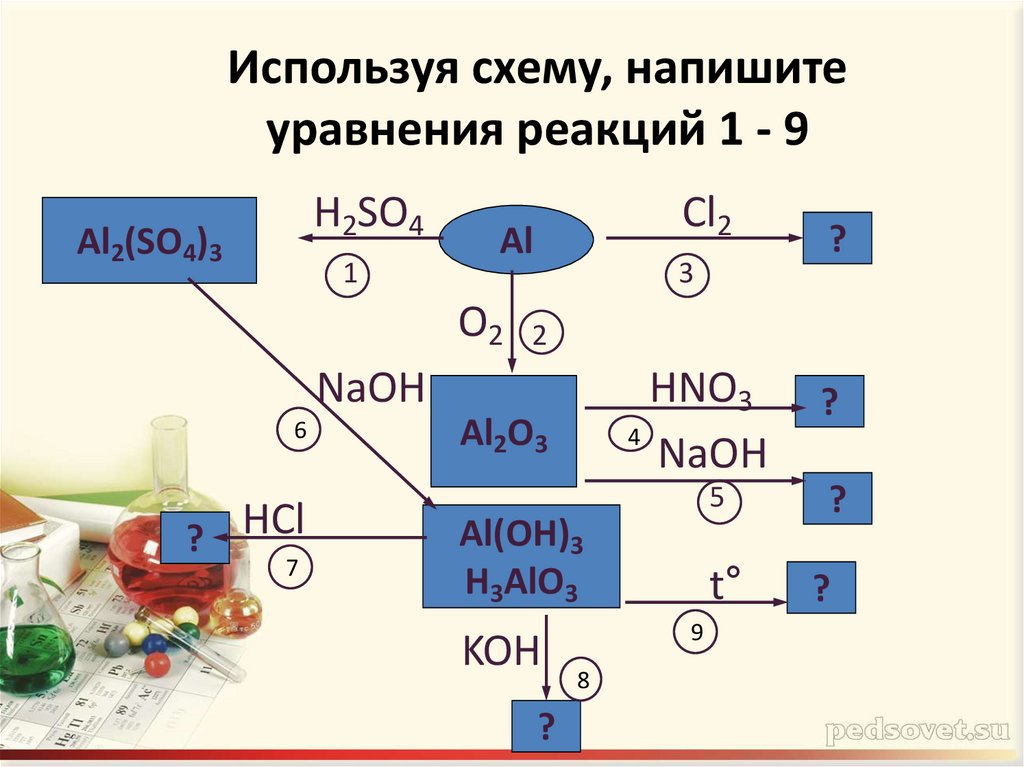
18. Используя схему, напишите уравнения реакций 1 - 9
H2SO4Al2(SO4)3
1
Cl2
Al
O2
3
2
NaOH
6
? HCl
7
?
HNO3
4
NaOH
Al2O3
5
Al(OH)3
H3AlO3
KOH
?
t°
9
8
?
?
?
19. Домашнее задание:
§ 47, № 520.
РЕФЛЕКСИЯМне все понравилось
Мне ничего не понятно
Мне было интересно
Мне было скучно
Мне было легко
Мне было трудно
Я узнал много нового
Я не узнал ничего нового
















 chemistry
chemistry








