Similar presentations:
Токи в жидкостях
1. Электрический ток в жидкостях. Законы электролиза
ЭЛЕКТРИЧЕСКИЙ ТОК В ЖИДКОСТЯХ.ЗАКОНЫ ЭЛЕКТРОЛИЗА
2.
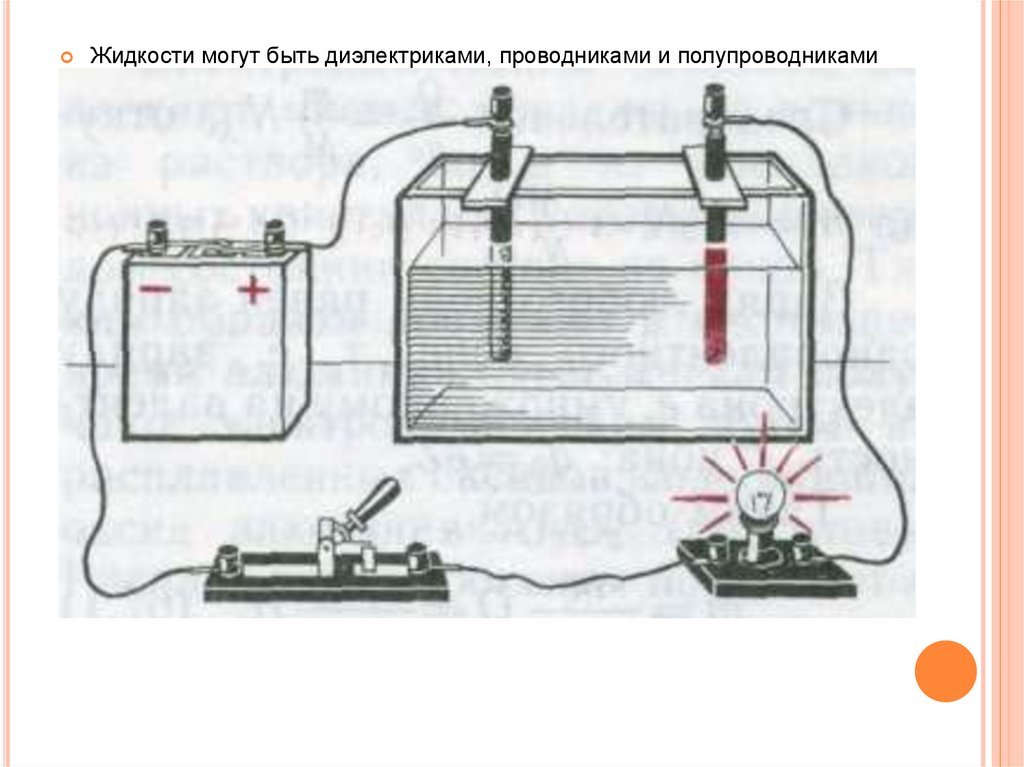
Жидкости могут быть диэлектриками, проводниками и полупроводникамиПроводниками являются растворы кислот, щелочей и солей, называемых
электролитами
При растворении электролитов происходит электролитическая
диссоциация — распад электролитов на ионы
При приложении внешнего электрического поля ионы могут упорядоченно
двигаться, т.е. создадут электрический ток
Таким образом, электролиты обладают ионной проводимостью (в
отличие от электронной проводимости в металлах; электронной и
дырочной проводимостей в полупроводниках; электронной проводимости в
вакууме)
Так как ионы — это атомы с недостатком или избытком электронов, то
ионная проводимость сопровождается переносом вещества
Поэтому электролиты называют проводниками второго рода (в отличие
от металлов, полупроводников и вакуума, являющихся проводниками
первого рода)
3.
Переносимое при ионной проводимости вещество выделяется (осаждаетсяили испаряется) на электродах, создающих электрическое поле:
на положительном электроде (аноде) отрицательные ионы отдают свои
лишние электроны (окислительная реакция)
на отрицательном электроде (катоде) положительные ионы получают
недостающие электроны (восстановительная реакция)
Процесс выделения на электроде вещества, связанный с
окислительной или восстановительной реакцией, называется
электролизом
Электролиз широко применяется в науке и технике (никелирование,
хромирование и т.д., гальванопластика, очистка металлов, выплавка
металлов)
4.
Вопрос: сколько вещества выделится при электролизе на одном изэлектродов (катоде или аноде)?
Масса выделившегося вещества — это суммарная масса отдельных
восстановленных атомов или молекул электролита:
m Nm 0
Масса одной молекулы:
m0
M
NA
При протекании тока I за время t переносится заряд
q I t
Этот заряд является суммой зарядов q0 отдельных ионов, пересекающих
поперечное сечение электролита:
q Nq0
Значит,
Отсюда количество ионов (т.е. фактически молекул) N, достигших
электрода при протекании тока, равно
Nq0 I t
N
I t
q0
5.
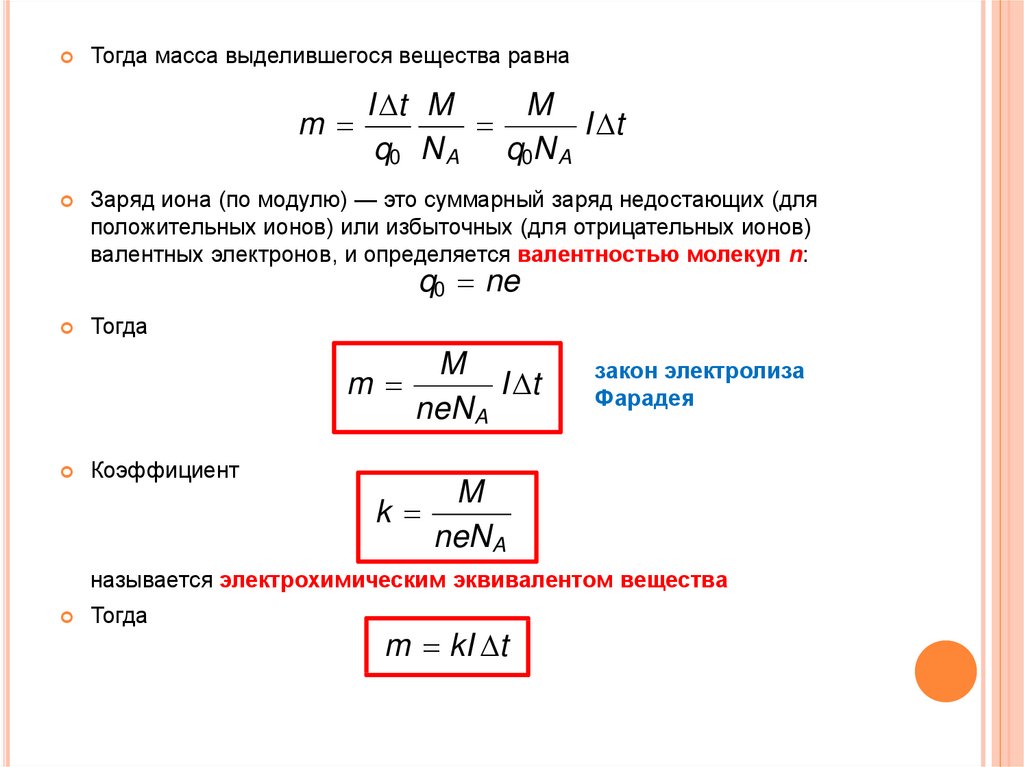
Тогда масса выделившегося вещества равнаm
M
I t M
I t
q0 N A q0N A
Заряд иона (по модулю) — это суммарный заряд недостающих (для
положительных ионов) или избыточных (для отрицательных ионов)
валентных электронов, и определяется валентностью молекул n:
q0 ne
Тогда
M
m
I t
neN A
Коэффициент
k
закон электролиза
Фарадея
M
neN A
называется электрохимическим эквивалентом вещества
Тогда
m kI t



 physics
physics








