Similar presentations:
Электрический ток в жидкостях
1.
ЭЛЕКТРИЧЕСКИЙ ТОК В ЖИДКОСТЯХБОГОМАЗ, КУРИЛОВА, ПОНОМАРЕВА, ФЕДОРОВА, КОВАЛЕНКО, СЫПАЧЕВА
2.
Вещества, растворы которых проводят электрический ток, называютэлектролитами.
Шведский ученый Сванте Аррениус, изучая электропроводность
растворов различных веществ, пришёл в 1877 г. к выводу, что причиной
электропроводности является наличие в растворе ионов, которые образуются
при растворении электролита в воде.
Как известно, электрический ток — это направленное движение
свободных электронов или ионов, т. е. заряженных частиц. В растворах
электролитов, проводящих ток, за это отвечают свободные ионы.
В 1882 году шведский химик С. Аррениус при изучении свойств
растворов электролитов обратил внимание, что они содержат больше частиц,
чем было в сухом веществе. Например, в растворе хлорида натрия 2 моля
частиц, а NaCl в сухом виде содержит лишь 1 моль. Это позволило ученому
сделать вывод, что при растворении таких веществ в воде в них появляются
свободные ионы. Так были заложены основы теории электролитической
диссоциации (ТЭД).
3.
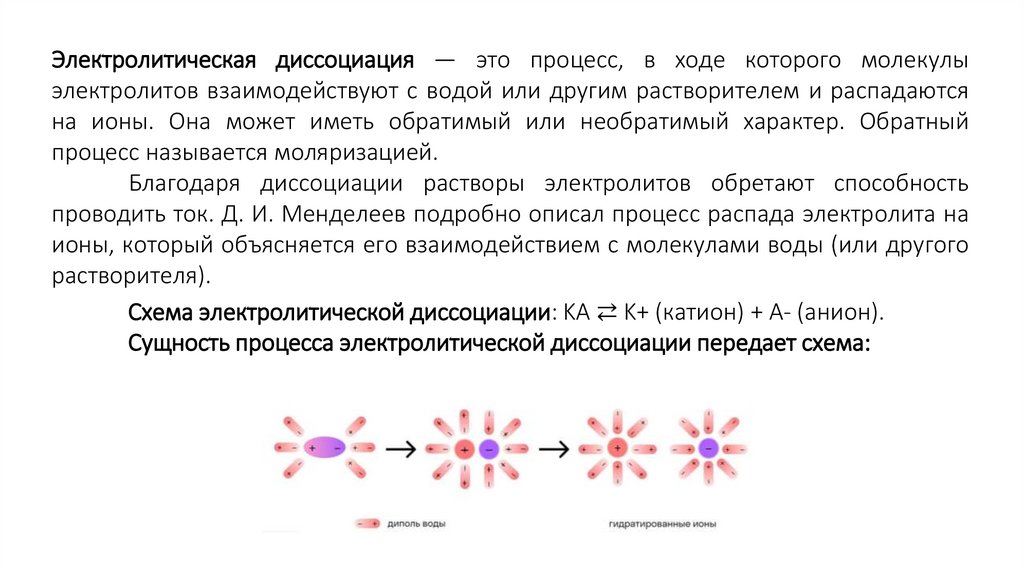
Электролитическая диссоциация — это процесс, в ходе которого молекулыэлектролитов взаимодействуют с водой или другим растворителем и распадаются
на ионы. Она может иметь обратимый или необратимый характер. Обратный
процесс называется моляризацией.
Благодаря диссоциации растворы электролитов обретают способность
проводить ток. Д. И. Менделеев подробно описал процесс распада электролита на
ионы, который объясняется его взаимодействием с молекулами воды (или другого
растворителя).
Схема электролитической диссоциации: KA ⇄ K+ (катион) + A- (анион).
Сущность процесса электролитической диссоциации передает схема:
4.
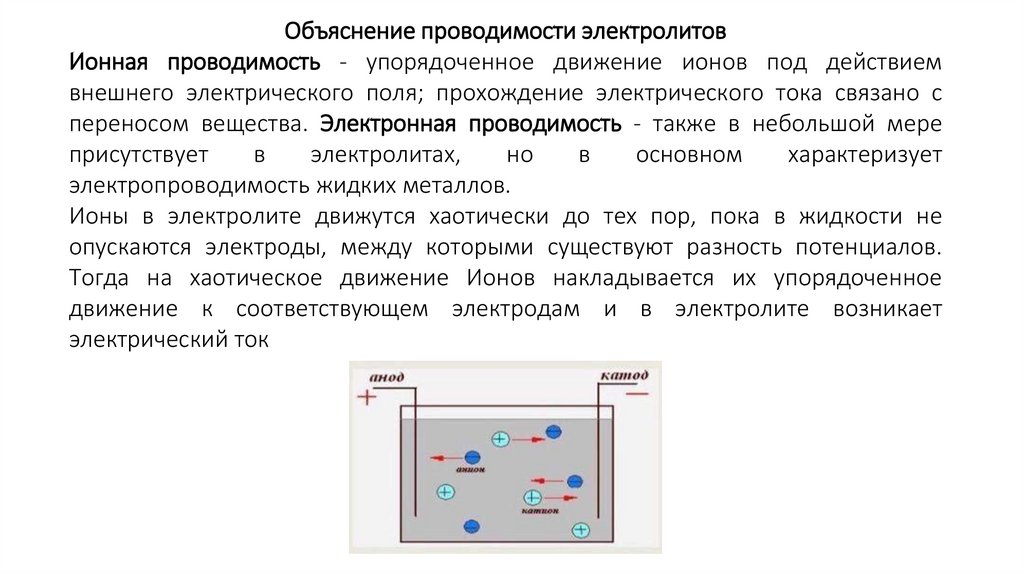
Объяснение проводимости электролитовИонная проводимость - упорядоченное движение ионов под действием
внешнего электрического поля; прохождение электрического тока связано с
переносом вещества. Электронная проводимость - также в небольшой мере
присутствует
в
электролитах,
но
в
основном
характеризует
электропроводимость жидких металлов.
Ионы в электролите движутся хаотически до тех пор, пока в жидкости не
опускаются электроды, между которыми существуют разность потенциалов.
Тогда на хаотическое движение Ионов накладывается их упорядоченное
движение к соответствующем электродам и в электролите возникает
электрический ток
5.
ЭлектролизЯвление электролиза – это выделение на электродах веществ, входящих в
электролиты, в процессе окислительно-восстановительных реакций,
которое возникает при прохождении через электролиты электрического
тока.
6.
Вещества, которые в результате подобных расщепленийобеспечивают ионную проводимость, называются электролитами.
Такое название предложил английский физик Майкл Фарадей.
Явление
электролиза
сопровождает
прохождение
электрического тока через жидкость. При электролизе происходит
выделение на электродах веществ, входящих в электролиты.
Положительно заряженные анионы под действием электрического
поля стремятся к отрицательному катоду, a отрицательно
заряженные катионы - к положительному аноду. На аноде
отрицательные ионы отдают лишние электроны (окислительная
реакция). На катоде положительные ионы получают недостающие
электроны (восстановительная реакция).
7.
Зависимость сопротивления электролита от температурыС увеличением температуры сопротивление электролитов уменьшается, т.к.
уменьшается вязкость жидкости, увеличивается подвижность ионов и
концентрация ионов, что способствует возрастанию тока Iэ при том же
напряжении U. Используя закон Ома, можно получить формулу для
сопротивления Rэ:
8.
Основные законы электролизаПервый закон Фарадея: масса выделившегося на электроде вещества прямо
пропорциональна прошедшему через электролит заряду:
где К - коэффициент пропорциональности, называемый электрохимическим
эквивалентом вещества.
Второй закон Фарадея - электрохимический эквивалент вещества пропорционален
атомной массе и обратно пропорционален валентности этого вещества:
где F - постоянная Фарадея, F = 96,5 кКл/моль; М - молярная масса ионов данного
вещества, Z - валентность ионов.
Объединенный закон Фарадея:
где I - сила тока, проходящего через электролит; t - время, в течение которого проходил ток.
9.
Электрохимический эквивалент вещества - это количество вещества, котороевыделяется или расходуется на электроде при прохождении электрического тока в
1 кулон. Он выражается в кг/Кл и зависит от валентности и молярной массы
вещества. Электрохимический эквивалент может быть получен расчетным путем,
если известна электрохимическая реакция, т.е. исходные вещества и её продукты.
Формула для расчета электрохимического эквивалента: E = M/n · F
где: E - электрохимический эквивалент (кг/Кл), M - молярная масса вещества
(г/моль), n - число электронов, участвующих в реакции (валентность), F постоянная Фарадея, примерно равная 96485 Кл/моль.
Электрохимический эквивалент используется в различных областях, включая
электрохимию, металлургию и анализ химических реакций, чтобы оценить
количество вещества, которое можно получить или использовать в процессе
электролиза.
10.
Применение электролиза:1. Электролитическое получение металлов из их солей или руд
2. Получение хлора и натриевой щелочи из раствора поваренной соли
(электролиз соляного раствора)
3. Производство водорода и кислорода из воды
4. Удаление загрязняющих веществ и ионов тяжелых металлов из сточных вод
5. Использование в аккумуляторах и топливных элементах для преобразования
химической энергии в электрическую
6. Применение в синтезе лекарственных препаратов и биомолекул
11.
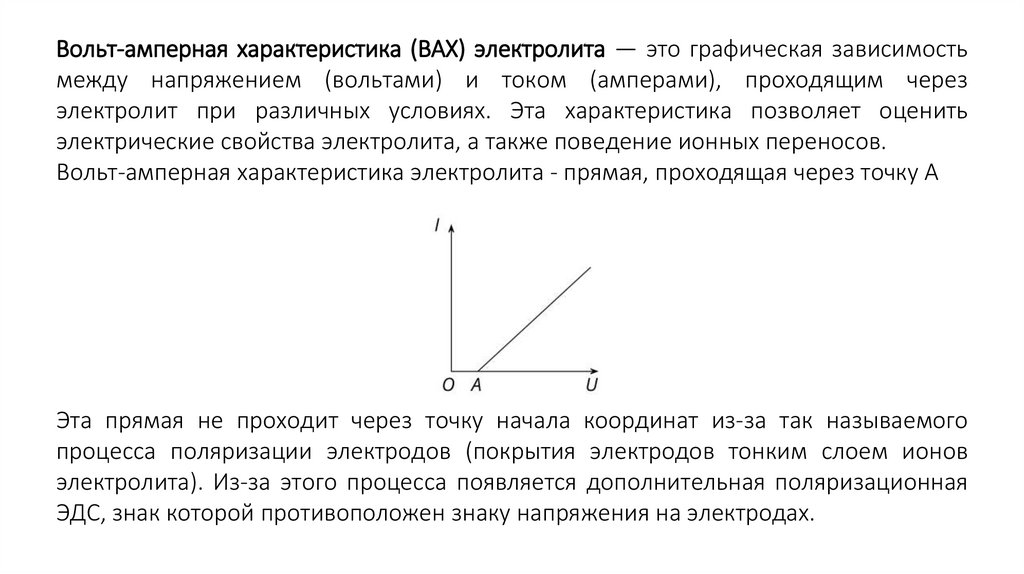
Вольт-амперная характеристика (ВАХ) электролита — это графическая зависимостьмежду напряжением (вольтами) и током (амперами), проходящим через
электролит при различных условиях. Эта характеристика позволяет оценить
электрические свойства электролита, а также поведение ионных переносов.
Вольт-амперная характеристика электролита - прямая, проходящая через точку А
Эта прямая не проходит через точку начала координат из-за так называемого
процесса поляризации электродов (покрытия электродов тонким слоем ионов
электролита). Из-за этого процесса появляется дополнительная поляризационная
ЭДС, знак которой противоположен знаку напряжения на электродах.








 physics
physics








