Similar presentations:
Основания в свете теории электролитической диссоциации (ТЭД)
1. ОСНОВАНИЯ В СВЕТЕ тэд
2.
Цели урока•Дать определение основаниям;
•Классифицировать основания;
•Ознакомиться с основными
химическими свойствами
растворимых и нерастворимых
оснований.
3.
Крестики-нолики «Основания»Найдите выигрышный путь, состоящий из
формул оснований.
Игровое поле № 1
Игровое поле № 2
NaOH
НNО3
MnО2
Н2SO4
Ca(OH)2
NН3
Н2 О
HСl
LiOH
Fе(ОН)3 Al(OH)3 Zn(OH)2
NaН
О2
N2O5
Ва(ОН)2
Cu(ОН)2 СаСО3
Назовите основания
4.
NaOH = Na+ + ОНBa(OH)2 = Ba2+ + 2ОН-5.
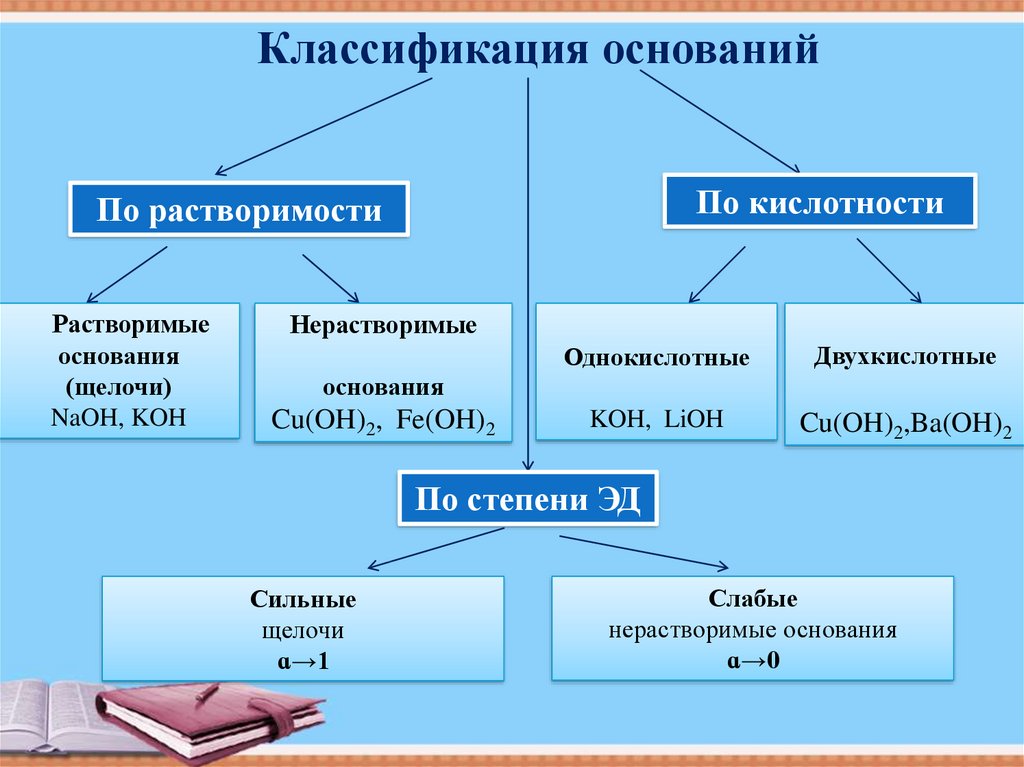
Классификация основанийПо кислотности
По растворимости
Растворимые
основания
(щелочи)
NaOH, KOH
Нерастворимые
Однокислотные
Двухкислотные
KOH, LiOH
Cu(OH)2,Ba(OH)2
основания
Cu(OH)2, Fe(OH)2
По степени ЭД
Сильные
щелочи
ɑ→1
Слабые
нерастворимые основания
ɑ→0
6.
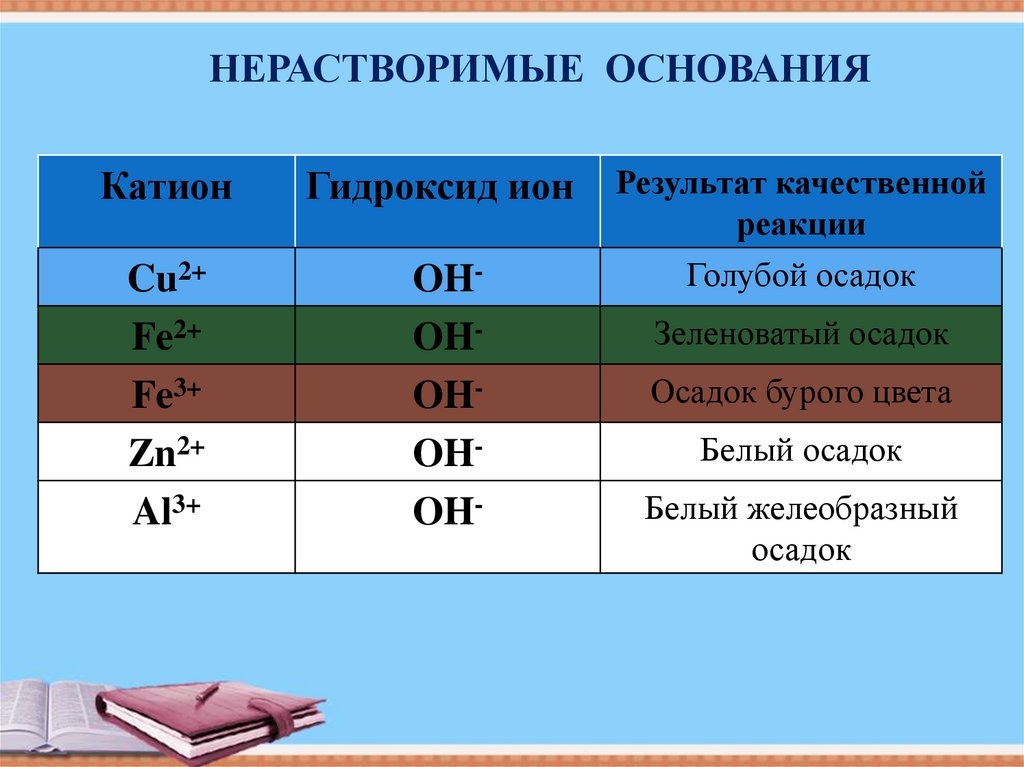
НЕРАСТВОРИМЫЕ ОСНОВАНИЯКатион
Гидроксид ион
Cu2+
Fe2+
Fe3+
Zn2+
Al3+
OHOHOHOHOH-
Результат качественной
реакции
Голубой осадок
Зеленоватый осадок
Осадок бурого цвета
Белый осадок
Белый желеобразный
осадок
7.
8.
2Al(ОН)3 + 3H2SO4 = Al2(SO4)3 + 6H2O2Al(ОН)3+6H+ + 3SO42- =2Al3+ + 3SO42- + 6H2O
Al(ОН)3 + 3H+ = Al3+ + 3H2O
NaOH + HCl = NaCl +H2O
H+ + OH- = H2O
Реакция нейтрализации
9.
2NaOH + N2O5 = 2Na NO3+ Н2О2Na+ + 2OH- + N2O5 =2Na+ + 2NO3-+Н2О
N2O5 + 2OH- =2NO3 - + Н2О
Кислотные оксиды
Кислоты
SO2
H2SO3
P2O5
H3PO4
СO2
H2СО3
10.
Ba(ОН)2 + Na2SO4 = BaSO4↓+ 2 NaOHBa2+ +2OH- +2Na++ SO42- = BaSO4↓ +2Na++ OHBa2+ + SO42- = BaSO4
Протекание реакции взаимодействия щелочей и
солей происходит только в случае образования
нерастворимого осадка или газа.
11.
Сu(OH)2 = CuO +H2O2Fe(OH)3 = Fe2O3 + 3H2O
12.
I. Тест1.Формула основания это:
а) NaOH б) HCl в) CuCl2
г) SO3
2. Метиловый оранжевый в растворе гидроксида калия:
а) синий
б) бесцветный
в) фиолетовый
г) желтый
3. С раствором гидроксида натрия взаимодействует:
а) оксид магния
б) сульфат бария
в) оксид фосфора(V)
г) сера
4. Гидроксид бария не взаимодействует с :
а) оксидом серы (VI)
б) гидроксидом натрия
в) серной кислотой
г) хлоридом меди (II)
5. Пара веществ, взаимодействующих друг с другом:
а) H2SO4 u Ва(ОН)2
б) CuO u Na2O
в) Сu u НСl
г) AgСl u NaOH
13.
II. СоотнеситеСвойства оснований
1) взаимодействие с
кислотой;
2) реакция с оксидом
неметалла;
3) взаимодействие с
солью;
4) основание↓ (t)
Продукты реакций
а) …=CaCl2 + H2O
б) …=ZnSO4 + H2↑
в) … = 2KNO3 + H2O
г) … = Fe2O3 + 3H2O
д) … =Na2SO4 + Cu(ОН)2↓
е) … = AgCl↓ + HNO3
14.
III. Какие вещества реагируют друг с другом?Выберите правильные ответы:
а) Cu + NaOH = …
б) Cu(OH)2 + HCl = …
в) CuSO4 + NaOH = …
г) CuO + Ca (OH)2 = …
Напишите уравнения возможных реакций
(молекулярные и сокращённые ионные).
15.
IV.Составить молекулярные, полные исокращённые ионные уравнения
химических реакций между
следующими веществами:
1) хлорид железа (III) и гидроксид натрия
2) oксид углерода(IV) и гидроксид калия
3) соляная кислота и гидроксид цинка
16.
Выводы:Общие свойства щелочей объясняются
присутствием в растворе гидроксид- ионов:
-мылкость на ощупь;
-изменение окраски индикаторов;
-взаимодействие с кислотами,
оксидами металлов, солями
и разложение нерастворимых оснований
при нагревании.














 chemistry
chemistry








