Similar presentations:
Азот и его соединения
1. Азот и его соединения
2. Строение атома азота
1. Электронная конфигурация атома азота.+7
N ))…2s22p3
2 5
2. Размещение электронов по орбиталям
Это типичный неметалл, p- элемент.
Степень окисления азота в соединениях -3,0,+ 1,+2,+3,+4,+5.
Степени окисления -3,
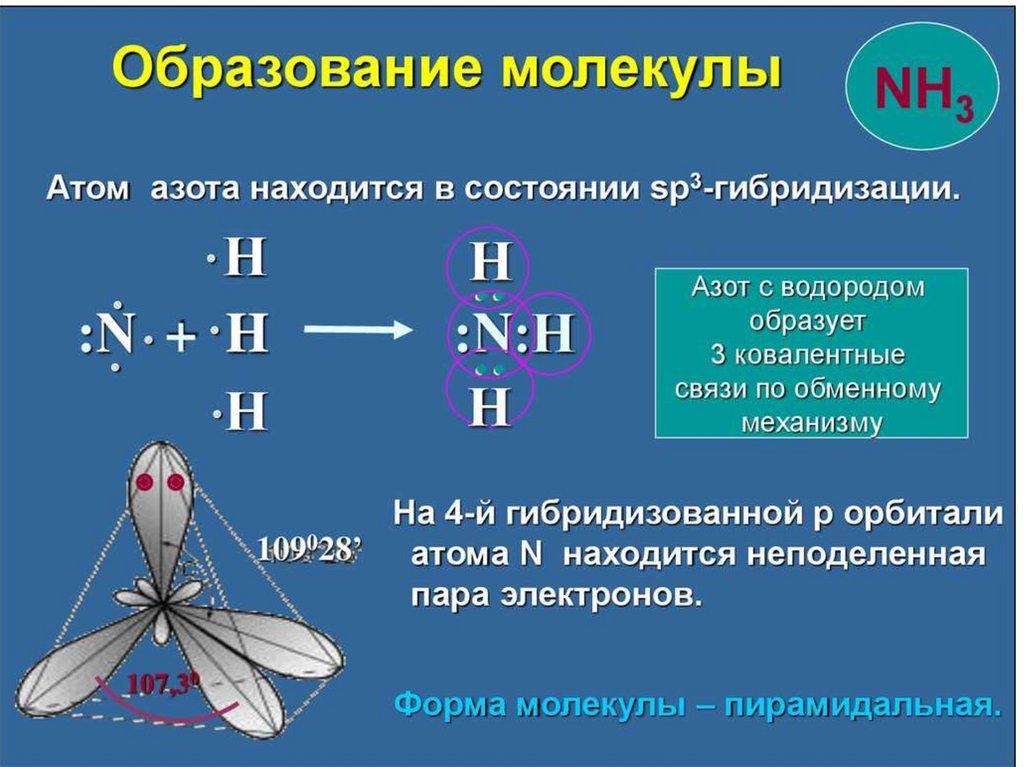
NH3
0, +1, +2, +3, +4, +5
N2 N2O NO N2O3 NO2 N2O5
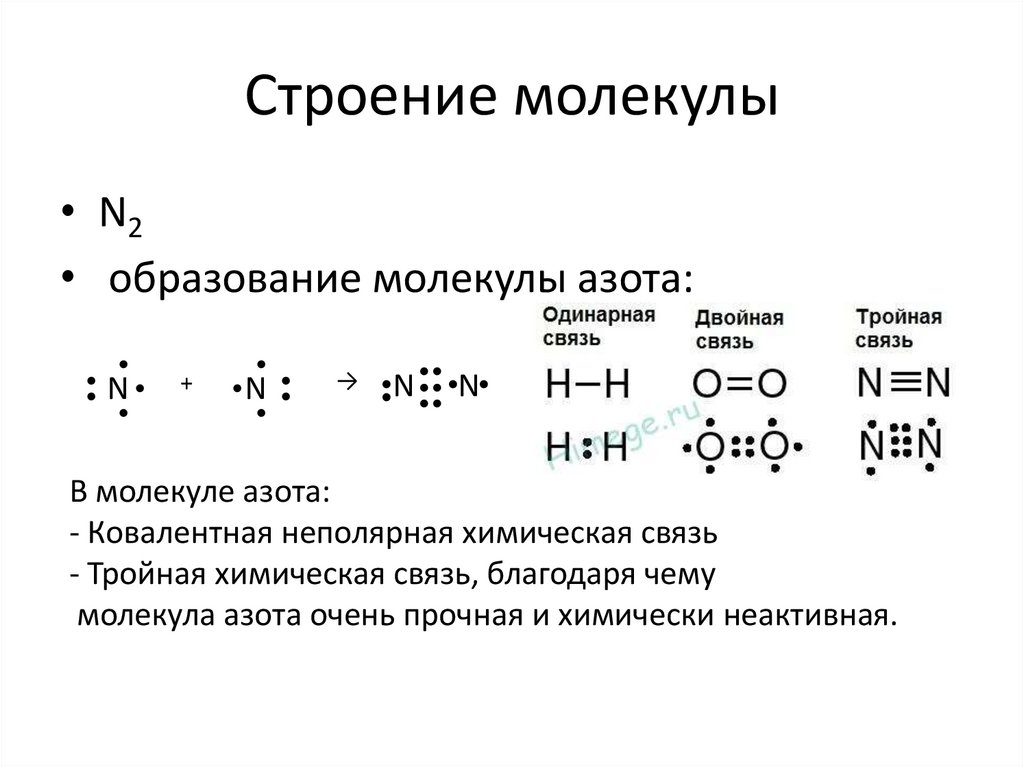
3. Строение молекулы
• N2• образование молекулы азота:
• N •
→
N
•
•
•
N
+
N
•
В молекуле азота:
- Ковалентная неполярная химическая связь
- Тройная химическая связь, благодаря чему
молекула азота очень прочная и химически неактивная.
4. Физические свойства азота
• Газ, без цвета, без запаха и вкуса.• При охлаждении до -196о превращается в
бесцветную жидкость, а при -210о – в белую
снегообразную массу.
• Малорастворим в воде
5. Химические свойства азота
Азот при взаимодействии с металлами проявляетокислительные свойства
• Взаимодействует с металлами при
нагревании, образуя нитриды:
3Mg + N2 → Mg3N2
Нитрид магния
• С литием реагирует при комнатной
температуре:
6Li + N2 → 2Li3N
Нитрид лития
6. Химические свойства азота
• С кислородом и фтором азот проявляетвосстановительные свойства:
N2 + O2 → 2NO
N2 + F2 → 2NF3
Оксид азота (II)
Реакция с кислородом протекает при температуре электрической дуги - 3000о -4000оС
7. Химические свойства
8. Нахождение элемента азота в природе
• В свободном виде - в воздухе(78% пообъёму)
• Входит в состав минералов: натриевая
селитра, калийная селитра
• Входит в состав белков (гемоглобин-белок
крови, миозин – белок мышц и т.д.). В
среднем белок на 16% состоит из азота.
9.
10.
11.
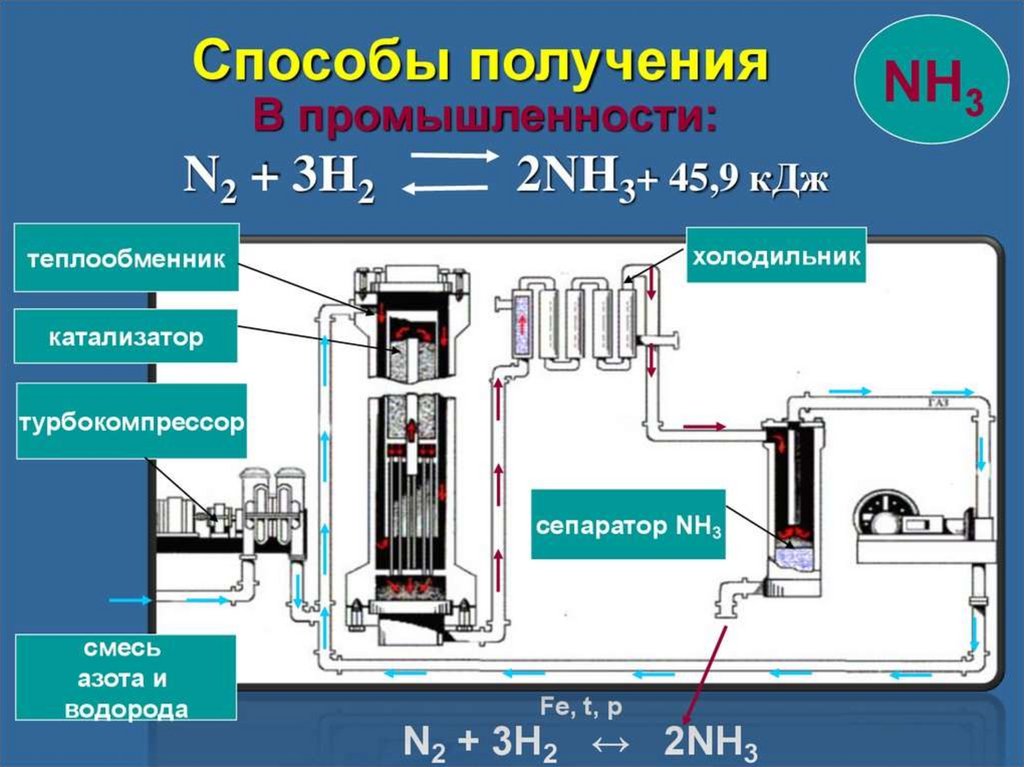
12. Получение в промышленности
• В 1913 году в Германии был создан первыйзавод каталитического синтеза аммиака
• N2 + 3H2↔ 2NH3 +Q
• Реакция обратимая, Т=300ºС , Р = 2030МПа, в присутствии катализаторапористого железа
13. Получение в лаборатории
• При нагревании смеси солей аммония сощелочами.
2NH4Cl +Ca(OH)2=CaCl2+2NH3↑ +2H2O
хлорид аммония
аммиак
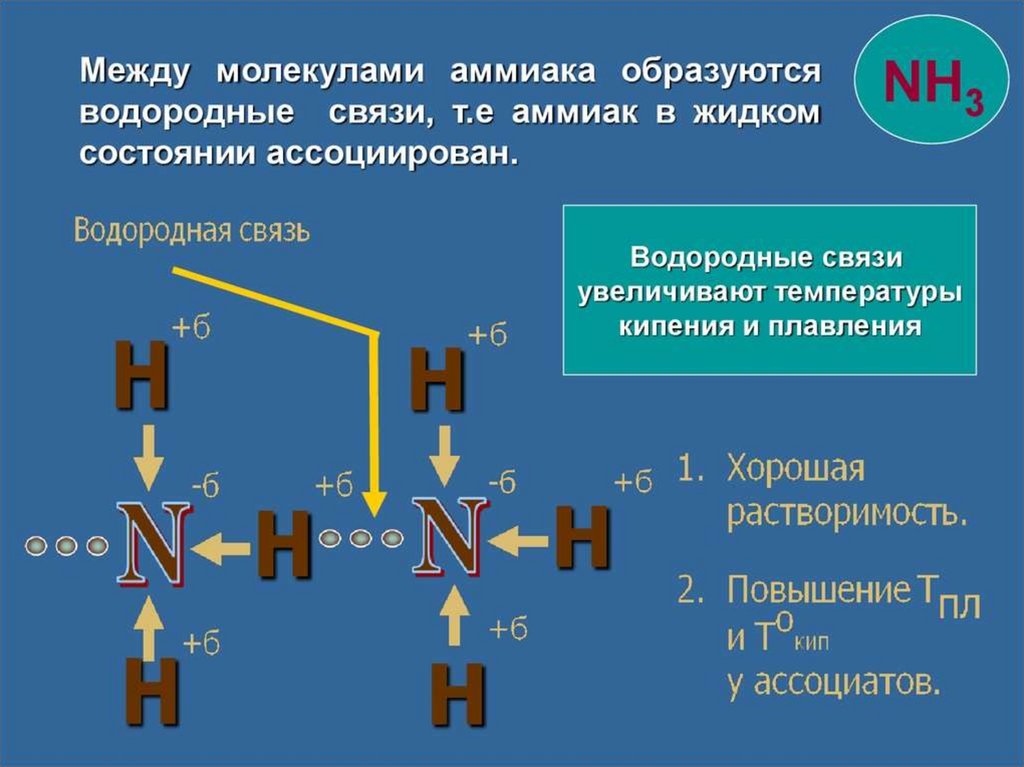
• Физические свойства
Бесцветный газ с характерным резким запахом, почти в 2
раза легче воздуха. Хорошо растворим в воде.
В 1V H2O – 700V NH3












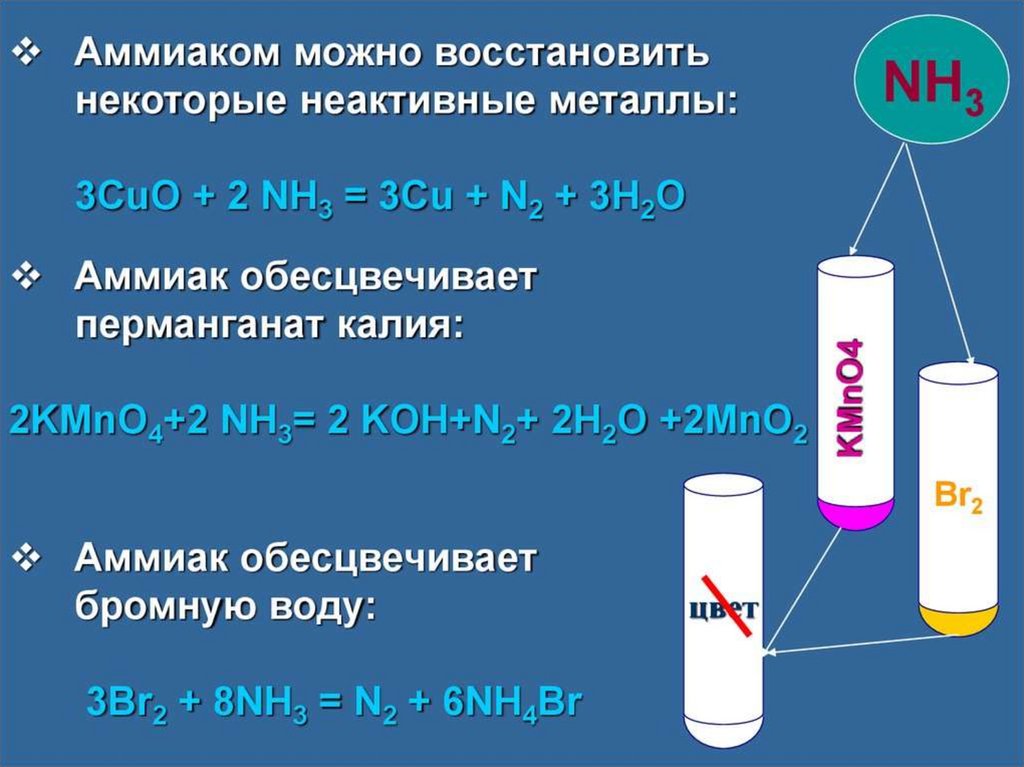
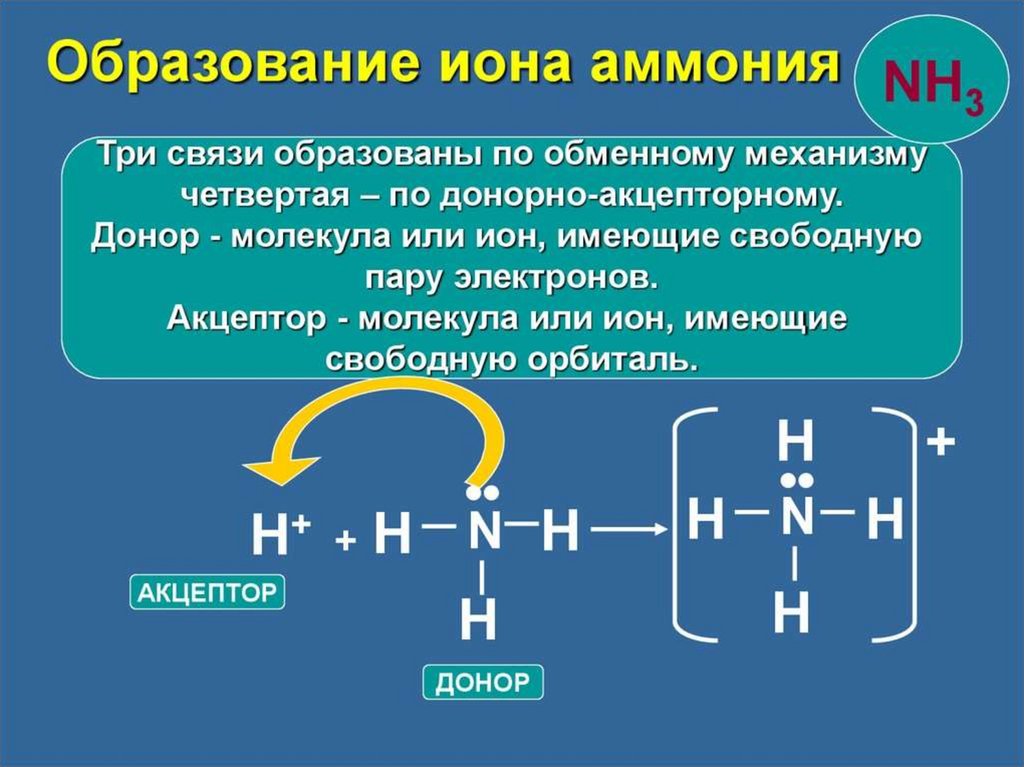


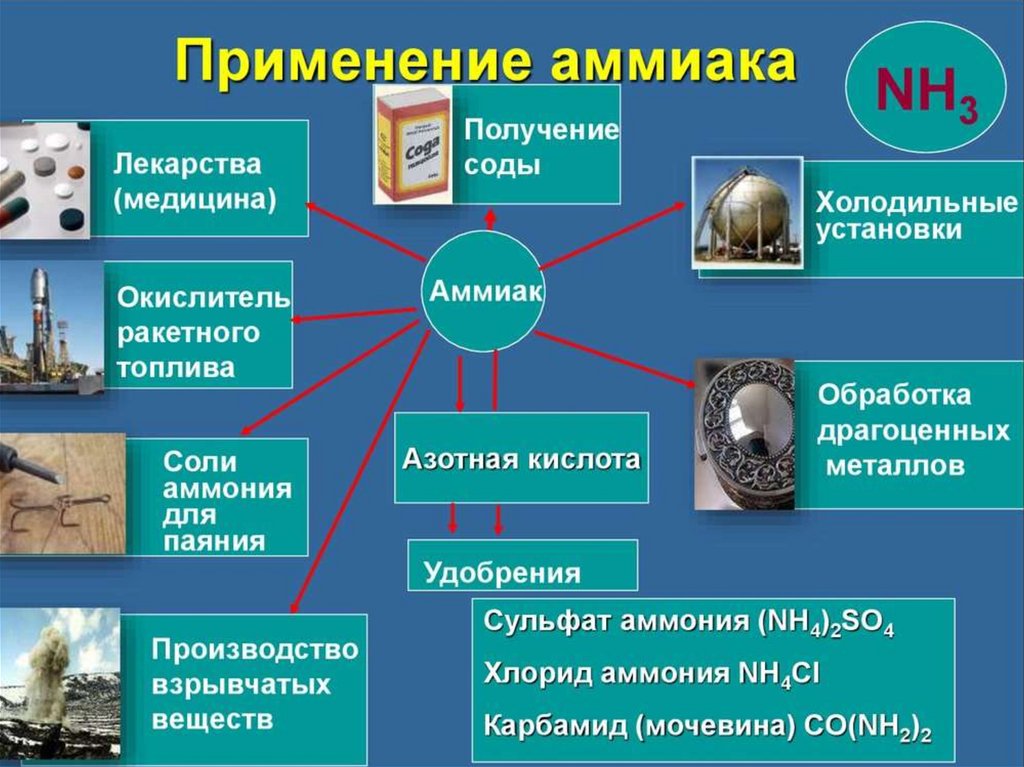
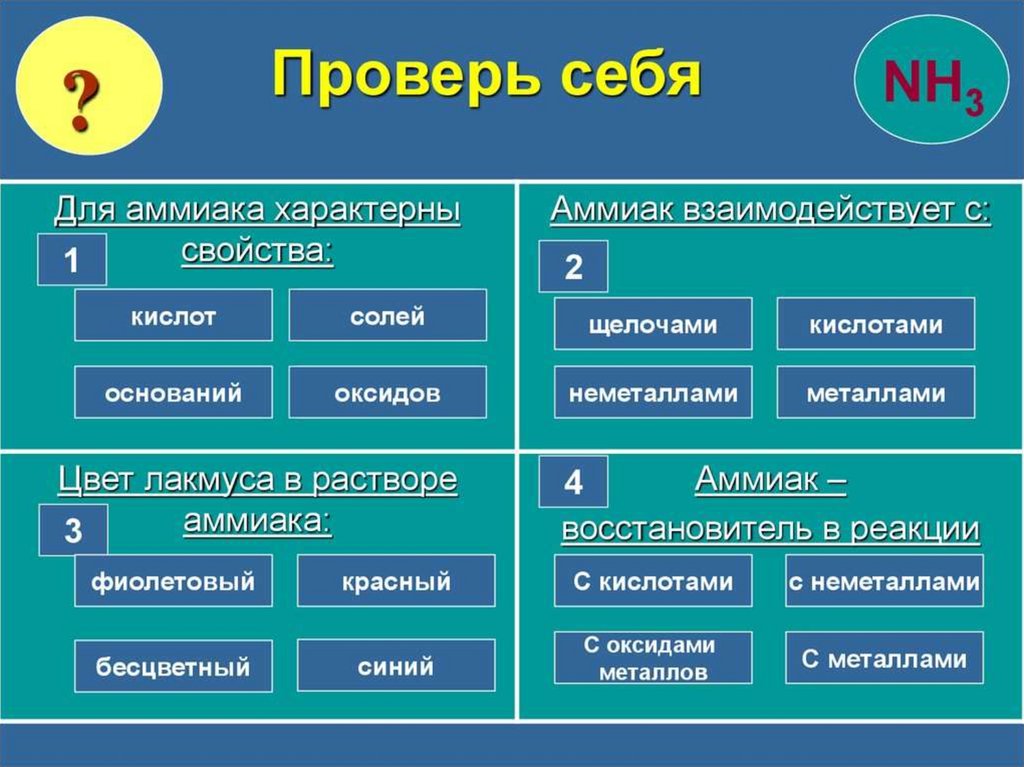


 chemistry
chemistry








