Similar presentations:
Электролиз. Расчетные задачи
1. C4
2. C4-1-2009
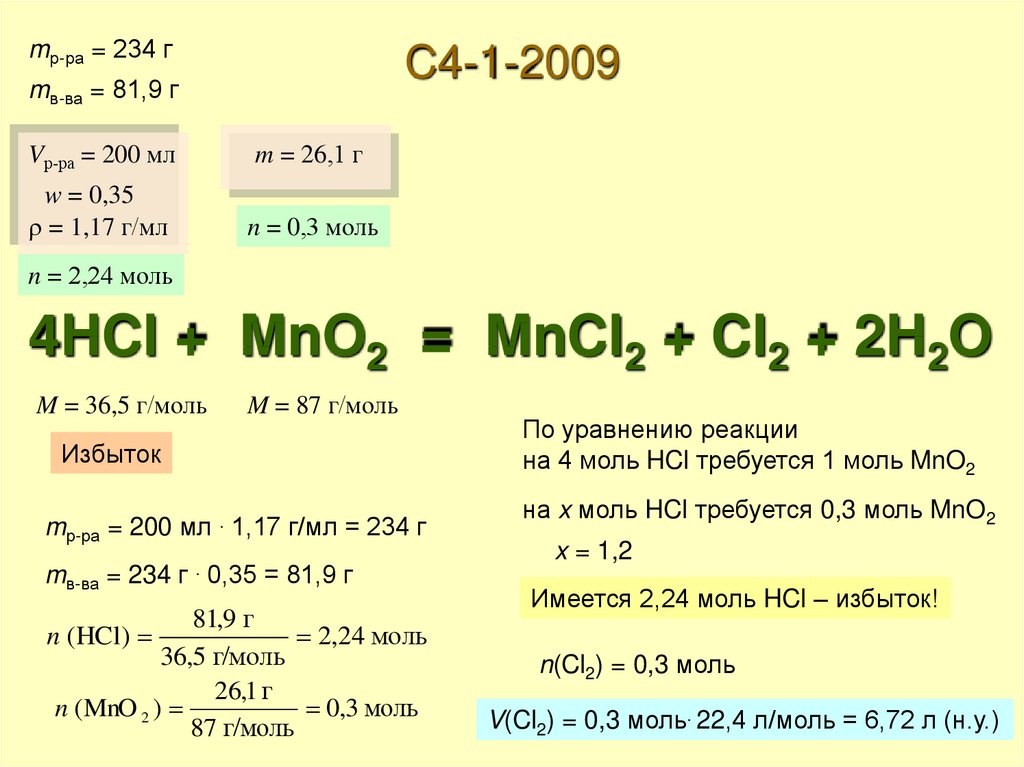
Какой объем хлора (н.у.) выделится, если к200 мл 35%-ной соляной кислоты
(плотность 1,17 г/мл) добавить при
нагревании 26,1 г оксида марганца(IV)?
Какая масса гидроксида натрия в холодном
растворе прореагирует с таким количеством
хлора?
3. C4-1-2009
mр-ра = 234 гC4-1-2009
mв-ва = 81,9 г
Vр-ра = 200 мл
m = 26,1 г
w = 0,35
= 1,17 г/мл
n = 0,3 моль
n = 2,24 моль
4HCl + MnO2 = MnCl2 + Cl2 + 2H2O
M = 36,5 г/моль
M = 87 г/моль
Избыток
mр-ра = 200 мл . 1,17 г/мл = 234 г
mв-ва = 234 г 0,35 = 81,9 г
.
81,9 г
2,24 моль
36,5 г/моль
26,1 г
n (MnO 2 )
0,3 моль
87 г/моль
n (HCl)
По уравнению реакции
на 4 моль HCl требуется 1 моль MnO2
на x моль HCl требуется 0,3 моль MnO2
x = 1,2
Имеется 2,24 моль HCl – избыток!
n(Cl2) = 0,3 моль
V(Cl2) = 0,3 моль. 22,4 л/моль = 6,72 л (н.у.)
4.
n = 0,3 мольn = 0,6 моль
Cl2 + 2NaOH = NaClO + NaCl + H2O
M = 40 г/моль
m (NaOH) = 0,6 моль . 40 г/моль = 24 г
Ответ: V(Cl2) = 6,72 л (н.у.)
m(NaOH) = 24 г
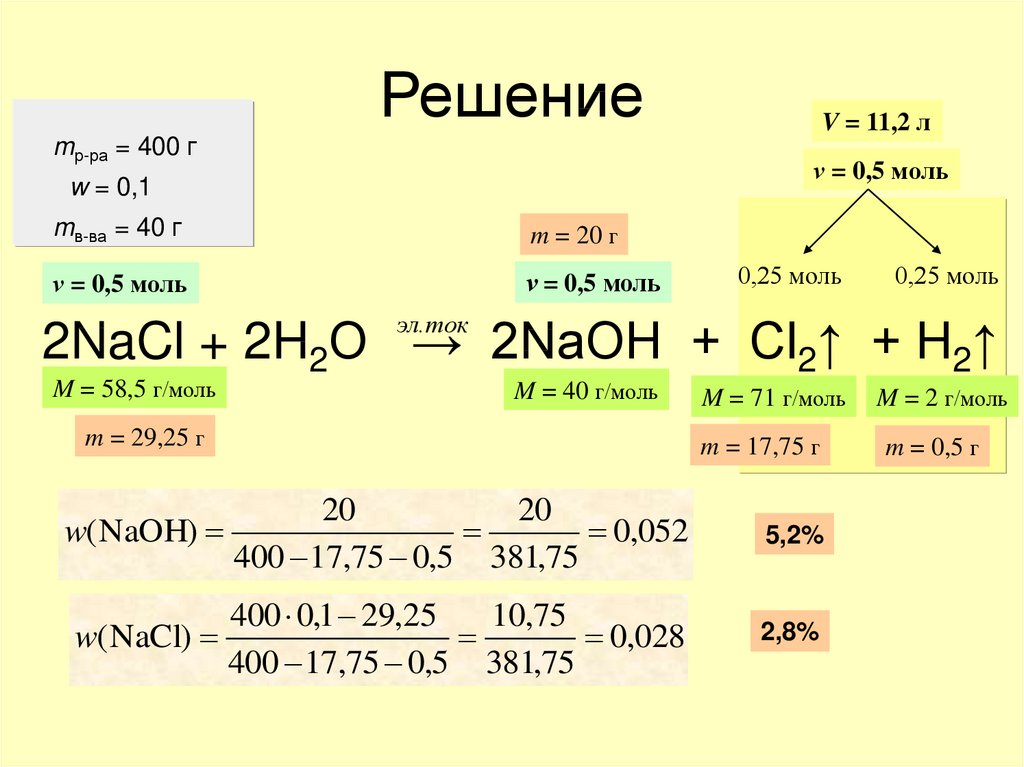
5. Расчетные задачи по теме «Электролиз»
• Через 10%-ный раствор хлорида натриямассой 400 г пропустили постоянный
электрический ток. Объем
выделившихся на электродах газов
составил 11,2 л (н.у.).
Вычислите:
а) массовые доли веществ в растворе
после реакции;
б) долю разложившегося хлорида натрия.
6. Решение
mр-ра = 400 гV = 11,2 л
ν = 0,5 моль
w = 0,1
mв-ва = 40 г
m = 20 г
ν = 0,5 моль
ν = 0,5 моль
0,25 моль
0,25 моль
эл.ток
2NaCl + 2H2O → 2NaOH + Cl2↑ + H2↑
M = 58,5 г/моль
M = 40 г/моль
m = 29,25 г
M = 71 г/моль
m = 17,75 г
20
20
w( NaOH)
0,052
400 17,75 0,5 381,75
5,2%
400 0,1 29,25
10,75
w( NaCl)
0,028
400 17,75 0,5 381,75
2,8%
M = 2 г/моль
m = 0,5 г
7. Решение (продолжение)
эл.ток2NaCl + 2H2O → 2NaOH + Cl2↑ + H2↑
29,25
w разл ( NaCl)
0,73
40
Ответ:
w(NaOH) = 5,2%
w(NaCl) = 2,8%
wразл ≈ 73%
8. С4-2-2009
• Рассчитайте, какой объем 10%-ногораствора хлороводорода плотностью
1,05 г/мл пойдет на полную
нейтрализацию гидроксида кальция,
если выделившийся при гидролизе газ
занял объем 8,96 л (н.у.).
9. С4-3-2009
• Газообразный аммиак, выделившийся прикипячении 160 г 7%-ного раствора
гидроксида калия с 9,0 г хлорида аммония,
растворили в 75 г воды. Определите
массовую долю аммиака в полученном
растворе.
10. С4-4-2009
• При обработке карбида алюминияраствором соляной кислоты, масса которого
320 г и массовая доля HCl 22%, выделилось
6,72 л (н.у.) метана. Рассчитайте массовую
долю соляной кислоты в полученном
растворе.
11. С4-5-2009
• Карбид кальция обработан избытком воды.Выделившийся газ занял объем 4,48 л (н.у.).
Рассчитайте, какой объем 20%-ной соляной
кислоты (плотностью 1,10 г/мл) пойдет на
полную нейтрализацию щелочи,
образовавшейся из карбида кальция.
12. C4-6-2009
• На нейтрализацию 7,6 г смеси муравьинойи уксусной кислот израсходовано 35 мл
20%-ного раствора гидроксида калия
(плотность 1,20 г/мл). Рассчитайте массу
уксусной кислоты и её массовую долю в
исходной смеси кислот.
13. С4-7-2009
Определите массу Mg3N2, полностьюподвергшегося разложению водой, если для
солеобразования с продуктами гидролиза
потребовалось 150 мл 4%-ного раствора
соляной кислоты плотностью 1,02 г/мл.
14. С4-8-2009
• Сероводород, выделившийся привзаимодействии избытка
концентрированной серной кислоты с 1,44 г
магния, пропустили через 160 г 1,5%-ного
раствора брома. Определите массу
выпавшего при этом осадка и массовую
долю кислоты в образовавшемся растворе.
15. С4-9-2009
• Оксид фосфора(V) массой 1,42 грастворили в 60 г 8,2%-ной ортофосфорной
кислоты и полученный раствор
прокипятили. Какая соль и в каком
количестве образуется, если к полученному
раствору добавить 3,92 г гидроксида калия?
16. С4-10-2009
• Рассчитайте, какой объем 10%-ногораствора хлороводорода плотностью
1,05 г/мл пойдет на полную нейтрализацию
гидроксида кальция, образовавшегося при
гидролизе карбида кальция, если
выделившийся при гидролизе газ занял
объем 8,96 л (н.у.).
17. C5
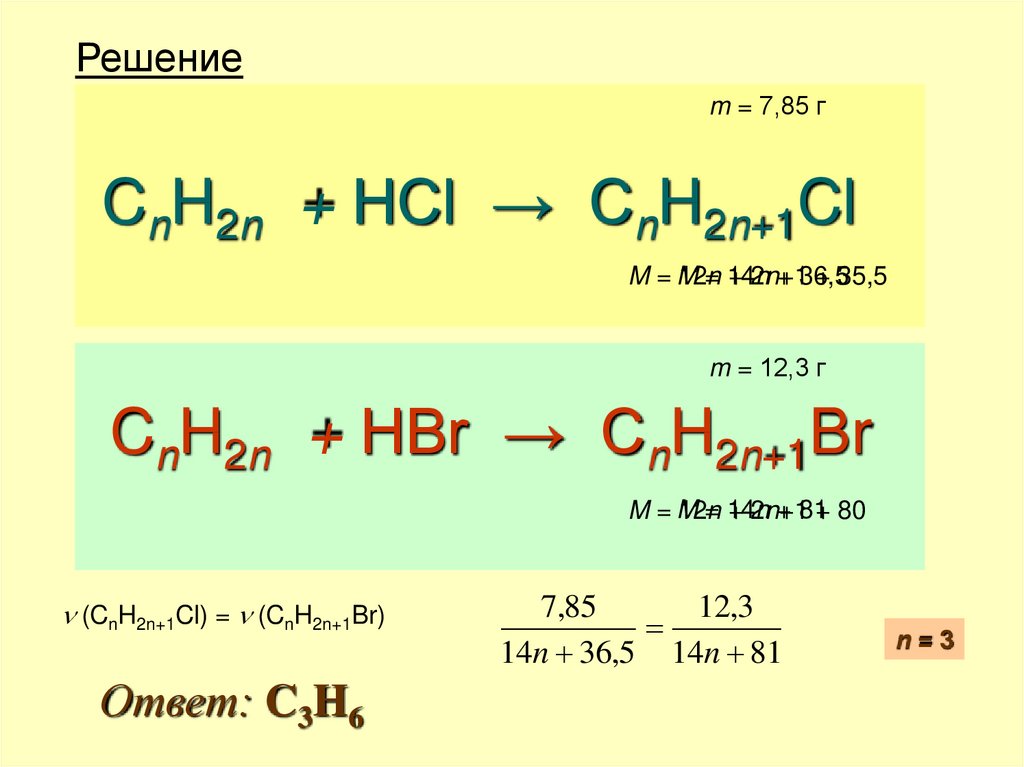
Задачи на вывод формул18. С5-2009-2
• При взаимодействии одного и того жеколичества алкена с различными
галогеноводородами образуется
соответственно 7,85 г хлорпроизводного
или 12,3 г бромпроизводного.
Определите молекулярную формулу алкена.
19. Решение
m = 7,85 гCnH2n + HCl → CnH2n+1Cl
M =M
12n
= 14n
+ 2n+1
+ 36,5
+ 35,5
m = 12,3 г
CnH2n + HBr → CnH2n+1Br
= 14n
+ 81+ 80
M =M
12n
+ 2n+1
(CnH2n+1Cl) = (CnH2n+1Br)
Ответ: C3H6
7,85
12,3
14n 36,5 14n 81
n=3


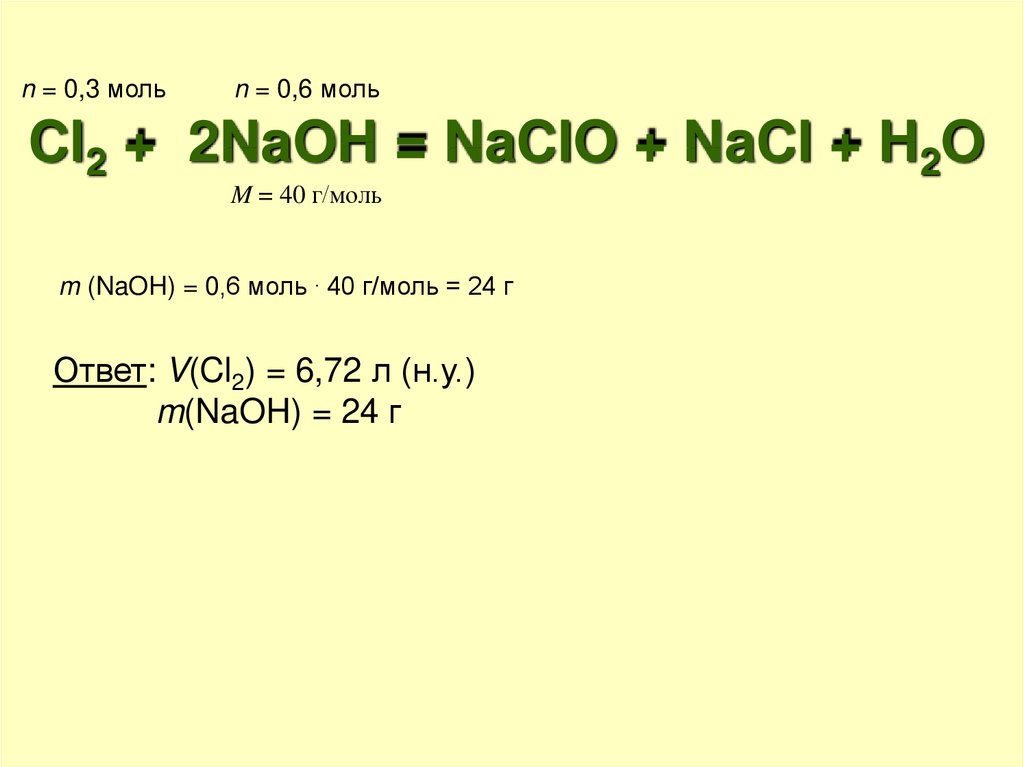














 chemistry
chemistry








