Similar presentations:
Массспектрометрическое (МС) секвенирование белков
1.
Занятие №12. Массспектрометрическое (МС)секвенирование белков
2.
Масс-спектрометрияЭто
анализ
ионизированных
молекул
исследуемого
вещества (и/или ионов фрагментов молекул) по отношению
массы к заряду (m/z). Анализ проводят в вакууме (чтобы не
мешали ионизированные молекулы воздуха).
3.
Схема масс-спектрометра и этапы анализа1. Дозатор проб (инжектор)
вводит пробу в масс-спектрометр
2. Ионизатор проб (источник ионов)
ионизация молекул вещества с фрагментацией или без
3. Анализатор масс
полученные
ионы
с
помощью
электрического
и/или
магнитного полей разделяются в пространстве по отношению
m/z
4. Детектор ионов
при
соприкосновении
с
детектором
электрический сигнал (возникает ток)
ионы
производят
4.
Классификация методов масс-спектрометрииДля любого метода масс-спектрометрии важны два момента:
Способ ионизации пробы (тип ионизатора)
Способ анализа отношения масса/заряд (m/z) (тип массанализатора)
Эти характеристики отражены в названии конкретного метода
масс-спектрометрии (напр., MALDI-TOF, где MALDI – тип
ионизатора, TOF – тип детекции m/z).
5.
Методы ионизации проб в масс-спектрометрахИонизация электронным ударом (EI, Electron Impact)
Химическая ионизация (CI, Chemical Ionization)
Ионизация в электроспрее (электрораспыление) (ESI,
Electro-Spray Ionization)
Матричная лазерная десорбция (MALDI, Matrix-Assisted
Lazer Desorbtion-Ionization)
6.
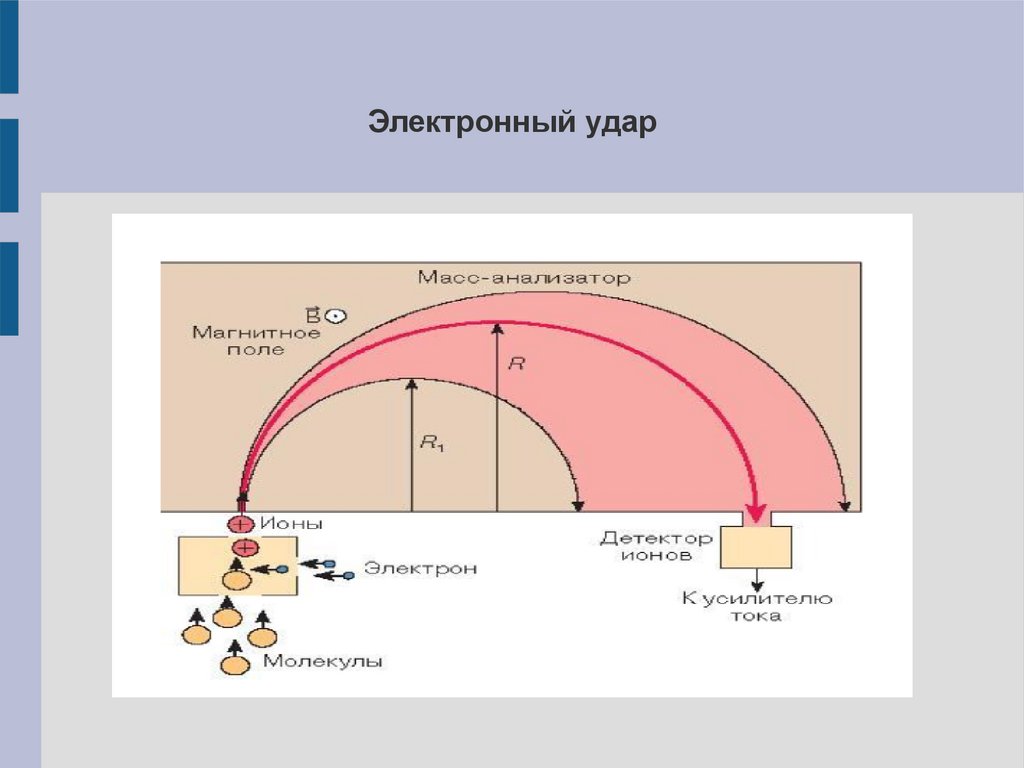
Ионизация электронным ударом (EI)Анализируемое вещество переводят в газовую фазу
(испарение нагревом) и бомбардируют пучком электронов.
Электроны пучка выбивают электроны из молекул –
получаются положительно заряженные ионы. При этом
происходит разложение молекул на фрагменты (ионы)
разного размера.
Недостатки:
анализируемые вещества должны быть летучими и
термостабильными – короткие пептиды (~10 АК), химически
модифицированные (ацетилирование, метилирование);
ионизация происходит с фрагментацией – можно
анализировать только короткие пептиды.
7.
Электронный удар8.
Химическая ионизация (CI)Источник ионов заполняется газом (метан). Производится
ионизация этого газа электронным ударом, а затем
ионизированный газ ионизирует (протонирует) молекулы
анализируемого вещества. Это более мягкий вариант по
сравнению с EI – молекулы не разбиваются на фрагменты.
Недостаток:
пептиды должны быть летучими и
(модифицированные короткие пептиды)
термостабильными
9.
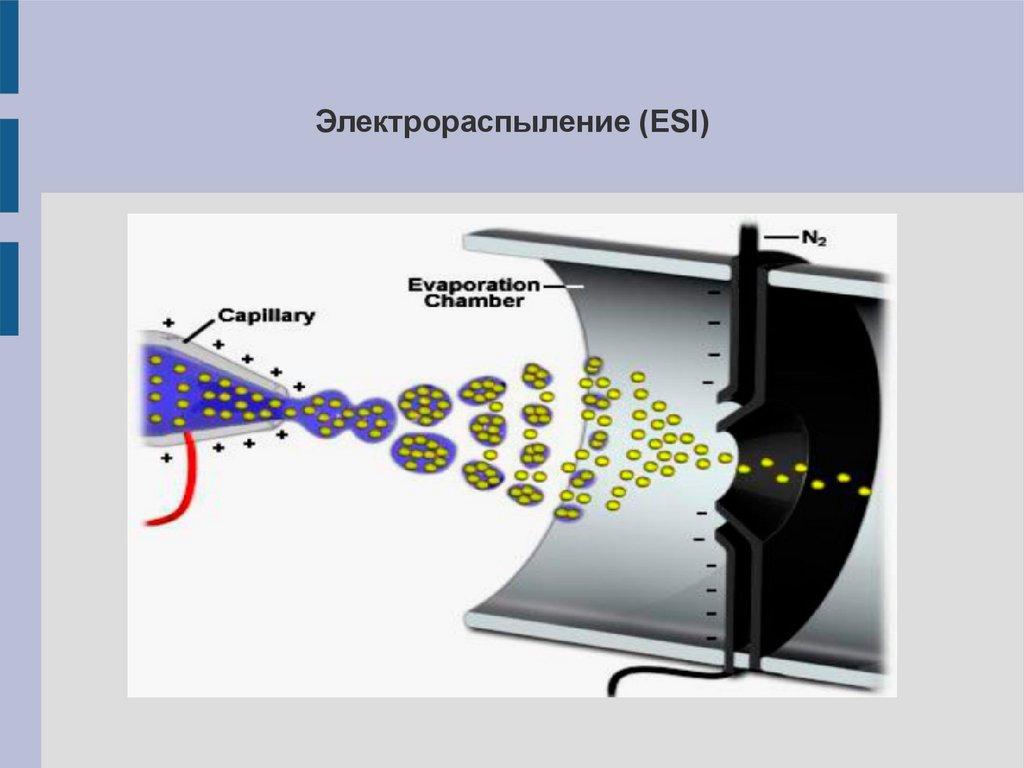
Электрораспыление (ESI)Вещество в полярном растворителе (жидкая форма) распыляют через
металлический капилляр, к которому приложено высокое напряжение
(2,5-4 кВ). Образуется пучок капель с высоким поверхностным
зарядом. Растворитель из капель постепенно испаряется (в потоке
нагретого инертного газа), силы отталкивания поверхностных зарядов
превышают силы поверхностного натяжения – капли дробятся
(взрываются) на более мелкие капли. Получаются многозарядные
ионы, которые попадают в масс-анализатор.
Преимущества:
можно анализировать нелетучие (длинные) полипептиды (~500 АК)
мягкий метод – фрагментации пептидов не происходит
идеально сочетается с ВЭЖХ
Недостаток:
пептиды должны быть растворимы в полярном растворителе
10.
Электрораспыление (ESI)11.
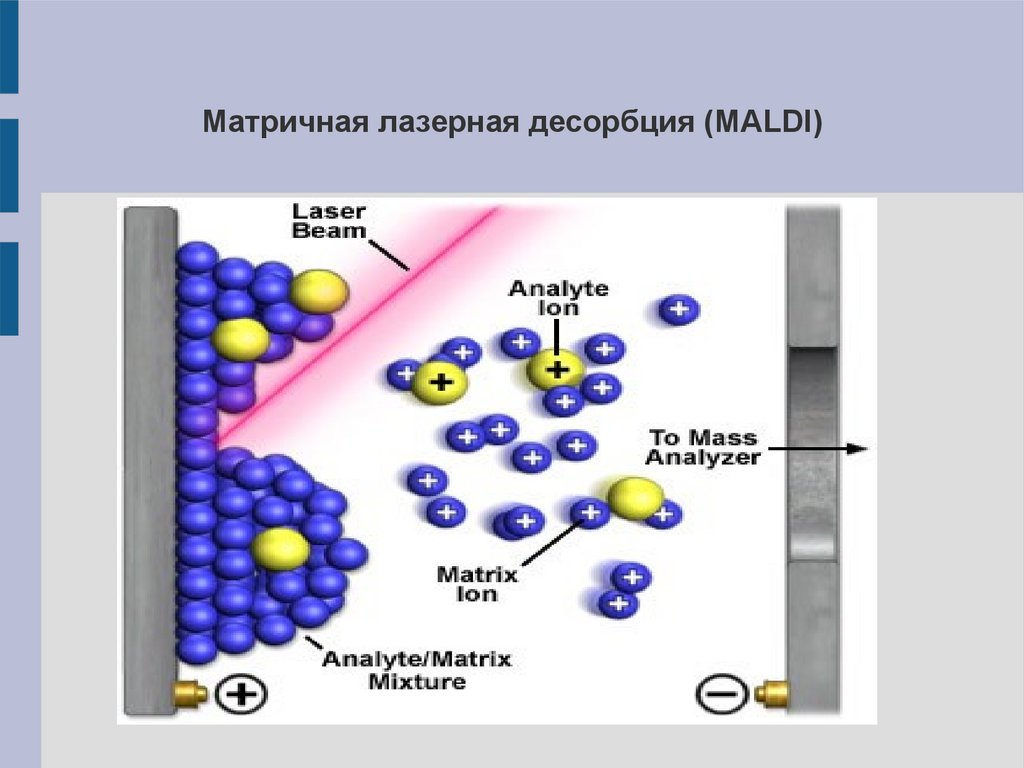
Матричная лазерная десорбция (MALDI)Исследуемое вещество помещают в матрицу – низкомолекулярное
вещество,
активно
поглощающее
лазерное
излучение:
предварительно вещество-образец растворяют вместе с веществомматрицей в одном растворителе, наносят на подложку и испаряют
растворитель. Подложку помещают в прибор и облучают короткими
лазерными
импульсами.
Вещество
матрицы
испаряется
и
ионизируется, увлекая за собой молекулы исследуемого вещества,
которые тоже ионизируются.
Преимущества:
можно анализировать нелетучие (длинные) полипептиды (длиннее,
чем в ESI, ~2000 АК)
мягкий метод – фрагментации пептидов не происходит
обеспечивается высокая чувствительность (фемтомоли, 10-15)
Недостаток:
нужно подбирать вещество матрицы
12.
Матричная лазерная десорбция (MALDI)13.
Методы разделения ионов (типы масс-анализаторов)Время-пролётное разделение (TOF, Time Of Flight)
Квадруполи
Ионная ловушка
Ионно-циклотронный резонанс
14.
Время-пролётное разделение ионов (TOF)После изначального разгона ионов из камеры ионизации на них
не действует никакое поле, и они движутся по инерции, обладая
одинаковой кинетической энергией. Следовательно, более
массивные ионы движутся медленнее (детектируются позже),
более лёгкие – быстрее (детектируются раньше).
Это один из наиболее частых вариантов детекции в случае
исследования пептидов.
15.
TOF16.
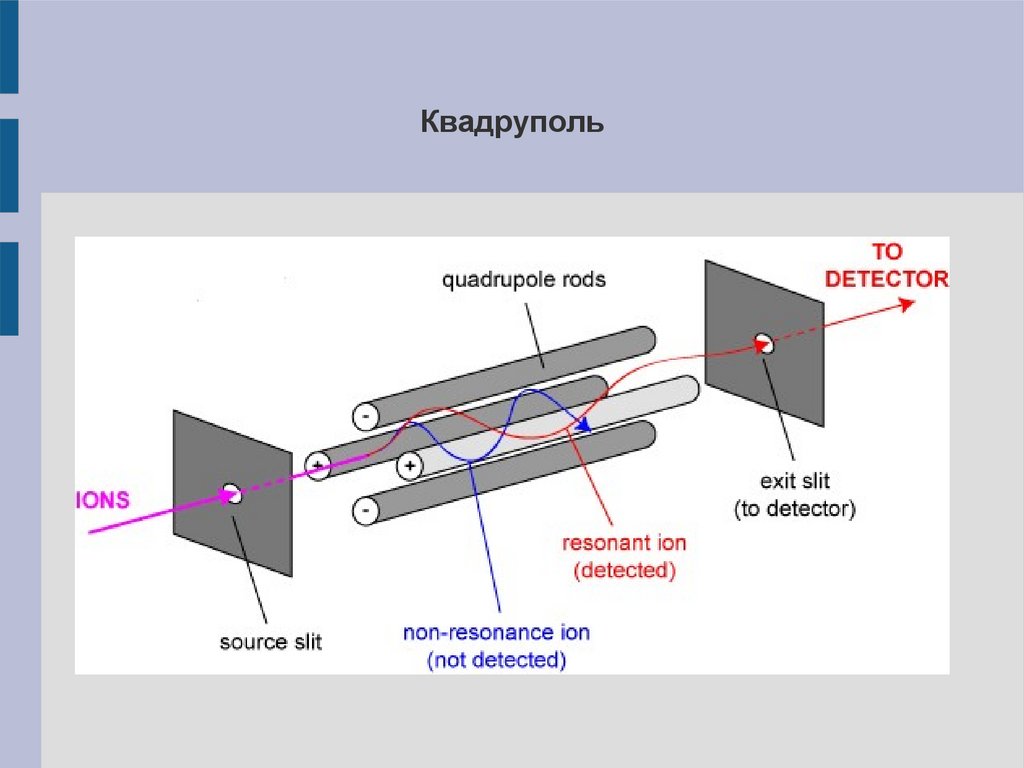
Разделение с помощью квадруполейИонный пучок направляют в пространство между четырьмя
параллельными электродами (квадруполь), два из которых
заряжены положительно, два – отрицательно. На электроды
наложено высокочастотное переменное напряжение. Проходя
через такое переменное поле, ионы колеблятся, и при
заданных частоте и амплитуде переменного поля только ионы
с определённым m/z попадают в анализатор.
17.
Квадруполь18.
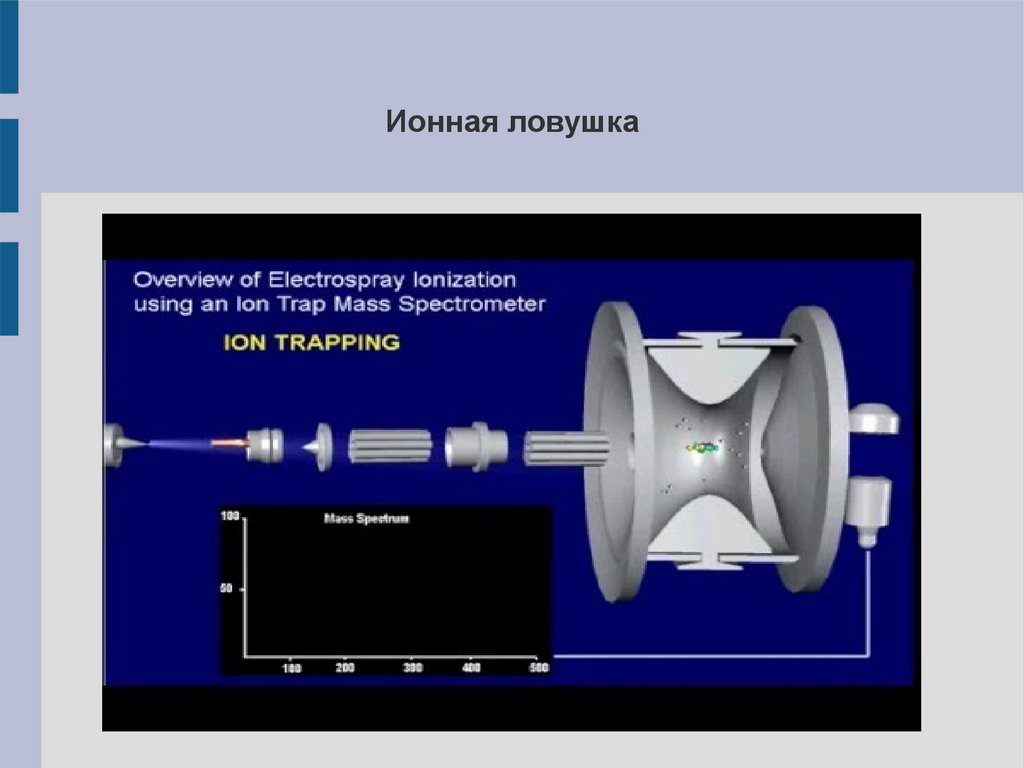
Ионная ловушкаПохож на квадрупольный анализатор: два электрода
(концевые) заземлены, между ними находится кольцевой
электрод, на который подаётся переменное высокочастотное
напряжение.
Ионы,
попав
в
пространство
между
электродами, остаются в нём, вращаясь по круговым
орбитам, радиус которых зависит от m/z; изменяя частоту и
амплитуду переменного поля, можно добиться выхода всех
ионов по очереди из области между электродами в детектор.
19.
Ионная ловушка20.
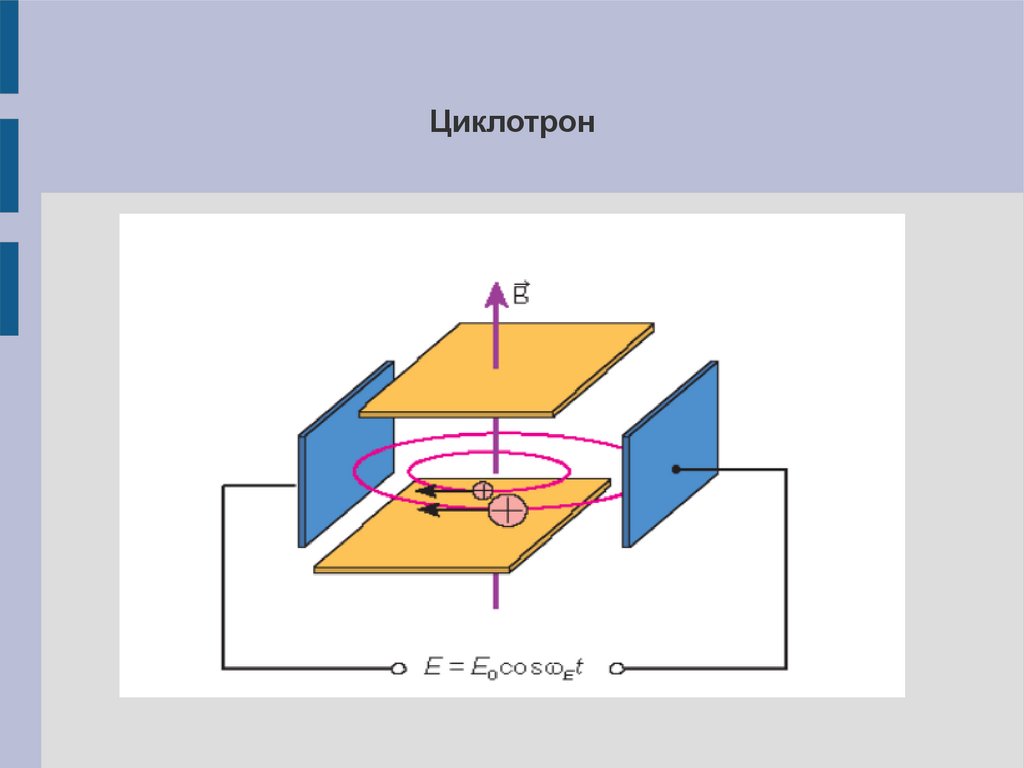
Ионно-циклотронный резонансИоны влетают в сильное магнитное поле, где начинают
двигаться по круговым орбиталям, радиус которых зависит от
m/z. Одновременно накладывается внешнее электрическое
поле с переменной частотой. При совпадении значения
частоты колебаний поля с частотой вращения иона последний
поглощает энергию и переходит на более высокую орбиту –
детекция сигнала.
21.
Циклотрон22.
Масс-спектрометрический протеомный анализI. Анализ de novo.
– включает получение индивидуальных препаратов белков, их
гидролиз и изучение масс-спектра смеси пептидов
II.
Анализ
белкового
профиля
(“отпечатки
пальцев”)
в
сравнении с базами данных.
–
не
требует
гидролиза
и
изучения
каждого
белка
индивидуально, а иногда не требует и выделения белков из
биологического образца
23.
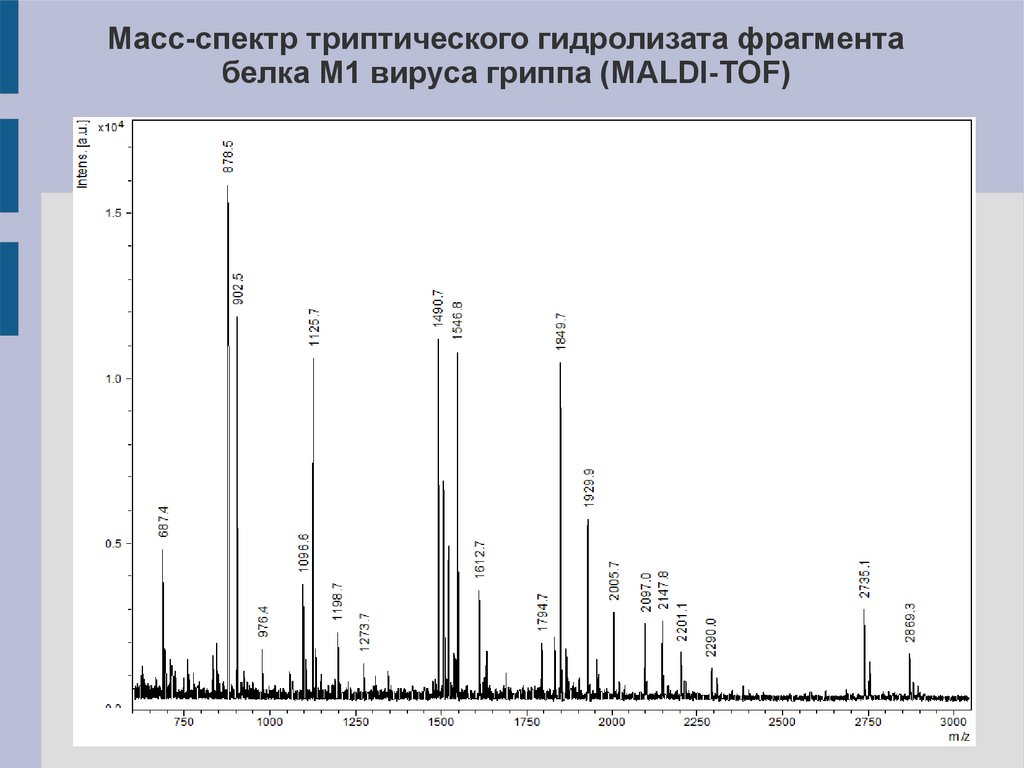
Масс-спектр триптического гидролизата фрагментабелка M1 вируса гриппа (MALDI-TOF)
24.
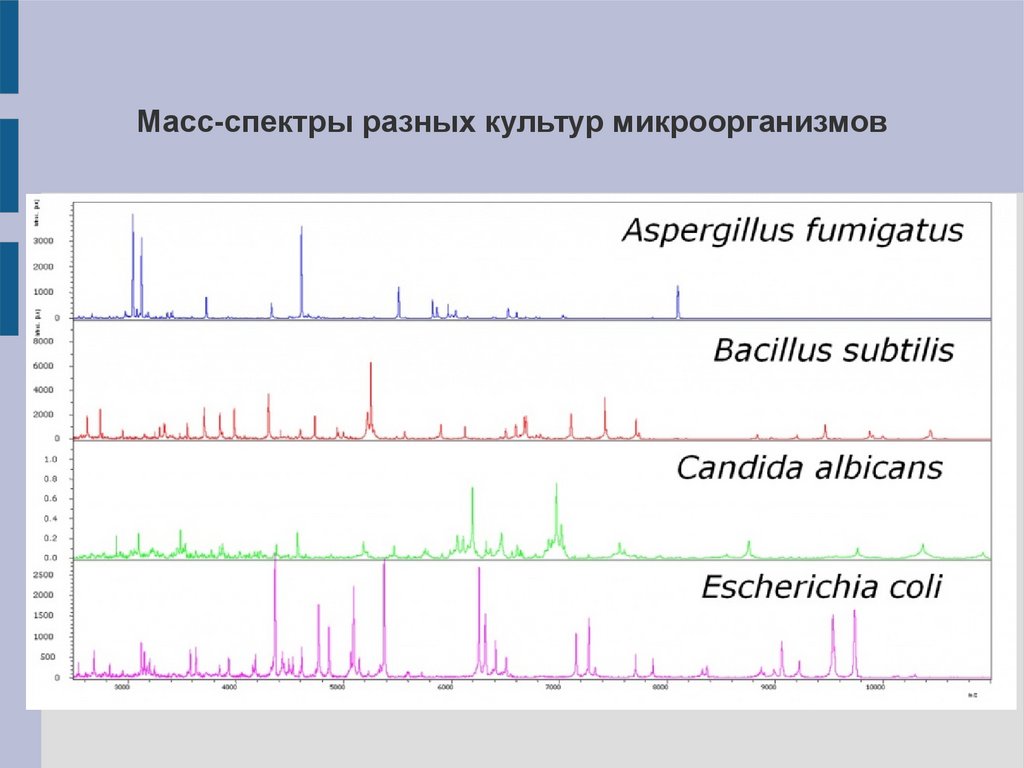
Масс-спектры разных культур микроорганизмов25.
Масс-спектрометрический протеомный анализ de novo1. Выделение и очистка смеси белков (протеом) из объекта.
2. Разделение смеси на отдельные белки (SDS-PAGE или
2D-PAGE).
3. Ферментативный протеолиз белка (трипсин) – получение
триптических фрагментов (пептиды).
3а. Разделение смеси пептидов (ВЭЖХ).
4. Определение масс-спектра набора пептидов.
5. Анализ данных (сборка белковой молекулы с помощью
протеомной базы данных).
26.
Основные варианты современного протеомногоанализа с помощью МС
I. MALDI-TOF MS
II.
HPLC-ESI
MS
(высокоэффективная
жидкостная
хроматография+МС с электрораспылением)
III. (HPLC)-MS/MS (тандемный масс-спектрометр c ВЭЖХ или
без)
27.
I. MALDI-TOFРазделение белков с помощью 2D PAGE
+ гидролиз целевого белка трипсином – получение смеси пептидов
28.
I. MALDI-TOF:масс-спектрометрия смеси пептидов
29.
II. HPLC/ESI MS:Разделение белков в SDS-PAGE
+ гидролиз целевого белка трипсином – получение смеси пептидов
30.
II. HPLC/ESI MS:масс-спектрометрия смеси пептидов с
предварительной хроматографией
31.
Тандемный масс-спектрометр (MS/MS)Для
детального
анализа
спектра
пептидной
смеси
используют 2 последовательно соединённых через камеру
соударений масс-спектрометра:
в первом проводится ионизация без фрагментации и
разделение ионов (ESI, реже MALDI);
в камере соударения проводится фрагментация полученных
ранее ионов (столкновение с атомами аргона, метод
бомбардировки быстрыми атомами – FAB)
во
втором
МС
набор
фрагментов
разделяется и детектируется
ионов
(дочерних)

























 physics
physics








