Similar presentations:
Злокачественный рост. Солидные опухоли. Лекция 8
1.
Злокачественный ростСолидные опухоли
(раки, саркомы и др.)
Инвазия,
метастазирование
Острые лейкозы
Интенсивное и
неограниченное во
времени деление
клеток
Блок
дифференцировки
Злокачественность лейкозов детерминируется блоком
дифференцировки неопластических клеток, подавлением
нормального кроветворения и возникающей в связи с этим
недостаточностью функции костного мозга (гибель
больных от инфекций, кровотечений и т.д.)
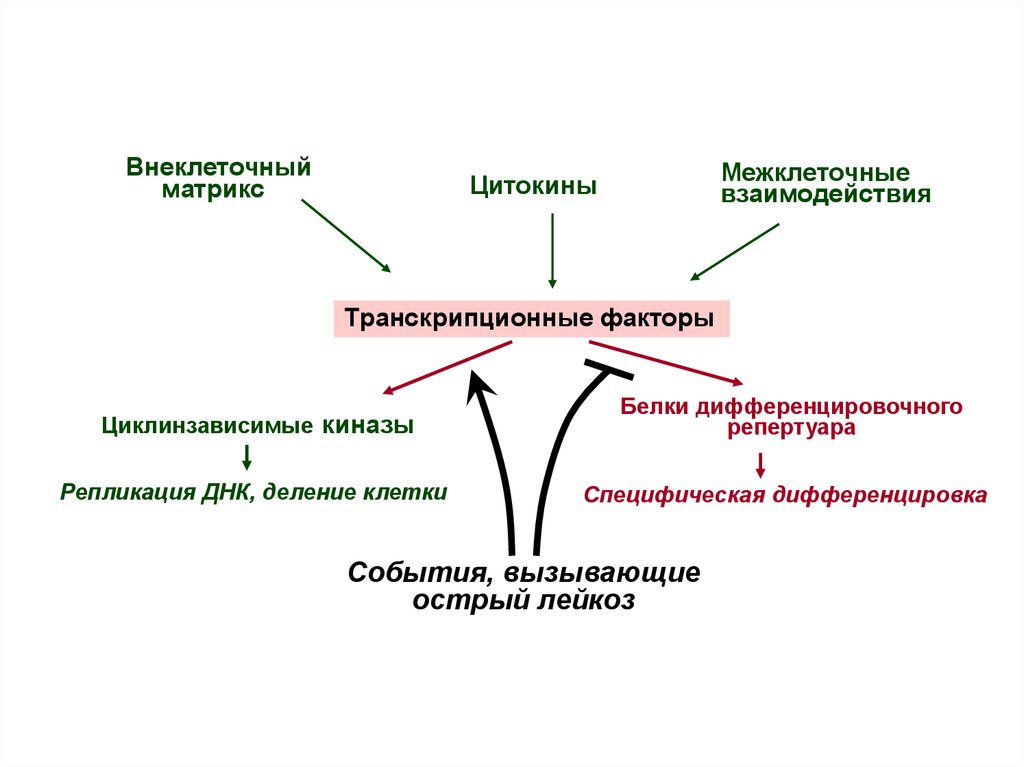
2.
Внеклеточныйматрикс
Межклеточные
взаимодействия
Цитокины
Транскрипционные факторы
Циклинзависимые киназы
Репликация ДНК, деление клетки
Белки дифференцировочного
репертуара
Специфическая дифференцировка
Cобытия, вызывающие
острый лейкоз
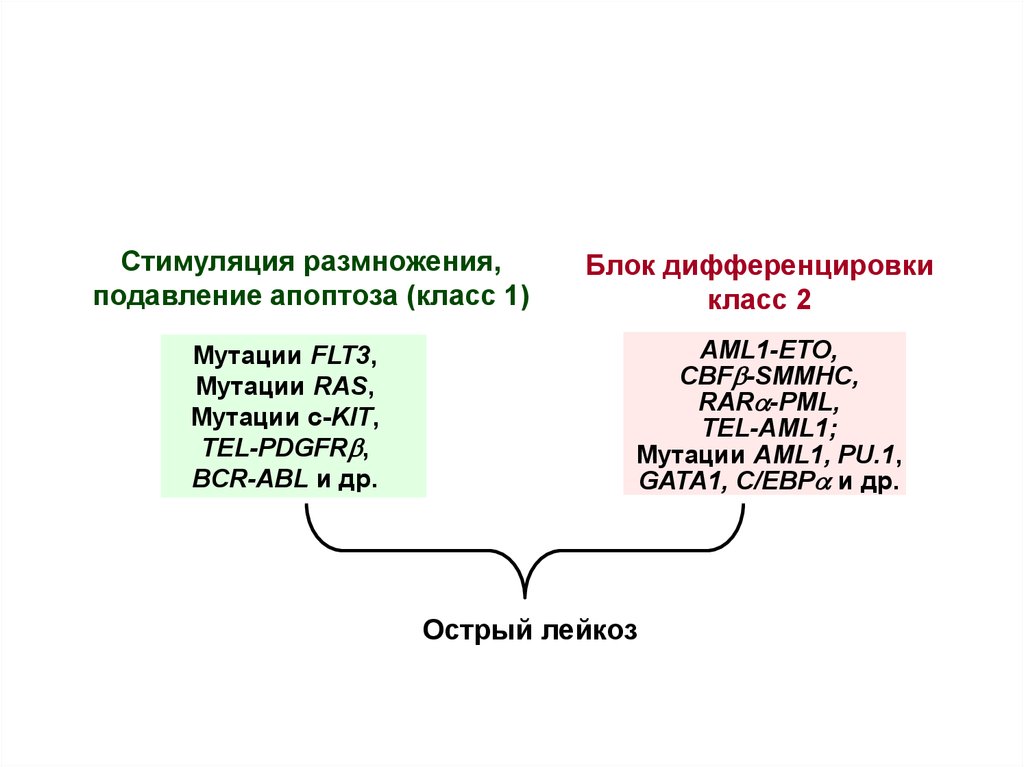
3.
Стимуляция размножения,подавление апоптоза (класс 1)
Мутации FLT3,
Мутации RAS,
Мутации c-KIT,
TEL-PDGFRb,
BCR-ABL и др.
Блок дифференцировки
класс 2
AML1-ETO,
CBFb-SMMHC,
RARa-PML,
TEL-AML1;
Мутации AML1, PU.1,
GATA1, C/EBPa и др.
Острый лейкоз
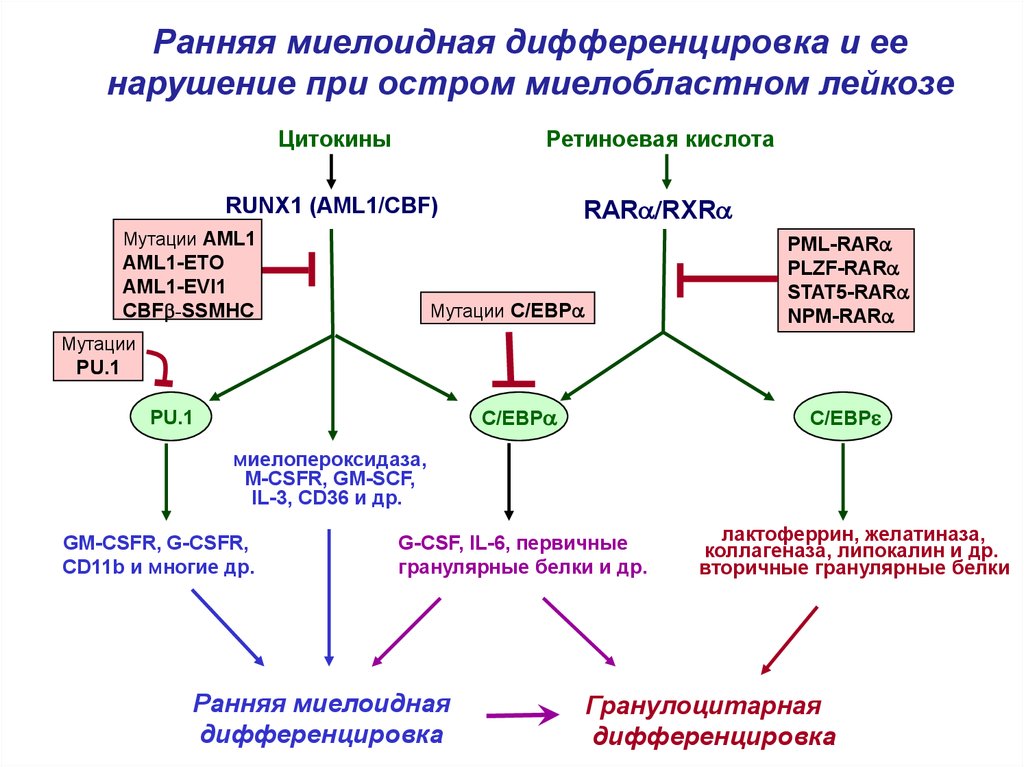
4.
Ранняя миелоидная дифференцировка и еенарушение при остром миелобластном лейкозе
Цитокины
Ретиноевая кислота
RUNX1 (AML1/CBF)
RARa/RXRa
Мутации AML1
AML1-ETO
AML1-EVI1
CBFb-SSMHC
PML-RARa
PLZF-RARa
STAT5-RARa
NPM-RARa
Мутации C/EBPa
Мутации
PU.1
C/EBPa
PU.1
C/EBPe
миелопероксидаза,
M-CSFR, GM-SCF,
IL-3, CD36 и др.
GM-CSFR, G-CSFR,
CD11b и многие др.
G-CSF, IL-6, первичные
гранулярные белки и др.
Ранняя миелоидная
дифференцировка
лактоферрин, желатиназа,
коллагеназа, липокалин и др.
вторичные гранулярные белки
Гранулоцитарная
дифференцировка
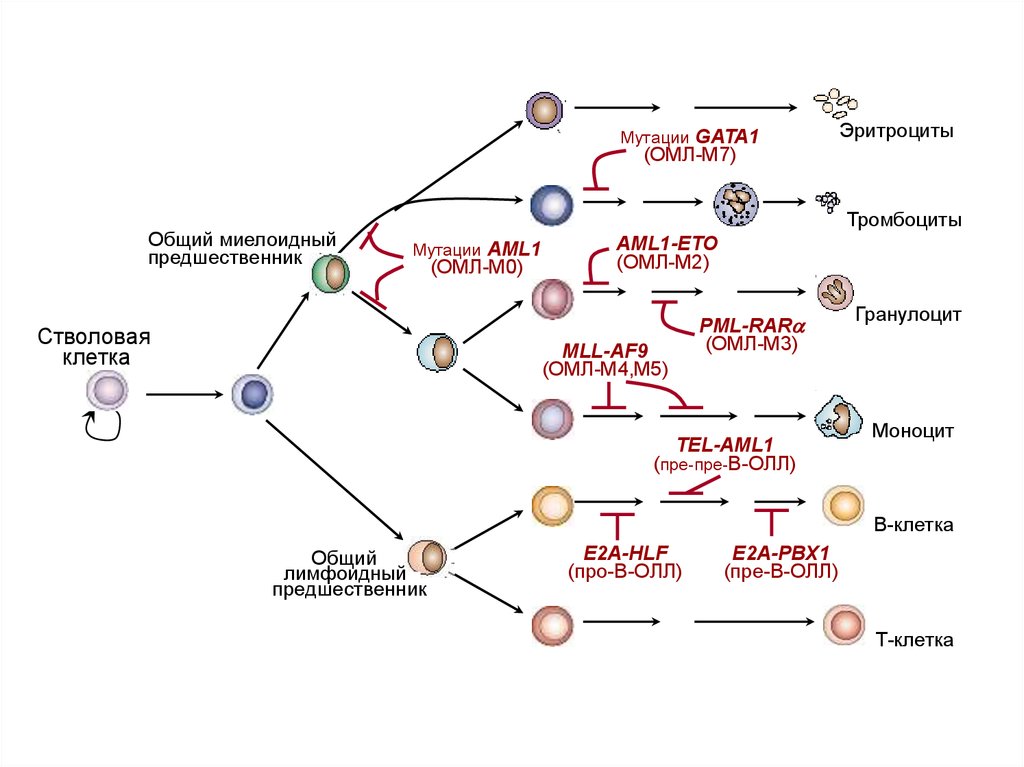
5.
Мутации GATA1Эритроциты
(ОМЛ-М7)
Общий миелоидный
предшественник
Тромбоциты
Мутации AML1
Cтволовая
клетка
(ОМЛ-М0)
AML1-ETO
(ОМЛ-М2)
MLL-AF9
(ОМЛ-М4,М5)
PML-RARa
(ОМЛ-М3)
TEL-AML1
(пре-пре-B-ОЛЛ)
Гранулоцит
Моноцит
В-клетка
Общий
лимфоидный
предшественник
E2A-HLF
(про-B-ОЛЛ)
E2A-PBX1
(пре-B-ОЛЛ)
Т-клетка
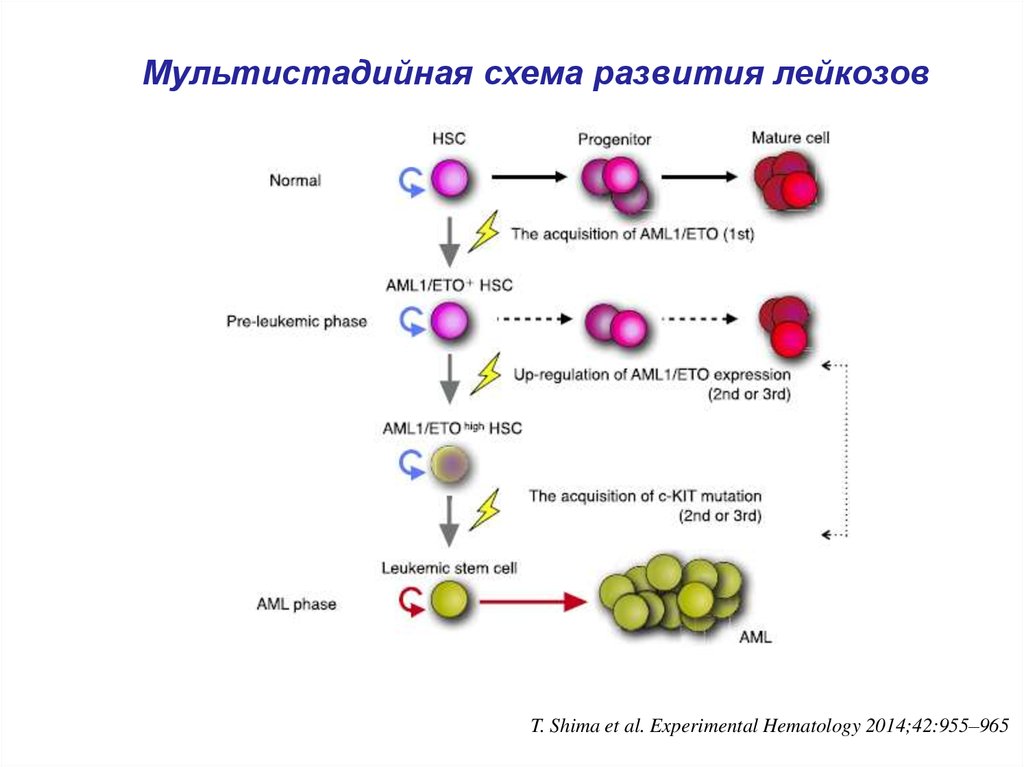
6. Мультистадийная схема развития лейкозов
T. Shima et al. Experimental Hematology 2014;42:955–9657.
Курс «Биология опухолевой клетки»(2019 г.)
Н.Л. Лазаревич
Лекция 8
Опухолевый супрессор р53: как один белок
контролирует многие аспекты канцерогенеза
8.
“p53 is a protein of many talents ...”K.Vousden, Cell, 2000
В PubMed число публикаций про p53 на 28.11.2019 - 97931
9.
Дисфункция р53 (мутации и др. аномалии) –наиболее универсальное молекулярное изменение
в опухолях человека. Она характерна для
большинства новообразований 50 разных типов.
Врожденные мутации р53 в половых клетках
ведут к синдрому Ли-Фраумени – наследственной
предрасположенности к развитию в молодом
возрасте сарком, рака молочной железы, опухолей
мозга, лимфолейкозов, и других новообразований.
10.
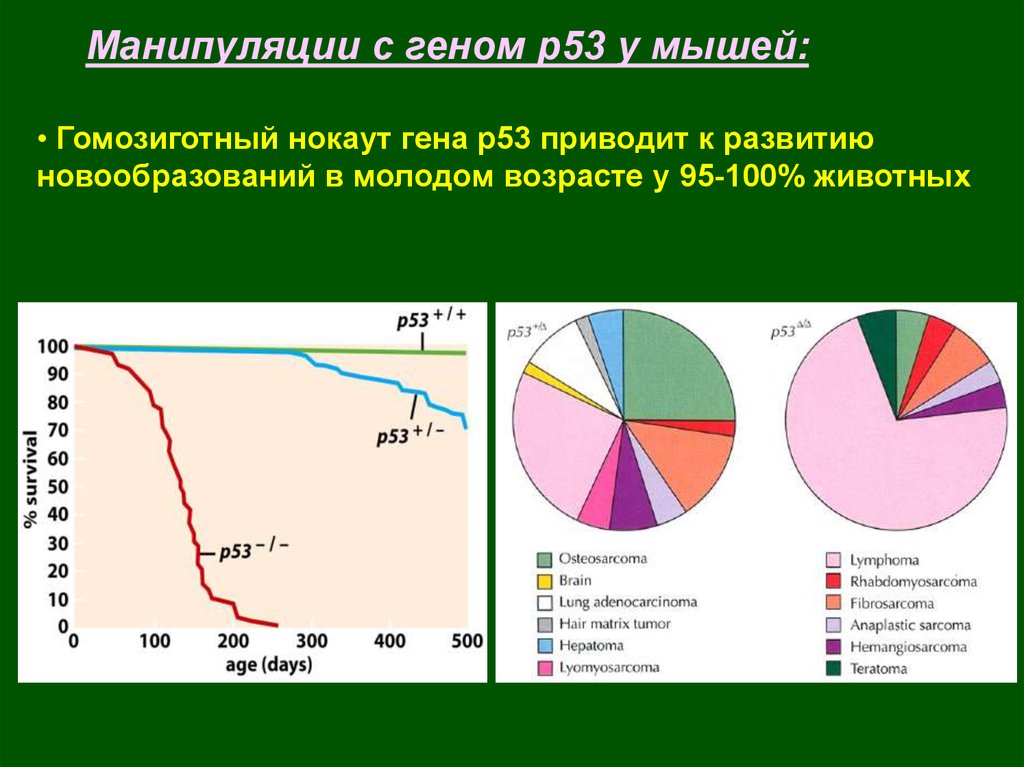
Манипуляции с геном р53 у мышей:• Гомозиготный нокаут гена р53 приводит к развитию
новообразований в молодом возрасте у 95-100% животных
11.
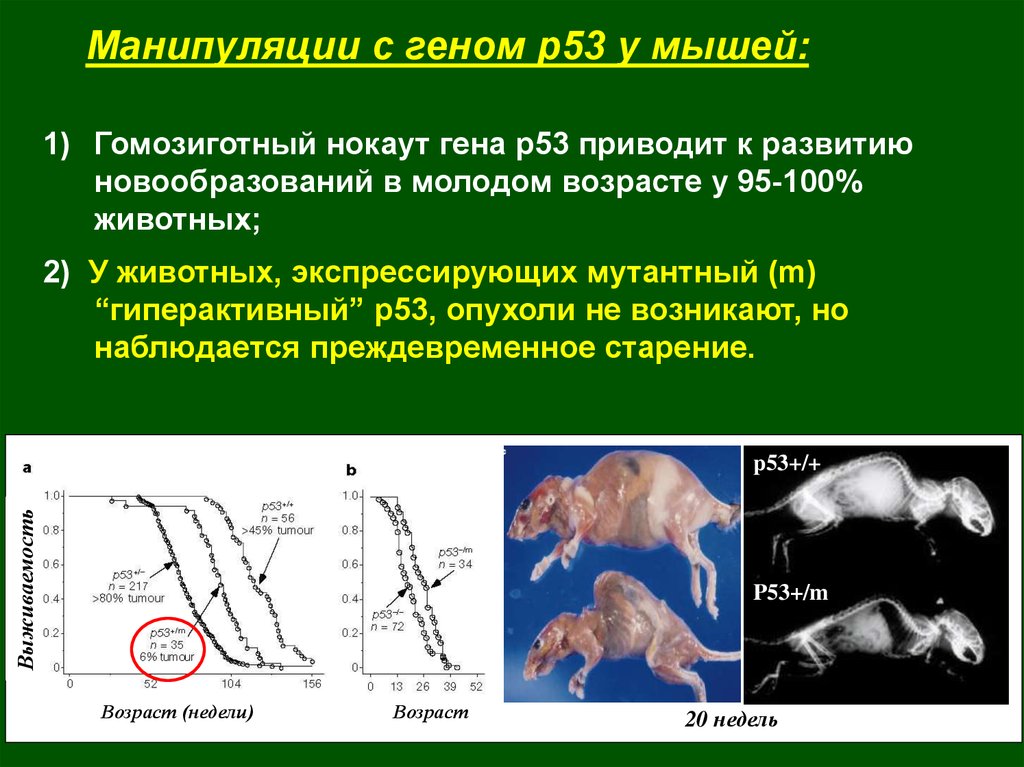
Манипуляции с геном р53 у мышей:1) Гомозиготный нокаут гена р53 приводит к развитию
новообразований в молодом возрасте у 95-100%
животных;
2) У животных, экспрессирующих мутантный (m)
“гиперактивный” р53, опухоли не возникают, но
наблюдается преждевременное старение.
Выживаемость
p53+/+
P53+/m
Возраст (недели)
Возраст
20 недель
12.
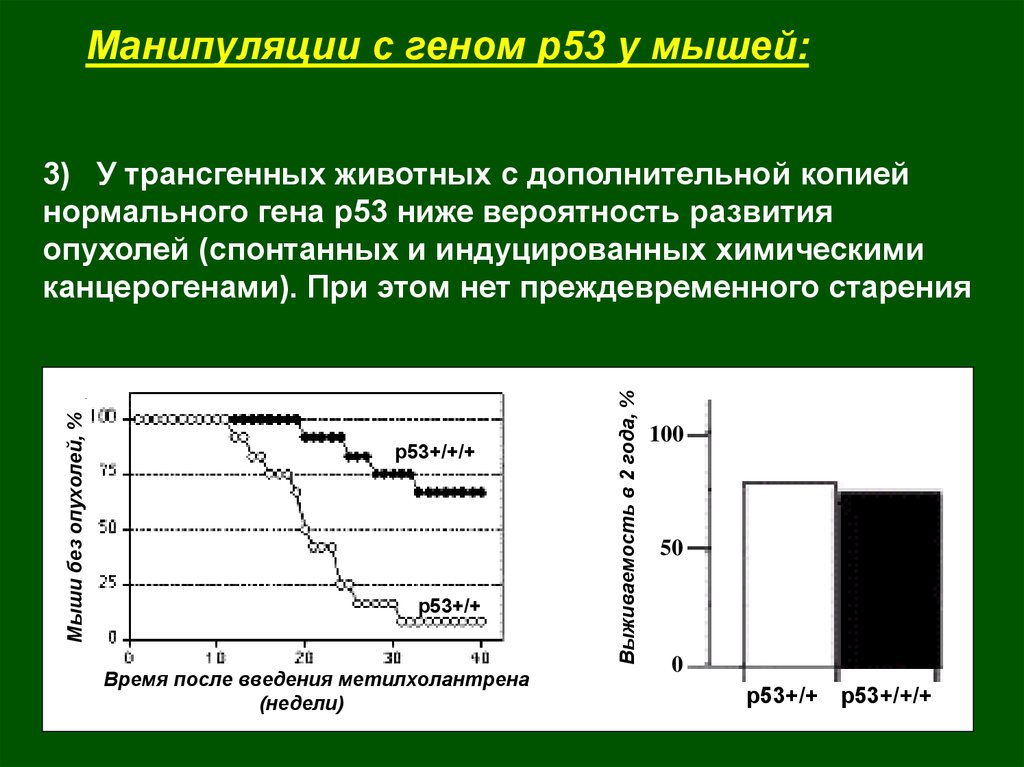
Манипуляции с геном р53 у мышей:p53+/+/+
p53+/+
Время после введения метилхолантрена
(недели)
Выживаемость в 2 года, %
Мыши без опухолей, %
3) У трансгенных животных с дополнительной копией
нормального гена р53 ниже вероятность развития
опухолей (спонтанных и индуцированных химическими
канцерогенами). При этом нет преждевременного старения
100
78%
75%
50
0
p53+/+ p53+/+/+
13.
Структурные доменыполноразмерного р53
P PP
ТA1
P
ТA2
Трансактивация
1-42 43-63
P
P
64-92
Сиквенс-специфическое
связывание ДНК
4 x PuPuPuCA/TA/TGPyPyPy
102-306
- сайты фосфорилирования;
Ac
Ac
P PAc P
ОлигоNLS меризация
Регуляция
307-355
364-393
- сайты ацетилирования
P – пролин-богатый домен (взаимодействие с другими белками)
14.
Изоформы р5353 kD
p53
полноразмерный
45 kD
p53b
альтернативный сплайсинг (интрон 9)
46 kD
p53g
альтернативный сплайсинг (интрон 9)
D40 p53(p47)
47 kD
альт. сплайсинг (интрон 2) / альт. инициация трансляции (экзон 4)
D40 p53b
41 kD
альт. сплайсинг (интроны 2,9) / альт. инициация трансляции (экзон 4)
D40 p53g
42 kD
альт. сплайсинг (интроны 2,9) / альт. инициация трансляции (экзон 4)
D133 p53
35 kD
внутренний промотор (интрон 4)
D133 p53b
25 kD
внутренний промотор (интрон 4) / альт. сплайсинг (интрон 9)
26 kD
D133 p53g
внутренний промотор (интрон 4) / альт. сплайсинг (интрон 9)
D p53
альтернативный сплайсинг (экзоны 7- 9)
p53as
(специфична для грызунов)
альтернативный сплайсинг (интрон 10)
15.
Конформация молекул белка р53претерпевает значительные изменения
В зависимости от приобретаемой конформации р53
способен:
Повышать транскрипцию определенных генов;
Подавлять транскрипцию ряда генов;
Стимулировать репарацию ДНК;
Подавлять репликацию ДНК вирусов;
16.
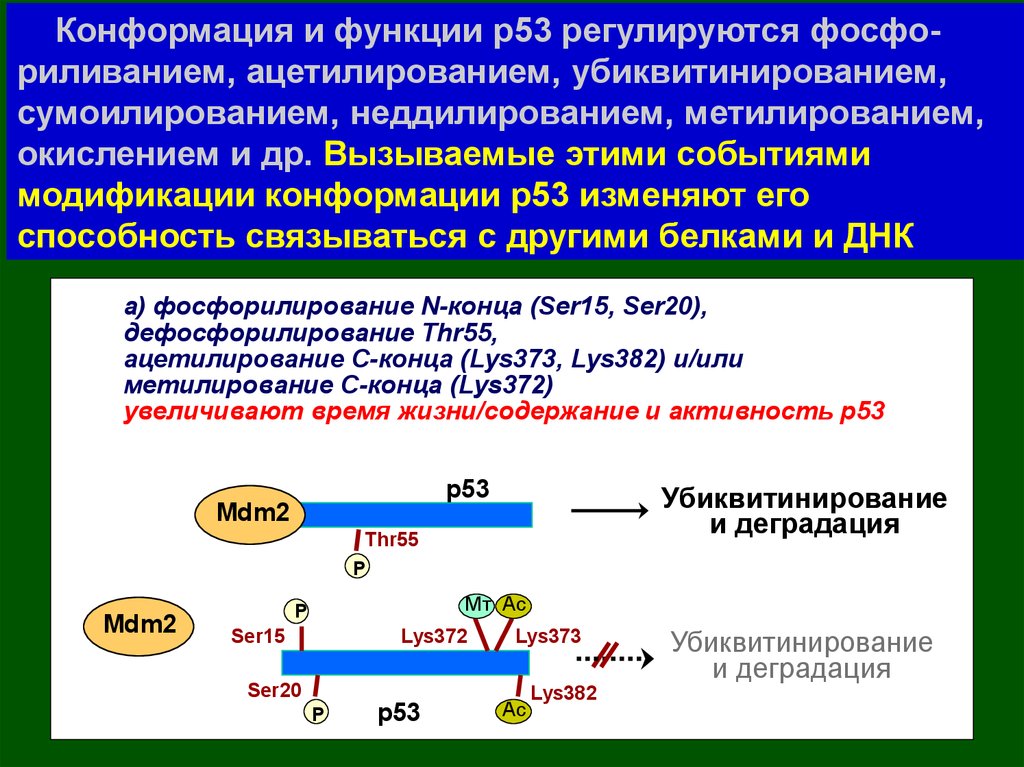
Конформация и функции р53 регулируютсяфосфориливанием, ацетилированием,
убиквитинированием, сумоилированием,
неддилированием, метилированием, окислением и др.
17.
Конформация и функции р53 регулируются фосфориливанием, ацетилированием, убиквитинированием,сумоилированием, неддилированием, метилированием,
окислением и др. Вызываемые этими событиями
модификации конформации р53 изменяют его
способность связываться с другими белками и ДНК
а) фосфорилирование N-конца (Ser15, Ser20),
дефосфорилирование Thr55,
ацетилирование С-конца (Lys373, Lys382) и/или
метилирование С-конца (Lys372)
увеличивают время жизни/содержание и активность р53
р53
Mdm2
Убиквитинирование
и деградация
Thr55
P
Mdm2
Mт Ac
P
Ser15
Lys372
Ser20
P
р53
Lys373
Ac
Lys382
Убиквитинирование
и деградация
18.
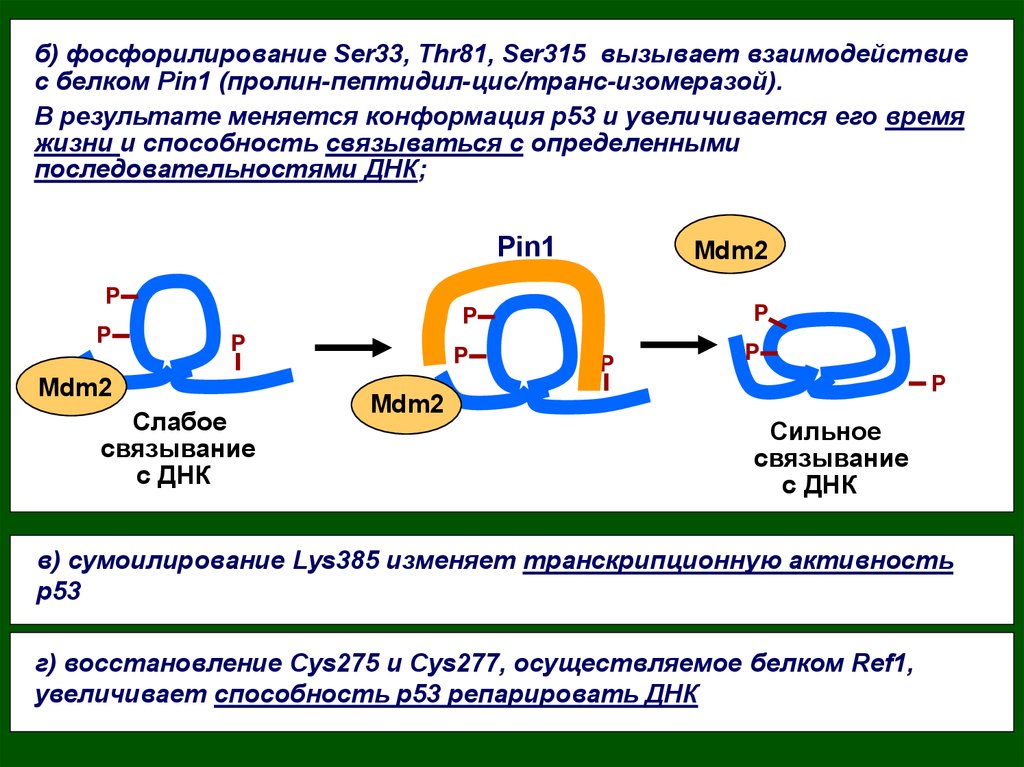
б) фосфорилирование Ser33, Thr81, Ser315 вызывает взаимодействиес белком Pin1 (пролин-пептидил-цис/транс-изомеразой).
В результате меняется конформация р53 и увеличивается его время
жизни и способность связываться с определенными
последовательностями ДНК;
Pin1
P
P
Mdm2
P
P
P
Mdm2
Слабое
связывание
с ДНК
P
Mdm2
P
P
P
Сильное
связывание
с ДНК
в) сумоилирование Lys385 изменяет транскрипционную активность
р53
г) восстановление Сys275 и Cys277, осуществляемое белком Ref1,
увеличивает способность р53 репарировать ДНК
19.
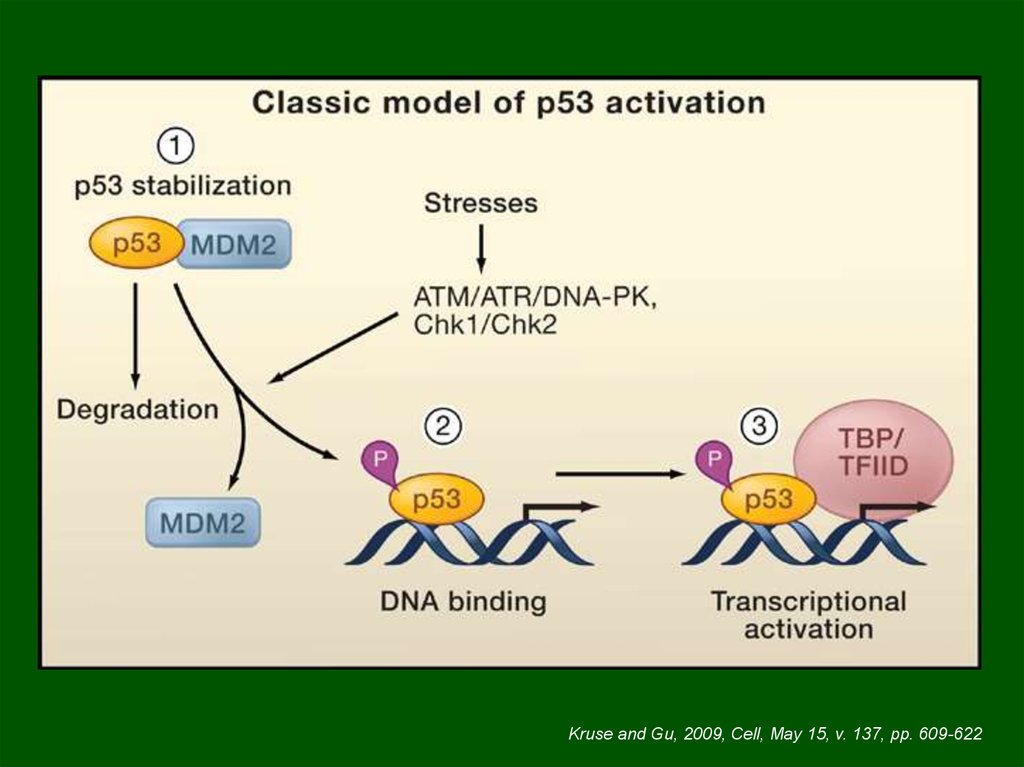
Kruse and Gu, 2009, Cell, May 15, v. 137, pp. 609-62220.
Kruse and Gu, 2009, Cell, v. 137, pp. 609-62221.
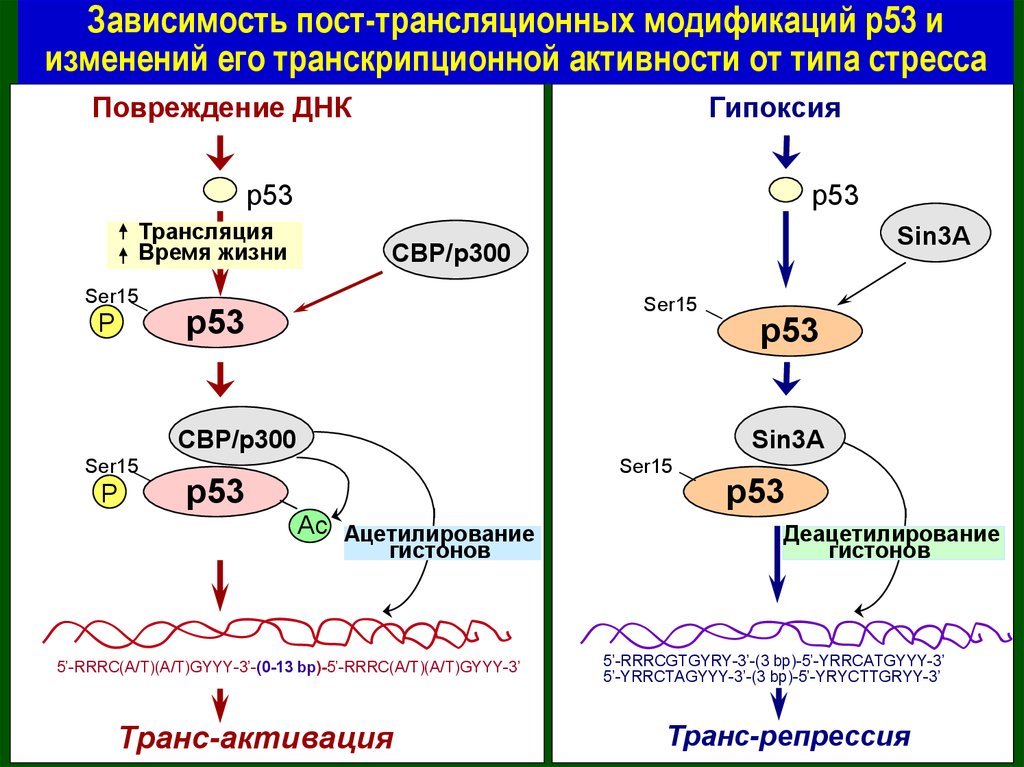
Зависимость пост-трансляционных модификаций р53 иизменений его транскрипционной активности от типа стресса
Повреждение ДНК
Гипоксия
p53
Трансляция
Время жизни
p53
Ser15
Ser15
p53
P
Sin3A
CBP/p300
p53
CBP/p300
Sin3A
Ser15
P
Ser15
p53
p53
Ac Ацетилирование
гистонов
5’-RRRC(A/T)(A/T)GYYY-3’-(0-13 bp)-5’-RRRC(A/T)(A/T)GYYY-3’
Транс-активация
Деацетилирование
гистонов
5’-RRRCGTGYRY-3’-(3 bp)-5’-YRRCATGYYY-3’
5’-YRRCTAGYYY-3’-(3 bp)-5’-YRYCTTGRYY-3’
Транс-репрессия
22.
Пост-трансляционные модификации регулируютбиологические активности р53
«Репарационная»
форма
Сys275,
Сys277
p53
Репарация ДНК
Селен
«Латентная»
форма
O
p53 Сys275,
Сys277
O
Повреждения ДНК,
стрессы
«Cтрессовые»
формы
Регуляция экспрессии генов,
контролирующих
• антиоксидантную защиту;
• движение и адгезию клеток;
• подавление репликации
вирусных ДНК
Ser15, Ser20, Ser33,
Ser46, Thr81, Ser315
P P
P
P
p53Ac
Ac
Lys373,Lys382
Изменения экспрессии генов,
индуцирующие:
• арест клеточного цикла;
• апоптоз
23.
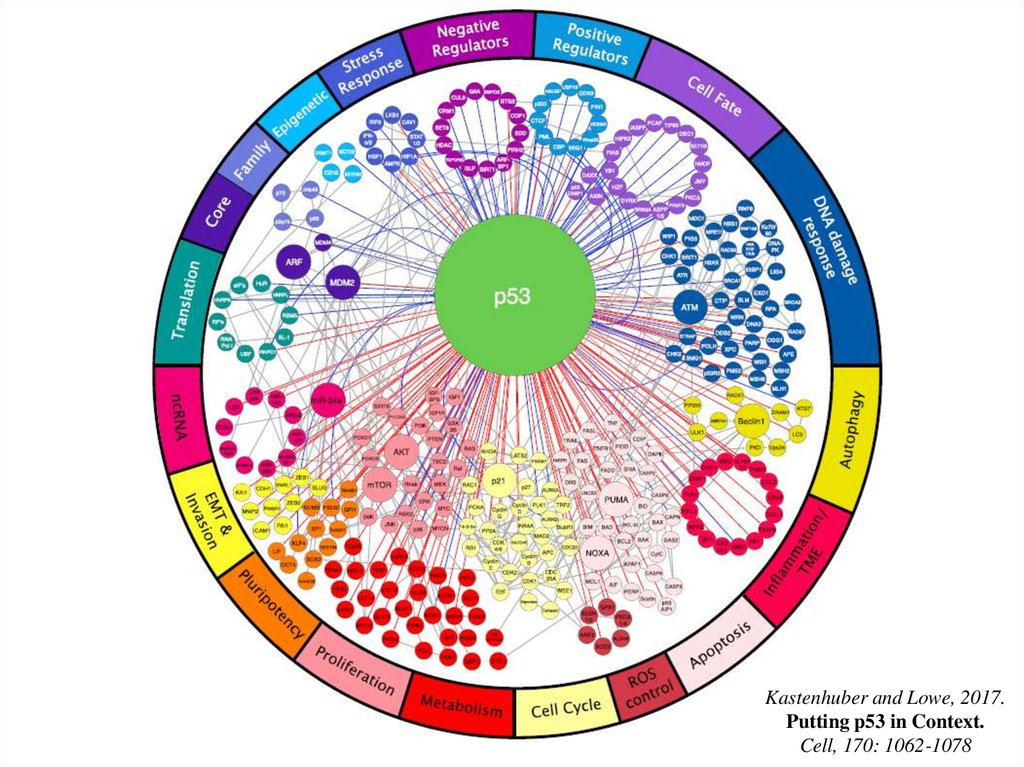
Некоторые гены-мишени р53 и регулируемые ими биологическиефункции (всего в геноме человека ~450 сайтов связывания р53)
Петли
негативной
авторегуляции
HGF/SF,
HGF1/MSP,
MET(HGF-R),
HB-EGF,
EGF-R,
CD44,
Pirh2,
COP1
Mdm2
р53
Wip1
SDF-1
Notch1
MCK,
SMA-a,
Nanog и др.
SESN1,
SESN2,
GPX1,
SOD2
p53R2
GADD45,
DDB2,
XPC,
XPE
XPG
DNA pol k
Миграция и
дифференцировка клеток
Детоксикация
радикалов и
репарация ДНК
Фибронектин,
SCO2,
PGM
Tsp1,
Tsp2,
SEMA3F,
BAI-1
GD-AIF
a2HP
Маспин
HIF-1,
VEGF
p21WAF1,
14-3-3s,
Reprimo,
BTG2,
B99
PTGF-b,
Cdc2,
Циклин B,
Cdc25A
EKT2
DP1
miR34
Подавление
гликолиза и
ангиогенеза
Остановка
клеточного
цикла
BAX,
PUMA,
p53AIP1,
PIG3,
Fas/APO1,
Killer/DR5,
APAF1,
Скотин,
PTEN
Сурвивин
BCL2
SESN1,
SESN2
Апоптоз,
аутофагия
24.
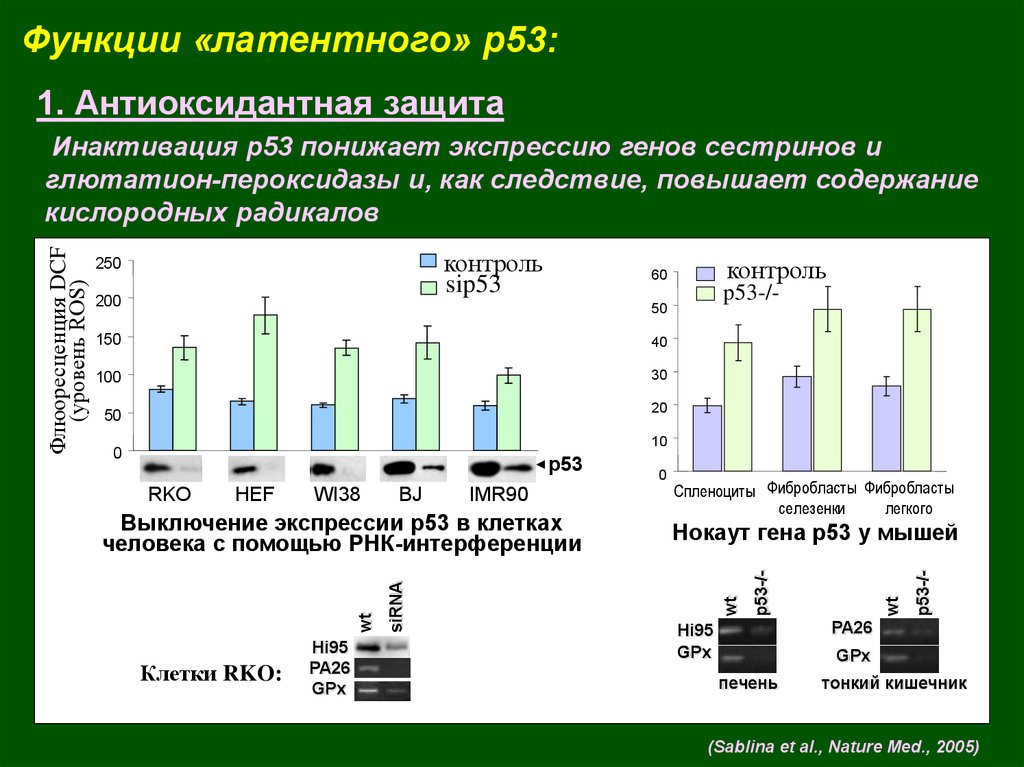
Функции «латентного» p53:1. Антиоксидантная защита
контроль
sip53
250
200
контроль
60
p53-/-
50
150
40
100
30
50
20
10
WI38
BJ
IMR90
Клетки RKO:
Hi95
PA26
GPx
siRNA
Выключение экспрессии р53 в клетках
человека с помощью РНК-интерференции
Спленоциты Фибробласты Фибробласты
селезенки
легкого
Нокаут гена р53 у мышей
p53-/-
HEF
wt
RKO
0
p53-/-
р53
wt
0
wt
Флюоресценция DCF
(уровень ROS)
Инактивация р53 понижает экспрессию генов сестринов и
глютатион-пероксидазы и, как следствие, повышает содержание
кислородных радикалов
PA26
Hi95
GPx
GPx
печень
тонкий кишечник
(Sablina et al., Nature Med., 2005)
25.
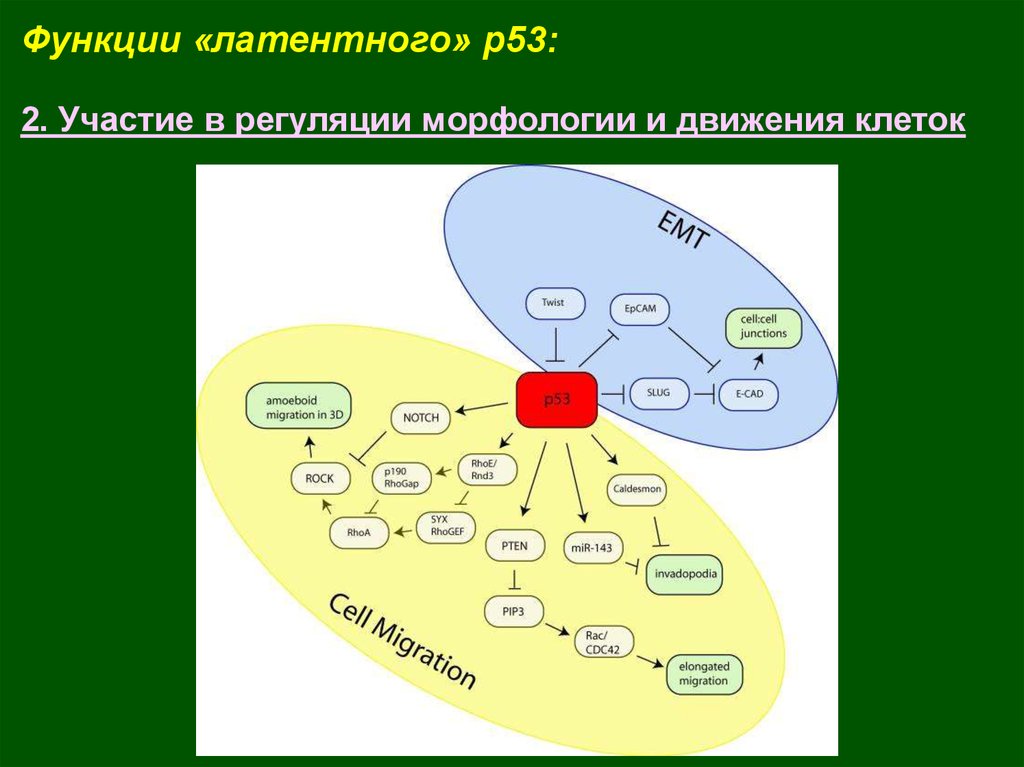
Функции «латентного» p53:2. Участие в регуляции морфологии и движения клеток
26.
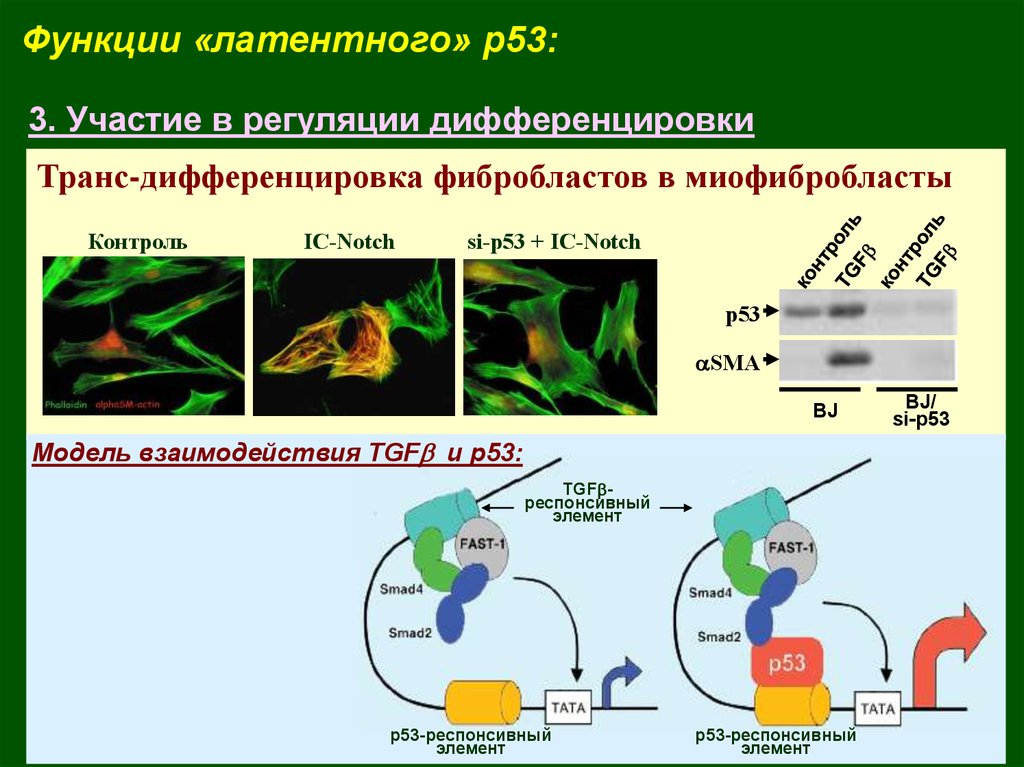
Функции «латентного» p53:3. Участие в регуляции дифференцировки
Транс-дифференцировка фибробластов в миофибробласты
Контроль
IC-Notch
si-p53 + IC-Notch
p53
aSMA
BJ
Модель взаимодействия TGFb и р53:
TGFbреспонсивный
элемент
р53-респонсивный
элемент
р53-респонсивный
элемент
BJ/
si-p53
27.
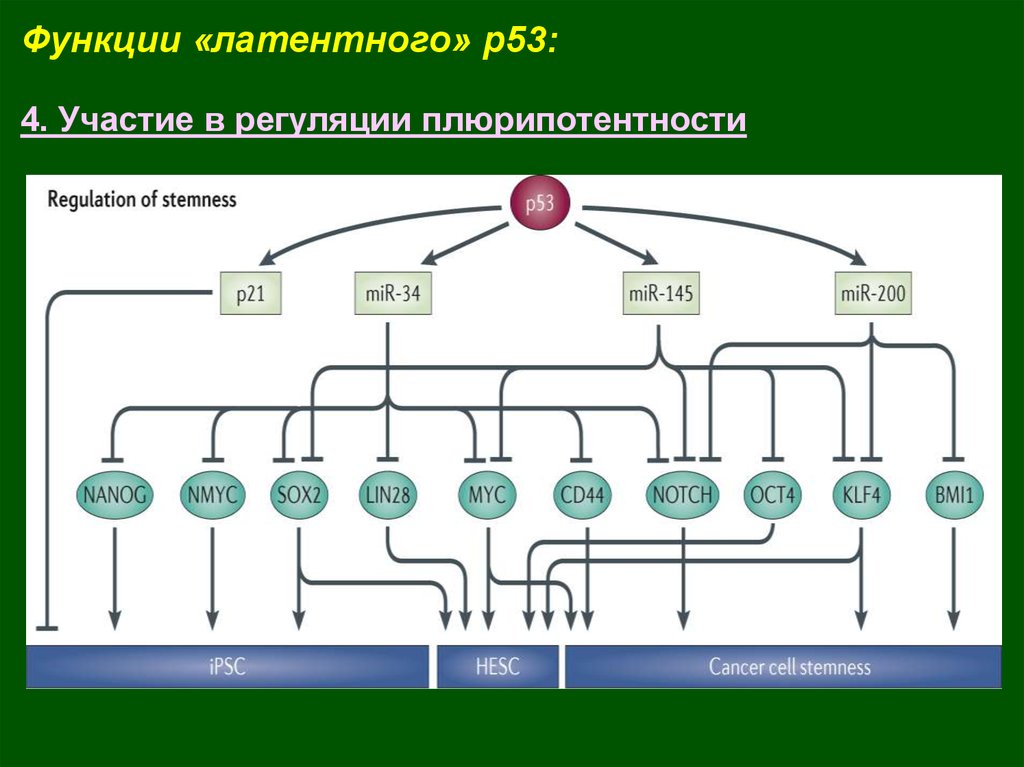
Функции «латентного» p53:4. Участие в регуляции плюрипотентности
28.
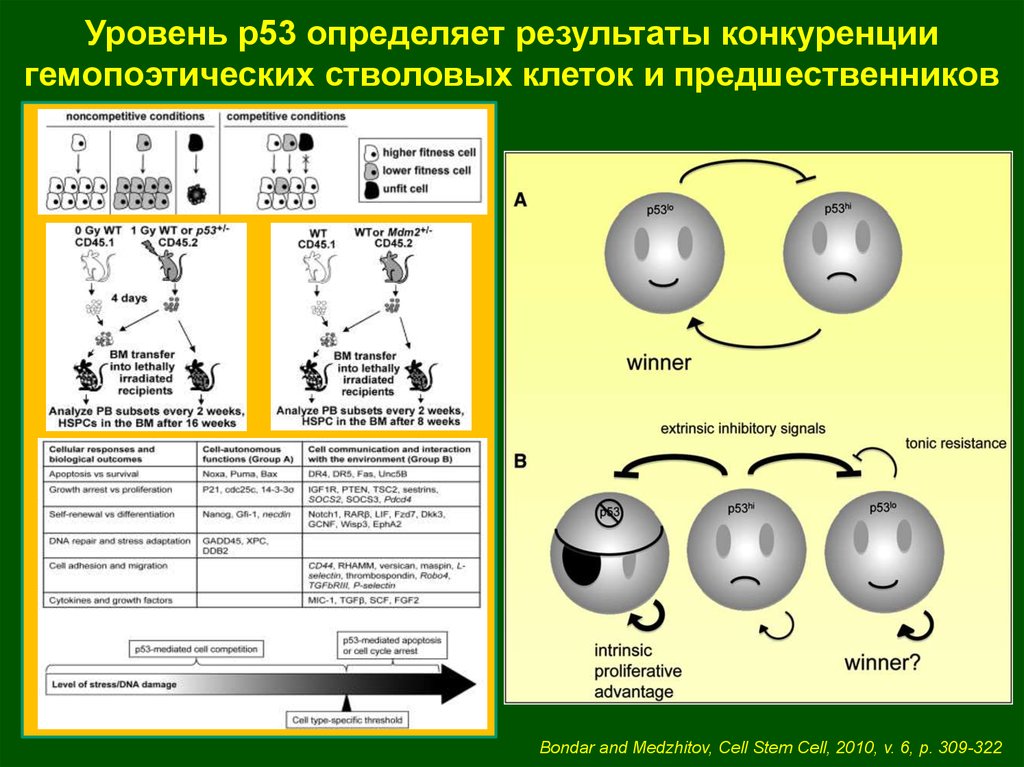
Уровень р53 определяет результаты конкуренциигемопоэтических стволовых клеток и предшественников
Bondar and Medzhitov, Cell Stem Cell, 2010, v. 6, p. 309-322
29.
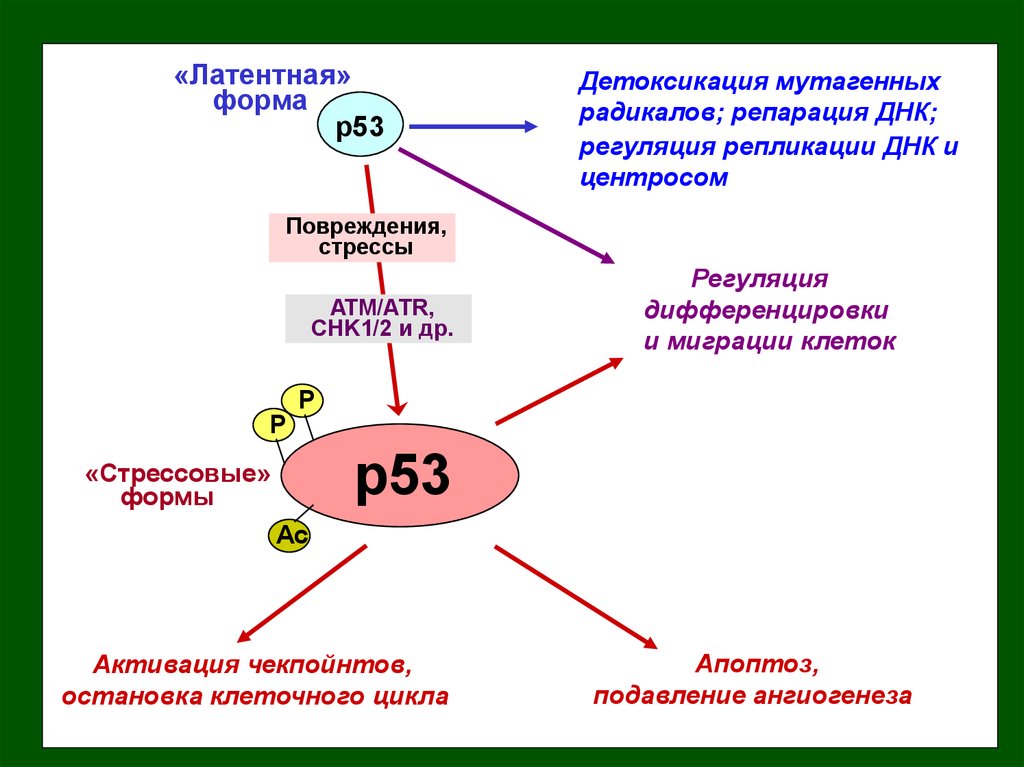
«Латентная»форма
p53
Детоксикация мутагенных
радикалов; репарация ДНК;
регуляция репликации ДНК и
центросом
Повреждения,
стрессы
ATM/ATR,
CHK1/2 и др.
Регуляция
дифференцировки
и миграции клеток
P
P
p53
«Стрессовые»
формы
Ac
Активация чекпойнтов,
остановка клеточного цикла
Апоптоз,
подавление ангиогенеза
30.
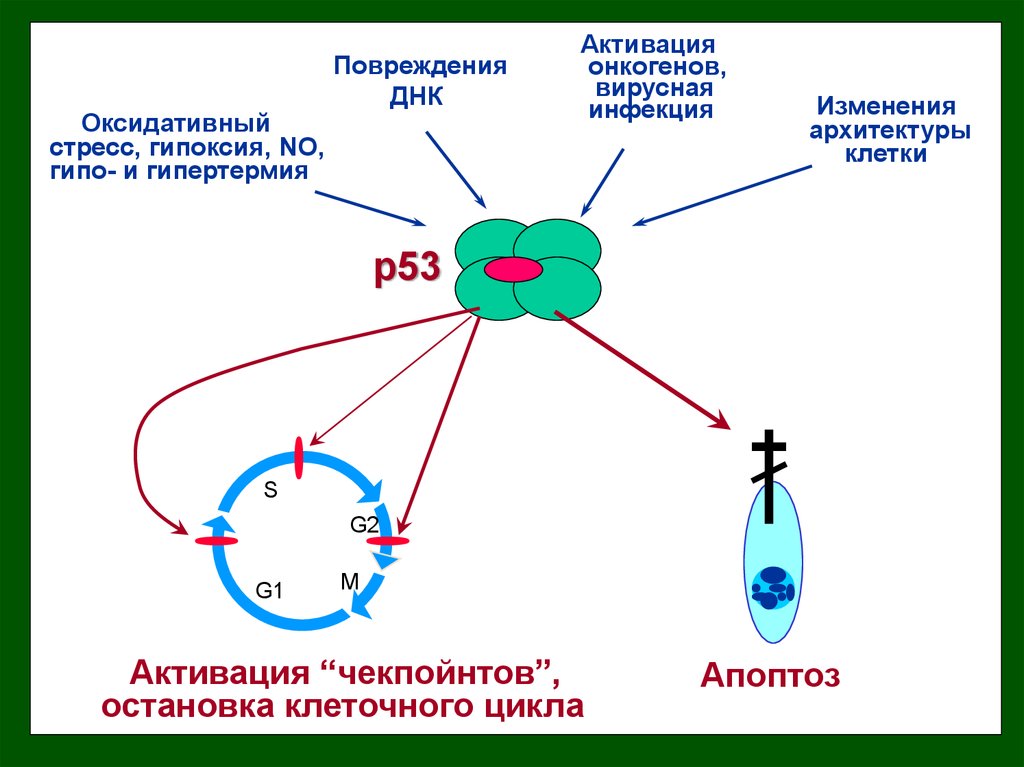
Оксидативныйстресс, гипоксия, NO,
гипо- и гипертермия
Повреждения
ДНК
Активация
онкогенов,
вирусная
инфекция
Изменения
архитектуры
клетки
p53
S
G2
G1
M
Активация “чекпойнтов”,
остановка клеточного цикла
Апоптоз
31.
Наборы генов, экспрессия которых изменяетсявследствие активации р53, зависят от типа стресса
(Microarray analysis, HCT116 p53+/+ vs. HCT116 p53-/-)
32.
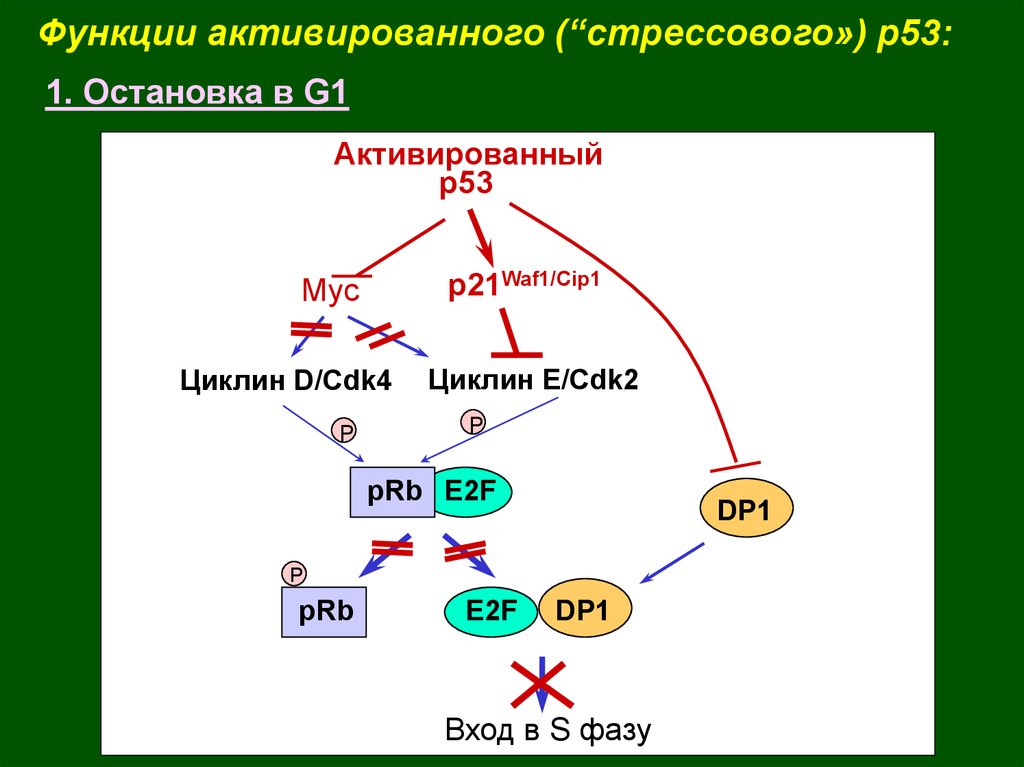
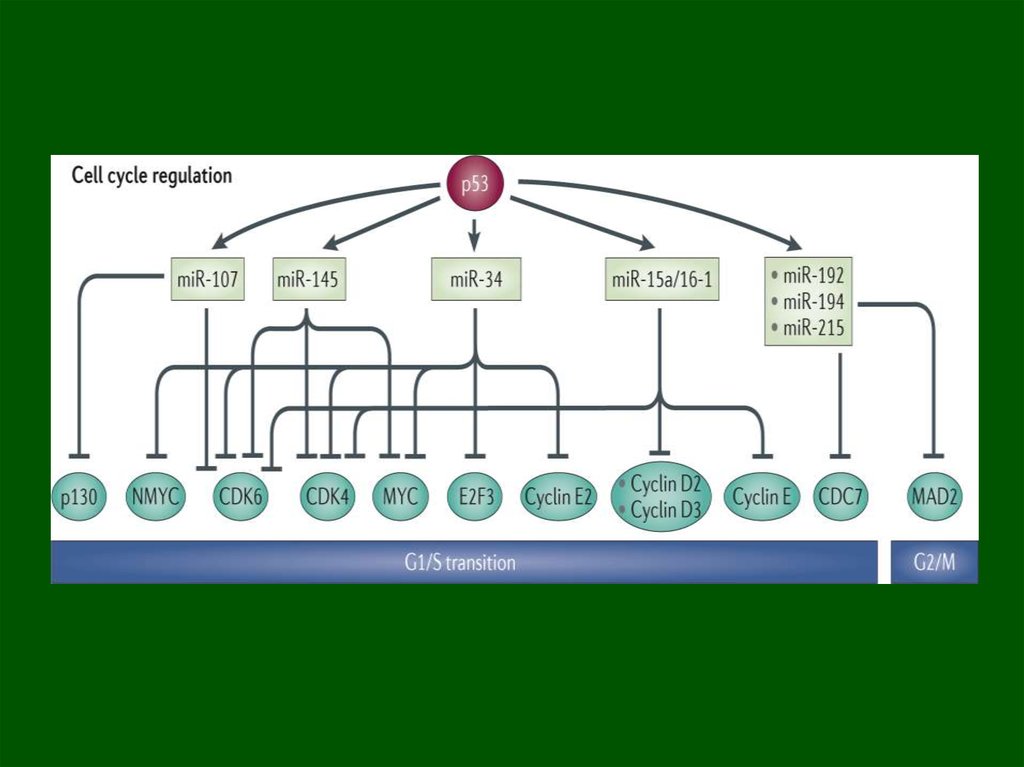
Функции активированного (“стрессового») p53:1. Остановка в G1
Активированный
р53
p21Waf1/Cip1
Myc
Циклин D/Cdk4
P
Циклин Е/Cdk2
P
pRb E2F
DP1
P
pRb
E2F
DP1
Вход в S фазу
33.
34.
Функции активированного (“стрессового») p53:2. Остановка в G2
Активированный
р53
14-3-3s
p21Waf1
Gadd45
Gadd45
Cdc2
14-3-3s
Циклин B
Cdс2
Циклин B Cdc2
Цитоплазма
Вход в митоз
Циклин B
Cdc2
35.
Функции активированного (“стрессового») p53:3. Остановка в S
p53
D p53
альтернативный сплайсинг (экзоны 7- 9)
Время после повреждения ДНК в G1 S
(часы)
0
4
8
12
16
D р53
p21Waf1/Cip1
D p53 не активирует апоптоз
Повреждение ДНК в S
Активированный
D р53 (P-Ser15 и др.)
p21Waf1/Cip1
р53
p21Waf1/Cip1
20
D p53 активен в S, но не
в других фазах цикла
Циклин A/Cdk2
Продвижение по S фазе
36.
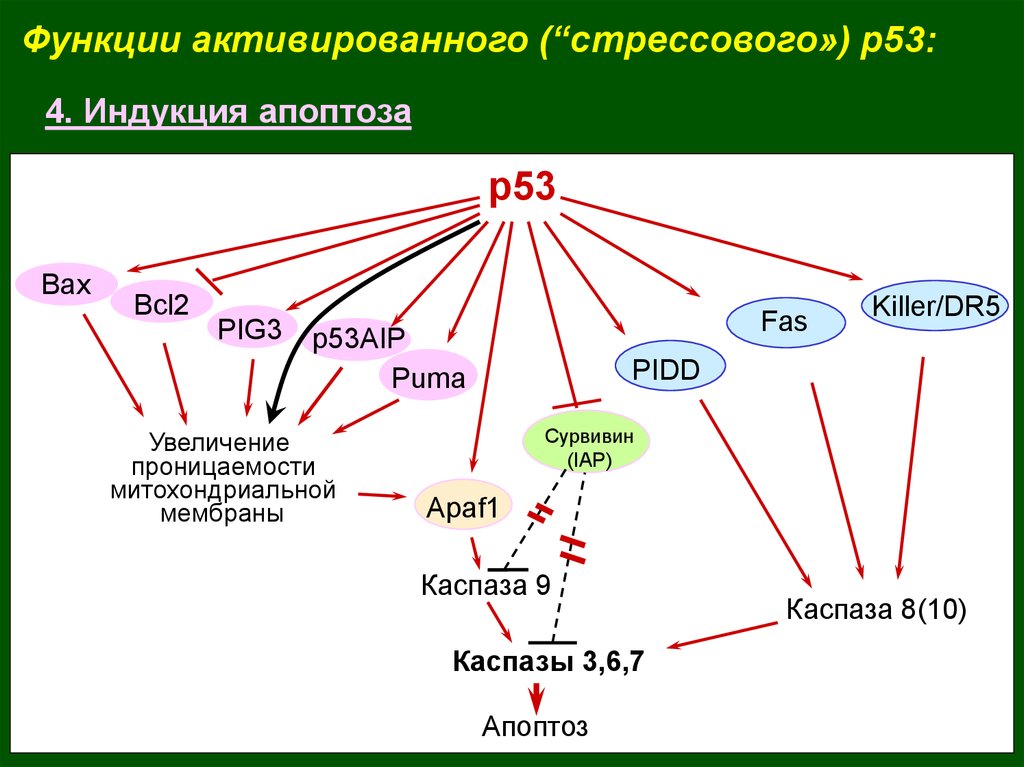
Функции активированного (“стрессового») p53:4. Индукция апоптоза
р53
Bax
Bcl2
PIG3
Fas
p53AIP
Puma
Увеличение
проницаемости
митохондриальной
мембраны
Killer/DR5
PIDD
Сурвивин
(IAP)
Apaf1
Каспаза 9
Каспазы 3,6,7
Апоптоз
Каспаза 8(10)
37.
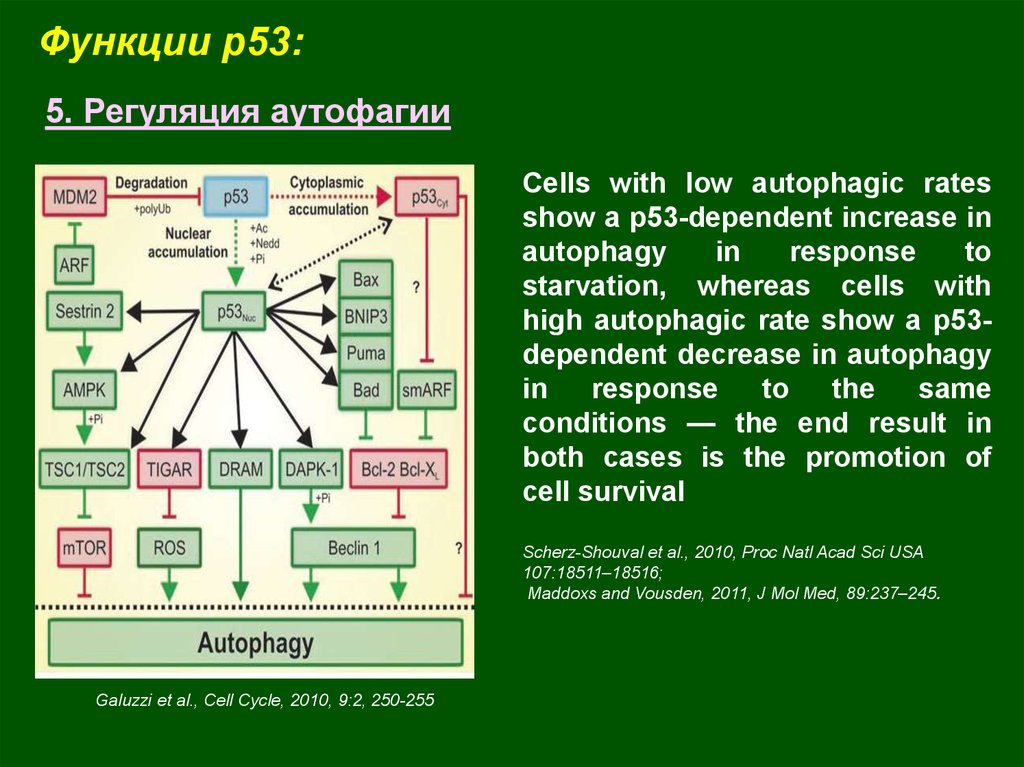
Функции p53:5. Регуляция аутофагии
Сells with low autophagic rates
show a p53-dependent increase in
autophagy
in
response
to
starvation, whereas cells with
high autophagic rate show a p53dependent decrease in autophagy
in
response
to
the
same
conditions — the end result in
both cases is the promotion of
cell survival
Scherz-Shouval et al., 2010, Proc Natl Acad Sci USA
107:18511–18516;
Maddoxs and Vousden, 2011, J Mol Med, 89:237–245.
Galuzzi et al., Cell Cycle, 2010, 9:2, 250-255
38.
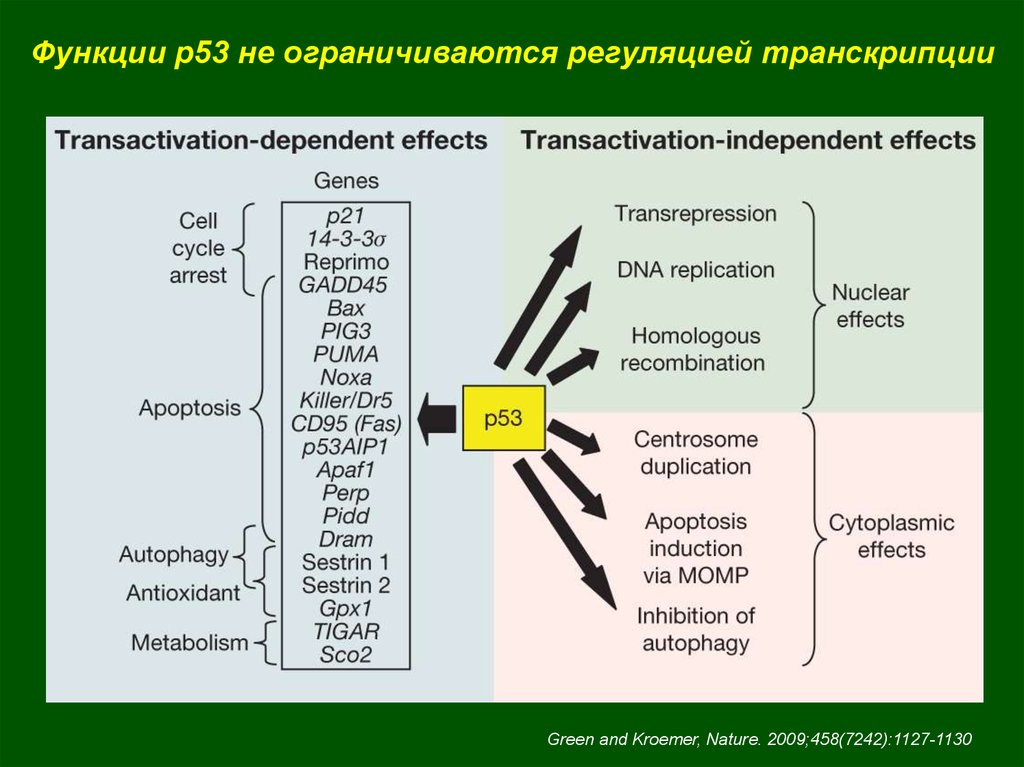
Функции p53 не ограничиваются регуляцией транскрипцииGreen and Kroemer, Nature. 2009;458(7242):1127-1130
39.
Отличия функциональных активностейактивированных (“стрессовых») изоформ p53
p53
D p53
альтернативный сплайсинг (экзоны 7- 9)
D p53 - активирует p21Waf1/Cip1, 14-3-3s, но не MDM2, BAX, PIG3
p53b
альтернативный сплайсинг (интрон 9)
Waf1/Cip1; сильнее чем р53 активирует BAX,
p53b -активирует p21
очень слабо активирует MDM2
D133 p53
внутренний промотор (интрон 4)
D133 p53 - ингибирует активацию р53-респонсивных генов
(доминантно-негативный эффект)
40.
При активации полноразмерного р53 судьбаклетки (апоптоз или остановка цикла)
зависит от:
1. Количественного уровня р53
Не все р53-респонсивные элементы имеют
одинаковую аффинность к р53. p21WAF1 и Gadd45
активируются при значительно меньшем уровне р53.
Поэтому, мало р53 - остановка цикла; много – апоптоз
Мало р53
р21WAF1
Много р53
PUMA
Остановка делений
р21WAF1
Апоптоз
PUMA
41.
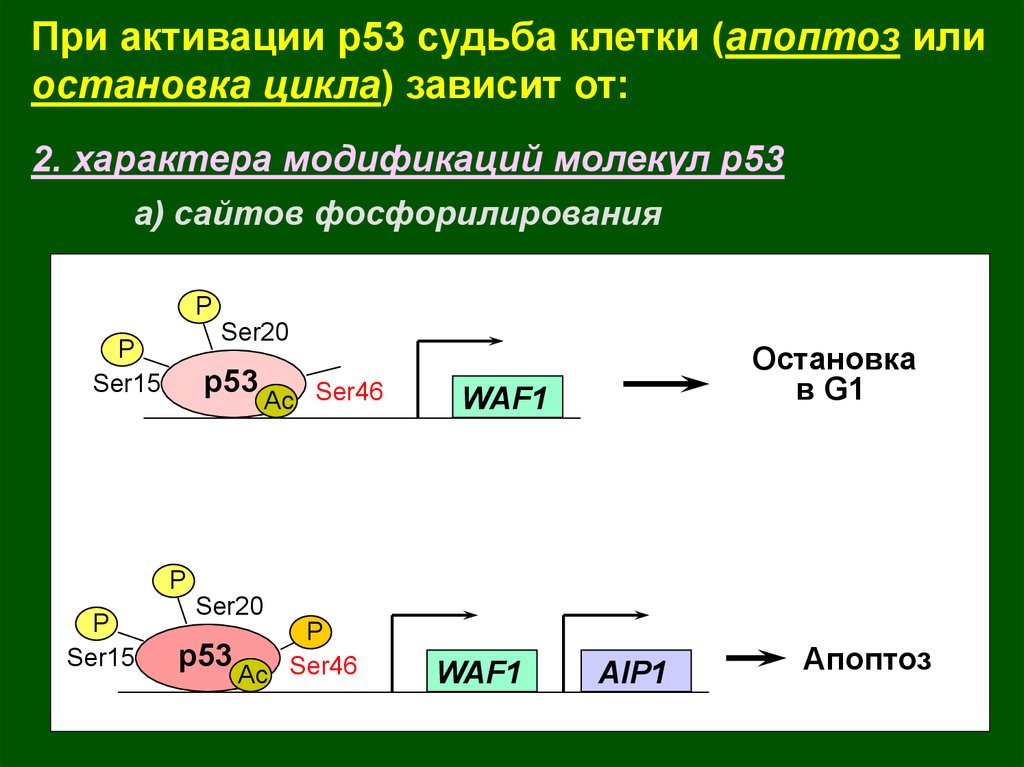
При активации р53 судьба клетки (апоптоз илиостановка цикла) зависит от:
2. характера модификаций молекул р53
а) сайтов фосфорилирования
P
Ser20
P
Ser15
p53
Ac Ser46
Остановка
в G1
WAF1
P
P
Ser15
Ser20
P
p53
Ac Ser46
WAF1
AIP1
Апоптоз
42.
Повреждение ДНКСильное
повреждение ДНК
p53
«Латентный»
P
Ser15
P Ser20
p53
Ac
3-6 час
p53DINP
p21Waf
P
Ser15
P Ser20
P
p53
Ac Ser46
8-12 час
Остановка
в G1
AIP1 и др.
Апоптоз
43.
При активации р53 судьба клетки зависит от:2. характера модификаций молекул р53
б) уровня и специфики ацетилирования
Kruse and Gu, 2009, Cell, v. 137, pp. 609-622
44.
При активации р53 судьба клетки (апоптоз илиостановка цикла) зависит от:
3. Экспрессии ко-факторов транскрипции, избирательно усиливающих ту или иную функцию р53
При связывании р53 с ASPP (TP53BP) -1 и -2 повышается
его аффинность к респонсивным элементам, содержащимся
в проапоптозных генах
ASPP
р21WAF1
PUMA
Остановка делений
р21WAF1
PUMA
Апоптоз
При связывании с Hzf (ZNF385), наоборот, уменьшается
аффинность к респонсивным элементам, содержащимся в
проапоптозных генах, и увеличивается способность активировать гены, продукты которых останавливают клеточный цикл
45.
Некоторые р53-зависимые механизмыподавления ангиогенеза
фибробласт,
эпителиоцит
HIF-1
H2O2
VEGF
p53
Tsp1
a(II)Ph
Tsp1
VEGF
эндотелиоцит
Подавление размножения
и/или апоптоз
46.
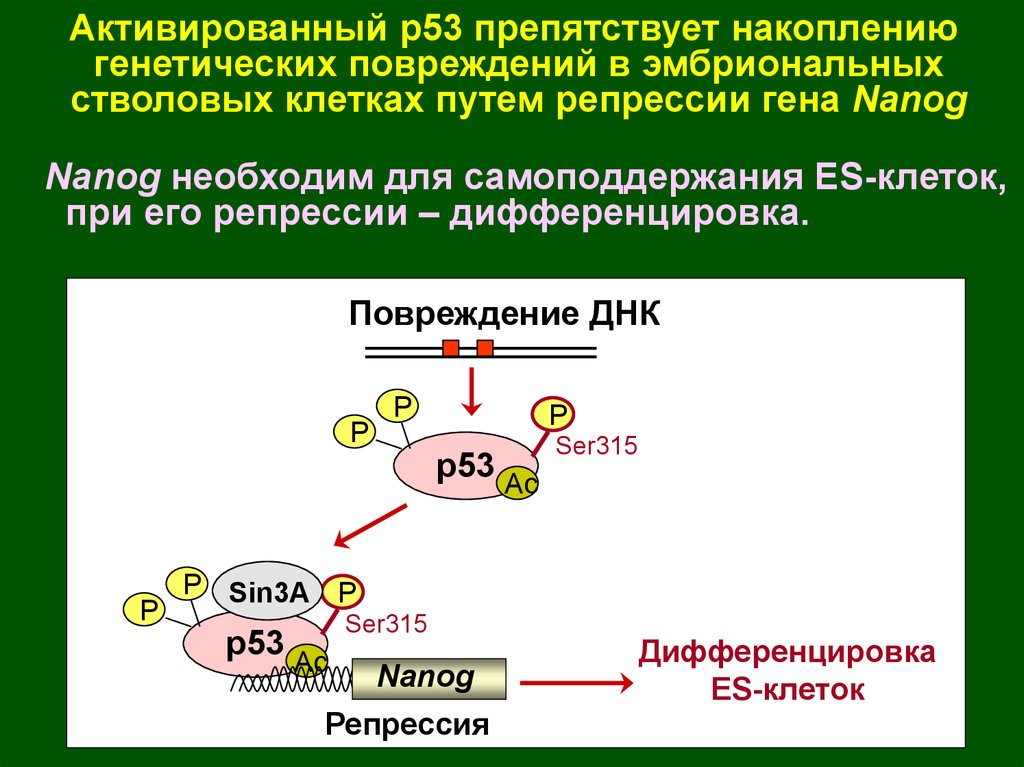
Активированный р53 препятствует накоплениюгенетических повреждений в эмбриональных
стволовых клетках путем репрессии гена Nanog
Nanog необходим для самоподдержания ES-клеток,
при его репрессии – дифференцировка.
Повреждение ДНК
P
P
P
p53 Ac
P
Ser315
P Sin3A P
p53 Ac
Ser315
Nanog
Репрессия
Дифференцировка
ES-клеток
47.
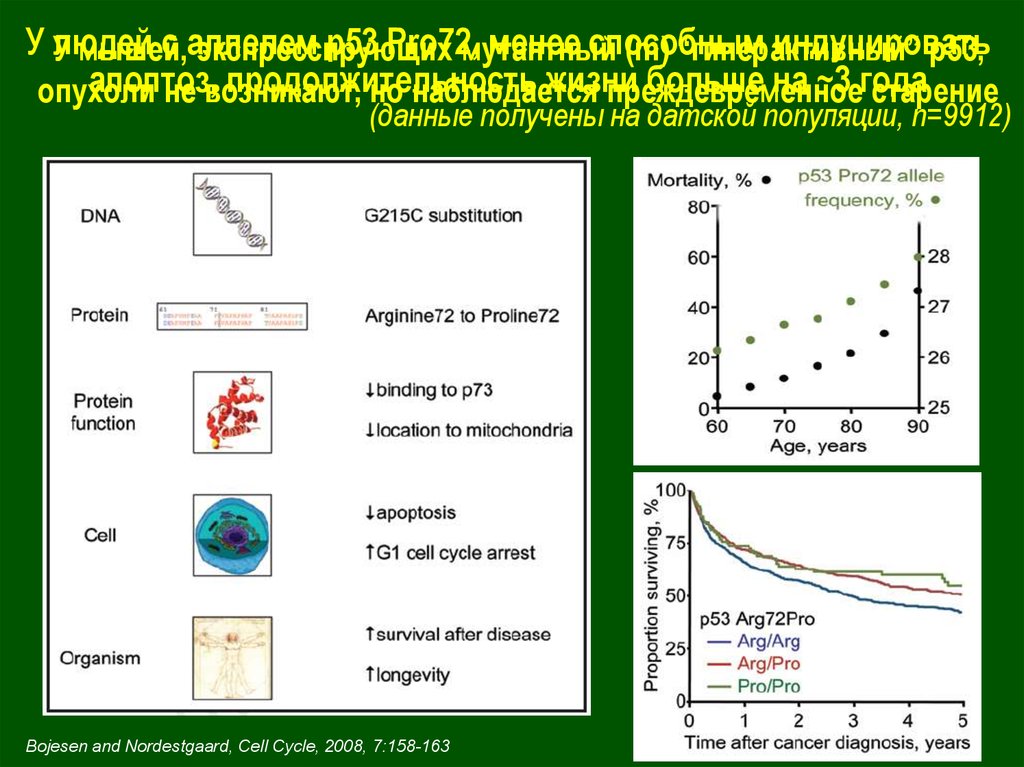
У людейc аллелем
р53 Pro72,
менее способным
индуцировать
У мышей,
экспрессирующих
мутантный
(m) “гиперактивный”
р53,
апоптоз,
продолжительность
жизни
больше на ~3 года
опухоли
не возникают,
но наблюдается
преждевременное
старение
(данные получены на датской популяции, n=9912)
Bojesen and Nordestgaard, Cell Cycle, 2008, 7:158-163
48.
Инактивация функции 53• Повышение содержания кислородных радикалов
• Ослабление G1- и G2-чекпойнтов
• Подавление индукции апоптоза
• Ослабление репарации ДНК
• Стимуляция ангиогенеза и васкулогенной мимикрии
• Гликолитический тип дыхания
• Повышение активности теломеразы
• Увеличение экспрессии маркеров плюрипотентности
• Мутагенез
• Нечувствительность к рост-супрессирующим сигналам
• Увеличение пролиферативного потенциала
(“иммортализация”)
• Увеличение доли клеток со свойствами ОСК
49.
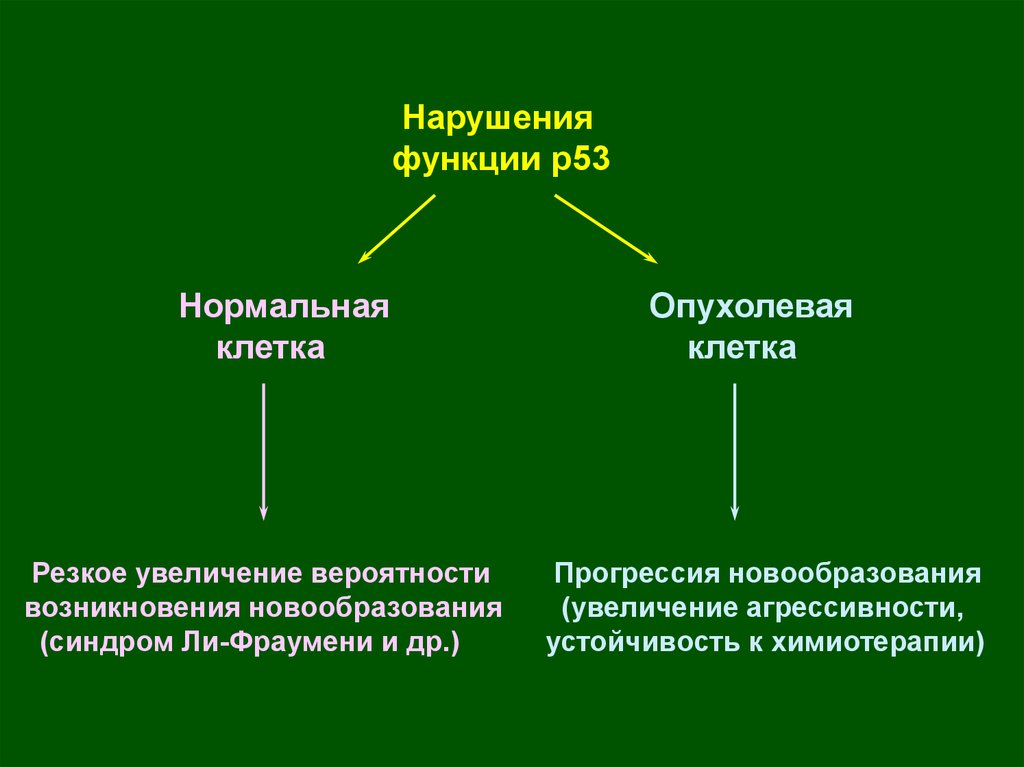
Нарушенияфункции р53
Нормальная
клетка
Резкое увеличение вероятности
возникновения новообразования
(синдром Ли-Фраумени и др.)
Опухолевая
клетка
Прогрессия новообразования
(увеличение агрессивности,
устойчивость к химиотерапии)
50.
Пути инактивации р53 в опухолевых клетках:1) Мутации гена р53
- 30-60% опухолей разной локализации.
2) Амплификация и гиперэкспрессия онкогена Mdm2
- 15-25% остеосарком и фибросарком.
3) Экспрессия онкобелка Е6
- HPV-позитивные раки шейки матки.
4) Нарушения транспорта р53 в ядро
- большая часть нейробластом и 10-15% раков молочной
железы (взаимодейсвтие с эстрогеновыми рецепторами).
5) NF-kB-зависимое подавление функциональной активности
р53
- подавляющее большинство раков почки
51.
Мутации р53 - наиболее универсальноемолекулярное изменение в опухолях человека
Число случаев (х1000) с мутациями р53
250
200 150 100 50 50 100 150 200 250
Развивающиеся страны
Развитые страны
% опухолей
3-4 стадий с
мутациями
р53
Рак легкого
70%
Рак толстой кишки
65%
Рак желудка
Рак мочевого пузыря
Рак молочной железы
45%
61%
30%
52.
В отличие от других опухолевых супрессоров, большинствомутаций р53 являются миссенс-мутациями, приводящими к
замене аминокислотных остатков
53.
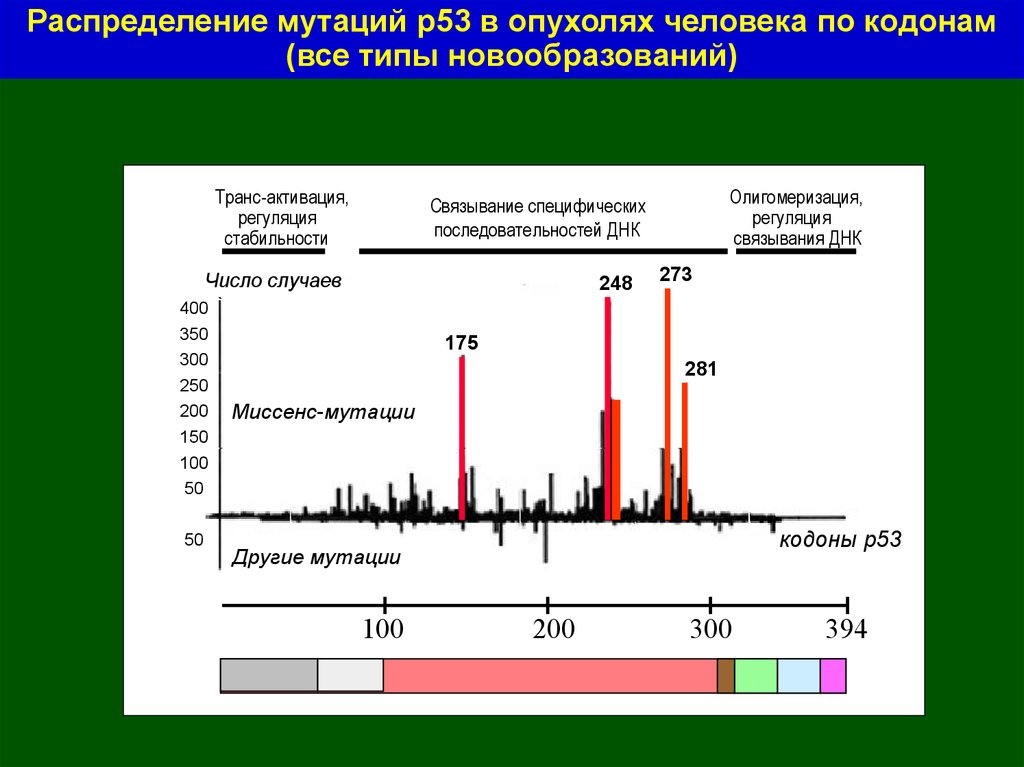
Распределение мутаций р53 в опухолях человека по кодонам(все типы новообразований)
Транс-активация,
регуляция
стабильности
Число случаев
400
350
300
250
200
150
Олигомеризация,
регуляция
связывания ДНК
Связывание специфических
последовательностей ДНК
248
273
175
281
Миссенс-мутации
100
50
50
кодоны р53
Другие мутации
100
200
300
394
54.
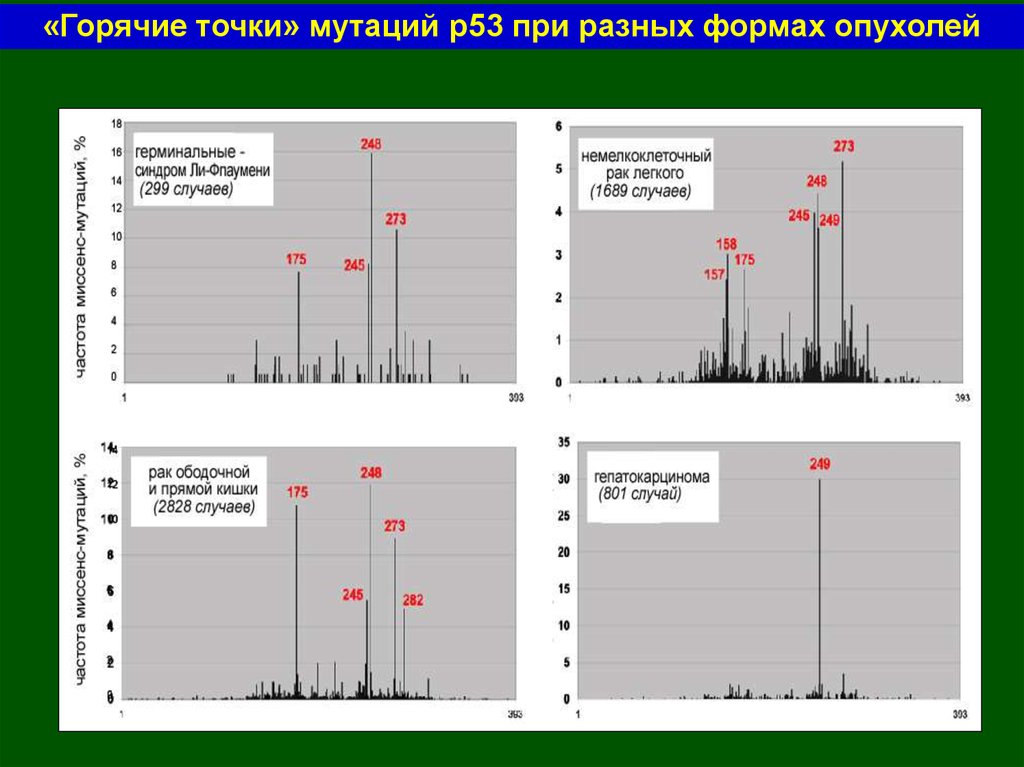
«Горячие точки» мутаций р53 при разных формах опухолей55.
Наиболее характерные для опухолей мутации необратимоизменяют конформацию белка, что позволило получить
антитела, различающие нормальные и мутантные формы р53
Доступные для антител эпитопы
Недоступные/разрушенные эпитопы
P
P
P
Ac
«Стрессовый»
«Латентный»
«Мутантный»
Онкогенные
мутации
56.
Наиболее характерные для опухолей мутантные р53инактивируют продукт неизмененного аллеля за счет
образования транскрипционно-неактивных тетрамеров
57.
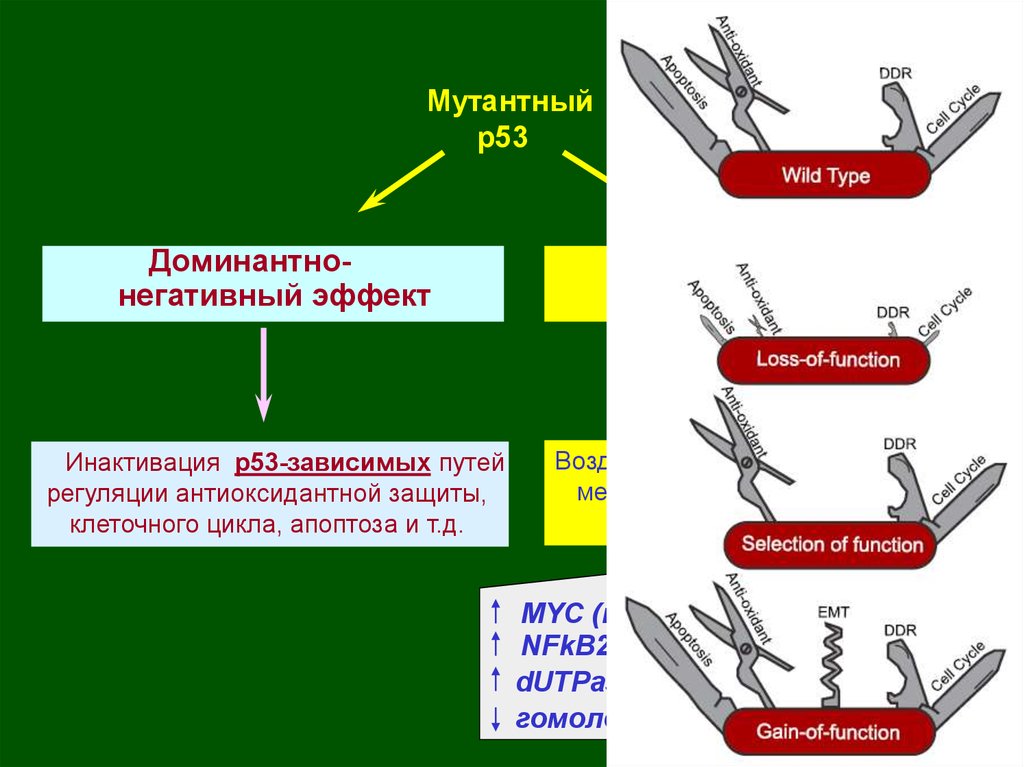
Мутантныйр53
Доминантнонегативный эффект
Инактивация р53-зависимых путей
регуляции антиоксидантной защиты,
клеточного цикла, апоптоза и т.д.
Новые активности
Воздействие на р53-независимые
механизмы регуляции клеточного
цикла, апоптоза и т.д.
МYC (пролиферация);
NFkB2 (выживаемость и др.);
dUTPase (устойчивость к 5-ФУ);
гомологи р53 – р73, p63
58.
Гомологи р53:November 28, 2019
97931
4986
2448
59.
Гомологи р53:р53
р63, p73
Трансактивация
ДНК-связывание
Олигомеризация
~25%
~65%
~35%
TAα
TAβ
TAγ
DNα
DNβ
DNγ
РНК каждого из генов, р63 и р73, экспрессируется с двух
промоторов и подвергается альтернативному сплайсингу.
В результате образуется как минимум 6 изоформ белка р63 и 14
изоформ белка р73, обладающих (ТА) или не обладающих (DN)
способностью транс-активировать р53-респонсивные гены и
индуцировать остановку клеточного цикла и апоптоз.
60.
Нокаут у мышей:p53-/-
~Нормальное развитие,
опухоли у 100% мышей
в возрасте до 1 года:
лимфомы, саркомы и
др.
p63-/-
Гибель после
рождения:
отсутствие
кожи и др.
эпителия
p73-/-
Жизнеспособные мыши
с расстройствами
зрения, слуха, поведения. Нет вомероназального органа.
Отсутствие опухолей в
возрасте до 2-х лет.
61.
p53Экспрессия:
Клетки
всех тканей
Активация: Самые разные
стрессы
Опухоли:
Инактивация
p63
p73
Стволовые и недифференцированные клетки ряда тканей
(в основном DN формы)
Некоторые стрессы
Повышение экспрессии
DN форм
62.
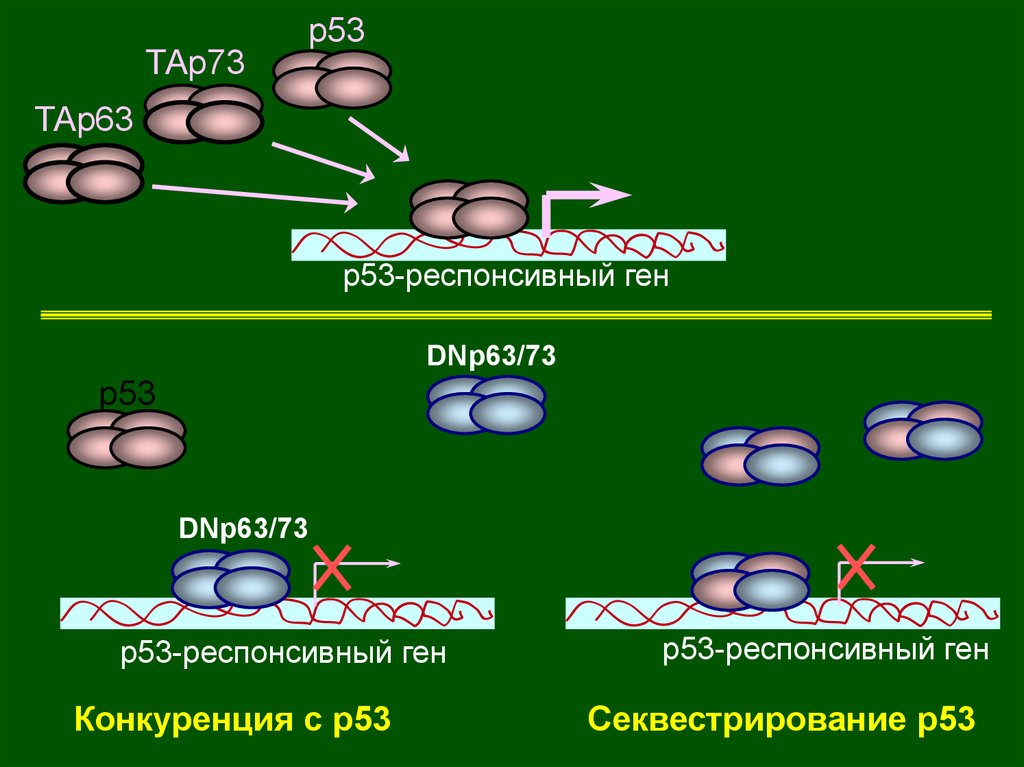
ТАp73p53
ТАp63
p53-респонсивный ген
DNp63/73
p53
DNp63/73
p53-респонсивный ген
Конкуренция с р53
p53-респонсивный ген
Секвестрирование p53
63.
Kastenhuber and Lowe, 2017.Putting p53 in Context.
Cell, 170: 1062-1078
64.
Курс «Биология опухолевой клетки»(2019 г.)
Н.Л. Лазаревич
Лекция 9
Эндогенные и экзогенные канцерогенные факторы






























 biology
biology








