Similar presentations:
Нестабильность генома неопластических клеток. Лекция 5
1.
Курс «Биология опухолевой клетки»(2019 г.)
Н.Л. Лазаревич
Лекция 5
Нестабильность генома неопластических клеток
2.
Интенсивное инеограниченное
во времени
деление клеток
Постоянная
инициация
митотических
циклов
Нечувствительность к
рост-ингибирующим
сигналам
(приобретение
бессмертия и др.)
Подавление
программируемой
гибели клеток
(апоптоза, аутофагии
и др.)
Нестабильность генома
(мутации и эпигенетические изменения)
3.
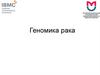
Онкогенез – многоступенчатый процессотбора клеток с рядом генетических изменений,
определяющих свойства злокачественной клетки
Вероятность образования
неопластических стволовых
клеток, несущих ряд генетических
изменений и обеспечивающих
развитие злокачественной опухоли,
резко увеличивается при
нестабильности генома.
Нестабильность генома
(повышенная генетическая
нестабильность) – увеличение
темпа возникновения различных
изменений генома, и, как следствие,
новых фенотипических признаков.
Она обеспечивает появление и
отбор все более и более
автономных и агрессивных клонов,
т.е. прогрессию опухолей.
4.
Легко обнаруживаемые проявления нестабильностигенома опухолевых клеток:
Множественные изменения кариотипа
Нестабильность
микросателлитной ДНК
(SKY – многоцветное спектральное кариотипирование)
Bat25
Клетка рака молочной железы
D17S250
ДНК из опухоли (Т) и
нормальной ткани (N)
пациента
с раком толстой кишки
5.
В первых исследованиях геномов и транскриптомов опухолевыхтканей (Wood еt al, Science, 2007; Jones et al., Parsons et al., Science, 2008)
при анализе последовательностей 23219 транскриптов (20261 белоккодирующих генов), в каждой из опухолей (24 рака молочной железы, 11
раков ободочной кишки, 24 рака поджелудочной железы, 22 глиобластомы)
было найдено 40-190 значимых мутаций (всего ~2000 мутированных
генов), затрагивающих активность не менее 12 сигнальных путей.
(Jones et al., Science, 2008)
6.
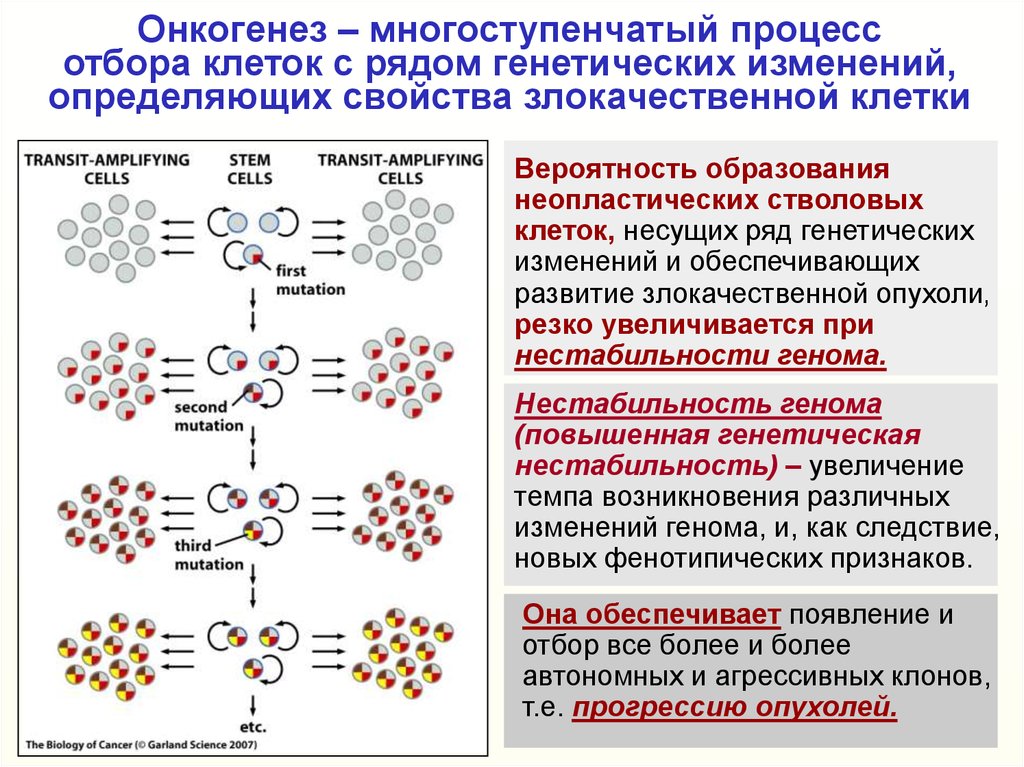
В настоящее время проанализированы lдесятки тысяч новообразованийи сведения об измененных генах, транскриптах и аномальных сигнальных
путях существенно расширены.
В частности, в одной из работ (Сurtis et. al., Nature. 2012, 486(7403):346-352)
проведен интегрированный анализ копийности, структуры и экспрессии
генов в клетках 1992 раков молочной железы. Были обнаружены аномалии
40% генов генома.
На основании анализа изменений, повторяющихся в значительных
группах опухолей, и их клинического течения выделено по меньшей мере
10 субтипов рака молочной железы.
7.
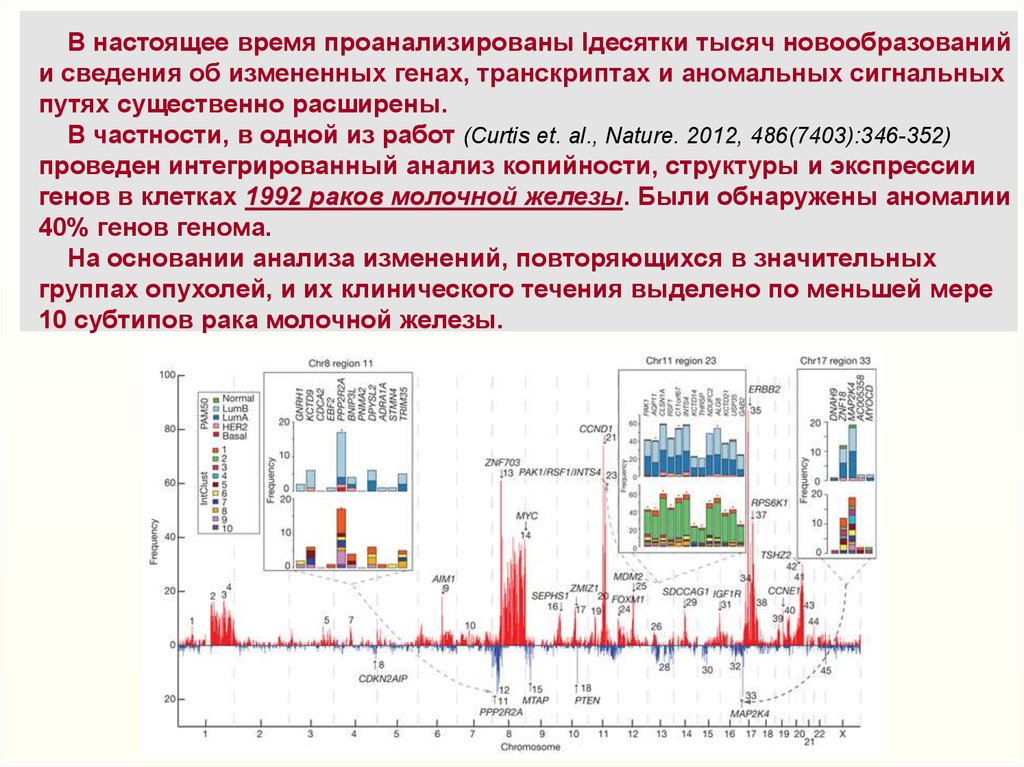
Многочисленные изменения геномов/транскриптомовопухолевых клеток являются отражением их генетической
нестабильности и клонального разнообразия формируемых
ими новообразований
Yates LR, Campbell PJ. Evolution of the cancer genome.
Nat Rev Genet. 2012, November, 13(11):795-806
8. Хромотрипсис
Одномоментный клеточный кризис,ведущий к образованию сложных
комплексных хромосомных перестроек
(10-100) в одной или нескольких
хромосомах.
Stephens P.J. et al., 2011. Cell. 144, 27–40;
Storchová Z, Kloosterman WP. Curr Opin Cell Biol. 2016;40:106-113
Rode A. et al, 2016, DOI: 10.1002/ijc.29888
Наблюдается в 2-3% опухолей
(остеосаркомы – до 33%) и при
некоторых врожденных
заболеваниях.
Возможные причины – γ-облучение,
свободные радикалы,
слипание/разрыв хромосом,
формирование микроядер при
нарушении митоза, незавершенный
апоптоз и др.
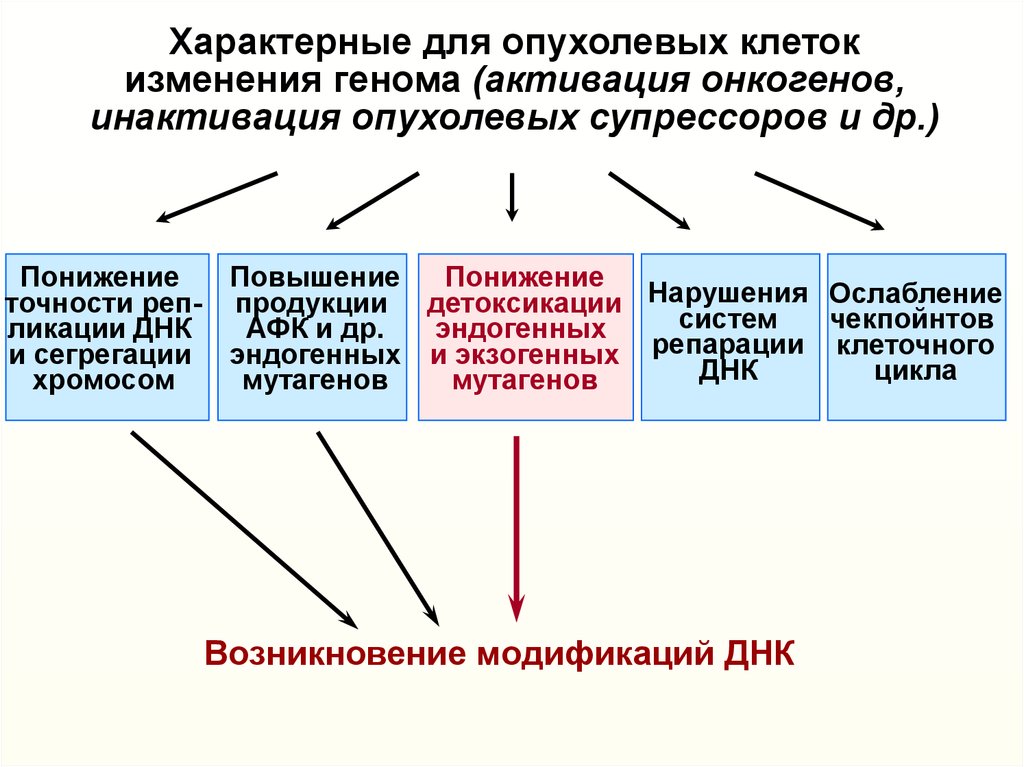
9.
Характерные для опухолевых клетокизменения генома (активация онкогенов,
инактивация опухолевых супрессоров и др.)
Понижение Повышение Понижение
точности реп- продукции детоксикации Нарушения Ослабление
систем
чекпойнтов
ликации ДНК
АФК и др.
эндогенных
и сегрегации эндогенных и экзогенных репарации клеточного
ДНК
цикла
хромосом
мутагенов
мутагенов
Ослабление
индукции
апоптоза
Возникновение и размножение
клеток с различными изменениями генома
10.
Характерные для опухолевых клетокизменения генома (активация онкогенов,
инактивация опухолевых супрессоров и др.)
Понижение Повышение
Понижение
точности реп- продукции детоксикации Нарушения Ослабление
систем
чекпойнтов
ликации ДНК
АФК и др.
эндогенных
и сегрегации эндогенных и экзогенных репарации клеточного
ДНК
цикла
хромосом
мутагенов
мутагенов
Возникновение модификаций ДНК
и изменений числа хромосом
11.
Мутагенные факторы:Экзогенные – солнечная иррадиация, химические мутагены
окружающей среды и т.д.
Эндогенные – а) ошибки репликации ДНК и митоза;
б) внутриклеточные свободные радикалы
(активные формы кислорода, азота и др.)
12.
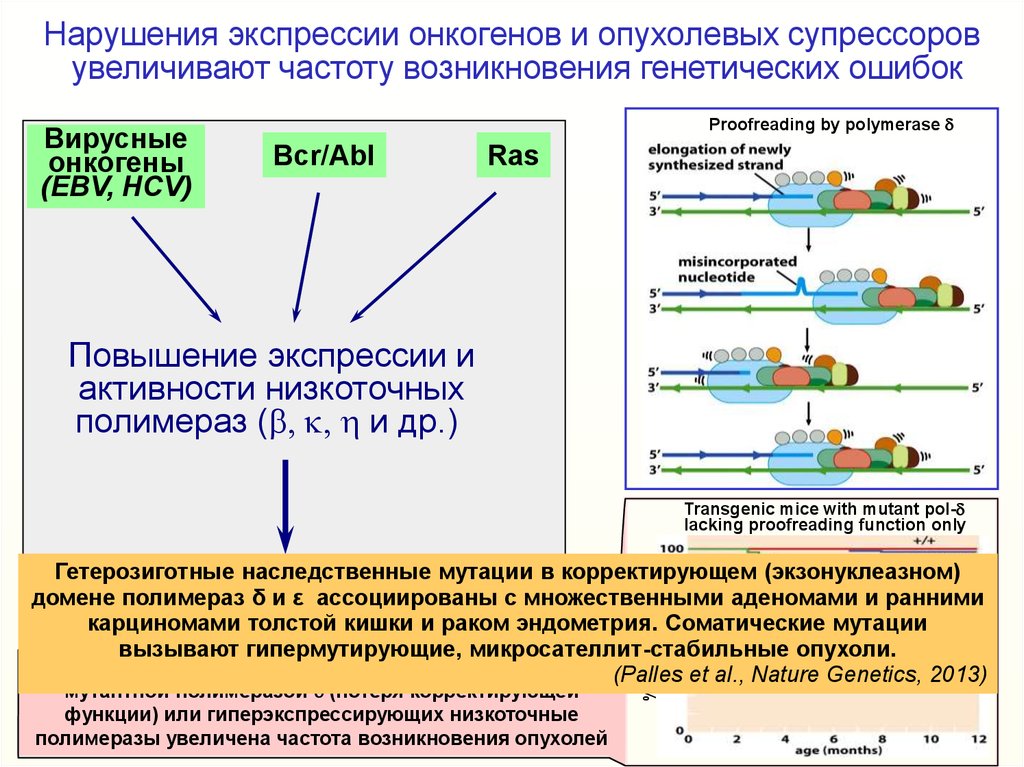
Нарушения экспрессии онкогенов и опухолевых супрессоровувеличивают частоту возникновения генетических ошибок
Вирусные
онкогены
(EBV, HCV)
Proofreading by polymerase d
Bcr/Abl
Ras
Повышение экспрессии и
активности низкоточных
полимераз (b, k, h и др.)
Transgenic mice with mutant pol-d
lacking proofreading function only
мутантной полимеразой-d (потеря корректирующей
функции) или гиперэкспрессирующих низкоточные
полимеразы увеличена частота возникновения опухолей
% of tumor-free
Гетерозиготные
наследственные
мутации в корректирующем (экзонуклеазном)
Понижение
точности
домене полимераз δ и ε ассоциированы с множественными аденомами и ранними
репликации
ДНК
карциномами
толстой кишки
и раком эндометрия. Соматические мутации
вызывают гипермутирующие, микросателлит-стабильные опухоли.
Нокаут полимеразы-d летален. У трансгенных мышей с (Palles et al., Nature Genetics, 2013)
13.
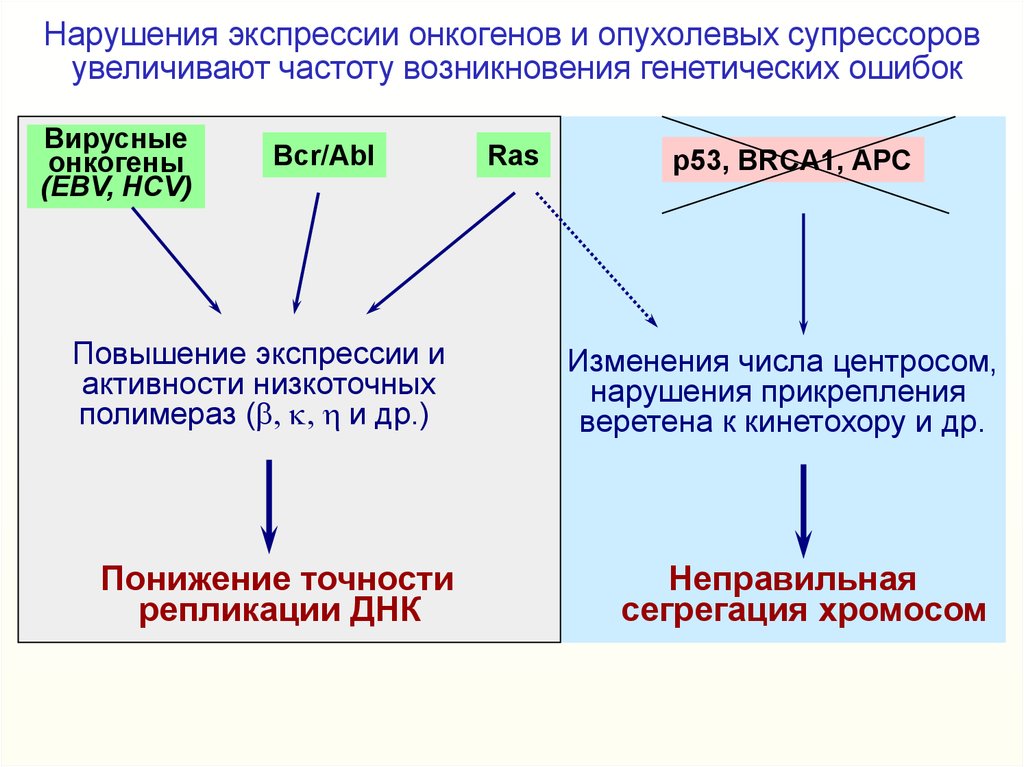
Нарушения экспрессии онкогенов и опухолевых супрессоровувеличивают частоту возникновения генетических ошибок
Вирусны
Вирусные
е
онкогены
онкогены
(EBV, HCV)
(EBV, HCV)
Bcr/Abl
Bcr/Abl
Повышение экспрессии
ии
Повышение
экспрессии
активности низкоточных
активности
низкоточных
полимераз (b, k, h и др.)
полимераз
Понижение
Понижение точности
точности
репликации
репликации ДНК
ДНК
Ras
Ras
p53, BRCA1, АРС
Изменения числа центросом,
нарушения прикрепления
веретена к кинетохору и др.
Неправильная
сегрегация хромосом
14.
Нормаp53
Амплификация
центросом
p53
BRCA1
p21Cip1
p21Cip1
Ras
Ras
CycE/
Cdk2
CycE/
Cdk2
Однократная
репликация
центросом
АPC, p53,
BRCA1 в
центросомах
Многократная
репликация
центросом
(конец G1/начало S)
Три дочерние клетки
в цитокинезе
BRCA1
Трехполюсный
митоз
Четырехполюсный
митоз
15. Анеуплоидия (~ 90% опухолей)
16.
Эндогенные мутагенные факторы:а) ошибки репликации ДНК и митоза;
б) внутриклеточные свободные радикалы
(активные формы кислорода, азота и др.)
17.
Активные формы кислорода (АФК) образуются в ходепостепенного восстановления молекул кислорода, как
побочные продукты ряда внутриклеточных процессов
Основные АФК:
супероксидный радикал – О2
перекись водорода – Н2О2
: одноэлектронное восстановление О2
: двуэлектронное восстановление О2
Другие АФК: гидроксильный радикал ( ОН), синглетный кислород (1O2),
пероксинитрит (ONOO-) и др.
Источники АФК:
• цепочка переноса электронов в митохондриях;
• окисление жирных кислот в пероксисомах;
• энзиматический синтез супероксидного радикала
NADPH-зависимыми оксидазами, ксантиноксидазой и т.д.
В присутствии металлов (Fe, Cu) О2 и Н2О2 образуют
гидроксильный радикал ОН – основной источник повреждений
макромолекул, в том числе и ДНК
18.
Метаболизм АФКПовреждения
-ОН + ОНCu+/Fe2+
Эндогенные
источники,
воспаление,
радиация,
хим. агенты
О2-
Н2О2
супероксиддисмутазы
(CuZnSOD,
MnSOD,
ECSOD)
Н 2О + О2
каталаза,
пероксиредоксины I-VI,
тиоредоксин,
глютатионпероксидазы
19.
АФК – не только повреждающие, нои важные сигнальные молекулы
Окисляя компоненты различных сигнальных
путей (фосфатазы и др.), они регулируют
деление клеток, их миграцию и другие
физиологические реакции
20.
Неблагоприятные последствия отклонений в уровнеАФК
Сильное
повышение
Массивные
повреждения
ДНК и др.
макромолекул
Остановка
деления,
апоптоз
Умеренное
повышение
Окисление
ДНК
Окисление
компонентов
сигнальных
путей
Мутагенез
Стимуляция
деления и
миграции
клеток
Понижение
Избыточное
восстановление
компонентов
сигнальных
путей
Замедление
деления и
миграции,
аномалии
митоза
21.
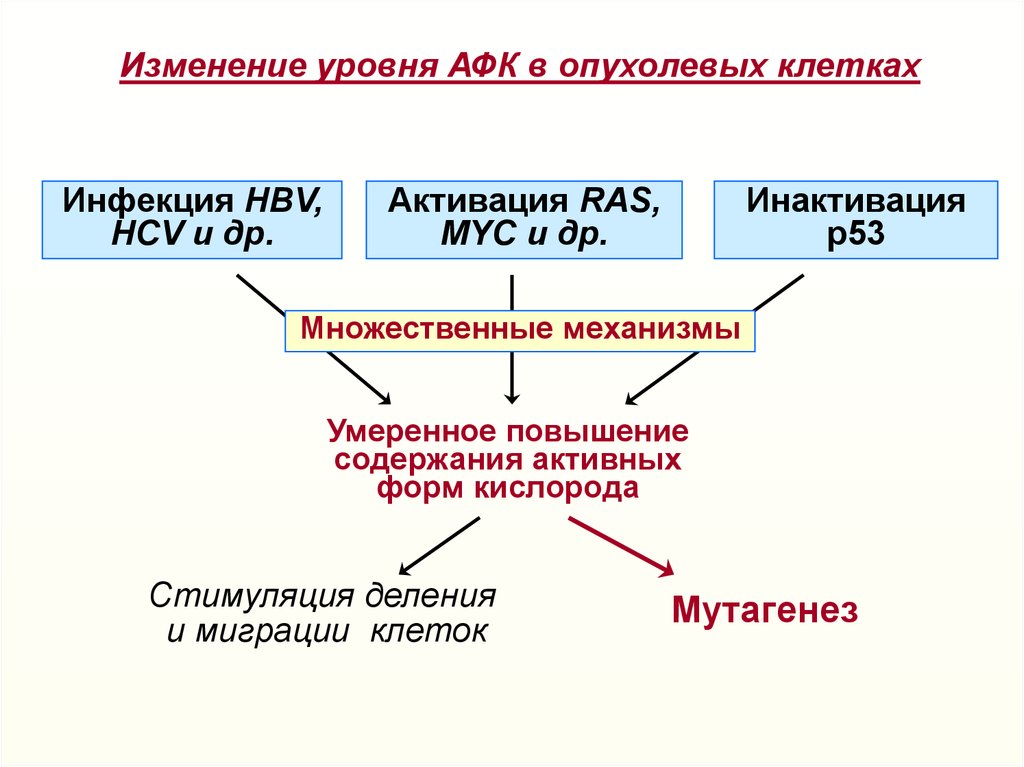
Окисление оснований в ДНК22.
Изменение уровня АФК в опухолевых клеткахИнфекция HBV,
HCV и др.
Активация RAS,
МYC и др.
Инактивация
р53
Множественные механизмы
Умеренное повышение
содержания активных
форм кислорода
Стимуляция деления
и миграции клеток
Мутагенез
23.
Активированныеонкогены RAS
PI3K-Rac-NADPH
оксидаза
Энзиматический синтез
супероксидного радикала
Репрессия генов сестринов,
гипофункция пероксиредоксинов
Подавление
антиоксидантной защиты
Повышение содержания
активных форм кислорода
Окисление ДНК и мутагенез
24.
Сигнальный путь Nrf2–Keap1Nrf2 – транскрипционный фактор, активирующий
экспрессию генов антиоксидантной защиты
Sporn and Liby, 2012 Nat Rev Cancer; 12(8):
doi:10.1038/nrc3278
25.
Perera and Bardeesy, Nature, 2011, 43-44When antioxidants are bad
New work suggests that ROS might have a role in mitigating certain cancers – see DeNicola et al., Nature, 2011, 475:106-111
Oncogene-induced Nrf2 transcription promotes ROS detoxification and tumorigenesis
ROS are mutagenic and may thereby promote cancer.
Normally, ROS levels are tightly controlled by an inducible antioxidant
program that responds to cellular stressors and is predominantly regulated
by the transcription factor Nrf2 and its repressor protein Keap1. In contrast
to the acute physiological regulation of Nrf2, in neoplasia there is evidence
for increased basal activation of Nrf2. Indeed, somatic mutations that
disrupt the Nrf2–Keap1 interaction to stabilize Nrf2 and increase the
constitutive transcription of Nrf2 target genes were recently identified,
indicating that enhanced ROS detoxification and additional Nrf2 functions
may in fact be protumorigenic. Here, we investigated ROS metabolism in
primary murine cells following the expression of endogenous oncogenic
alleles of Kras, Braf and Myc, and found that ROS are actively suppressed
by these oncogenes. K-RasG12D, B-RafV619E and MycERT2 each
increased the transcription of Nrf2 to stably elevate the basal Nrf2
antioxidant program and thereby lower intracellular ROS and confer a more
reduced intracellular environment. Oncogene-directed increased
expression of Nrf2 is a new mechanism for the activation of the Nrf2
antioxidant program, and is evident in primary cells and tissues of mice
expressing K-RasG12D and B-RafV619E, and in human pancreatic cancer.
Furthermore, genetic targeting of the Nrf2 pathway impairs K-RasG12Dinduced proliferation and tumorigenesis in vivo. Thus, the Nrf2 antioxidant
and cellular detoxification program represents a previously unappreciated
mediator of oncogenesis.
См. также Geismann et al., Onco Targets Ther., 7:1497-518, 2014
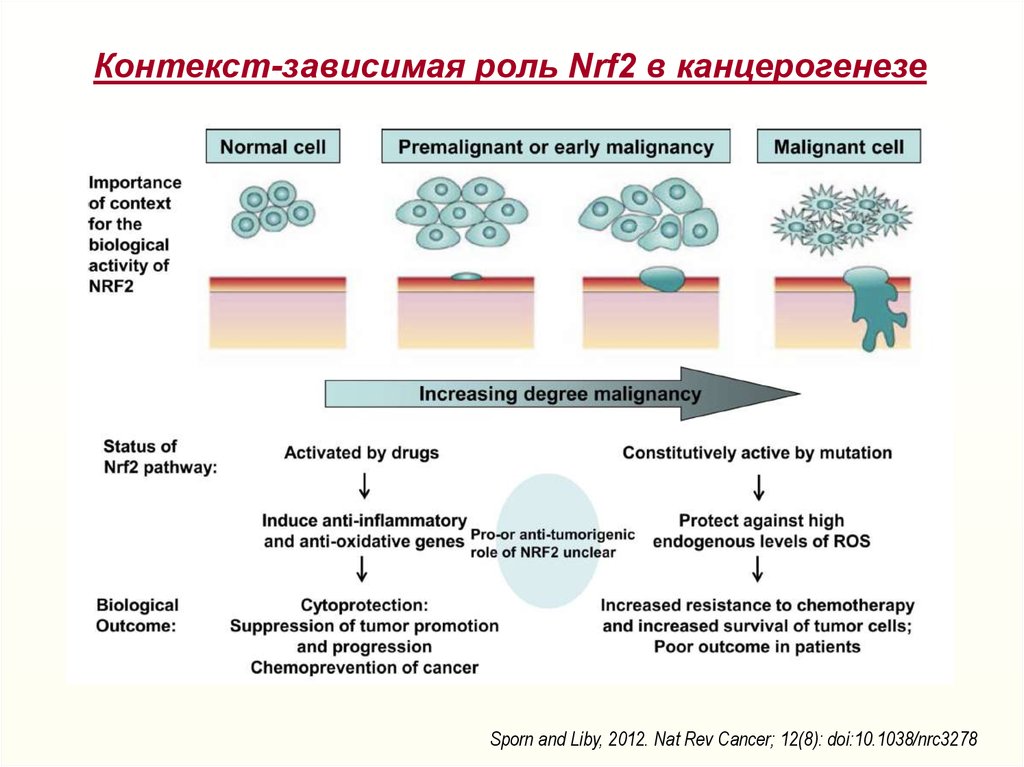
26. Контекст-зависимая роль Nrf2 в канцерогенезе
Sporn and Liby, 2012. Nat Rev Cancer; 12(8): doi:10.1038/nrc327827.
Нарушения Nrf2–Keap1 сигнализации в опухолях28.
Инфекция HBV,HCV и др.
Активация RAS,
МYC и др.
Инактивация
р53
Увеличенный синтез iNOS
Повышение содержания NO
Нитрирование ДНК и мутагенез
29.
Характерные для опухолевых клетокизменения генома (активация онкогенов,
инактивация опухолевых супрессоров и др.)
Понижение
Повышение
Понижение
точности реп- продукции детоксикации Нарушения Ослабление
систем
чекпойнтов
ликации ДНК
АФК и др.
эндогенных
и сегрегации эндогенных и экзогенных репарации клеточного
ДНК
цикла
хромосом
мутагенов
мутагенов
Возникновение модификаций ДНК
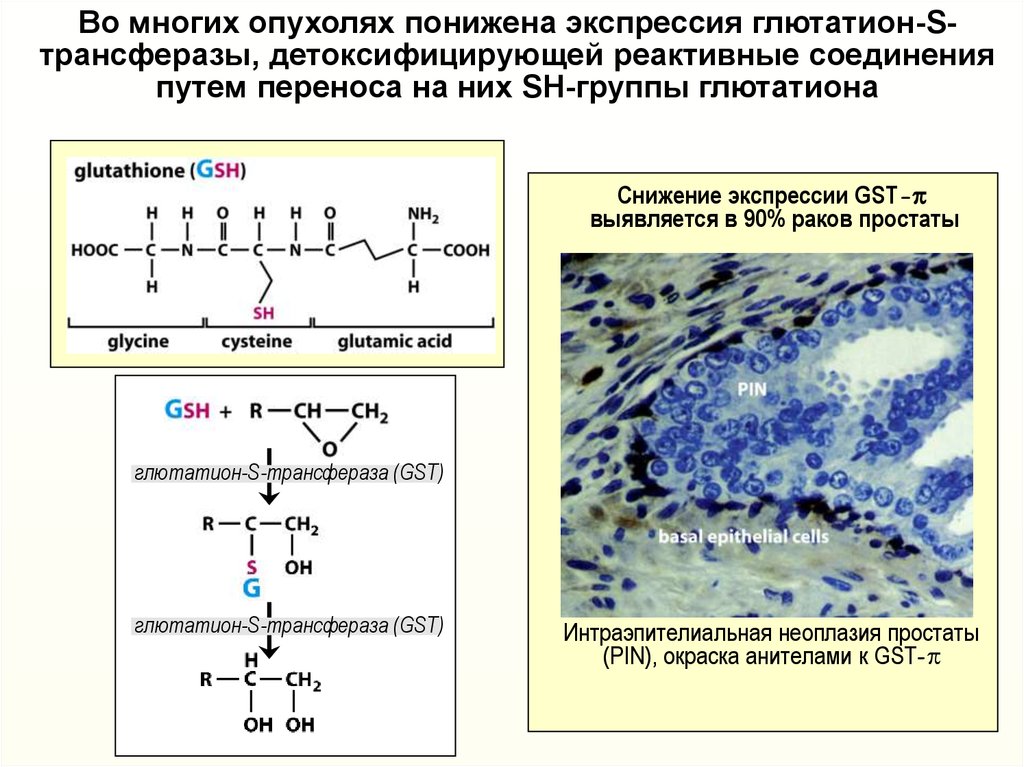
30.
Во многих опухолях понижена экспрессия глютатион-Sтрансферазы, детоксифицирующей реактивные соединенияпутем переноса на них SH-группы глютатиона
Снижение экспрессии GST-p
выявляется в 90% раков простаты
глютатион-S-трансфераза (GST)
глютатион-S-трансфераза (GST)
Интраэпителиальная неоплазия простаты
(PIN), окраска анителами к GST-p
31.
Характерные для опухолевых клетокизменения генома (активация онкогенов,
инактивация опухолевых супрессоров и др.)
Понижение Повышение Нарушения
Понижение
Нарушения
точности реп- продукции детоксикации
систем
систем
ликации ДНК
АФК и др.
эндогенных
репарации
репарации
и сегрегации эндогенных и экзогенных
ДНК
ДНК
хромосом
мутагенов
мутагенов
Ослабление
чекпойнтов
клеточного
цикла
Появление
клеток с нарушениями
Возникновение
различных
модификаций ДНК
структуры
ДНК (мутациями)
и/или изменений
генома
32.
Повреждение ДНКБелки-сенсоры
аномальных структур ДНК
Передатчики сигналов
(BRCA1, ATM/ATR и др.)
связывание белков,
фосфорилирование
Белки
репарационных
систем
Восстановление
структуры ДНК
Chk1, Chk2,
р53 и др.
Остановка
деления, апоптоз
33.
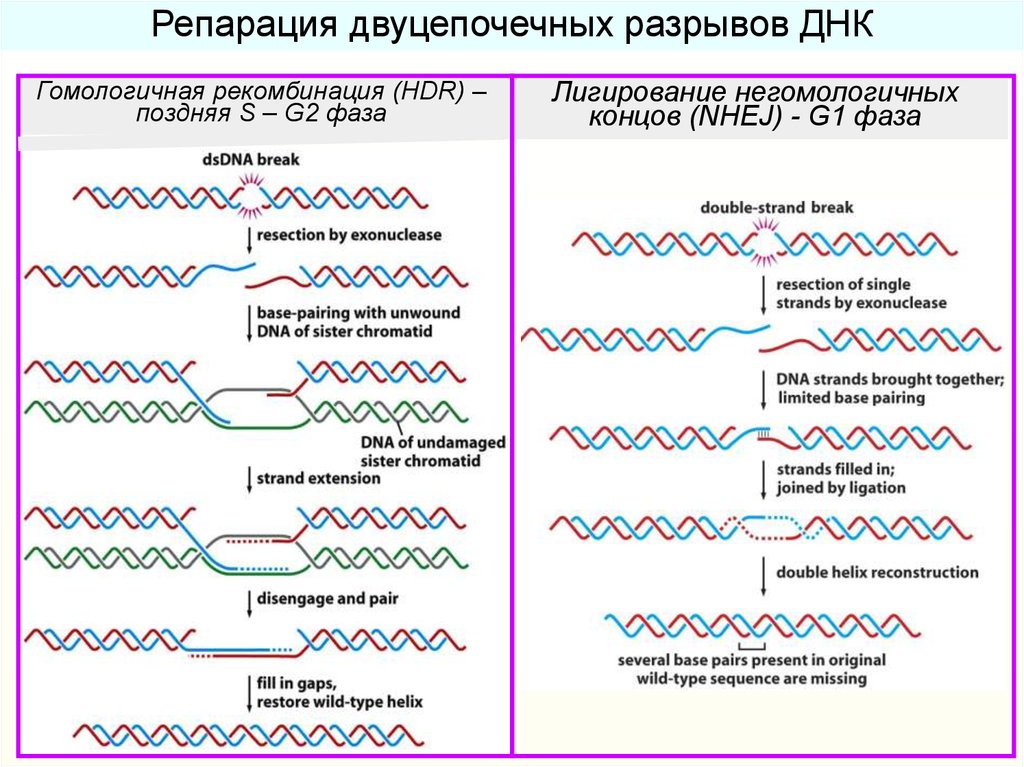
Эксцизионная репарация ДНК34.
Репарация двуцепочечных разрывов ДНКГомологичная рекомбинация (HDR) –
поздняя S – G2 фаза
Лигирование негомологичных
концов (NHEJ) - G1 фаза
35.
Ошибкирепликации
MSH2/MSH3,
MSH2/ MSH6
УФ-облучение
Распознавание
TFIIH
MLH1/PMS2,
MLH1/MLH3
нуклеазы
XPC-hHR23
Эксцизия
Застройка бреши
(репликация)
Эксцизионная
репарация
XPG, XPA, RPA,
HPF-ERCC1 и др.
γ-облучение
Mre11-NBS1
-Rad50, 53BP1,
Ku70/Ku80, PARP
Распознавание
Процессинг
Лигирование
негомологичных
концов
ИЛИ
Гомологичная
рекомбинация
Репарация
двунитевых
разрывов ДНК
36.
Наследственные заболевания, связанные сповреждением систем репарации ДНК
Нарушения репарации ДНК
Эксцизионная
неспаренных оснований
– MSH2,6, MLH1, PMS2
Cиндром Линча II - неполипозный
рак толстой кишки, рак яичника
нуклеотидов (NER)
– XPG, XPE, XPA и др.
Возраст возникновения рака кожи
при пигментной ксеродерме
Пигментная ксеродерма,
рак кожи
37.
Наследственные заболевания, связанные сповреждением систем репарации ДНК
Нарушения репарации ДНК
Эксцизионная
неспаренных оснований (BER)
– MSH2,6, MLH1, PMS2
нуклеотидов (NER)
– XPG, XPE, XPA и др.
Двунитевых разрывов
– NBS1, LIG4
Межнитевых сшивок
– FANCA, FANCG и др.
Cиндром Линча II - неполипозный
рак толстой кишки, рак яичника
Пигментная ксеродерма,
рак кожи
Ниймегенский синдром,
лимфоидные новообразования
Анемия Фанкони,
острый миелолейкоз и др.
Контроль рекомбинаций ДНК
Хеликазы
– BLM, WRN и др.
Синдромы Блюма, Вернера и др.,
лейкозы и др. новообразования
38.
Характерные для опухолевых клетокизменения генома
Повышение Понижение
Понижение
Нарушения
продукции точности реп- детоксикации Нарушения
систем
систем
РФК и др. ликации ДНК эндогенных
эндогенных и сегрегации ирепарации
экзогенных репарации
ДНК
ДНК
мутагенов
хромосом
мутагенов
Ослабление
чекпойнтов
клеточного
цикла
Генетическая нестабильность
39.
Повреждение ДНКБелки-сенсоры
аномальных структур ДНК
Передатчики сигналов
(BRCA1,ATM/ATR и др.)
связывание белков,
фосфорилирование
Белки
репарационных
систем
Восстановление
структуры ДНК
Chk1, Chk2,
р53 и др.
Остановка
деления, апоптоз
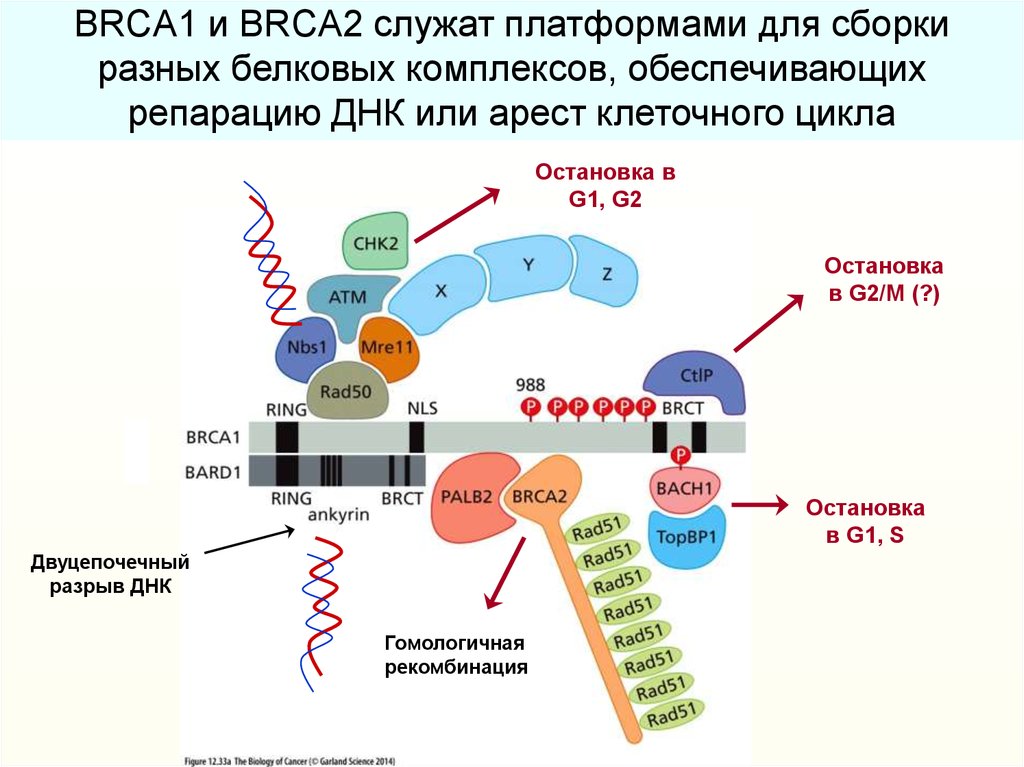
40.
BRCA1 и BRCA2 служат платформами для сборкиразных белковых комплексов, обеспечивающих
репарацию ДНК или арест клеточного цикла
Остановка в
G1, G2
Остановка
в G2/M (?)
Остановка
в G1, S
Двуцепочечный
разрыв ДНК
Гомологичная
рекомбинация
41.
Изменения в делящихся фибробластах мышейc дефектным BRCA2 (brca2-mut/brca2-mut)
Метафаза с разрывами и
рекомбинациями хромосом
Дефектный цитокинез
(абсцизия)
42.
Механизмы подавления активности циклин-зависимых киназ иостановки клеточного цикла при повреждениях ДНК
Нарушения
структуры
ДНК
BRCA1
ATM, ATR
Chk1, Chk2
p53
Cdc25A,C
p21Cip1
TopBP1
CycE
Cdk2
CycA
Cdk2
CycB
Cdc2
pRb
G1
S
G2
Митоз
43.
Нарушения репарации ДНКЭксцизионная
неспаренных оснований
– MSH2,6, MLH1, PMS2
нуклеотидов (NER)
– XPG, XPE, XPA и др.
Двунитевых разрывов
– NBS1, LIG4
Межнитевых сшивок
– FANCA, FANCG и др.
Cиндром Линча II - неполипозный
рак толстой кишки, рак яичника
Пигментная ксеродерма,
рак кожи
Ниймегенский синдром,
лимфоидные новообразования
Анемия Фанкони,
острый миелолейкоз и др.
Сигнализация от
поврежденной ДНК
ATM
Aтаксия-телеангиоэктазия,
лимфолейкозы, лимфомы
BRCA1, BRCA2
Рак молочной железы, яичника
p53, CHK2
Синдром Ли-Фраумени –
различные новообразования
44.
Характерные для опухолевых клетокизменения генома
Повышение Понижение
Понижение
Понижение
Нарушения
продукции точности
точности репреп- детоксикации Нарушения Ослабление
систем
систем
G1, S, G2 и
РФК и др. ликации
ликации ДНК
ДНК эндогенных
эндогенных ии сегрегации
сегрегации ирепарации
экзогенных репарации митотических
ДНК
ДНК
чекпойнтов
мутагенов
хромосом
хромосом
мутагенов
Генетическая нестабильность
45.
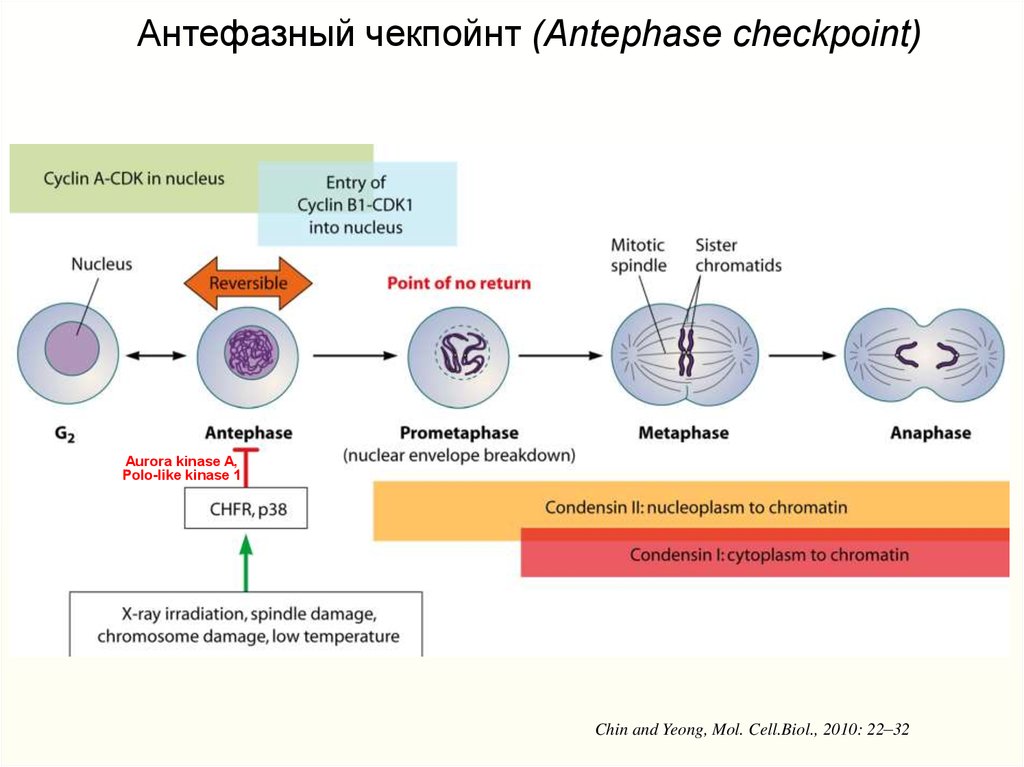
Антефазный чекпойнт (Antephase checkpoint)Aurora kinase A,
Polo-like kinase 1
Chin and Yeong, Mol. Cell.Biol., 2010: 22–32
46.
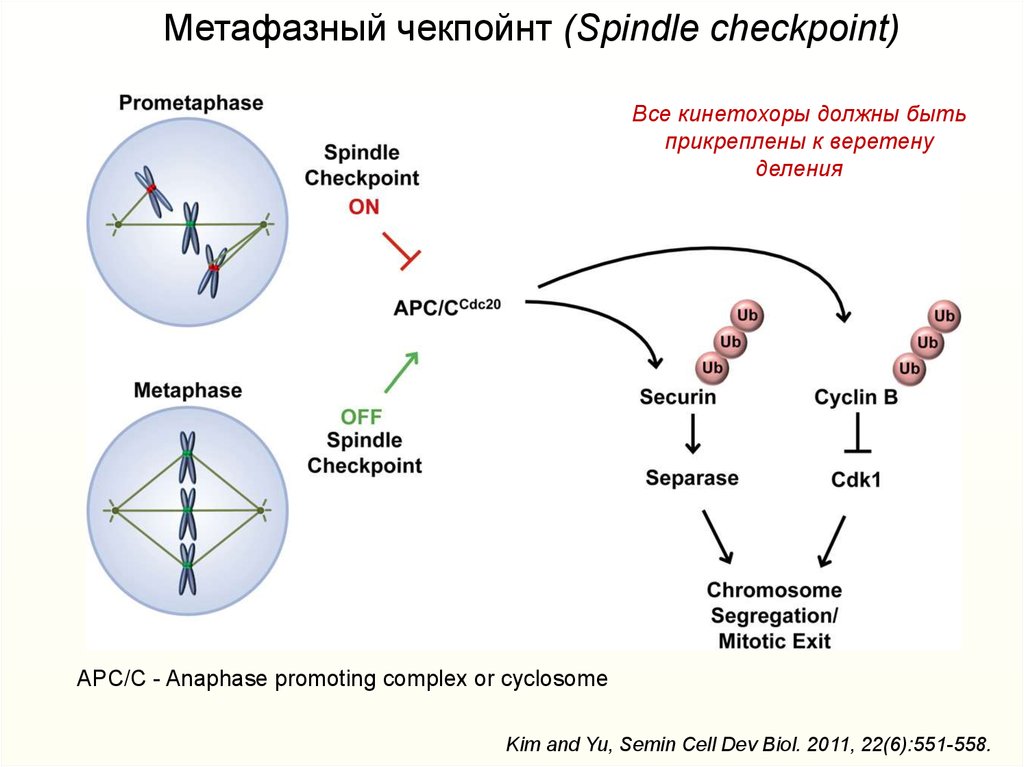
Метафазный чекпойнт (Spindle checkpoint)Все кинетохоры должны быть
прикреплены к веретену
деления
APC/C - Anaphase promoting complex or cyclosome
Kim and Yu, Semin Cell Dev Biol. 2011, 22(6):551-558.
47.
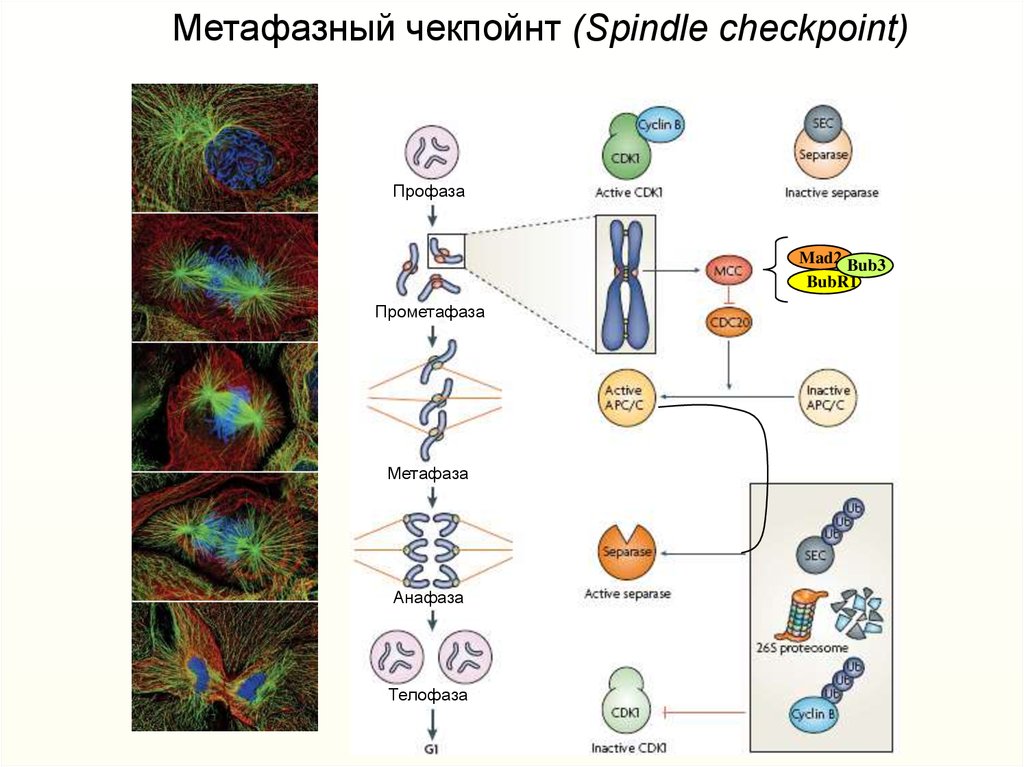
Метафазный чекпойнт (Spindle checkpoint)Профаза
Mad2 Bub3
BubR1
Прометафаза
Метафаза
Анафаза
Телофаза
48.
Механизмы остановки клеточного циклапри повреждениях ДНК
Нарушения
структуры ДНК
Нарушения веретена деления
Разрушение
микротрубочек
Неприкрепленный
кинетохор
ATM, ATR
Chk1, Chk2
Chfr
(Е3 убиквитинлигаза)
Cdc25A,C
p53
p21Cip1
Bub1, Bub3
BubR1, Mad1/2
APC/C
(Е3 убиквитинлигаза)
CycE
Cdk2
CycA
Cdk2
CycB
Cdc2 Aurora kinase A,
Polo-like kinase 1
Cекурин
Cепараза
G1
S
G2
Профаза Метафаза Анафаза
Митоз
49.
Изменения митотических чекпойнтовв опухолевых клетках человека
Гиперэкспрессия AURKA
Гиперэкспрессия PLK1
Инактивация Chfr
Мутации MAD2
Bub1, Bub3, BubR1
Многие новообразования
Рак желудка,
В-клеточные лимфомы
20-40% различных опухолей
(рак желудка, носоглотки и др.)
30-40% раков желудка,
5-10% раков толстой кишки
50.
Характерные для опухолевых клетокизменения генома
Повышение Понижение
продукции точности реп- Нарушения
систем
РФК и др.
ликации ДНК
эндогенных и сегрегации репарации
ДНК
мутагенов
хромосом
Ослабление Ослабление
чекпойнтов
индукции
клеточного апоптоза и
цикла
аутофагии
Генетическая нестабильность
51.
Повышенная изменчивостьнеопластических клеток
Увеличение вероятности
появления клонов клеток
с изменениями структуры
и/или копийности генов
Увеличение вероятности
эпигенетических изменений
(метилирования ДНК и др.)
52.
Метилирование ДНК – важный механизмтканеспецифичной регуляции генной транскрипции
Осуществляется метилтрансферазами (Dnmt1, Dnmt3, Dnmt3a)
по 5-му положению цитозинового остатка динуклеотидов 5’CpG.
Метилированные сайты узнаются определенными белками (MeCP2
и др.), привлекающими многокомпонентные комплексы, содержащие
HDAC, что индуцирует деацетилирование гистонов, компактизацию
хроматина и, как следствие, подавление транскрипции генов.
53.
Метилирование опухолевых супрессоров в новообразованияхМетилирование промотора гена p16INK4a
Интраэпителиальная неоплазия шейки матки (CIN)
Рак шейки матки в соседней области
54.
Для опухолевых клеток характерно:Активация Ras, инактивация р53
Инактивация APC и др.
ДНК-метилтрансфераза-1
Метилирование
CpG-островков в
промоторах генов
Деметилазы
Деметилирование
промоторов регуляторных
генов и одиночных
CpG-динуклеотидов
Подавление транскрипции
генов опухолевых супрессоров
(RB, INK4, E-кадгерин и др.) и
компонентов систем репарации
ДНК (MLH1 и др.)
Отмена
рост-ингибирующих
сигналов
Мутагенез,
рекомбинации
ДНК
Блокирование
дифференцировки
55.
Нарушениясистем
репарации
ДНК
Амплификация
центросом,
многополюсные
митозы
Ослабление
MAD3-зависимого
митотического
чекпойнта
инактивация опухолевого супрессора р53
Повышение уровня
эндогенных мутагенов
(активные формы
кислорода )
Ослабление
G1- и G2-чекпойнтов
клеточного цикла при
повреждениях ДНК
Ингибирование
апоптоза при
повреждениях
ДНК
активация онкогенов RAS
Понижение
точности
репликации
ДНК
Эпигенетическая
репрессия генов
(метилирование
промоторов)
56.
Курс «Биология опухолевой клетки»(2019 г.)
Н.Л. Лазаревич
Лекция 6
Изменения морфологии неопластических клеток,
детерминирующие «локомоторный» фенотип










































 medicine
medicine biology
biology