Similar presentations:
Применение CAR-T лимфоцитов для лечения глиом
1. Применение CAR-T лимфоцитов для лечения глиом
ПРИМЕНЕНИЕ CAR-T ЛИМФОЦИТОВДЛЯ ЛЕЧЕНИЯ ГЛИОМ
ВЫПОЛНИЛА РАБОТУ: СТУДЕНТКА ОЛД 611 ИВАНОВА А. А.
2. Патоморфологическая характеристика глиом
ПАТОМОРФОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА ГЛИОМПод собирательным названием глиомы объединены около 80 % злокачественных
первичных опухолей мозга.
Глиомы формируются из нескольких видов глиальных клеток. В зависимости от
исходного типа клеток глиомы делят на четыре типа:
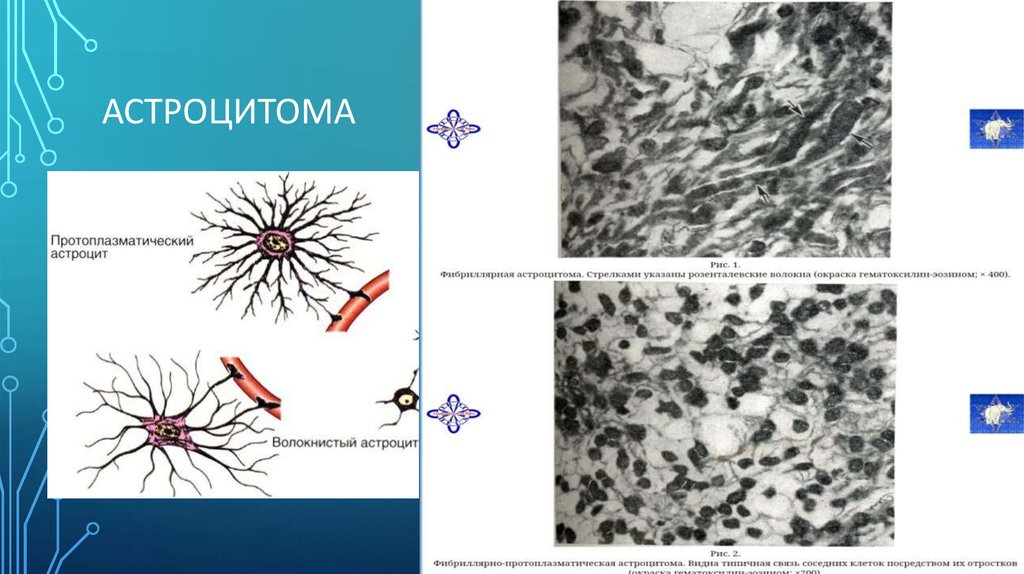
1) Астроцитомы – составляют около 60% первичных опухолей мозга
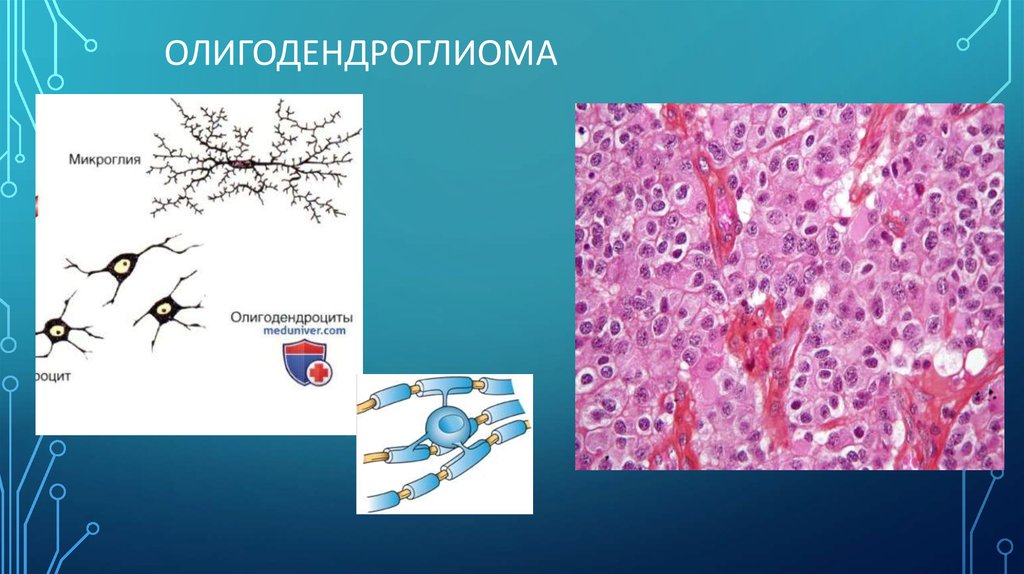
2) Олигодендроглиомы – около 3% первичных опухолей, преимущественно у взрослых
(около 50 % всех олигодендроглиом составляют олигоастроцитомы) Пиковый возраст
50-60 лет.
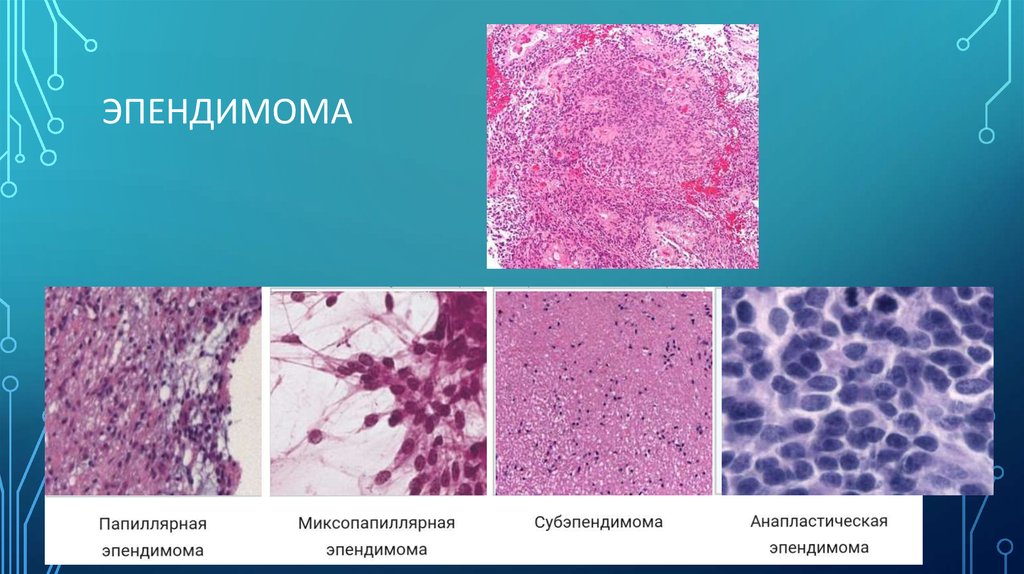
3) Эпендимомы - чаще встречаются у детей и располагаются, преимущественно, в IV
желудочке
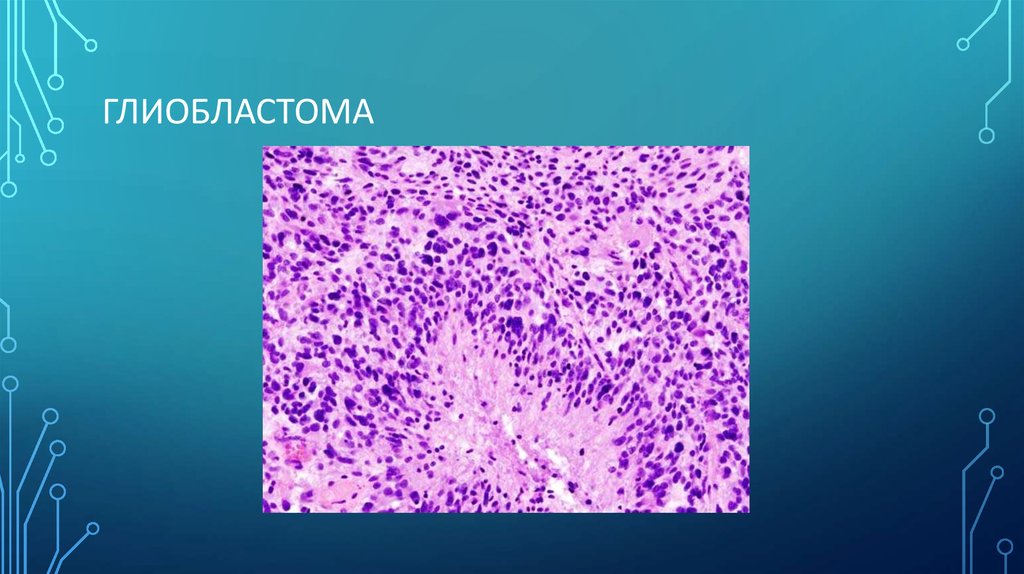
4) Глиобластомы – большинство носят первичный характер
3. Астроцитома
АСТРОЦИТОМА4. Олигодендроглиома
ОЛИГОДЕНДРОГЛИОМА5. Эпендимома
ЭПЕНДИМОМА6. Глиобластома
ГЛИОБЛАСТОМА7. Степени злокачественности
СТЕПЕНИ ЗЛОКАЧЕСТВЕННОСТИ• Опухоли 1-й степени имеют низкую пролиферативную активность, зачастую дискретную природу,
благодаря чему успешно подвергаются резекции без повторных рецидивов
• Опухоли 2-й степени являются в целом инфильтративными и обладают низкой митотической
активностью, однако чаще, чем опухоли первого типа, рецидивируют после хирургического
удаления. Некоторые типы опухолей склонны к прогрессированию в опухоли с более высокой
степенью малигнизации.
• Опухоли 3-й степени являются гистологически малигнизированными, включая ядерную атипию и
повышенную митотическую активность. Такие опухоли имеют анапластическую гистологию и
инфильтративную способность. Обычно в качестве лечения они подвергаются агрессивной
адъювантной терапии.
• Опухоли 4-й степени митотически активны, склонны к некрозу и в целом связаны с быстрым дои послеоперационным прогрессом и фатальным исходом. Обычно в качестве лечения они
подвергаются агрессивной адъювантной терапии.
8. Статистика заболеваемости опухолями мозга
СТАТИСТИКА ЗАБОЛЕВАЕМОСТИ ОПУХОЛЯМИ МОЗГА• Официальные статистические данные в Российской Федерации по заболеваемости
первичными опухолями центральной нервной системы – в среднем 4,8 случая на 100 тысяч
населения в 2015 году (4,2 случая в 2010г.).
• По данным государственной медицинской статистики, абсолютное число впервые в жизни
установленных диагнозов злокачественных новообразований мозга и др. отделов ЦНС (С70-72
МКБ) в 2015 году составило 4377 чел.
• Средний возраст больных с впервые в жизни установленным диагнозом злокачественного
новообразования центральной нервной системы (С71-72 МКБ) в России в 2015г. составил 53,5
лет (в 2005г. – 48,7 лет).
• Общая заболеваемость в РФ за 2015г. по данной локализации в 2015 году составила 8896
случаев, в том числе 655 детей в возрасте до 17 лет.
• Последние годы отмечается рост частоты диагностируемых опухолей головного мозга, в том
числе вторичных (метастазов).
9. Статистика выживаемости при опухолях головного мозга
СТАТИСТИКА ВЫЖИВАЕМОСТИ ПРИ ОПУХОЛЯХГОЛОВНОГО МОЗГА
• Прогноз излечения и выживаемости при первичных опухолях головного мозга напрямую
зависят от возраста пациента, его общего состояния, а также типа раковых клеток и других
факторов. Статистика выживаемости в течение пяти лет варьируется от 66% для молодого
возраста (от новорожденности до 19 лет) и до 5% для пожилых (75 лет и старше).
• При эпендимомах и олигодендроглиомах 5-летний прогноз выживаемости благоприятный:
85% и 81% пациентов в возрасте 20-44 лет, 69% и 45% пациентов в возрасте 55-64 лет.
• Прогноз менее благоприятный при мультиформной глиобластоме: в течение пяти лет
выживает 13% пациентов в возрасте 20-44 лет и 1% пациентов в возрасте 55-64 лет.
• Точная статистика заболеваемости вторичными опухолями головного мозга неизвестна, на
сегодняшний день ее оценивают примерно в 30 случаев на 100 тыс. населения в год
10.
• Биохимическая навигация с 5аминолевуленовой кислотой (5-АЛК)по использованию
интраоперационной флуоресцентной
диагностики в хирургии опухолей
головного мозга
11. Химиотерапия при глиобластоме
ХИМИОТЕРАПИЯ ПРИ ГЛИОБЛАСТОМЕВ настоящее время предпочтение отдается алкилирующему
препарату второго поколения, принадлежащему к классу
имидазотетразинов, — темозоломиду (TMZ).
Он легко проникает через ГЭБ и накапливается в тканях
опухоли в концентрациях, достаточных для реализации его
противоопухолевой активности.
Особый интерес представляют исследования по применению
TMZ в сочетании с ЛТ. Показано, что TMZ в 2,5–3 раза
увеличивает гибель опухолевых клеток под воздействием ЛТ,
элиминирует опухолевые элементы, находящиеся вне зоны
облучения, повышает радиочувствительность опухолевых
клеток. То есть TMZ является прямым
радиосенсибилизатором, усиливающим эффективность ЛТ.
12. Режимы применения TMZ
РЕЖИМЫ ПРИМЕНЕНИЯ TMZ• 75 мг/м2 на фоне лучевой терапии (ЛТ) — непрерывно и с перерывом между циклами
облучения (с переходом на последующий регламентирующий протокол);
• два 5-дневных цикла в дозе 150–200 мг/м2 соответственно двум этапам ЛТ
с переходом на последующий регламентирующий протокол;
• 75 мг/м2 в течение 3 нед с 7-дневным перерывом (пролонгированный курс);
• 75 мг/м2 в течение 14 дней с 7-дневным интервалом;
• 5-дневный курсовой прием в стандартных дозах (200 мг/м2) с 23-дневным перерывом
в адъювантном режиме;
• 5-дневный курсовой прием в стандартных дозах (150 мг/м2) с 23-дневным перерывом
в адъювантном режиме; «облегченный» курсовой прием (при возникновении
«допустимых» тромбоцитопении и нейтропении) — 100 мг/м2.
13. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКАЯ ХАРАКТЕРИСТИКА ГЛИОМ
Наиболее частыми причинами являются мутации и хромосомные абберации,
которые могут приводить к активации онкогенов и/или инактивации генов
опухолевых супрессоров.
Мутации в генах IDH1/2, TP53, метилизирование гена MGMT наиболее часто
обсуждаются как прогностические маркеры глиом. Ранними событиями в
процессе глиомогенеза являются мутации гена IDH1 (особенно R132H),
которые приводят к накоплению онкометаболита 2-гидроксиглутарата, а
также активируют процесс гиперметилирования при глиомах.
Метилированный статус промотора гена MGMT ассоциирован с более
благоприятным ответом на терапию темозоломидом, а мутация IDH1 — с
лучшей выживаемостью пациентов.
14.
В настоящее время молекулярно-генетический анализ глиальной опухоли для ее точнойдиагностики встает на первый план:
Согласно новой классификации инфильтрующих глиом (CNS WHO, 2016), устаревшие
гистологические подтипы (астроцитомы, олигодендроглиомы и др.) дополняются
новыми диагностическими маркерами, включающими тестирование на наличие
мутаций IDH, TERT, TP53, коделеции 1p/19q, мутаций гистонов.
Гетерогенность клеток глиом/глиобластом приводит к их высокой устойчивости против
стандартных типов терапии, таких как хирургическое вмешательство, радиация,
химиотерапия, комбинированное лечение.
15.
16. Химерный рецептор антигена (CAR)
ХИМЕРНЫЙ РЕЦЕПТОР АНТИГЕНА (CAR)• Это рекомбинантный гибридный белок, сочетающий
фрагмент антитела, обладающий способностью очень
избирательно связываться с конкретными антигенами,
с сигнализирующими доменами, способными
активировать Т-клетки. Поскольку такой гибридный
белок состоит из частей, полученных из разных
источников, его называют химерным
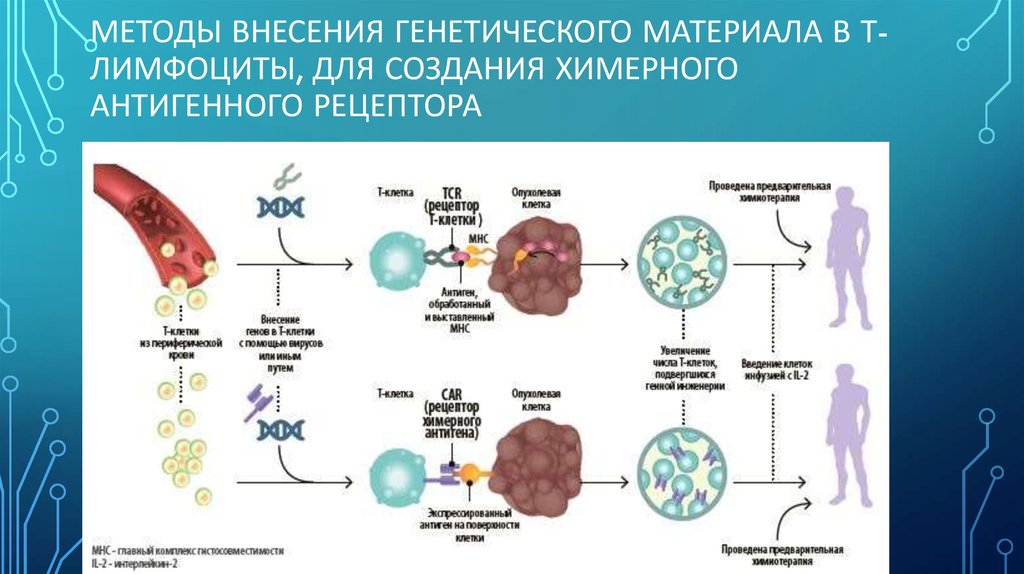
17. Методы внесения генетического материала в Т-лимфоциты, для создания химерного антигенного рецептора
МЕТОДЫ ВНЕСЕНИЯ ГЕНЕТИЧЕСКОГО МАТЕРИАЛА В ТЛИМФОЦИТЫ, ДЛЯ СОЗДАНИЯ ХИМЕРНОГОАНТИГЕННОГО РЕЦЕПТОРА
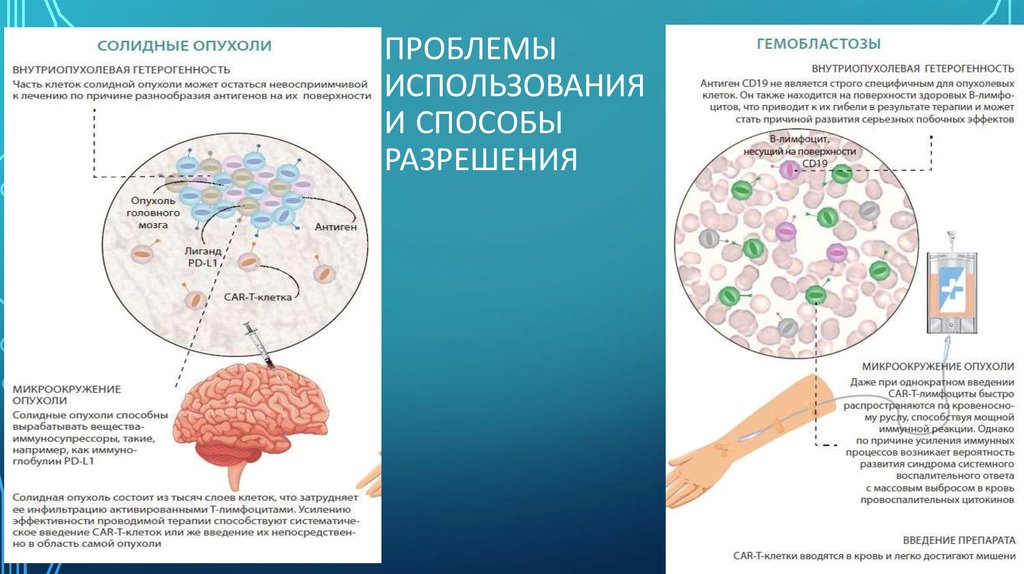
18. Проблемы использования и способы разрешения
ПРОБЛЕМЫИСПОЛЬЗОВАНИЯ
И СПОСОБЫ
РАЗРЕШЕНИЯ
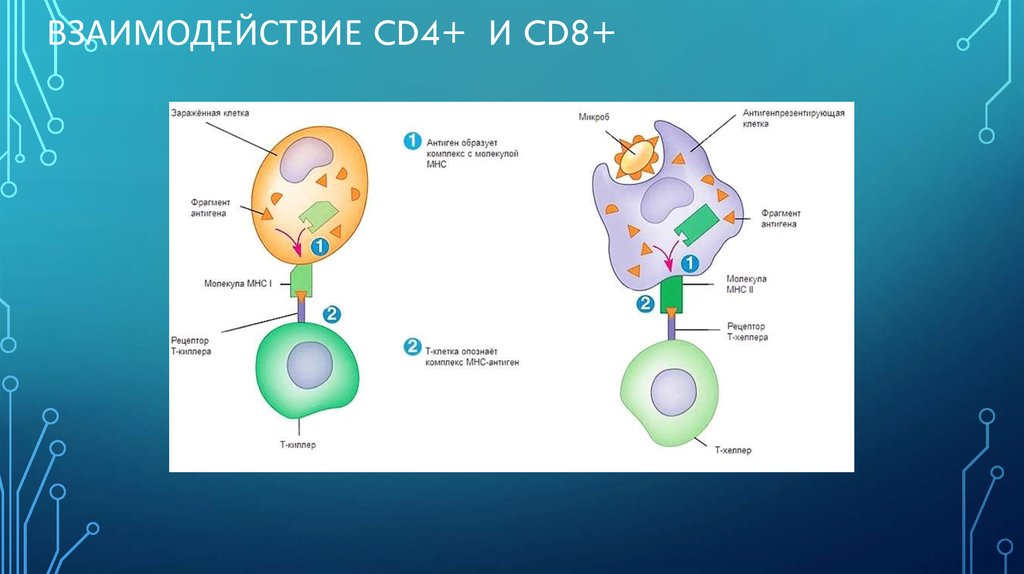
19. Взаимодействие CD4+ и CD8+
ВЗАИМОДЕЙСТВИЕ CD4+ И CD8+20. Notch-рецептор
NOTCH-РЕЦЕПТОР• Так же имеет место синтезируемый рецептор Notch для одного
антигена клетки, чтобы индуцировать экспрессию CAR для второго
рецептора. Такие Т клетки с двухрецепторным «замком-затвором»
способны активироваться только в отношении опухолевых клеток,
имеющих оба антигена, что повышает их избирательность в
отношении именно опухолевых клеток.
21. Использование в гипоксических условиях
ИСПОЛЬЗОВАНИЕ В ГИПОКСИЧЕСКИХ УСЛОВИЯХ• Поскольку характерной особенностью примерно 50 % твёрдых
опухолей является гипоксическая среда, были спроектированы Тклетки CAR, которые реагируют на гипоксическую среду — они
неэффективны, если не находятся в гипоксической среде. С этой
целью к ним добавлен субдомен HIF1α (hypoxia-inducible factor 1alpha).
22. Заключение
ЗАКЛЮЧЕНИЕТерапия Т-лимфоцитами с химерными антигенными рецепторами является
активно развивающимся разделом иммунотерапии злокачественных
опухолей.
Успехи, достигнутые современной молекулярной биологией и иммунологией,
позволяют конструировать все новые эффективные виды химерных
рецепторов к различным поверхностным опухолевым антигенам. Уже
достигнутые клинические результаты применения данного метода
показывают перспективность его использования в онкологии.















 medicine
medicine








