Similar presentations:
Бактерии в геохимических круговоротах. Круговорот серы. Заморные явления в водоемах и сероводородное заражение Черного моря
1. Бактерии в геохимических круговоротах
Круговорот серы. Ассимиляторное идиссимиляторное восстановления сульфата.
Заморные явления в водоемах и сероводородное
заражение Черного моря.
ПущГЕНИ
М.Б. Вайнштейн
30 сентября 2019
2.
Химический элемент + электронывосстановление.
Химический элемент - электроны
окисление.
Сульфат (S 6+) + 8 электронов
сульфид (S 2-).
3.
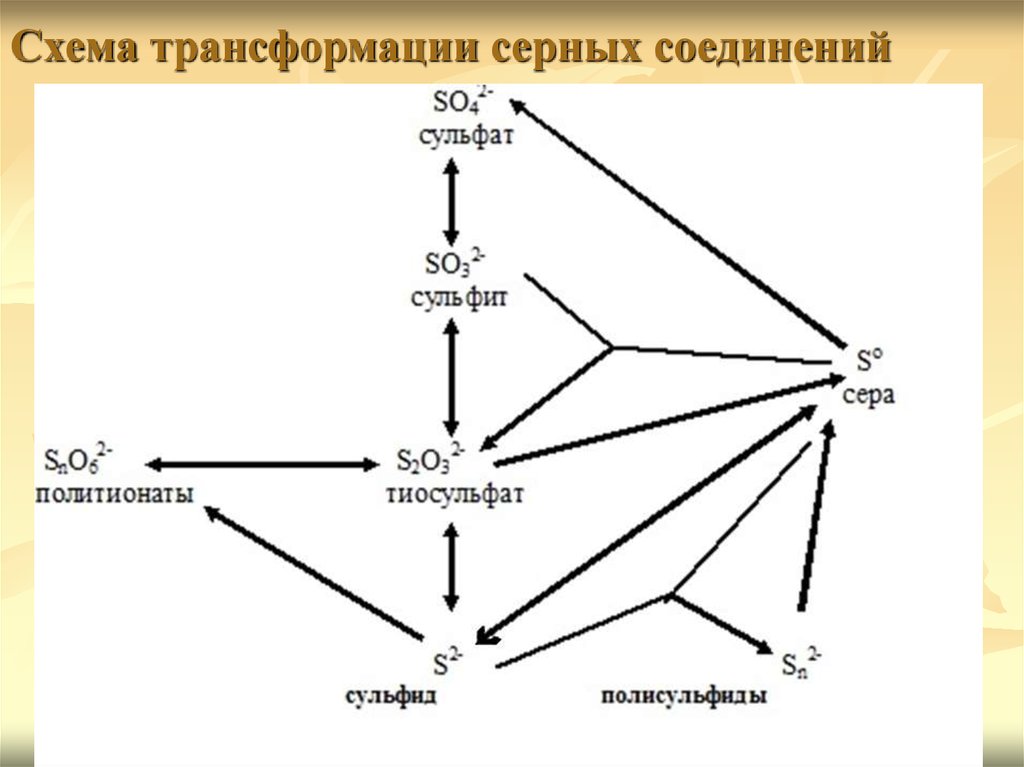
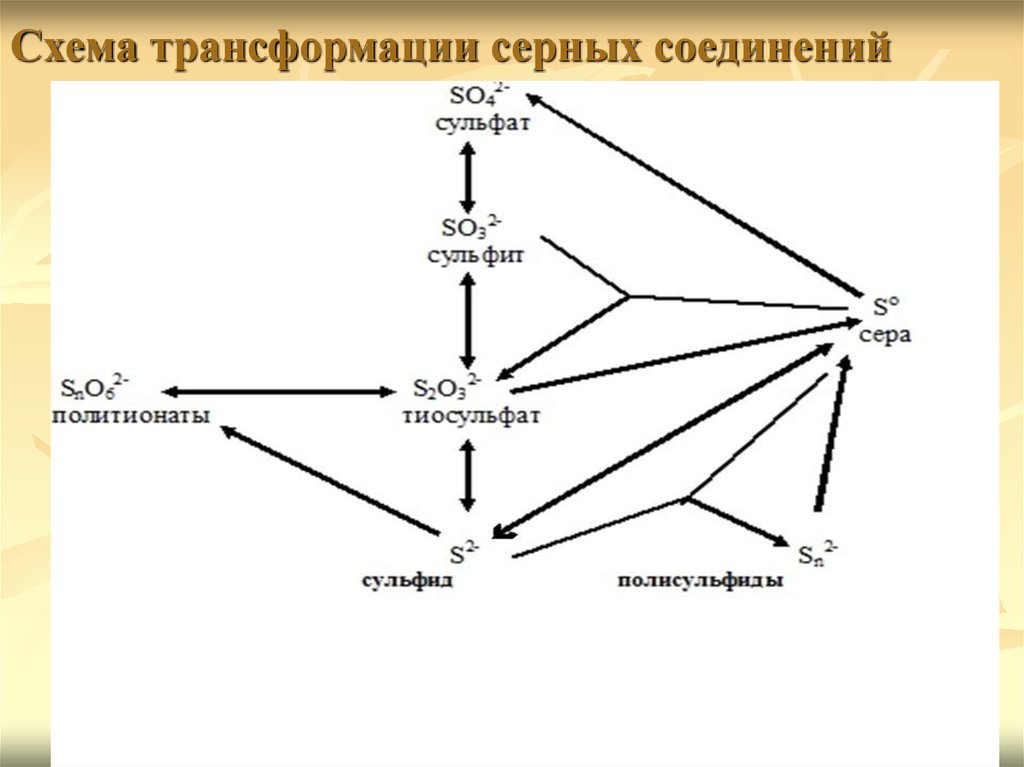
Схема трансформации серных соединений4.
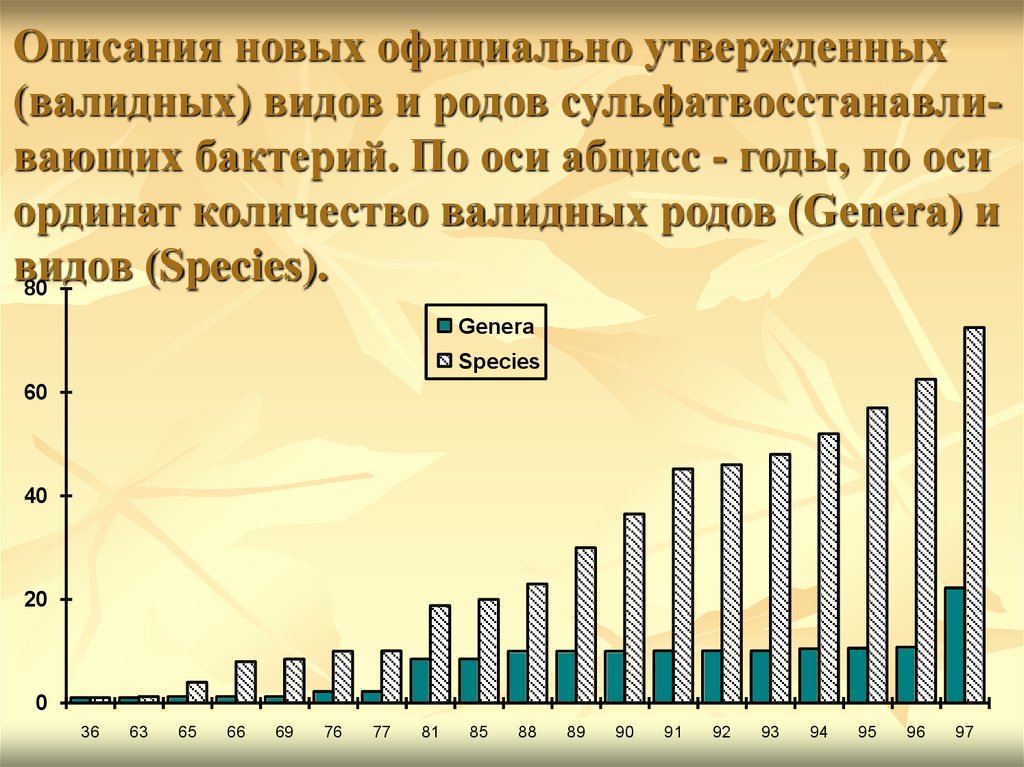
Описания новых официально утвержденных(валидных) видов и родов сульфатвосстанавливающих бактерий. По оси абцисс - годы, по оси
ординат количество валидных родов (Genera) и
видов
(Species).
80
Genera
Species
60
40
20
0
36
63
65
66
69
76
77
81
85
88
89
90
91
92
93
94
95
96
97
5.
«…количество валидных родов (Genera) ивидов (Species).»
А.С. Пушкин «Капитанская дочка» – капитан
Миронов и его инвалиды.
Кто такие инвалиды?
Вопрос 1.
Что означает «валидный род / вид»?
Вопрос 2.
Где в природе много доступных бактериям
сульфатов?
6.
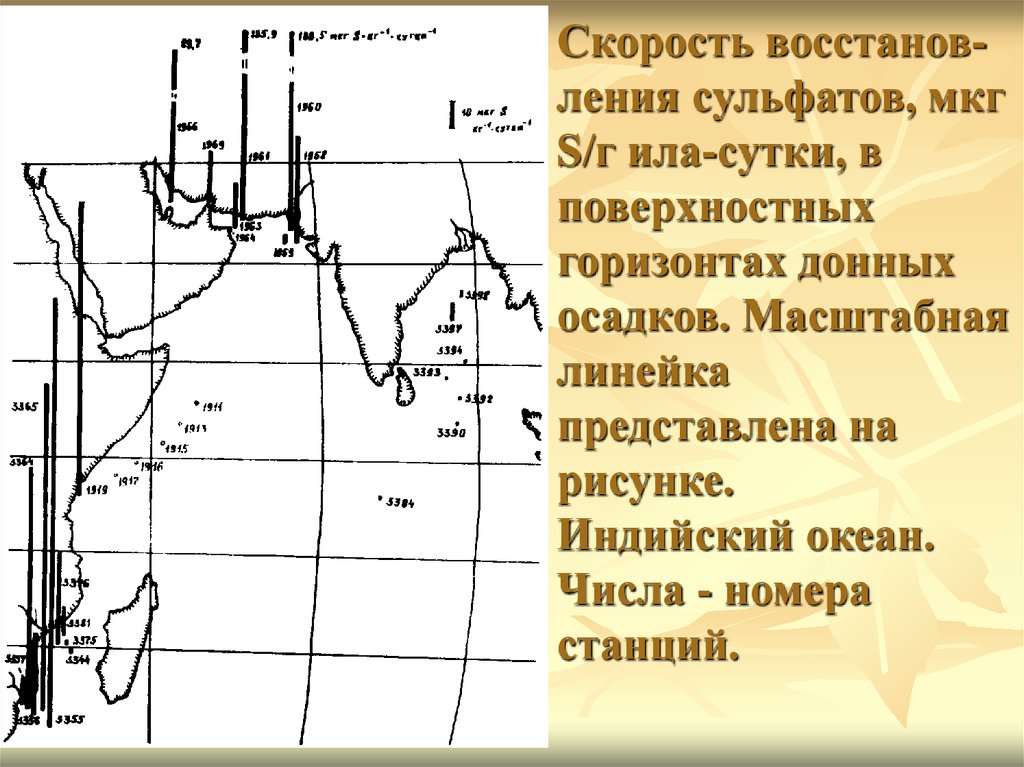
Скорость восстановления сульфатов, мкгS/г ила-сутки, в
поверхностных
горизонтах донных
осадков. Масштабная
линейка
представлена на
рисунке.
Индийский океан.
Числа - номера
станций.
7.
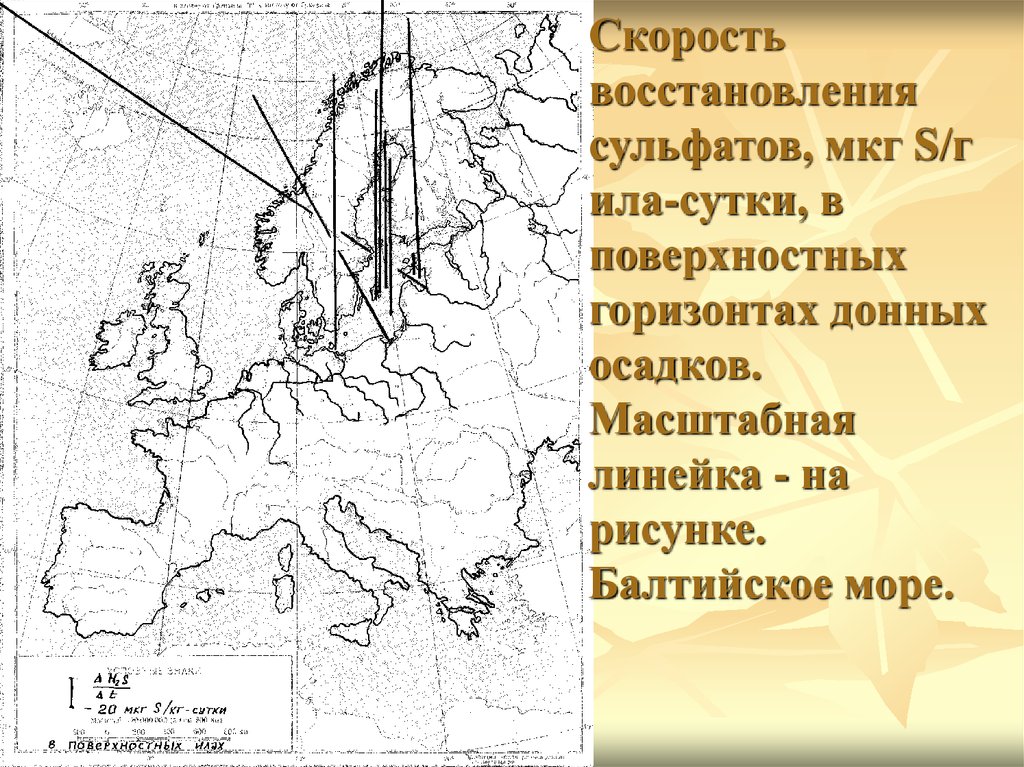
Скоростьвосстановления
сульфатов, мкг S/г
ила-сутки, в
поверхностных
горизонтах донных
осадков.
Масштабная
линейка - на
рисунке.
Балтийское море.
8.
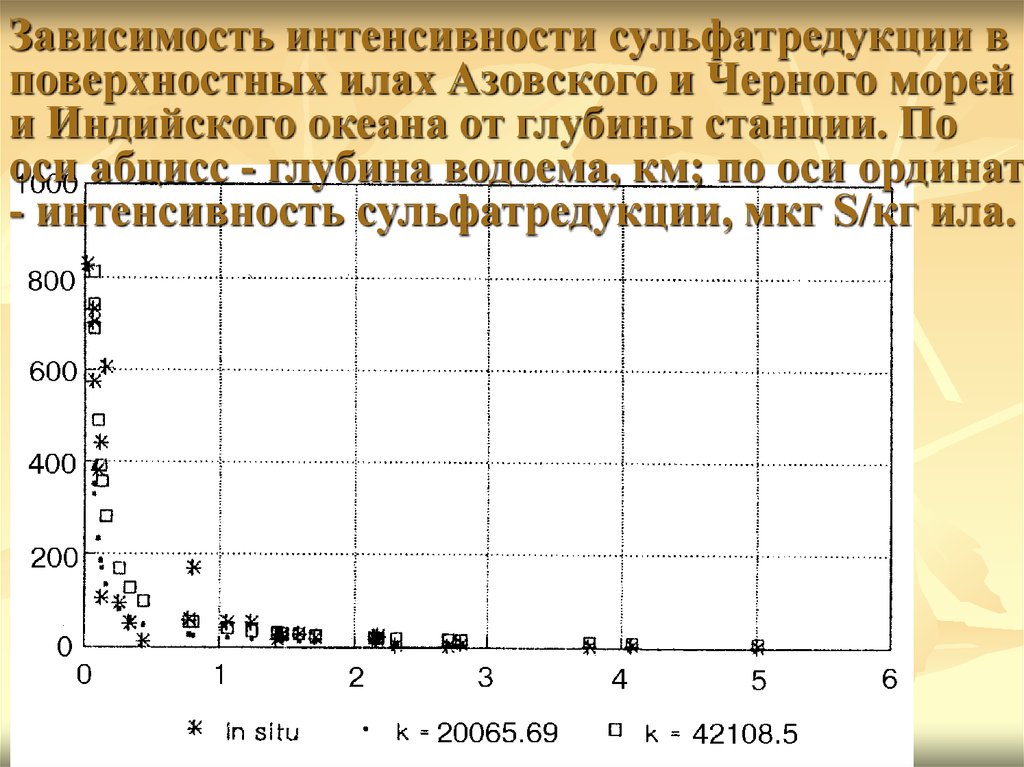
Зависимость интенсивности сульфатредукции вповерхностных илах Азовского и Черного морей
и Индийского океана от глубины станции. По
оси абцисс - глубина водоема, км; по оси ординат
- интенсивность сульфатредукции, мкг S/кг ила.
9.
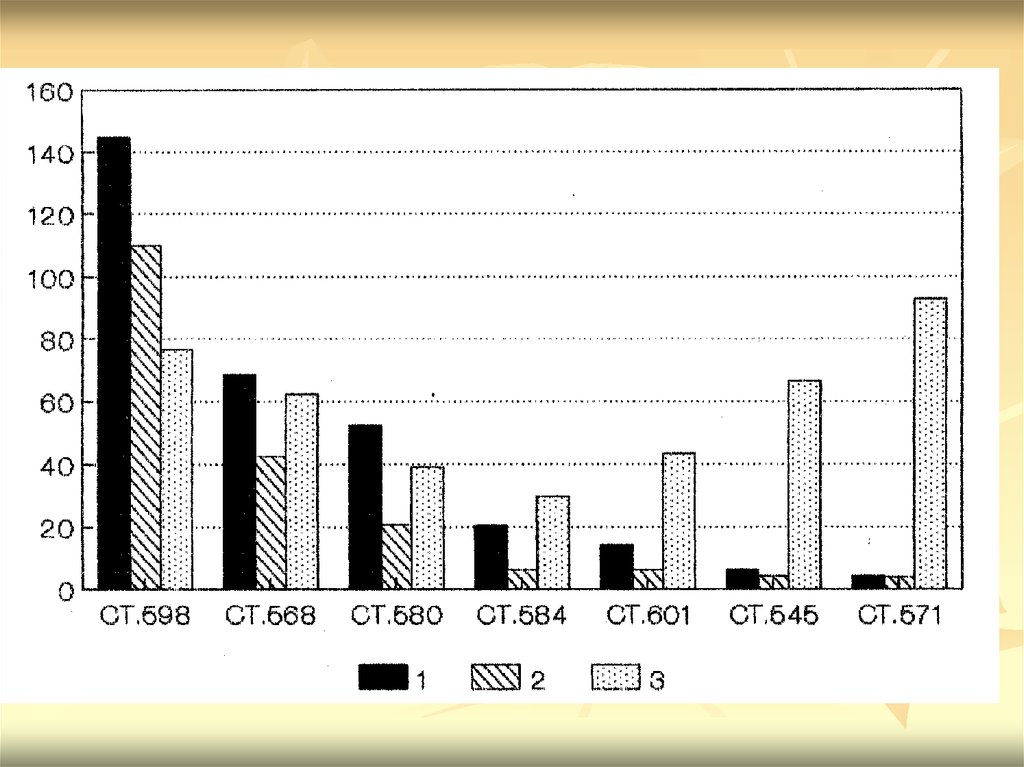
Расчетное распределение органическогоуглерода в Черном море по разрезу "берегбатиаль". На оси абцисс указаны номера
станций, приведенные в порядке увеличения
глубины.
1 – исходное содержание органического
вещества, кг с/м2;
2 – расчетное потребление органического
вещества на сульфатредукцию, кг с/м2;
3 – расчетное потребление органического
вещества на сульфатредукцию, %.
10.
11.
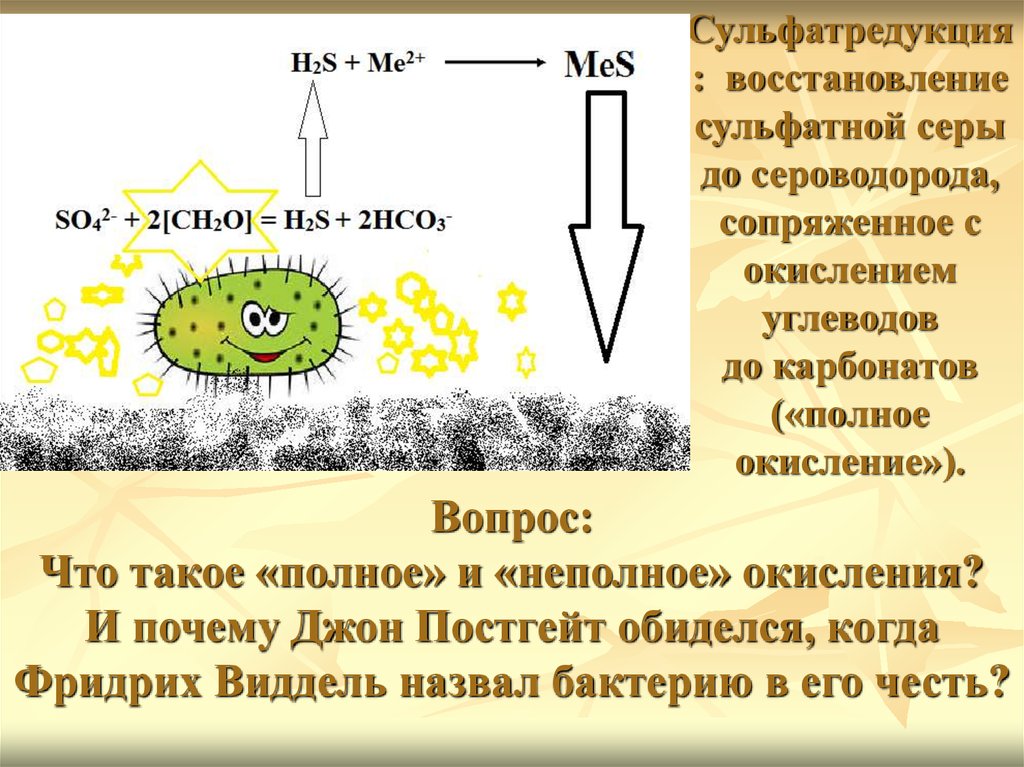
Вайнштейн М.Б.Сульфатредукция
: восстановление
сульфатной серы
до сероводорода,
сопряженное с
окислением
углеводов
до карбонатов
(«полное
окисление»).
Вопрос:
Что такое «полное» и «неполное» окисления?
И почему Джон Постгейт обиделся, когда
Фридрих Виддель назвал бактерию в его честь?
12.
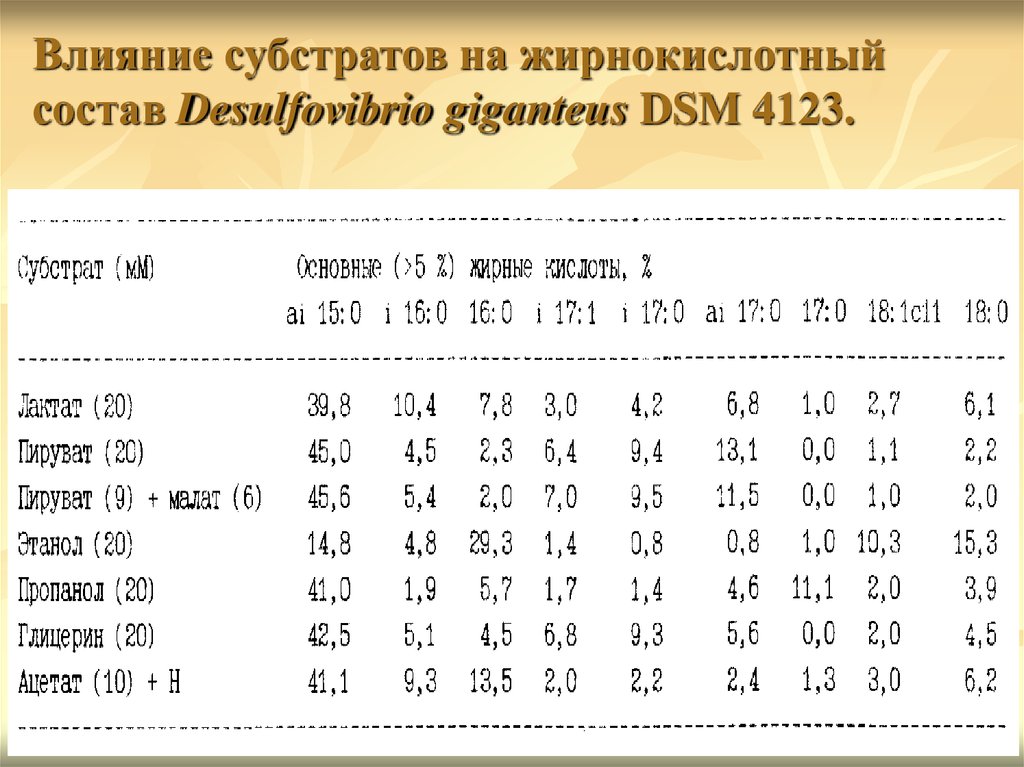
Влияние субстратов на жирнокислотныйсостав Desulfovibrio giganteus DSM 4123.
13.
Первая культура сульфатредуцирующихбактерий была выделена в Нидерландах
М. Бейеринком.
14.
Почему на сульфатредукторов обратили внимание вНидерландах?
15.
16.
17.
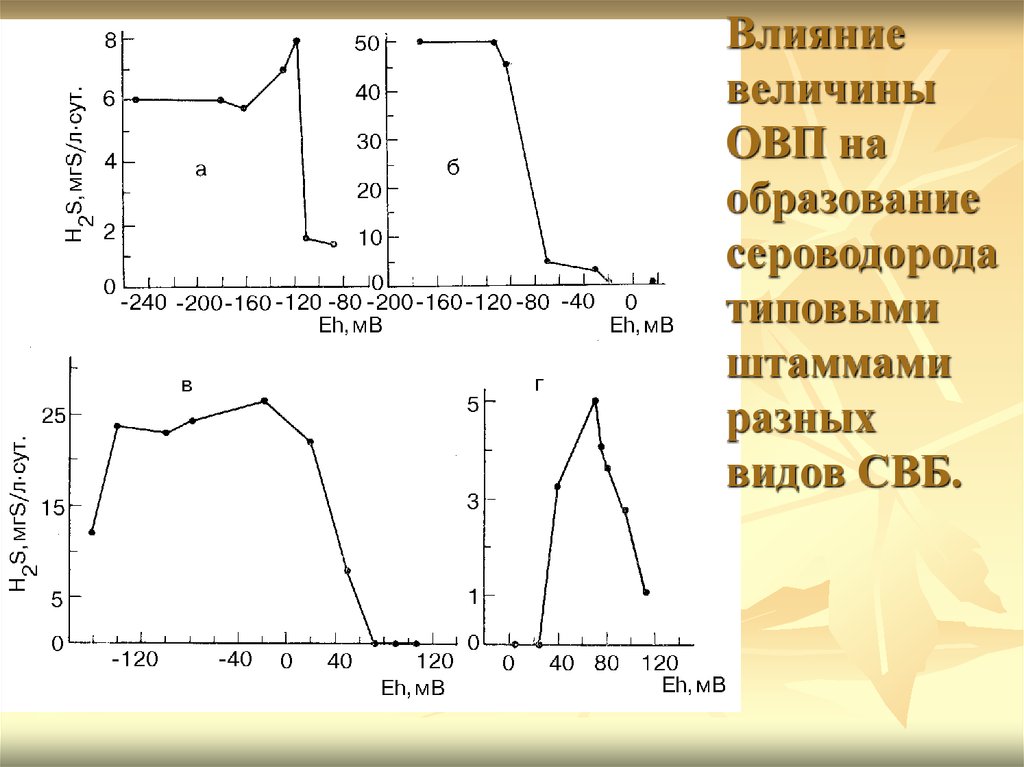
Влияниевеличины
ОВП на
образование
сероводорода
типовыми
штаммами
разных
видов СВБ.
18.
Схема трансформации серных соединений19.
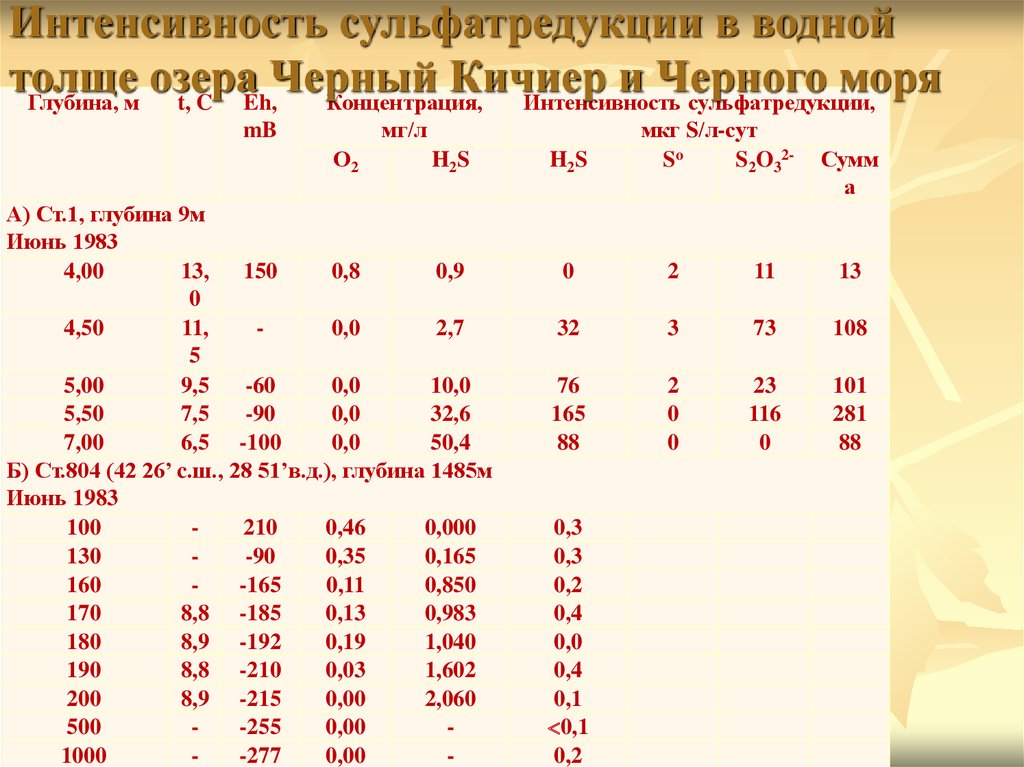
Интенсивность сульфатредукции в воднойтолще
озера
Черный
Кичиер
и Черного моря
Глубина, м
t, C Eh,
Концентрация,
Интенсивность сульфатредукции,
мг/л
mB
О2
H2S
А) Ст.1, глубина 9м
Июнь 1983
4,00
13, 150
0,8
0,9
0
4,50
11,
0,0
2,7
5
5,00
9,5
-60
0,0
10,0
5,50
7,5
-90
0,0
32,6
7,00
6,5 -100
0,0
50,4
Б) Ст.804 (42 26’ c.ш., 28 51’в.д.), глубина 1485м
Июнь 1983
100
210
0,46
0,000
130
-90
0,35
0,165
160
-165
0,11
0,850
170
8,8 -185
0,13
0,983
180
8,9 -192
0,19
1,040
190
8,8 -210
0,03
1,602
200
8,9 -215
0,00
2,060
500
-255
0,00
1000
-277
0,00
-
H2S
мкг S/л-сут
So
S2O32-
Сумм
а
0
2
11
13
32
3
73
108
76
165
88
2
0
0
23
116
0
101
281
88
0,3
0,3
0,2
0,4
0,0
0,4
0,1
0,1
0,2
20.
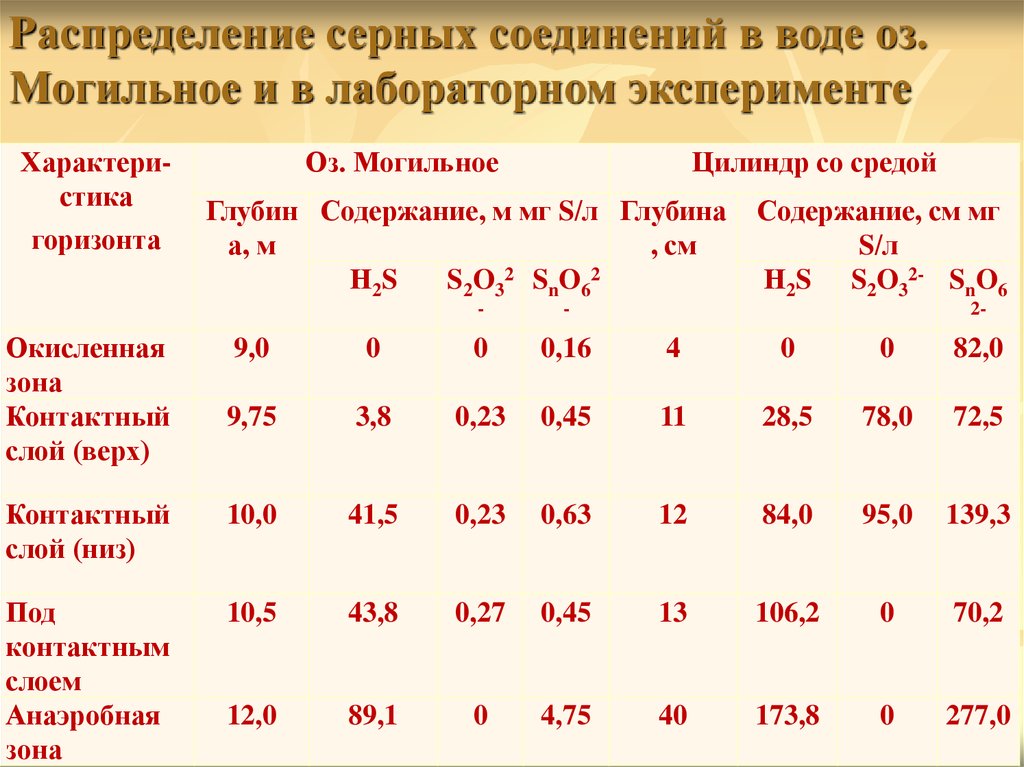
Распределение серных соединений в воде оз.Могильное и в лабораторном эксперименте
Характеристика
горизонта
Окисленная
зона
Контактный
слой (верх)
Оз. Могильное
Цилиндр со средой
Глубин Содержание, м мг S/л Глубина
а, м
, cм
Н2S
S2O32 SnO62
-
-
Содержание, см мг
S/л
Н2S S2O32- SnO6
2-
9,0
0
0
0,16
4
0
0
82,0
9,75
3,8
0,23
0,45
11
28,5
78,0
72,5
Контактный
слой (низ)
10,0
41,5
0,23
0,63
12
84,0
95,0
139,3
Под
контактным
слоем
Анаэробная
зона
10,5
43,8
0,27
0,45
13
106,2
0
70,2
12,0
89,1
0
4,75
40
173,8
0
277,0
21.
Лет 20 назад была попытка разведения мидийпод Одессой – вроде устричных плантаций, однако, случился сероводородный замор, и всё
хозяйство погибло. Тогда это трактовалось как
подъем глубинных сероводородных вод Черного
моря и вызвало ряд журналистских статей о
том, что сероводород начал подниматься из
глубин Черного моря и скоро достигнет
поверхности и отравит все живое!
Вопрос:
Каковы основные причины этого замора?
22.
Происхождение Черноморского сероводорода1-я гипотеза: гнилостный.
2-я: сульфатредукционный.
3-я: древний, поступающий по разломам.
Методы проверки:
- расчетный химический по балансу,
- расчетный химический по соотношению
«сульфат : хлорид»,
- изотопный,
- подтверждение современного процесса,
- подтверждение присутствия бактерий.
23.
24.
Образование метана культурой Desulfosarcinavariabilis ВКМ В-1167 при росте на различных
субстратах
Субстрат (его исходное
содержание, мМ)
Метан,
мкмол из 10
мл среды
Белок
Биомассы,
мг/л
Продукция
метана,
мг/мг белка
Бензоат (5мМ)
56,8
172
0,528
Лактат (20 мМ)
57,8
165
0,560
Бензоат (5 мМ) + лактат (20
мМ)
Пируват (10 мМ)
0,0
202
0,0
0,0
147
0,0
Н2 + СО2 (2 атм.)
69,0
52
2,128
Н2 + ацетат (10 мМ)
3,6
51
0,112
Бензилсульфонат (2 мМ)
68,0
42
2,592
25.
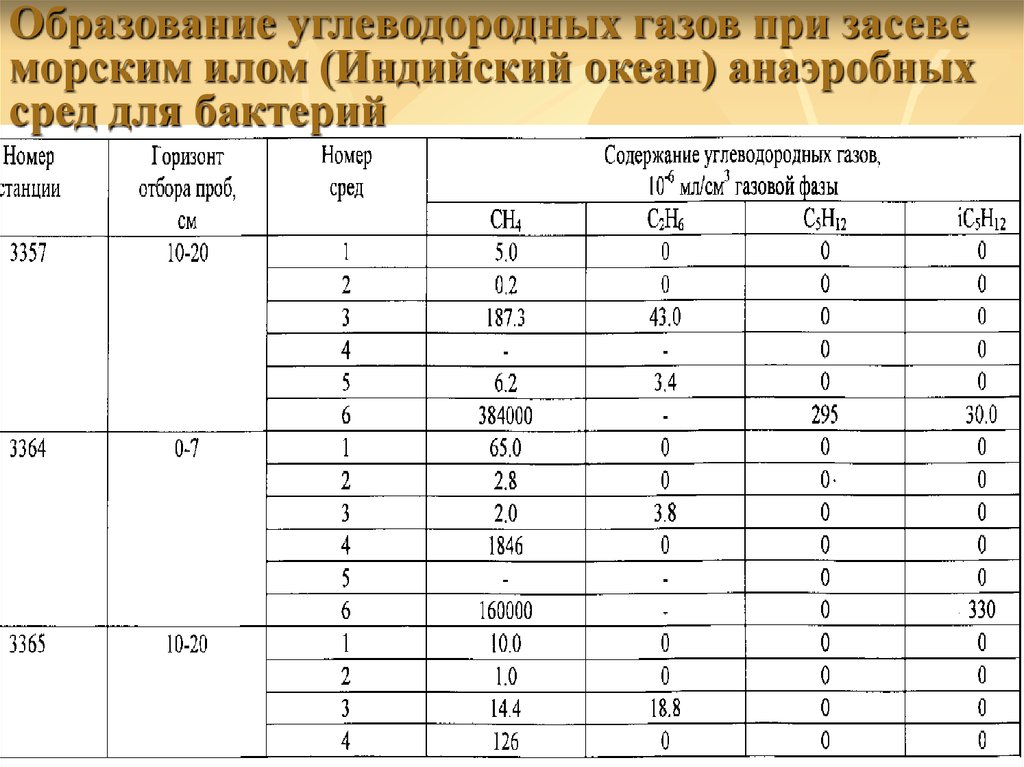
Образование углеводородных газов при засевеморским илом (Индийский океан) анаэробных
сред для бактерий
26.
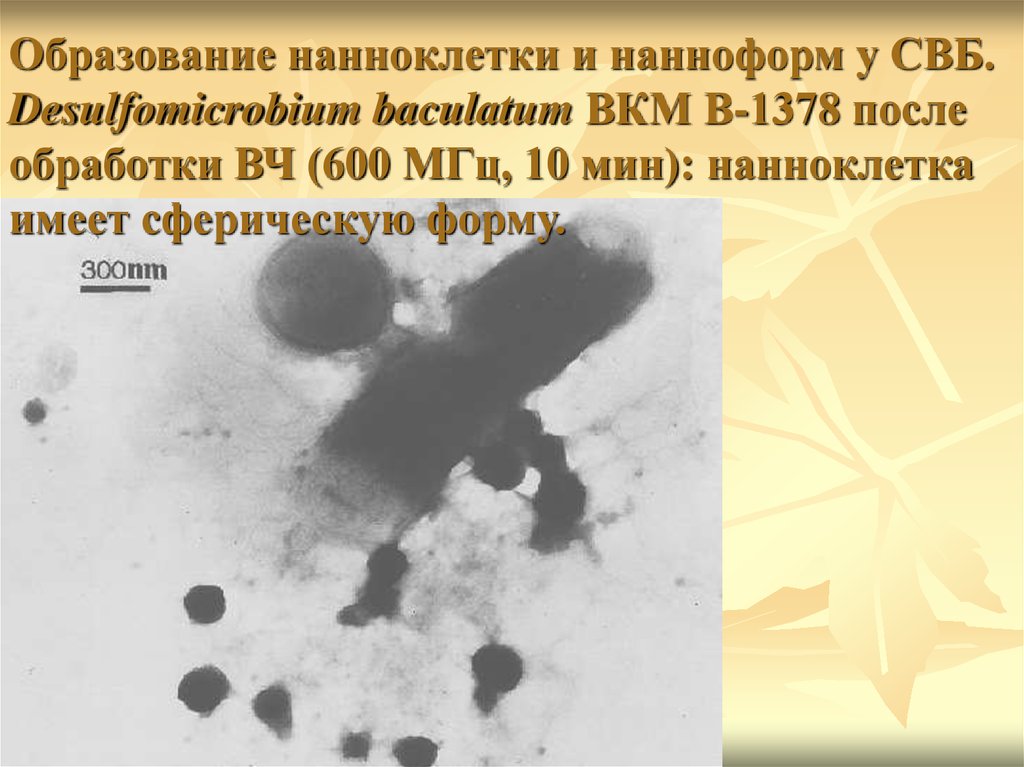
Образование нанноклетки и нанноформ у СВБ.Desulfomicrobium baculatum ВКМ В-1378 после
обработки ВЧ (600 МГц, 10 мин): нанноклетка
имеет сферическую форму.
27. Бактерии в геохимических круговоротах Биовыщелачивание тионовыми бактериями
и участие микроорганизмовв круговороте серы
28.
Классический метод добычи ценных металлов из руд –пирометаллургия – выплавка при высокой
температуре. Этот метод непригоден, если
содержание металла не более 1%.
При низких содержаниях металлов их добывают
растворением из руд – гидрометаллургия.
Минеральное сырье практически нерастворимо в
воде, поэтому требуется разрушение основной
структуры минералов или хелатирование металлов.
Первый в мире патент на биовыщелачивание
(выщелачивание растворами с использованием
бактерий) был выдан в США в 1958 г.
Наиболее востребованными оказались тионовые
бактерии, используемые для добычи ценных
металлов из сульфидных руд.
Классические виды тионовых бактерий автотрофны,
то есть не нуждаются в добавлении дополнительных
ростовых субстратов в руду, и используют энергию
окисления сульфидов – компонентов минерального
сырья руды.
29. Проблемы биовыщелачивания ацидофилами: внесение серной кислоты
Основные добавки для химического выщелачивания - минеральныекислоты, из которых предпочтение обычно отдается серной как
сильной и нелетучей даже при разогреве. Например, по патенту
США 4,098,870 (1978) для выщелачивания железо-никелевой руды
вносят серную кислоту из расчета 0,8 на 1 часть сухой руды.
Внесение кислоты
- разрушает/растворяет некоторые минералы,
- способствует окислению минеральных сульфидов,
- создает благоприятные условия для строгих ацидофилов.
Вместе с этим внесение серной кислоты экономически невыгодно:
- увеличивает себестоимость металла за счет цены кислоты,
- требует затрат на последующую ремедиацию закисленного участка.
По заказу CANMET-Mining and Mineral Sciences Laboratories, Канада,
мы получили грант МНТЦ на выполнение проекта «Выщелачивание
никелевых руд умеренными ацидофилами».
30. Мы исследовали 16S рДНК бактерий из образцов трех видов отвалов (хвостов) канадской никелевой руды c нейтральными значениями
рН. Всеварианты схожи по
составу бактериальных
сообществ: в них
преобладали
неизвестные и
некультивируемые на
стандартных средах
виды Acidithiobacillus.
31. Доминирующие группы бактерий в отвалах канадских руд
В соответствии с определенной величиной сходства≥97% найденных бактериальных
последовательностей с известными в базе данных
GenBank 39 полученных нами клонов были
идентифицированы как представители
Acidithiobacillus, Leptospirillum, Halothiobacillus и
Pseudomonas. Наиболее широко был представлен род
Aciditiobacillus.
В целом доминирование в бактериальном
разнообразии микробиот может быть представлено
по следующей схеме в порядке убывания:
Acidithiobacillus > Leptospirillum > Halothiobacillus >
Thiomonas > Pseudomonas > Delftia.
32. Бактериальные сообщества из рудных отвалов в накопительных культурах
A0A1
A2
A3
A4
B0
B1
B2
B3
B4
C0
C1
C2
C3
C4
Буквами А, В и С
обозначены образцы
отвалов, A0, B0 и С0 –
исходный
состав
микрофлоры
образцов.
В экспериментах по выщелачиванию накопительные культуры,
засеянные образцами инкубировали при различных условиях: A1 – pH 2,
28 оC; A2 – pH 4, 28 оC; A3 – pH 2, 45 оC; A4 – pH 4, 45 оC; B1 – рH 2, 28
оC; B2 – pH 4, 28 оC; B3 – pH 2, 45 оC; B4 – pH 4, 45 оC; C1 – pH 2, 28 оC;
C2 – pH 4, 28 оC; C3 – pH 2, 45 оC; C4 – pH 4, 45 оC.
33. Филогенетический анализ 16S рДНК накопительных культур привел к тем же результатам, что и анализ исходных отвалов руд: в
культурах былиобнаружены
многочисленные
«некультивируемые»
штаммы бактерий родов
Acidithiobacillus,
Leptospirillum и
Halothiobacillus.
34. Модельные опыты по выщелачиванию никеля из сульфидных руд
Рудаt,оС рН
28º
A
2
45º
28º
Засев
Отвалы
A
4
Выщелачивание руд
природной
микрофлорой
рудных
отвалов.
28º
2
Отвалы
B
4
28º
2
45º
45º
32,758
0,000
28º
28º
24,348
16,472
45º
C
0,000
0,000
45º
28º
0,000
0,000
45º
B
СNi,
мг/л
4
Руда
C
27,819
Отвалы
C
50,445
75,473
52,247
31,489
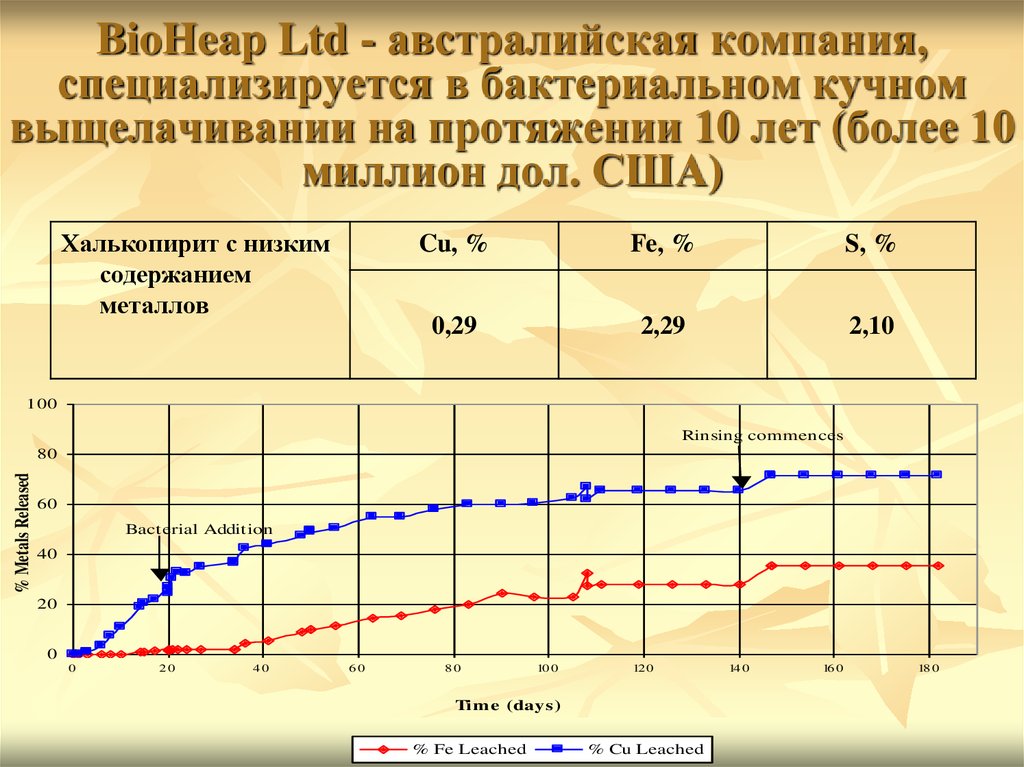
35. BioHeap Ltd - австралийская компания, специализируется в бактериальном кучном выщелачивании на протяжении 10 лет (более 10
миллион дол. США)Халькопирит с низким
содержанием
металлов
Cu, %
Fe, %
S, %
0,29
2,29
2,10
100
Rinsing commences
% Metals Released
80
60
Bact erial Addit ion
40
20
0
0
20
40
60
80
10 0
12 0
Ti me (days)
% Fe Leached
% Cu Leached
14 0
16 0
18 0
36.
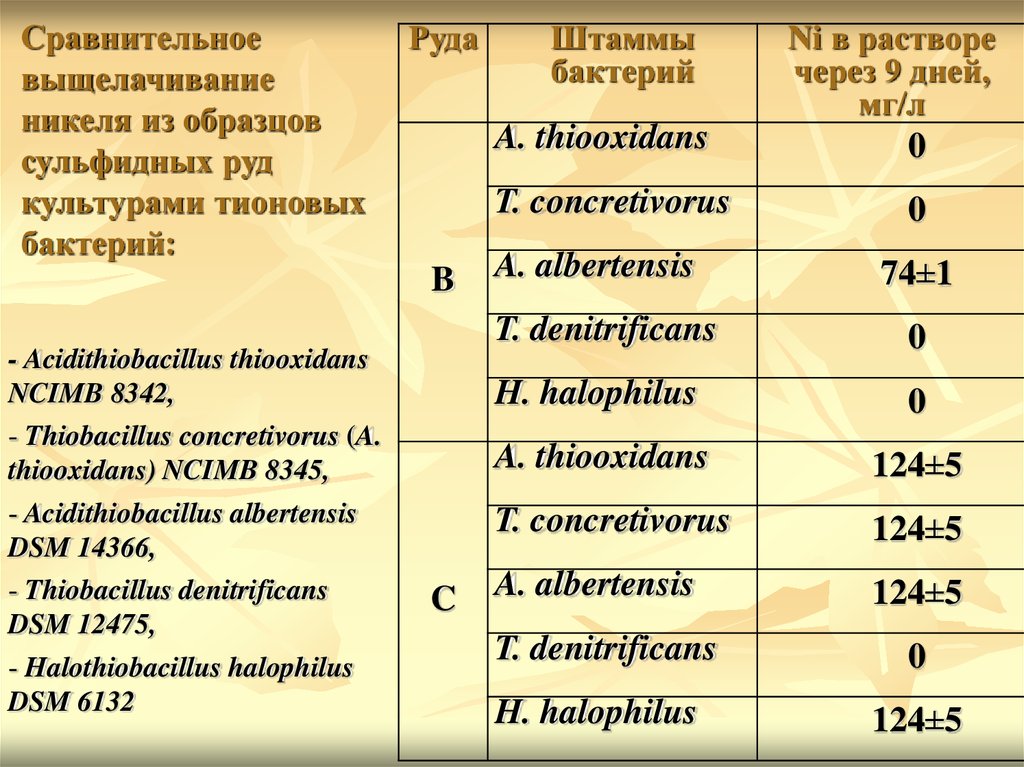
Сравнительноевыщелачивание
никеля из образцов
сульфидных руд
культурами тионовых
бактерий:
Руда
A. thiooxidans
T. concretivorus
B
- Acidithiobacillus thiooxidans
NCIMB 8342,
- Thiobacillus concretivorus (A.
thiooxidans) NCIMB 8345,
- Acidithiobacillus albertensis
DSM 14366,
- Thiobacillus denitrificans
DSM 12475,
- Halothiobacillus halophilus
DSM 6132
Штаммы
бактерий
C
A. albertensis
Ni в растворе
через 9 дней,
мг/л
0
0
74±1
T. denitrificans
0
H. halophilus
0
A. thiooxidans
124±5
T. concretivorus
124±5
A. albertensis
124±5
T. denitrificans
0
H. halophilus
124±5
37.
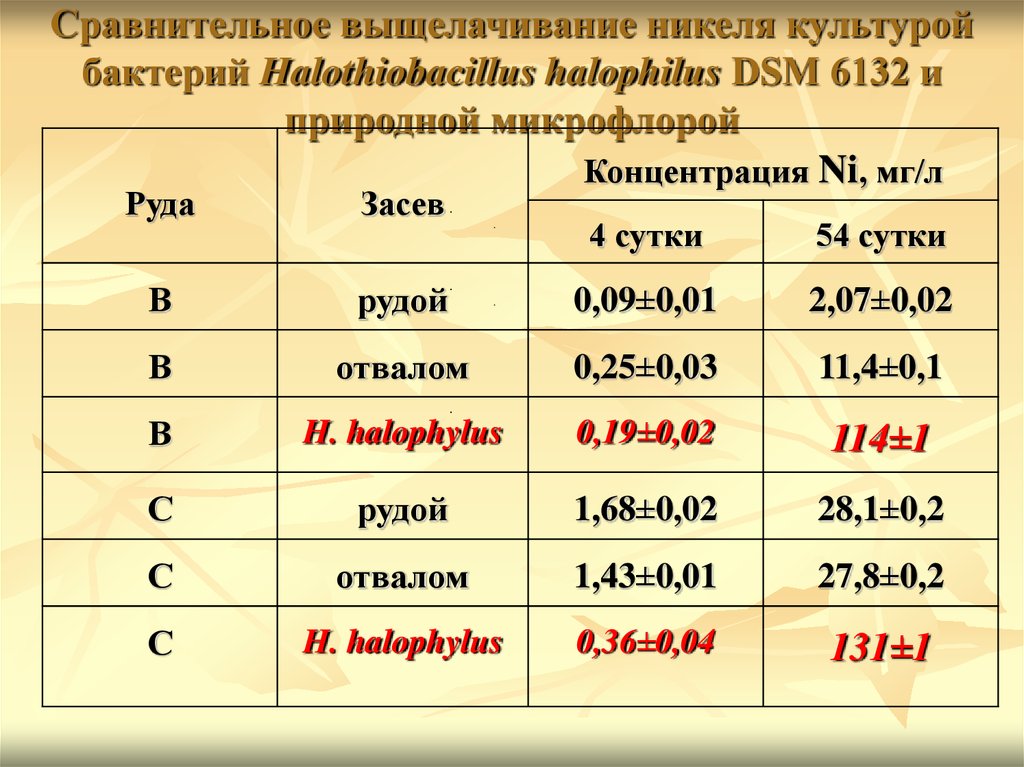
Сравнительное выщелачивание никеля культуройбактерий Halothiobacillus halophilus DSM 6132 и
природной микрофлорой
Концентрация Ni, мг/л
Руда
Засев
В
4 сутки
54 сутки
рудой
0,09±0,01
2,07±0,02
В
отвалом
0,25±0,03
11,4±0,1
В
H. halophylus
0,19±0,02
114±1
С
рудой
1,68±0,02
28,1±0,2
С
отвалом
1,43±0,01
27,8±0,2
С
H. halophylus
0,36±0,04
131±1
38.
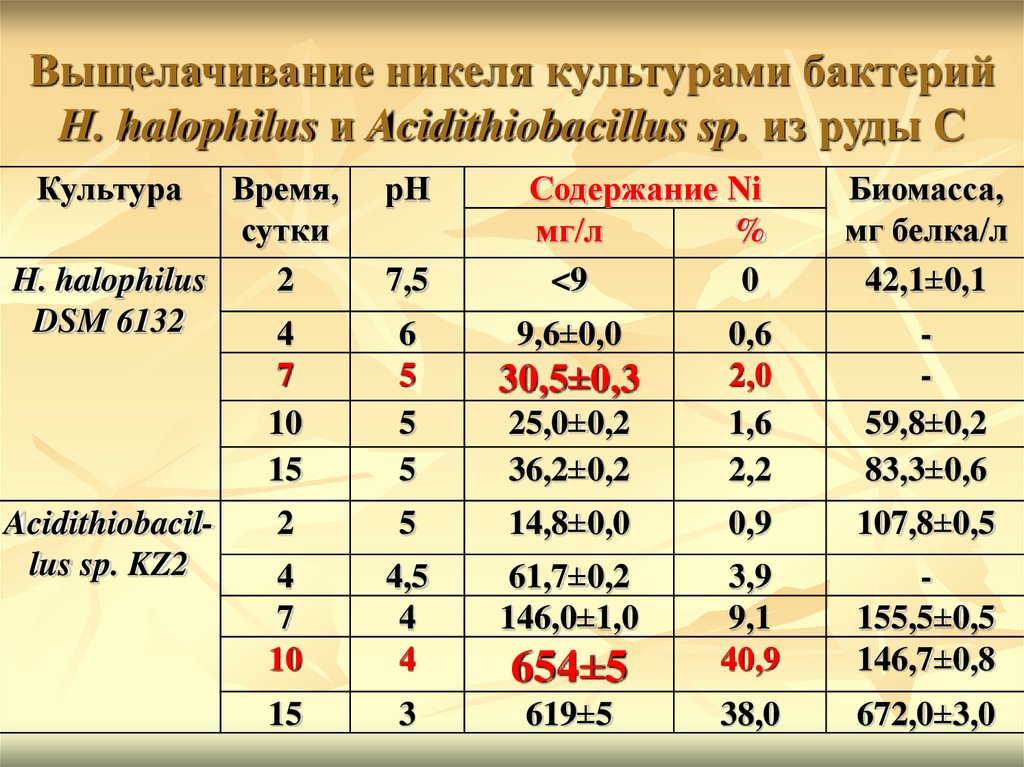
Выщелачивание никеля культурами бактерийH. halophilus и Acidithiobacillus sp. из руды C
Культура
Время,
сутки
H. halophilus
2
DSM 6132
4
Acidithiobacillus sp. KZ2
рН
7,5
Содержание Ni
мг/л
%
<9
0
9,6±0,0
Биомасса,
мг белка/л
42,1±0,1
7
10
15
6
5
5
5
25,0±0,2
36,2±0,2
0,6
2,0
1,6
2,2
59,8±0,2
83,3±0,6
2
5
14,8±0,0
0,9
107,8±0,5
4
7
10
4,5
4
4
61,7±0,2
146,0±1,0
654±5
3,9
9,1
40,9
155,5±0,5
146,7±0,8
15
3
619±5
38,0
672,0±3,0
30,5±0,3
39. Основной итог завершенного проекта МНТЦ
Замена кислотолюбивых штаммов микроорганизмов наумеренные позволит отказаться от применения серной
кислоты, уменьшить себестоимость и расходы на
восстановление закисленного грунта.
Применение умеренно кислотолюбивых штаммов на первом
этапе позволяет использовать более кислотолюбивые на втором
без дополнительного внесения серной кислоты и без
образования мешающих выходу ценных металлов окислов
железа.
Содержание никеля в выщелачивающем
растворе, мг/л
800
700
600
500
рН (кислотность) 80,1
Ni, мг/л (бактерии 1-го этапа)
Ni, мг/л бактерии второго этапа)
400
300
200
100
0
0,
2,
4,
7,
10,
15,
Время, дни
17,
19,
22,
25,
40. J. T. Pronk, W. M. Meijer, W. Hazeu, J. P. Van Dijken, P. Bos, and J. G. Kuenen Growth of Thiobacillus ferrooxidans on Formic
AcidApplied аnd Environmental Microbiology
1991, V. 57, № 7, pр. 2057-2062
«… Thiobacillus ferrooxidans ATCC 21834, which, however, could not grow on
formate in normal batch cultures. However, the organism could be grown on
formate when the substrate supply was growth limiting, e.g., in formate-limited
chemostat cultures. The cell densities achieved by the use of the latter cultivation
method were higher than cell densities reported for growth of T. ferrooxidans on
ferrous iron or reduced sulfur compounds. Inhibition of formate oxidation by cell
suspensions, but not cell extracts, of formate-grown T. ferrooxidans occurred at
formate concentrations above 100 mM. This observation explains the inability of
the organism to grow on formate in batch cultures. Cells grown in formate-limited
chemostat cultures retained the ability to oxidize ferrous iron at high rates.
Ribulose 1,5-bisphosphate carboxylase activities in cell extracts indicated that T.
ferrooxidans employs the Calvin cycle for carbon assimilation during growth on
formate. Oxidation of formate by cell extracts was NAD(P) independent.»
41.
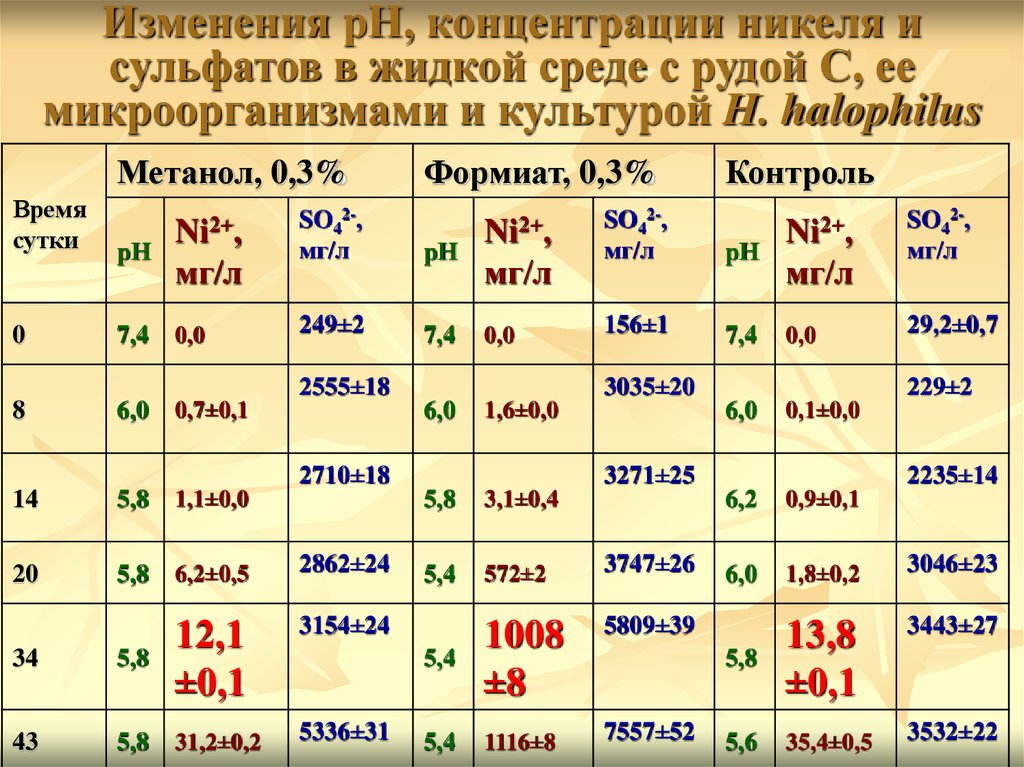
Изменения рН, концентрации никеля исульфатов в жидкой среде с рудой С, ее
микроорганизмами и культурой H. halophilus
Метанол, 0,3%
Время
сутки
рН
0
7,4
Ni2+,
мг/л
0,0
Формиат, 0,3%
SO42-,
мг/л
рН
249±2
7,4
Ni2+,
мг/л
0,0
2555±18
8
6,0
5,8
1,1±0,0
20
5,8
6,2±0,5
2862±24
3154±24
34
5,8
12,1
±0,1
43
5,8
31,2±0,2
5336±31
рН
156±1
7,4
Ni2+,
мг/л
0,0
3,1±0,4
5,4
572±2
3747±26
5809±39
5,4
1008
±8
5,4
1116±8
7557±52
29,2±0,7
0,1±0,0
3271±25
5,8
SO42-,
мг/л
229±2
6,0
1,6±0,0
2710±18
14
SO42-,
мг/л
3035±20
6,0
0,7±0,1
Контроль
2235±14
6,2
0,9±0,1
6,0
1,8±0,2
3046±23
3443±27
5,8
13,8
±0,1
5,6
35,4±0,5
3532±22
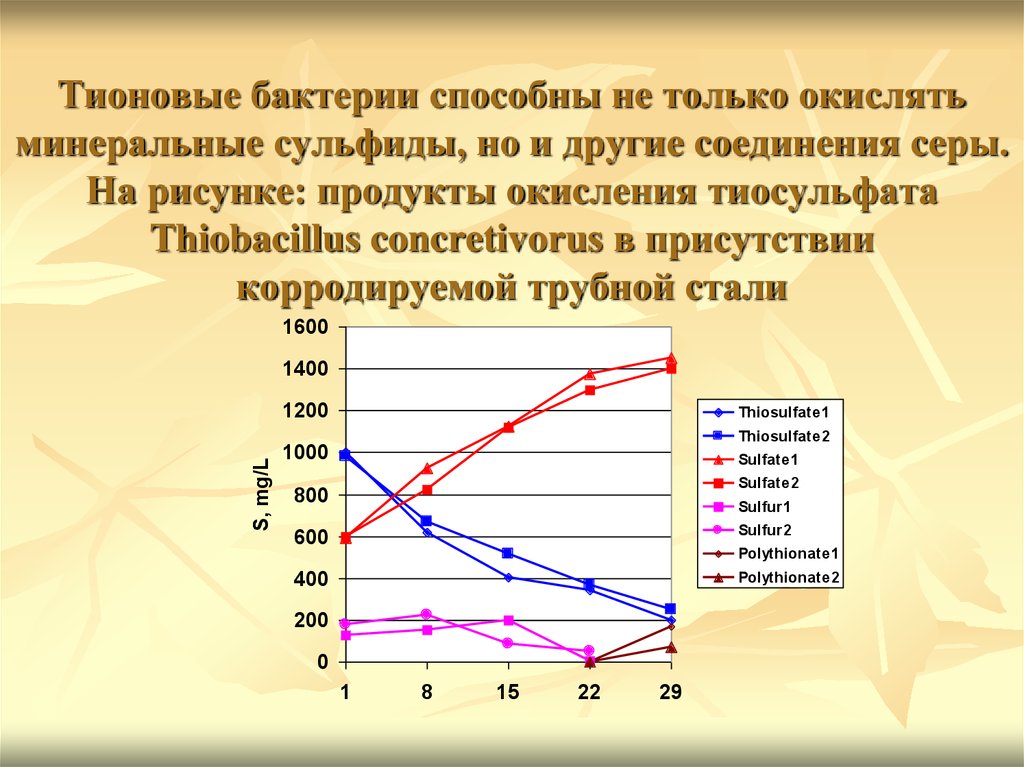
42. Тионовые бактерии способны не только окислять минеральные сульфиды, но и другие соединения серы. На рисунке: продукты окисления
тиосульфатаThiobacillus concretivorus в присутствии
корродируемой трубной стали
1600
1400
S, mg/L
1200
Thiosulfate1
Thiosulfate2
1000
Sulfate1
Sulfate2
800
Sulfur1
600
Sulfur2
400
Polythionate2
Polythionate1
200
0
1
8
15
22
29
43. Коррозия бетона за счет образования сульфата ( серная кислота + бетон гипс ) бактериями Т. concretivorus
Коррозия бетона за счет образования сульфата( серная кислота + бетон гипс )
бактериями Т. concretivorus
Контроль
С бактериями
С бактериями,
срез корочки
гипса
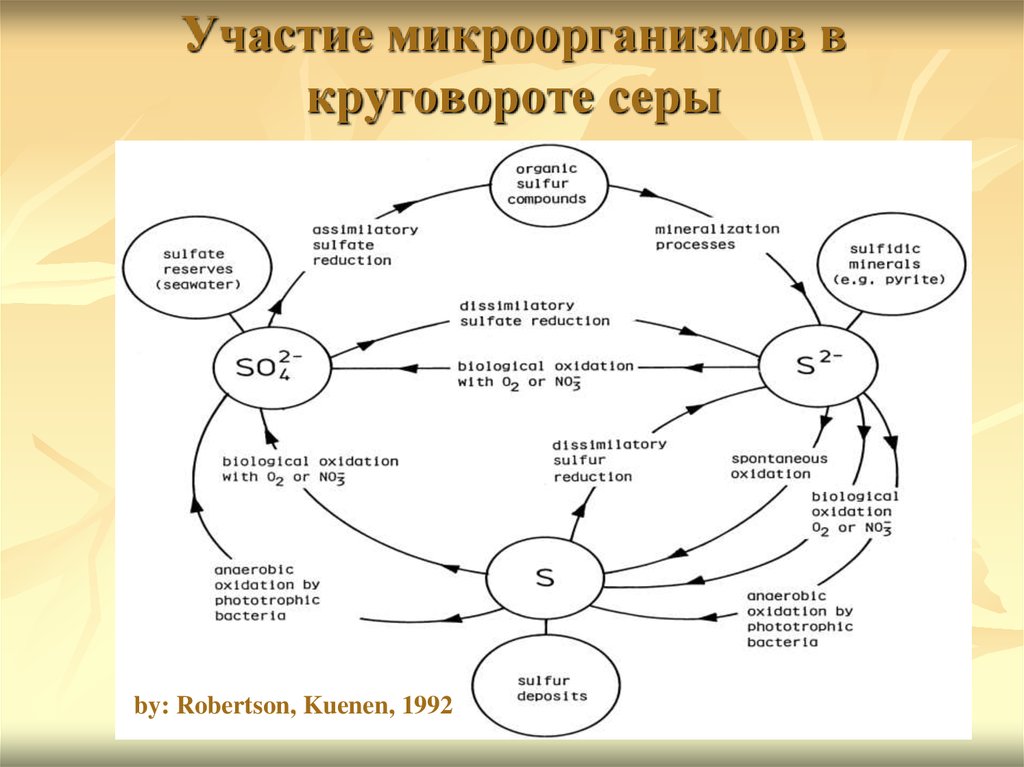
44. Участие микроорганизмов в круговороте серы
by: Robertson, Kuenen, 199245.
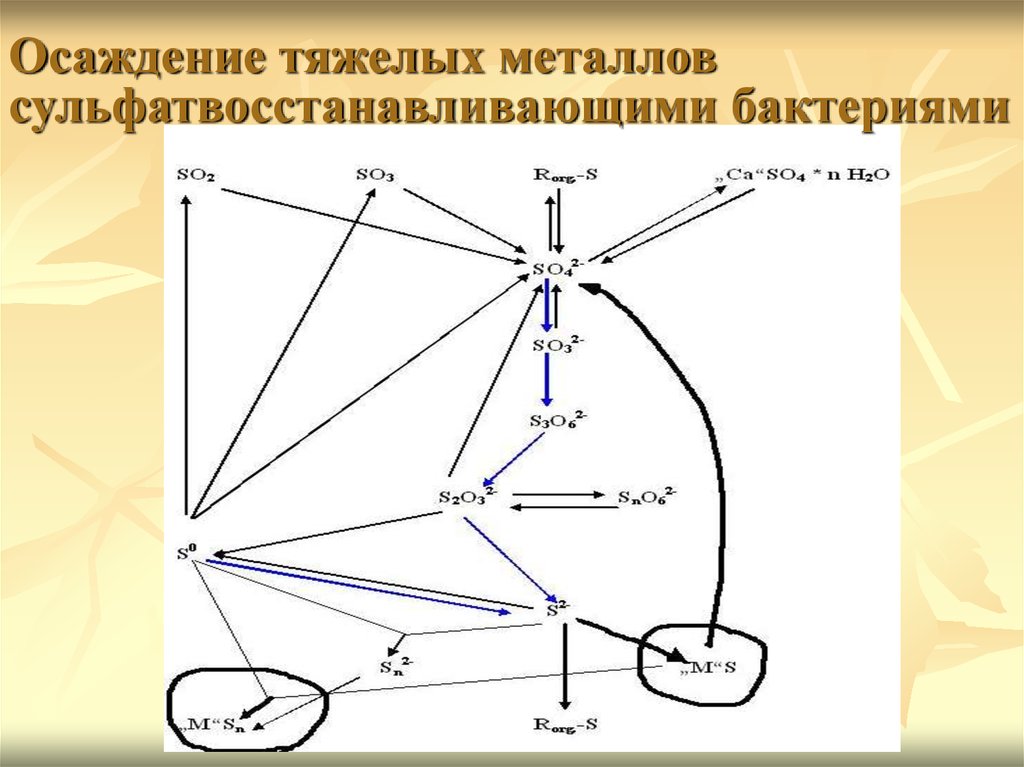
Осаждение тяжелых металловсульфатвосстанавливающими бактериями


























 biology
biology chemistry
chemistry








