Similar presentations:
Теоретические основы органической химии. Лекция 25
1.
Теоретические основы органическойхимии
Строение и свойства ион-радикалов
Лекция 25
(электронно-лекционный курс)
Проф. Бородкин Г.И.
2.
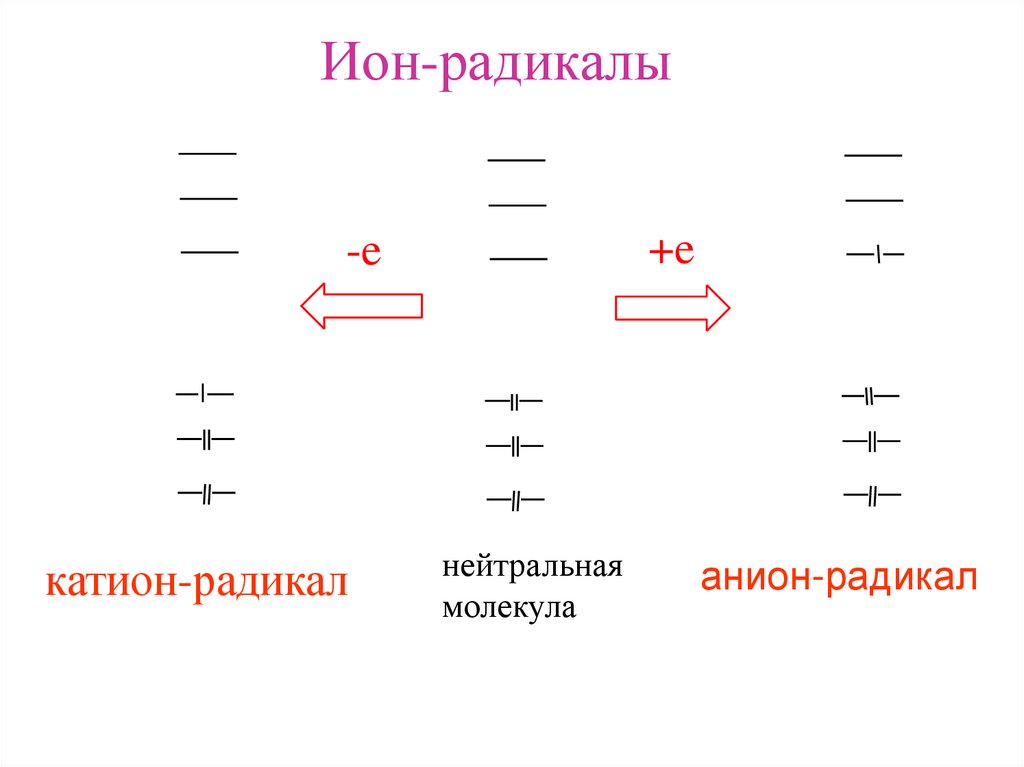
Ион-радикалы+e
-e
катион-радикал
нейтральная
молекула
анион-радикал
3.
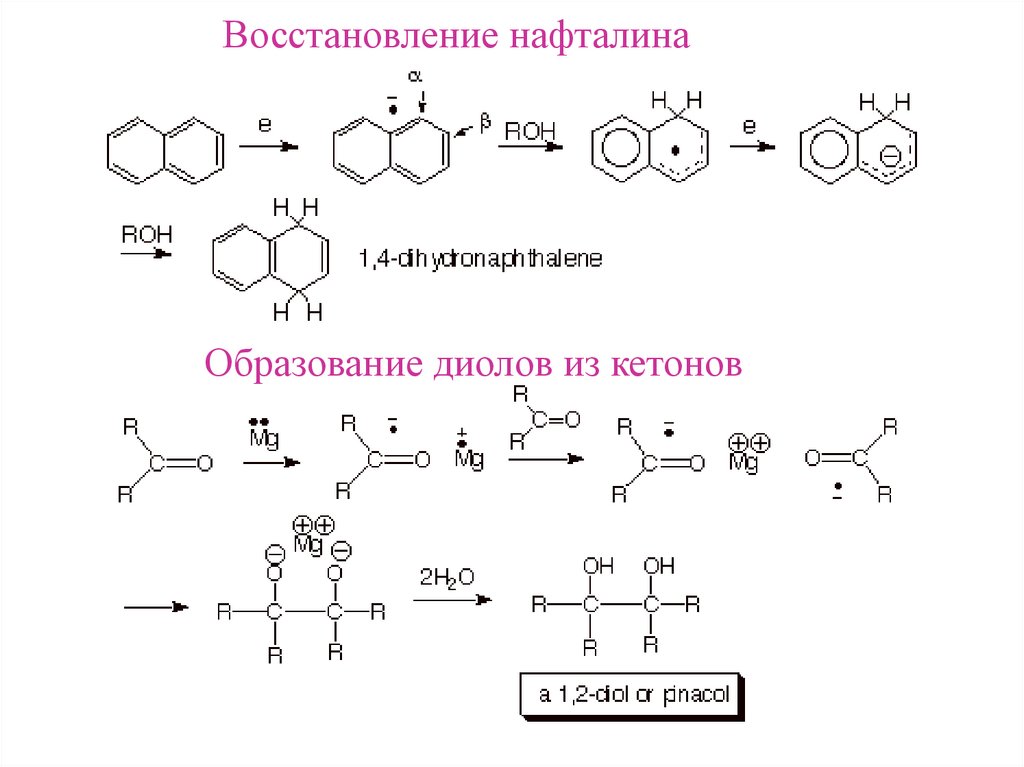
Восстановление нафталинаОбразование диолов из кетонов
4.
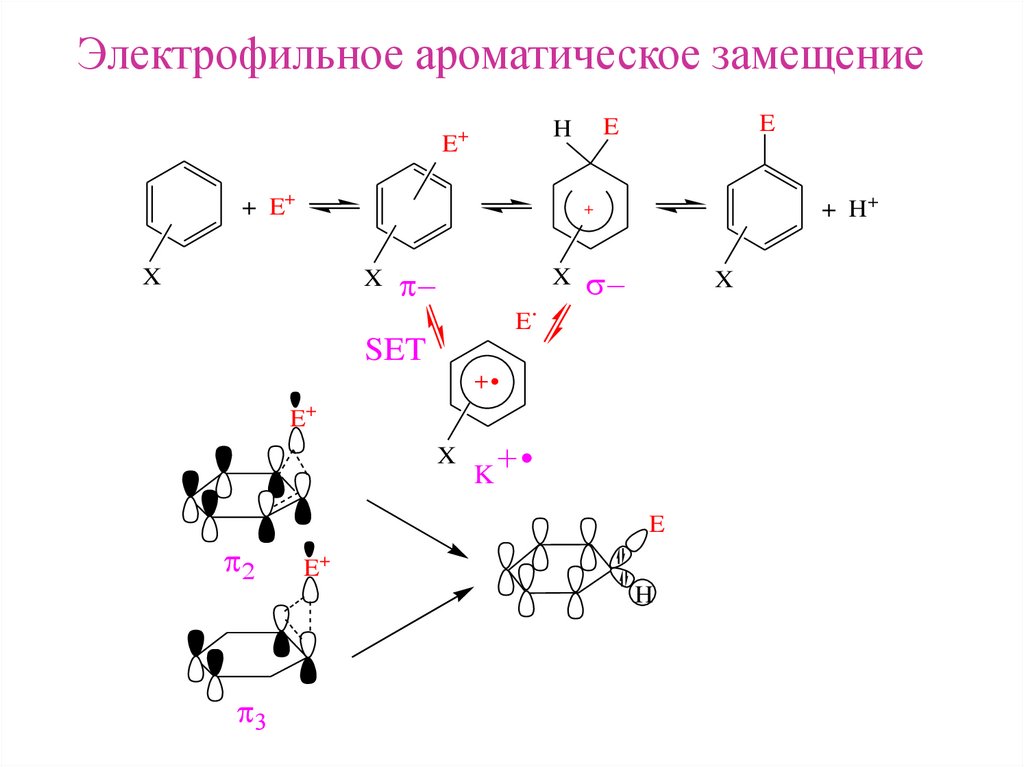
Электрофильное ароматическое замещение+ E+
E
E
H
E+
+ H+
+
X
X
X
E
.
X
SET
E+
X
K
E
E+
H
5.
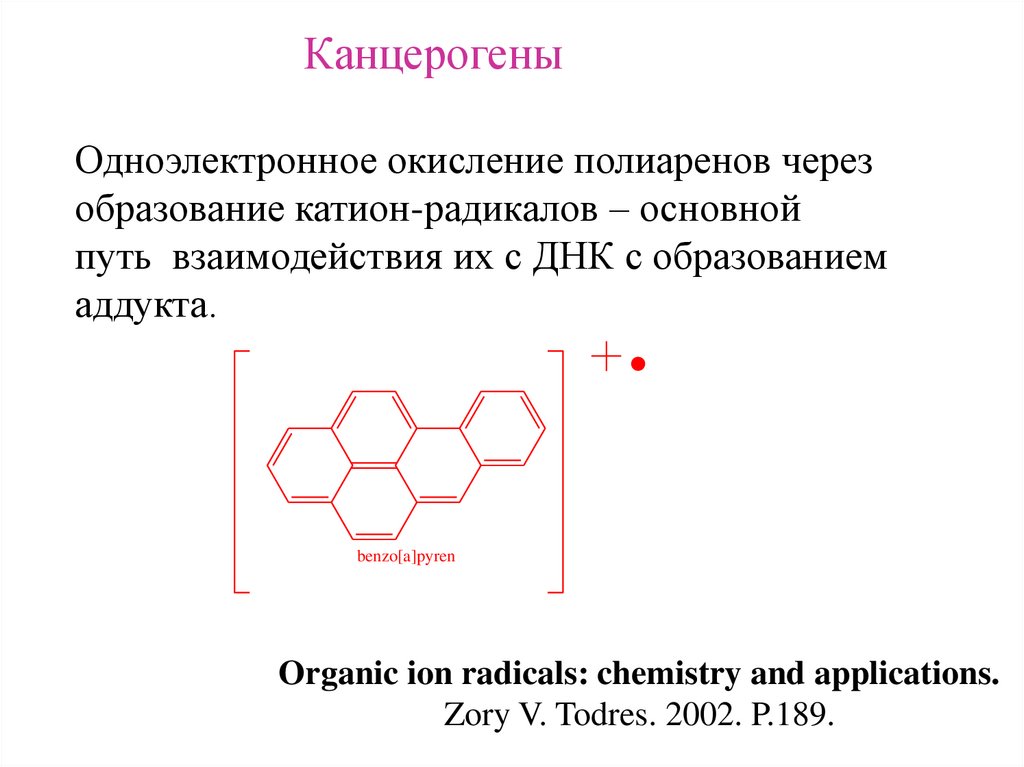
КанцерогеныОдноэлектронное окисление полиаренов через
образование катион-радикалов – основной
путь взаимодействия их с ДНК с образованием
аддукта.
benzo[a]pyren
Organic ion radicals: chemistry and applications.
Zory V. Todres. 2002. P.189.
6.
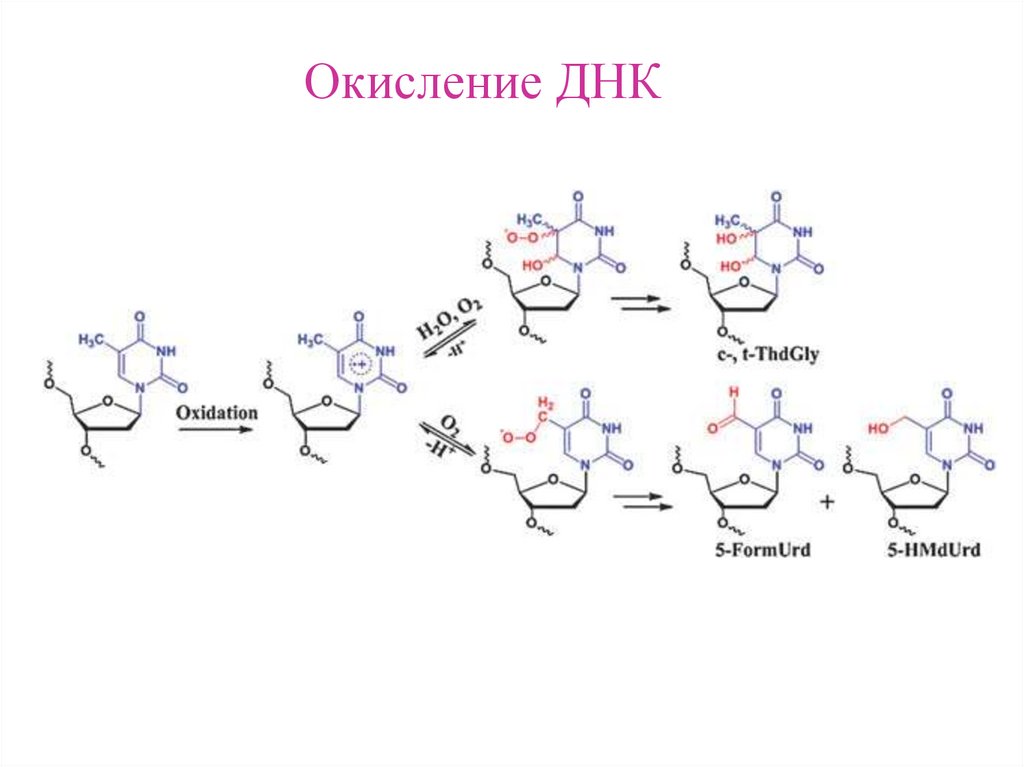
Окисление ДНК7.
Методы изучения ион-радикаловЭПР (t > 10 сек., струевая методика до 10 4)
Переходы удовлетворяют резонансу:
hn = gmHo
h – постоянная Планка
g – фактор (параметр, характерный для ион-радикала)
m магнитон Бора
Но – сила внешнего магнитного поля
Сверхтонкое взаимодействие между ядром
и неспаренным электроном вызывает сверхтонкое
расщепрение (сведения о структуре ион-радикала)
8.
2. Метод измерения магнитной восприимчивостиПозволяет определить концентрацию ион-радикалов
. ЯМР
Позволяет определить концентрацию ион-радикалов по
сдвигу сигналов
4. Метод ХПЯ
1) установление механизма реакции
2) природа радикальной пары
3) можно определить констаны скорости реакции
Метод ХПЯ более чувствителен, чем ЭПР
9.
5. ЭСПхарактеризует разницу энергий занятых
(или SOMO) и незанятых МО]
6. ИКС (сведения о строении ион-радикалов)
7. Электрохимические методы
1) Установление последовательности превращений
2) Определяет обратимость превращений
8. Масс-спектрометрия
Бомбардировка электронами (5-70 Ev), мало структурной
информации
10.
8. Фотоэлектронная спектроскопияВ газе: облучение фотонами с определенной
энергией (He(I)a 21.21ev).
Измеряется кинетическая энергия поглощаемых
электронов и определяется вертикальный
потенциал ионизации.
Iv = Ehn – Eкин.
Дает информацию об энергиях занятых МО.
11.
Ион-радикалы -доноровАлканы плохие акцепторы и доноры электронов
СН4
Ip, э.в.
12.61
С10 Н22
Ip, э.в.
9.65
Анион-радикалы алканов крайне неустойчивы,
их выход из простых алканов в 104 раз ниже,
чем сответствующих катион-радикалов
+e
AlkH
-
CH ,
CH2 ,
CH3 ,
-
C2H
12.
AlkH ионизируются в газе (Hea), но трудноокисляются в растворе
Техника матричной изоляции
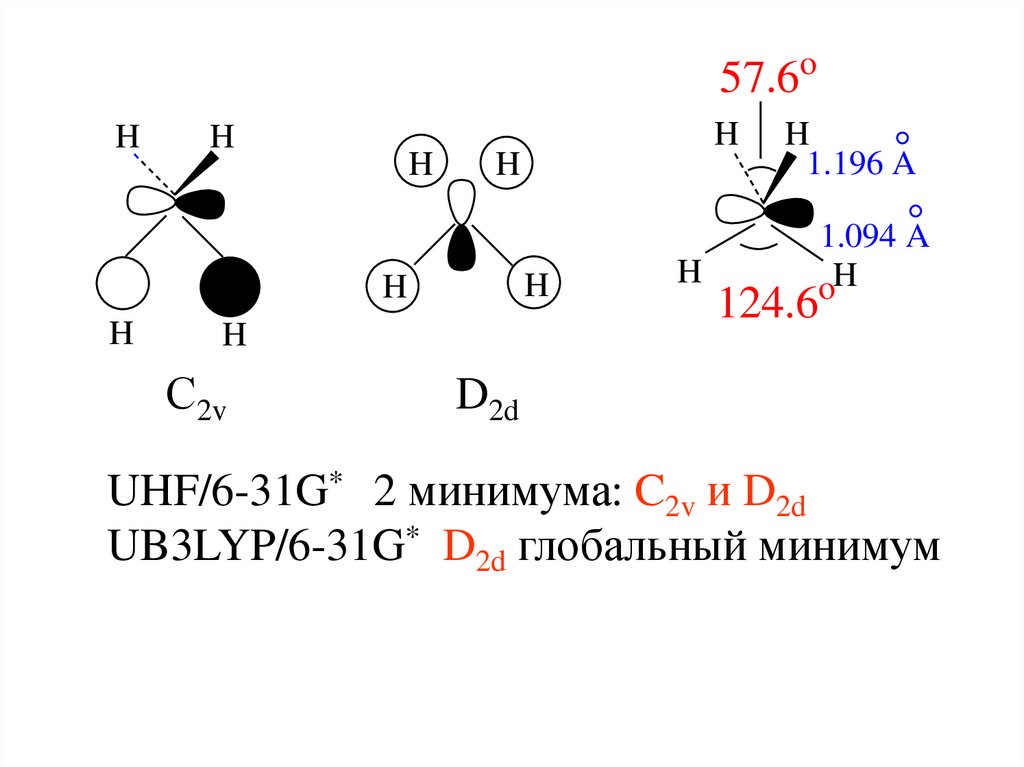
CH4
С2v, D2d
Обнаружен в космосе
aH = 5.48 mT
13.
57.6oH
H
H
H
H
H
H
H
С2v
H
H
H
1.196 A
1.094 A
oH
124.6
D2d
UHF/6-31G* 2 минимума: C2v и D2d
UB3LYP/6-31G* D2d глобальный минимум
14.
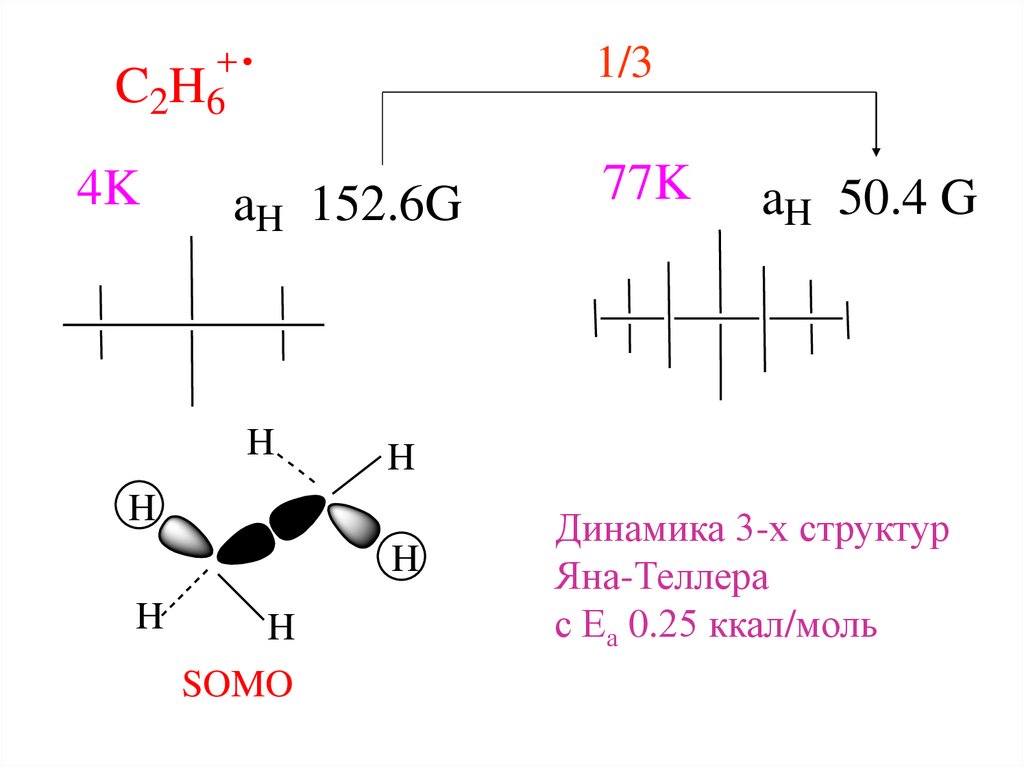
1/3C2H6
4K
aH 152.6G
H
H
H
SOMO
aH 50.4 G
H
H
H
77K
Динамика 3-х структур
Яна-Теллера
с Еа 0.25 ккал/моль
15.
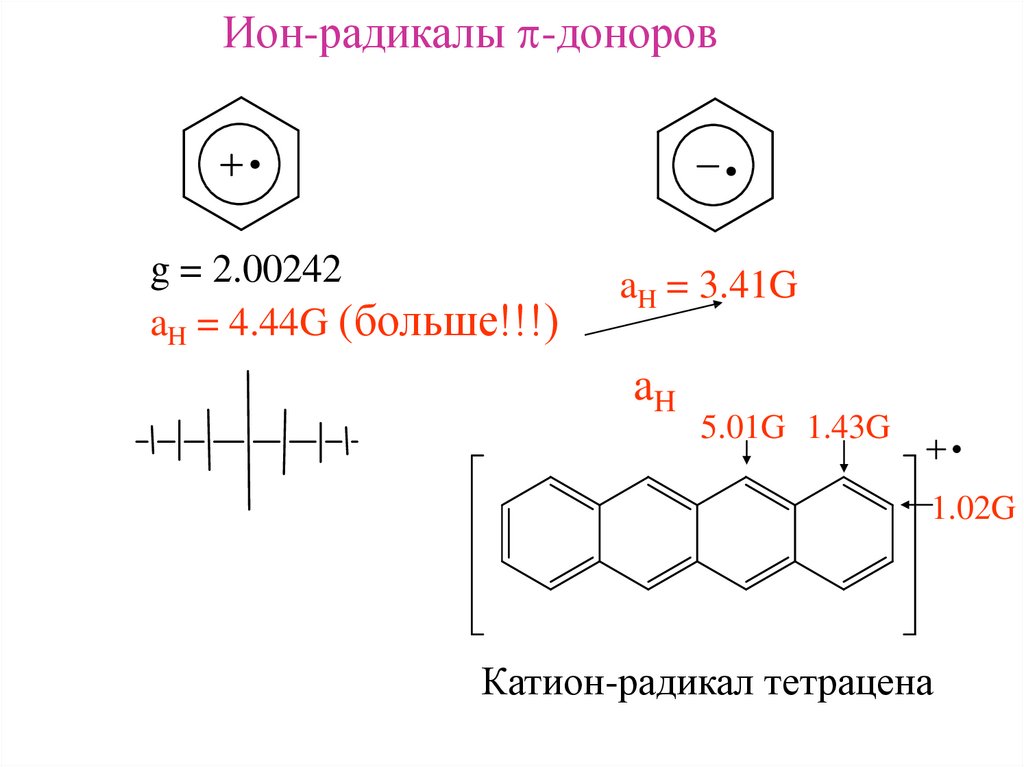
Ион-радикалы -доноровg = 2.00242
aH = 4.44G (больше!!!)
aH = 3.41G
aH
5.01G 1.43G
1.02G
Катион-радикал тетрацена
16.
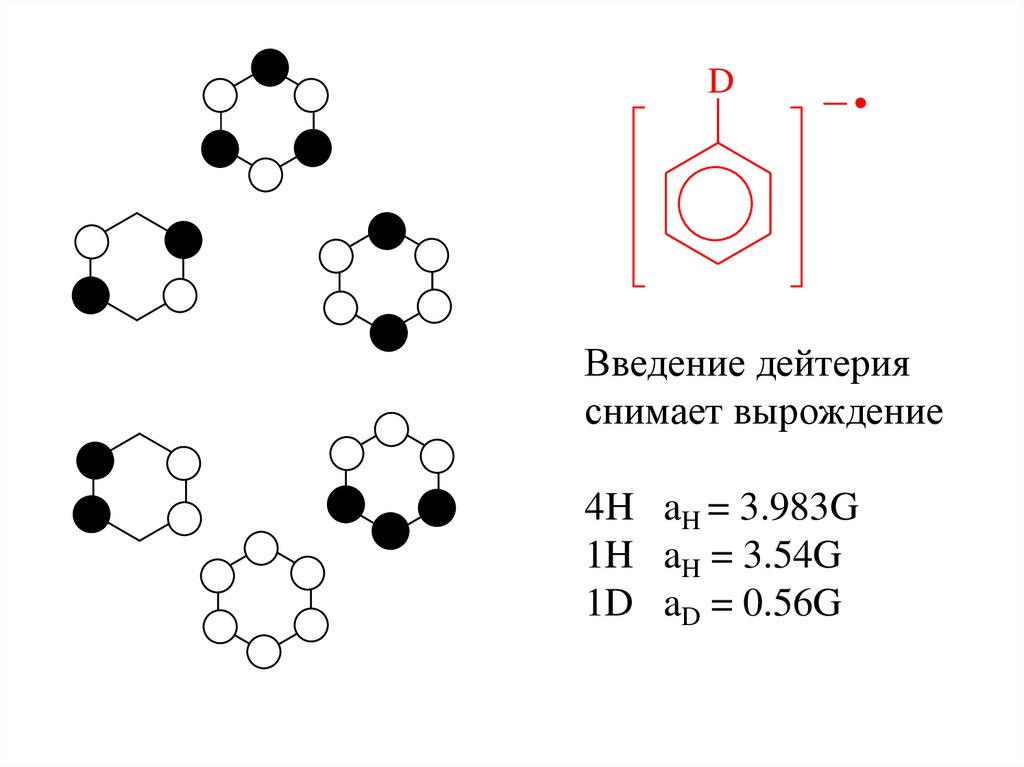
DВведение дейтерия
снимает вырождение
4H aH = 3.983G
1H aH = 3.54G
1D aD = 0.56G
17.
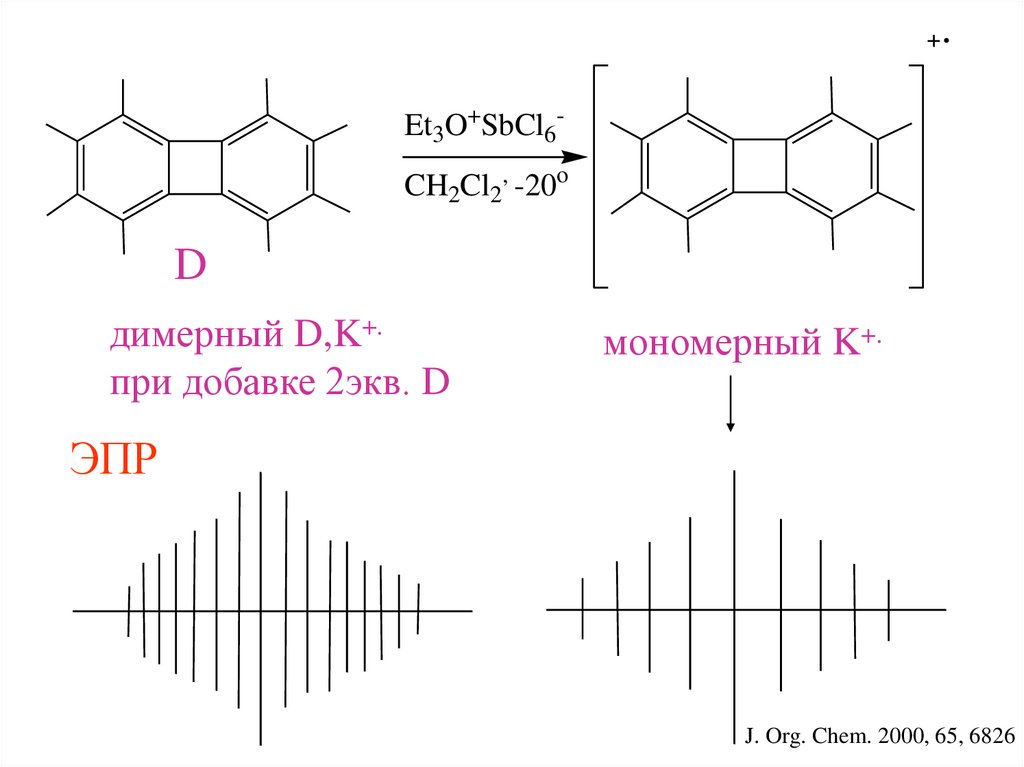
Et3O+SbCl6CH2Cl2, -20oD
димерный D,K+.
при добавке 2экв. D
мономерный K+.
ЭПР
J. Org. Chem. 2000, 65, 6826
18.
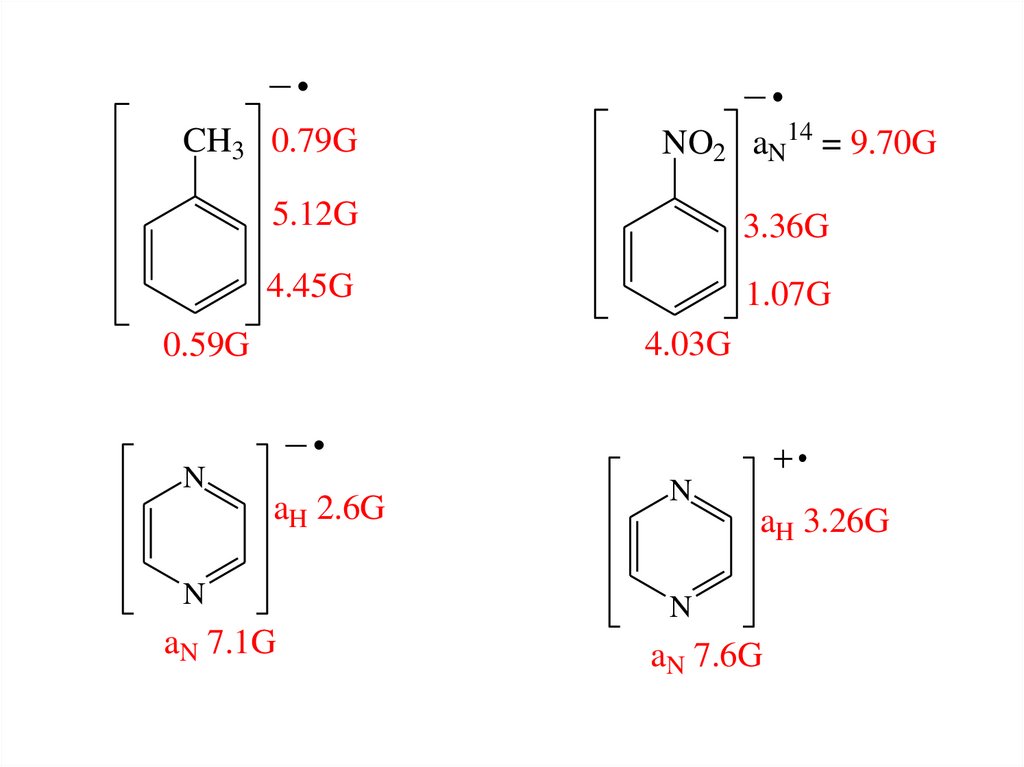
CH3 0.79GNO2 aN14 = 9.70G
5.12G
3.36G
4.45G
1.07G
4.03G
0.59G
N
aH 2.6G
N
aN 7.1G
N
aH 3.26G
N
aN 7.6G
19.
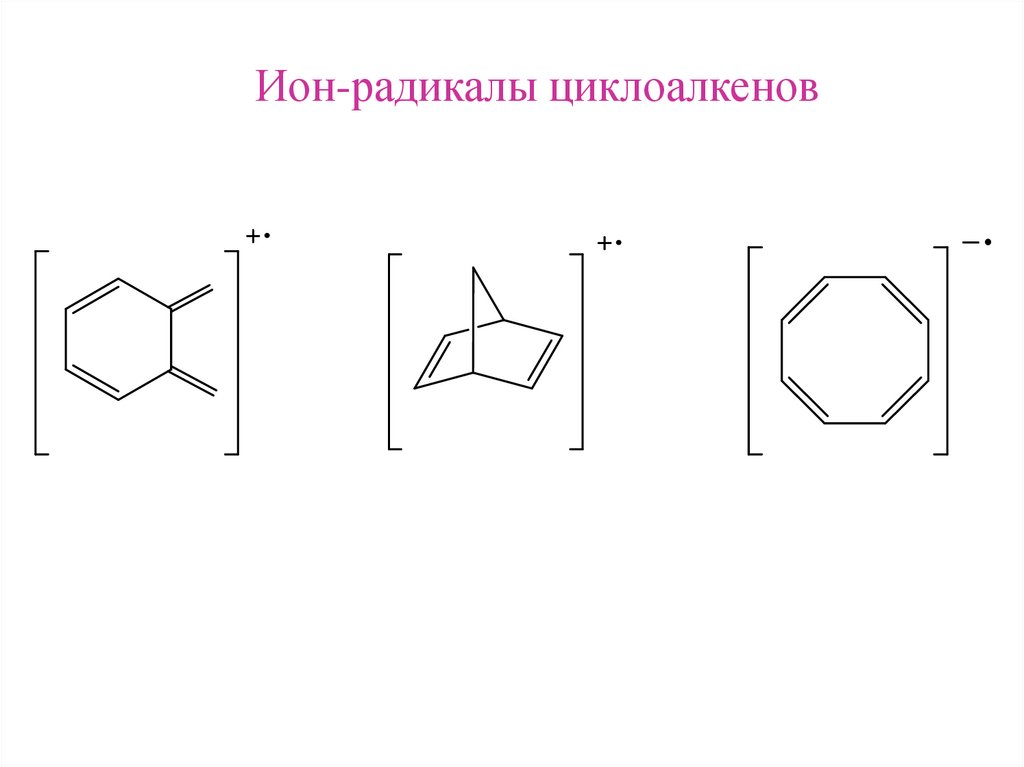
Ион-радикалы циклоалкенов20.
Ион-радикалы n-доноровN
aH 7.34G
N
(CH2)n (CH2)n (CH2)n
N
aN 16.96G
N
O
O
21.
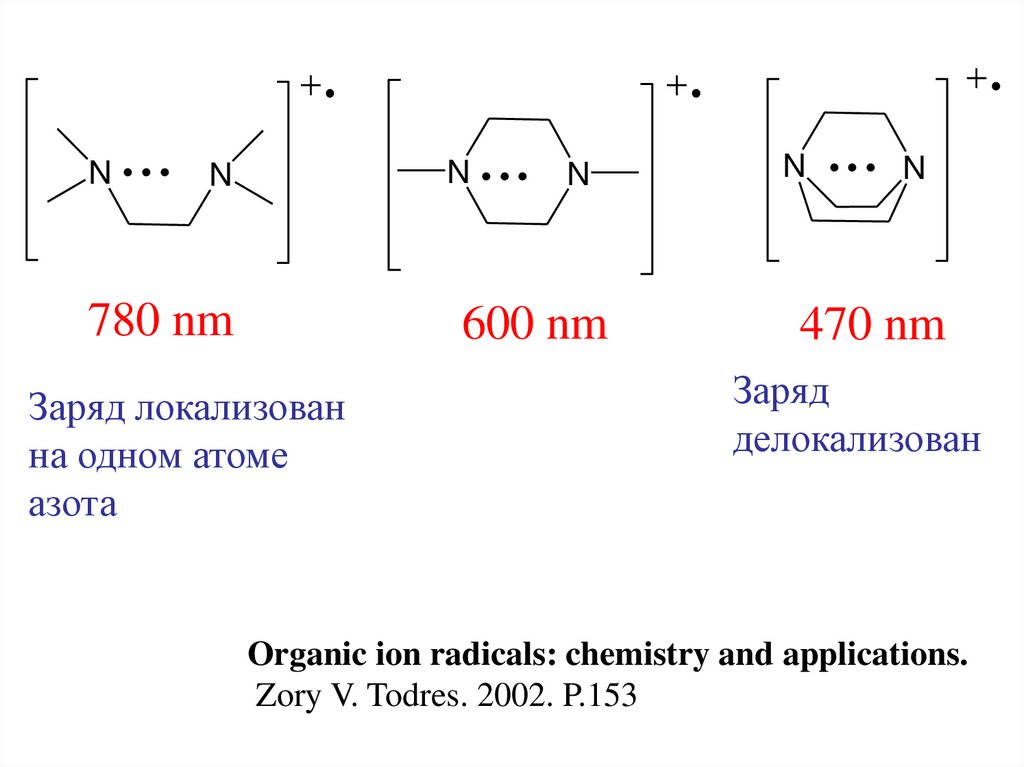
N...
N
N
780 nm
...
N
600 nm
Заряд локализован
на одном атоме
азота
N
...
N
470 nm
Заряд
делокализован
Organic ion radicals: chemistry and applications.
Zory V. Todres. 2002. P.153
22.
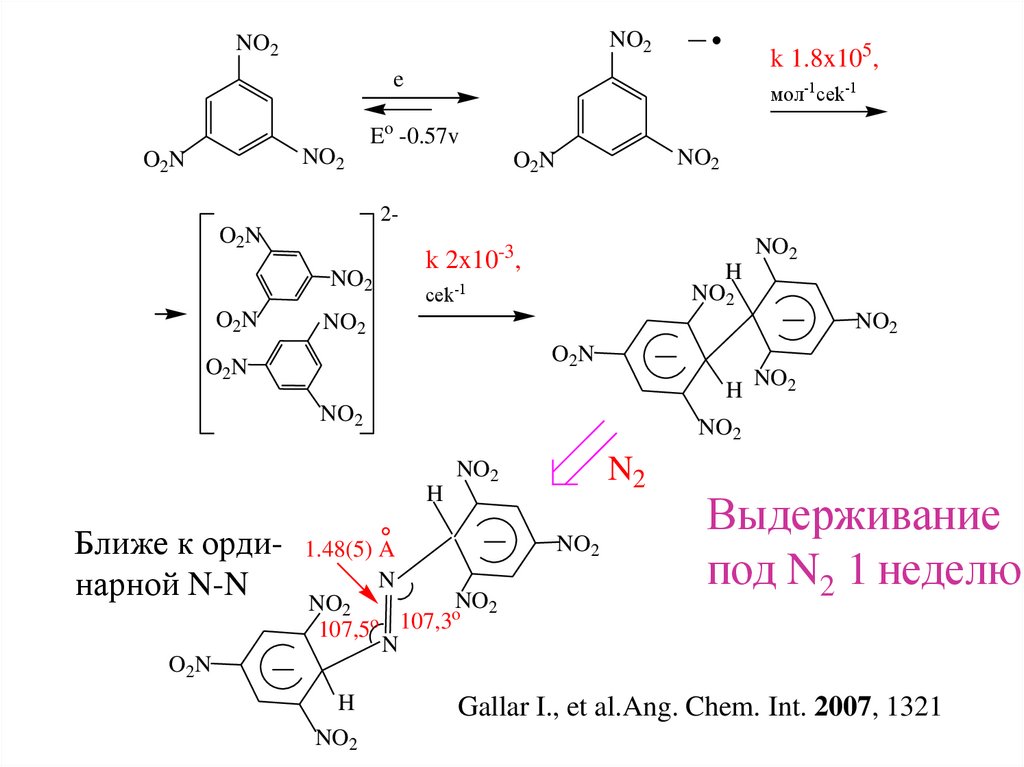
NO2NO2
k 1.8x105,
e
мол-1cek-1
Eo -0.57v
NO2
O 2N
NO2
O 2N
2-
O 2N
NO2
O2 N
NO2
k 2x10-3,
H
NO2
-1
cek
NO2
NO2
O 2N
O2 N
H
NO2
NO2
N2
NO2
H
Ближе к ординарной N-N
O 2N
1.48(5) A
N
NO2
NO2
o
107,5o 107,3
N
H
NO2
NO2
NO2
Выдерживание
под N2 1 неделю
Gallar I., et al.Ang. Chem. Int. 2007, 1321








 chemistry
chemistry