Similar presentations:
Основы химической кинетики
1.
Основы химическойкинетики
и
1
Доцент кафедры химии
биохимии ЧГМА , к.б.н.,
Бондаревич Е.А.
2. ПЛАН
21. Классификация химических реакций
2. Скорость химической реакции
3. Закон действующих масс. Порядок реакции
и молекулярность
4. Влияние
температуры
на
скорость
химической реакции. Правило Вант-Гоффа
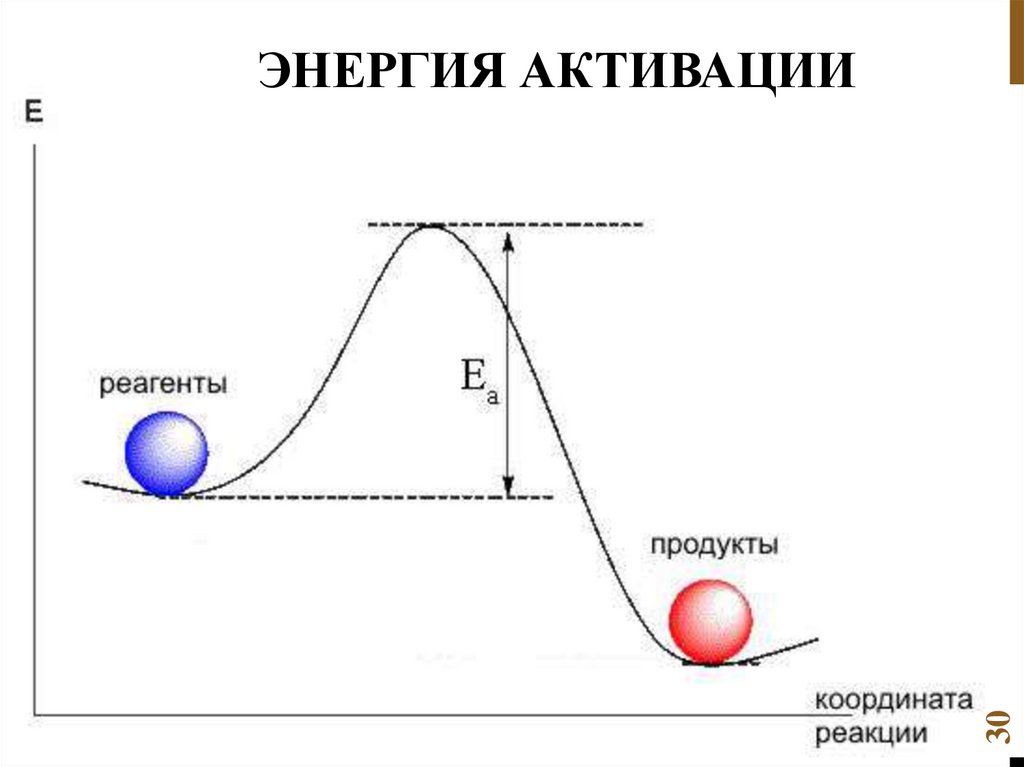
5. Энергия активации. Уравнение Аррениуса
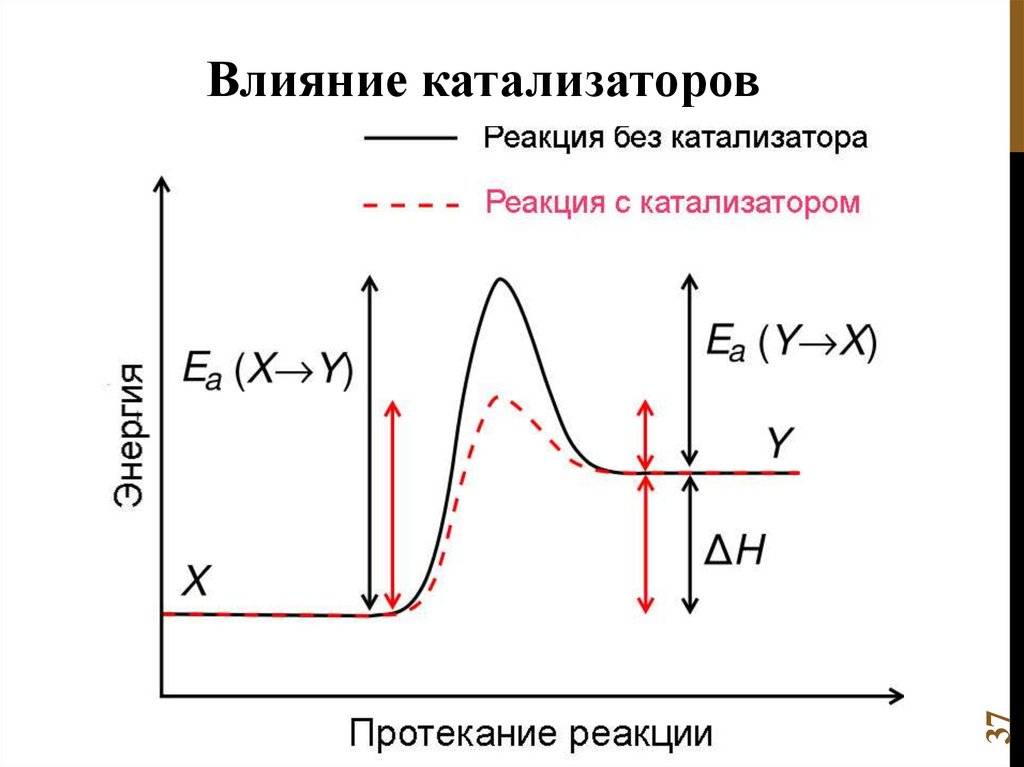
6. Катализ
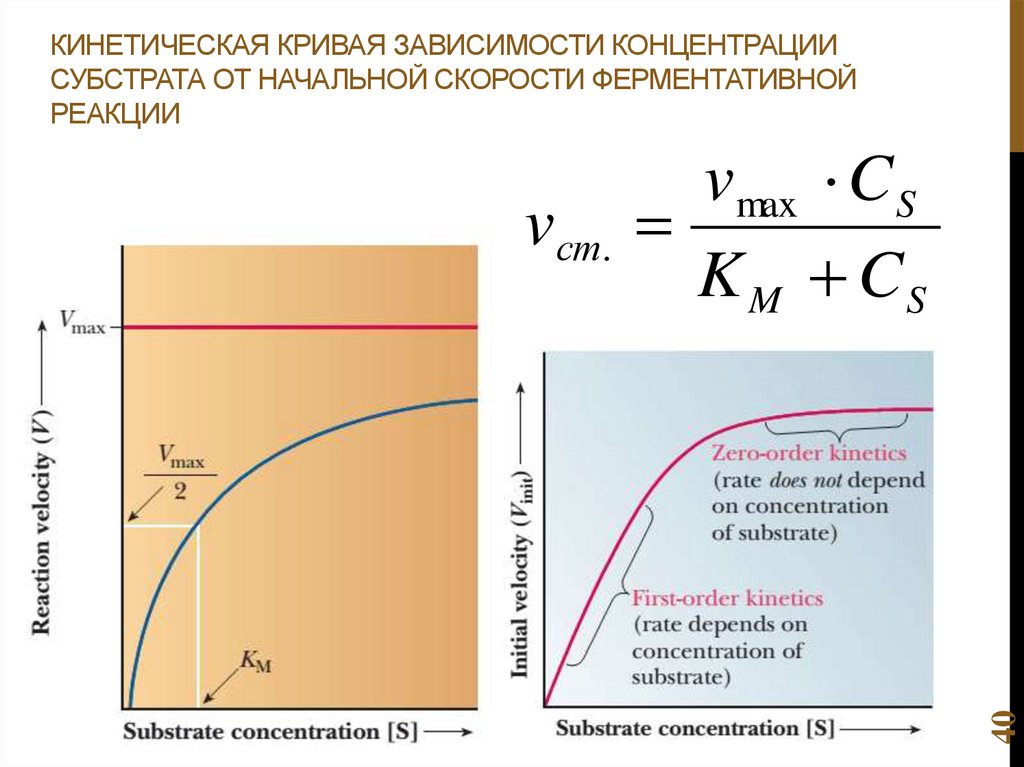
7. Ферменты
3.
ХИМИЧЕСКАЯ КИНЕТИКА – (от греч. κίνησις –движущий) - наука о скоростях и закономерностях
протекания химических процессов во времени.
Предметом изучения химической кинетики
являются:
1. Скорость хим. реакций (СХР);
2. Факторы, влияющие на СХР;
3. Пути и закономерности протекания химических
процессов во времени.
4. Классификация реакций по механизму
КЛАССИФИКАЦИЯ РЕАКЦИЙ ПОМЕХАНИЗМУ
Простые реакции протекают в одну стадию в
соответствии со стехиометрическим уравнением. Такие
реакции довольно редки:
I2 → 2I
Сложные реакции – это совокупность нескольких
простых. Каждая стадия сложной реакции может быть
описана простой реакцией. Самая длительная стадия
называется лимитирующей.
4
1 стадия) HI + H2O2 HIО + H2O
2 стадия) HI + HIО I2 + H2O
суммарная реакция: 2HI + H2O2 I2 + 2H2O
5. Классификация химических реакций
КЛАССИФИКАЦИЯ ХИМИЧЕСКИХРЕАКЦИЙ
Гомогенные- реакции в которых
реагенты
находятся
в
одном
агрегатном состоянии;
Гетерогенные- реакции в которых
реагенты находятся в различных
агрегатных состояниях.
5
6. Скорость химической реакции
СКОРОСТЬ ХИМИЧЕСКОЙРЕАКЦИИ
6
Под скоростью химической реакции
понимается число элементарных актов
взаимодействия реагентов в единицу
времени, сек., мин., час, в единице
объема – мл, литр, м3
- для
гомогенных реакций или на единице
поверхности.
7. Скорость химической реакции
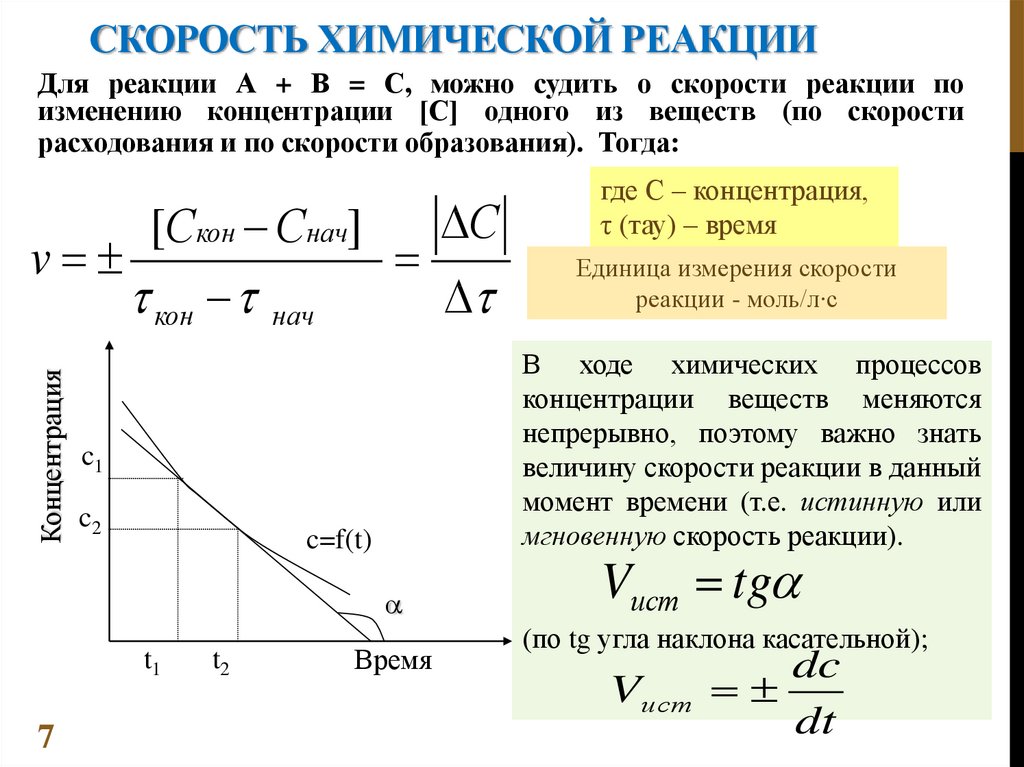
СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИДля реакции А + В = С, можно судить о скорости реакции по
изменению концентрации [С] одного из веществ (по скорости
расходования и по скорости образования). Тогда:
Концентрация
С
[Скон Снач]
v
кон нач
c=f(t)
t1
7
t2
Единица измерения скорости
реакции - моль/л∙с
В ходе химических процессов
концентрации веществ меняются
непрерывно, поэтому важно знать
величину скорости реакции в данный
момент времени (т.е. истинную или
мгновенную скорость реакции).
c1
c2
где С – концентрация,
τ (тау) – время
Время
Vист tg
(по tg угла наклона касательной);
Vист
dc
dt
8.
8Изменение концентрации исходных веществ и продуктов
реакции в зависимости от времени
9.
Факторы, влияющие на скоростьхимических реакций:
природа реагирующих веществ;
концентрация реагирующих веществ;
температура;
катализатор;
9
Для гетерогенных реакций:
величина поверхности раздела;
скорость диффузии
реагентов в зону реакции и
продуктов реакции из этой зоны.
10.
Природа реагентовТемпература
S поверхности соприкосновения
10
Концентрация
11.
Закон действующих масс1865 г Н.Н. Бекетов (Российская Империя) и 1867 г К.М. Гульдберг и
П. Вааге (Норвегия)
Скорость гомогенных реакций зависит от числа встреч молекул
реагирующих веществ в единицу времени в единице объема.
Число соударений тем больше, чем выше концентрация каждого
из исходных веществ.
аА + bB = продукты
m
n
v kc ( A)c ( B)
11
где с(А) и с(В) – молярные концентрации реагирующих
веществ; k – константа скорости реакции.
m и n - эмпирические коэффициенты, не обязательно
совпадающие со стехиометрическими коэффициентами a и
b. (m+n) – определяет полный (суммарный) порядок
кинетического уравнения химической реакции.
12.
Для простых (элементарных) реакций показателистепени совпадает со стехиометрическими
коэффициентами:
Н+ + ОН- = Н2О
v k H
OH
12
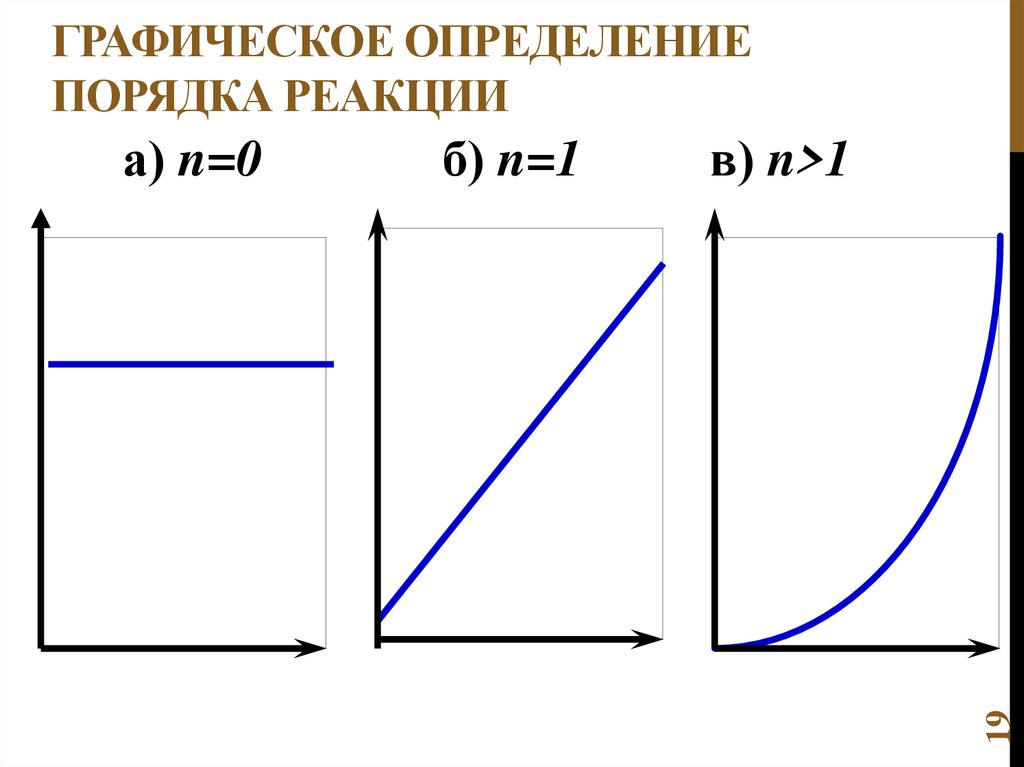
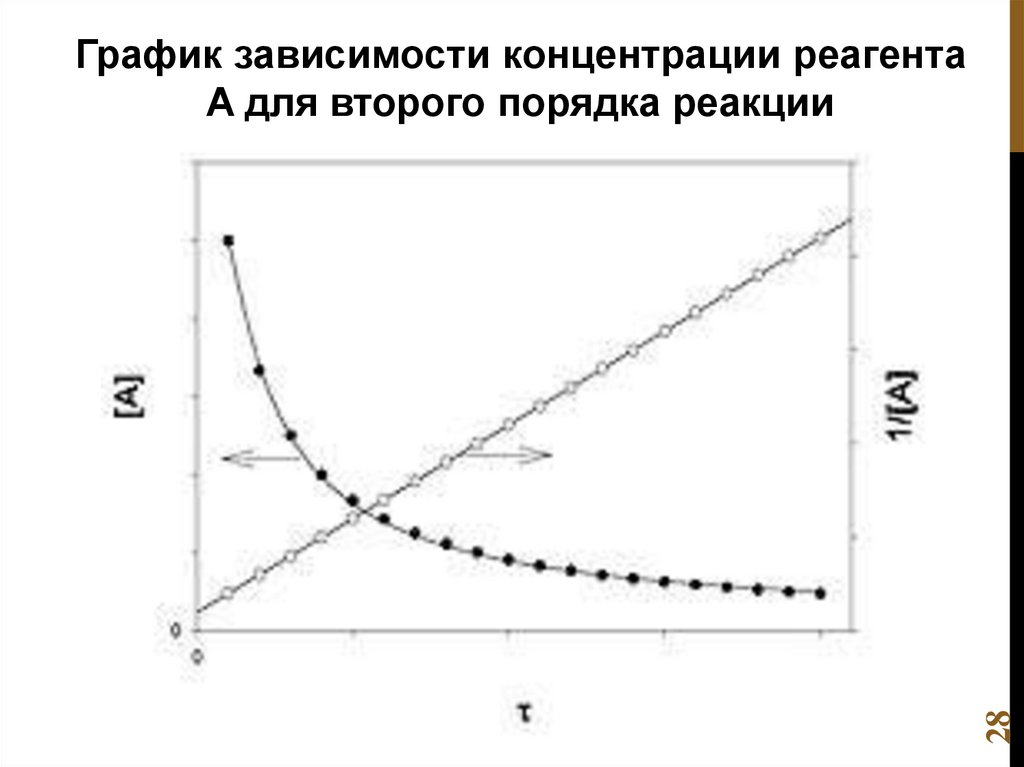
Реакция второго порядка
13.
Порядок реакции для сложных реакций:2 N2O5(г.) → 4 NO2(г.) + O2(г.)
v k N 2O5
1
реакция первого порядка
Гетерогенная реакция
S (тв.) + O2 (г.) → SO2 (г.)
v k O2
13
реакция первого порядка
14.
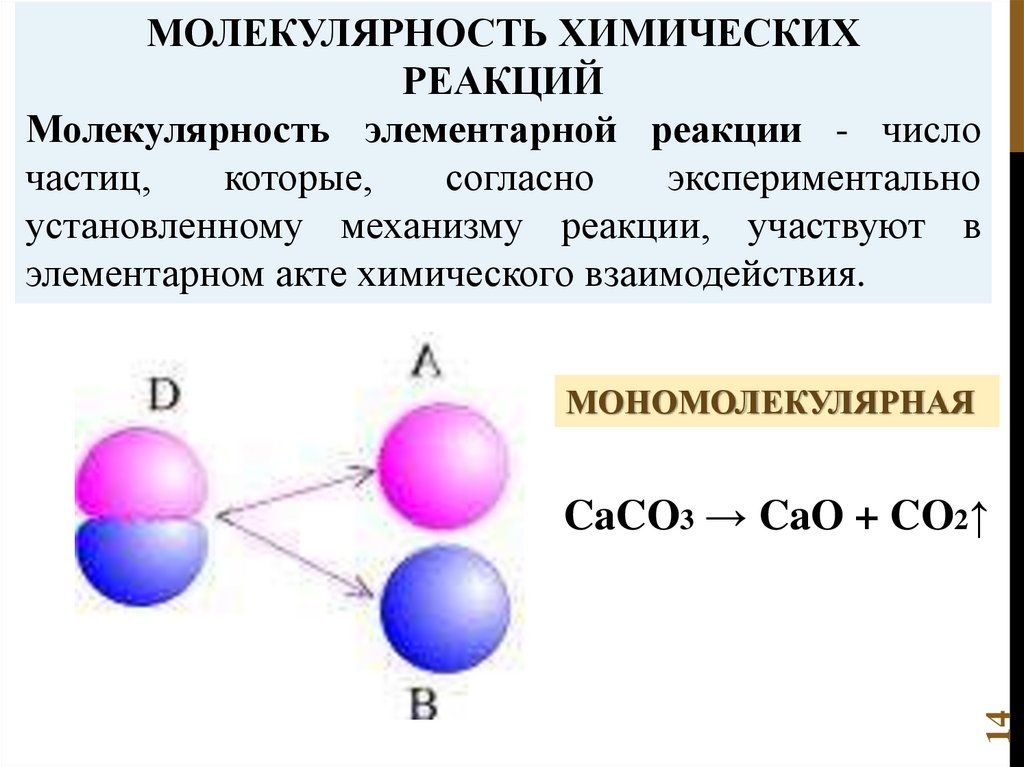
МОЛЕКУЛЯРНОСТЬ ХИМИЧЕСКИХРЕАКЦИЙ
Молекулярность элементарной реакции - число
частиц,
которые,
согласно
экспериментально
установленному механизму реакции, участвуют в
элементарном акте химического взаимодействия.
МОНОМОЛЕКУЛЯРНАЯ
14
CaCO3 → CaO + CO2↑
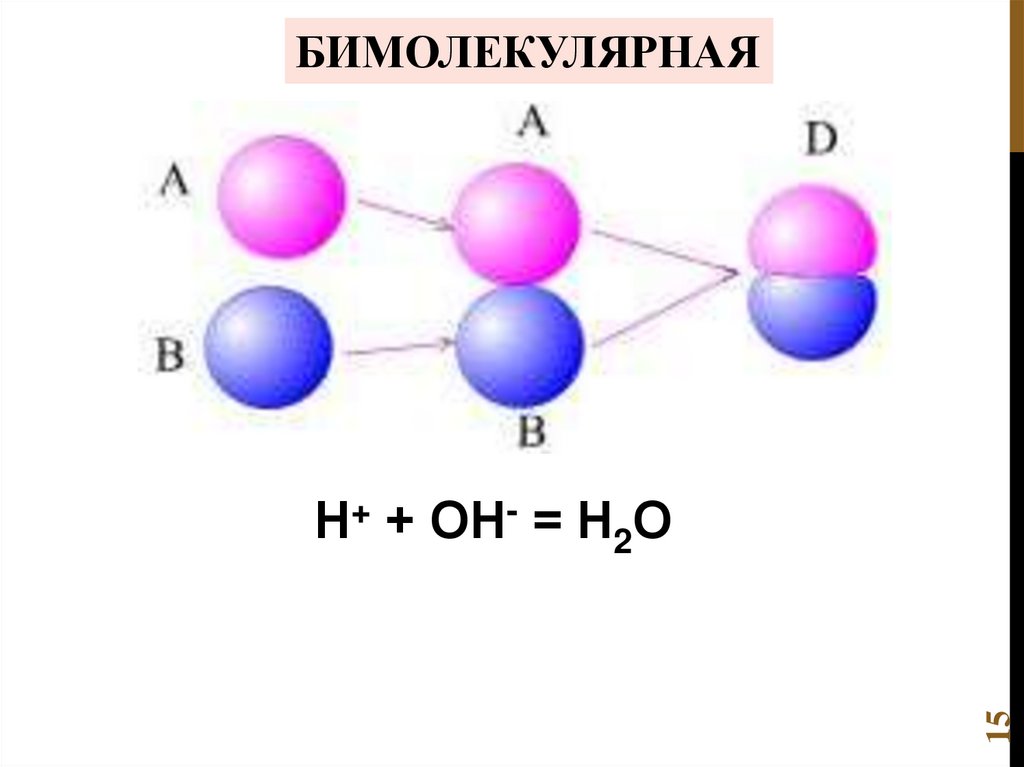
15.
БИМОЛЕКУЛЯРНАЯ15
Н+ + ОН- = Н2О
16.
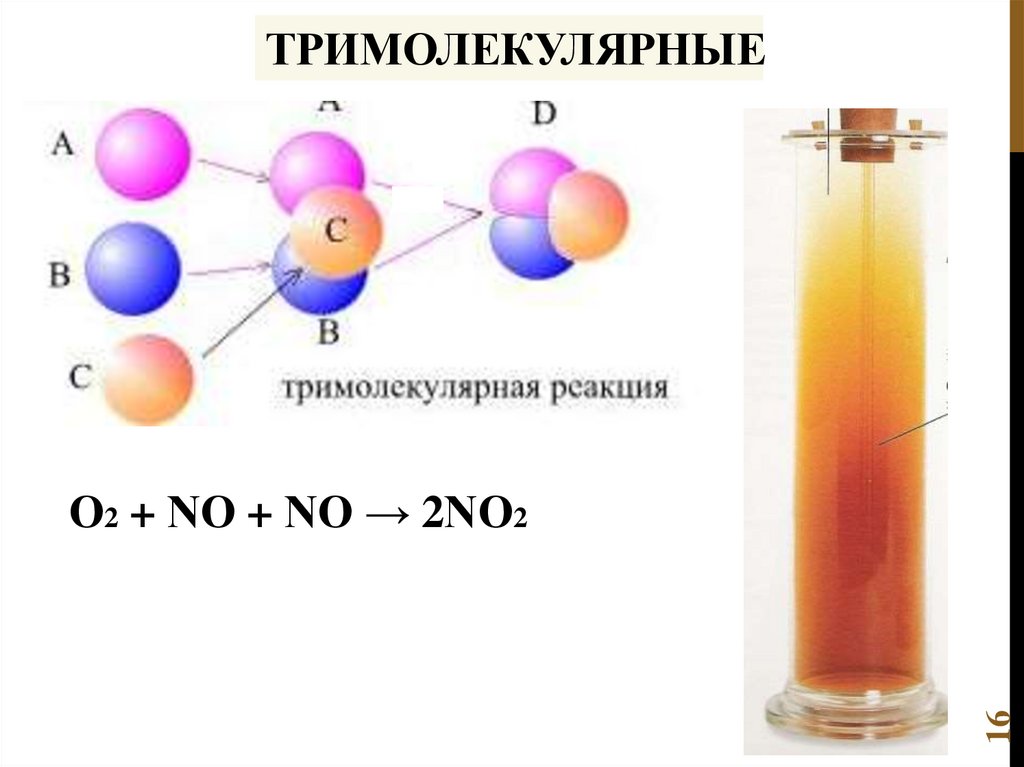
ТРИМОЛЕКУЛЯРНЫЕ16
О2 + NО + NО → 2NО2
17.
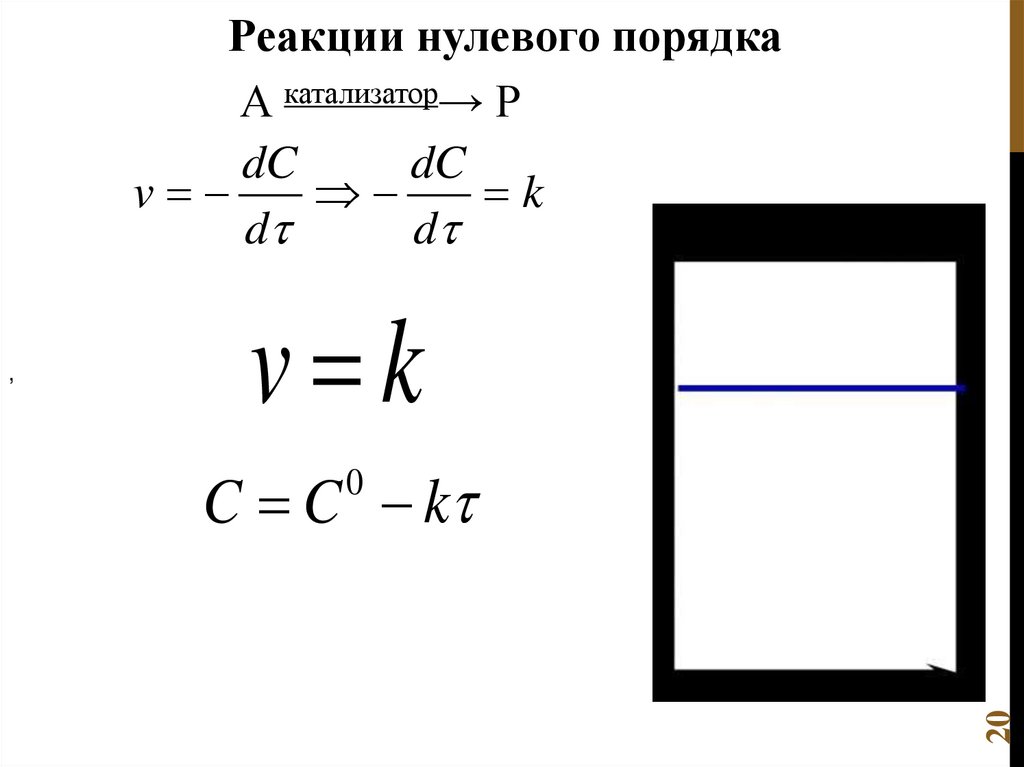
Константа скорости реакцииdC
( m n)
kC
d
Где С – концентрация,
промежуток времени τ.
через
определенный
17
−





























 chemistry
chemistry








