Similar presentations:
Биохимия, наука о химических основах жизнедеятельности
1. БИОХИМИЯ наука о химических основах жизнедеятельности
1.Статическая2.Динамическая
3.функциональная
2. Объект исследования и разделы
БиохимияБиохимия
растений
микроорганизмов
Биохимия животных
Биохимия человека
3.
Биохимия человекаЭволюционная
Космическая
Фармацевтическая
всасывание лекарств, их биотрансформация,
обезвреживание
Клиническая
биохимия
Скрининг, диагностика, мониторинг,
эффективность лечения
Медицинская энзимология
энзимопатология (фенилкетонурия)
энзимодиагностика (АЛТ АСТ)
энзимотерапия (мезим, пензитал,пепсин)
4.
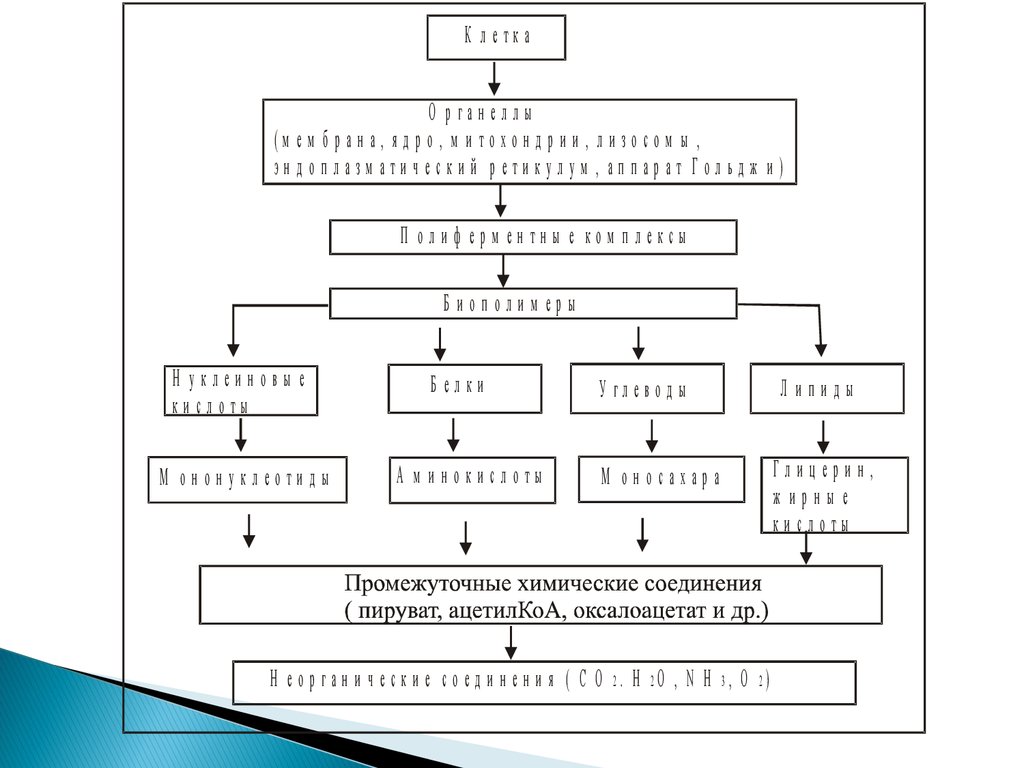
К леткаО рганеллы
(м ем б р ан а, я д р о , м и то хо н д р и и , л и зо со м ы ,
эн д о п л азм ати ч еск и й р ети кул ум , ап п ар ат Гол ьд ж и )
П ол и ф ерм ен тн ы е ком п лексы
Б иополим еры
Н уклеиновы е
ки слоты
М он он уклеоти д ы
Белки
А м инокислоты
У гл е в о д ы
Л ипиды
М оносахара
Глицерин,
ж ирны е
ки слоты
Н е о р г а н и ч е с к и е с о е д и н е н и я ( С О 2. Н 2О , N Н 3, О 2)
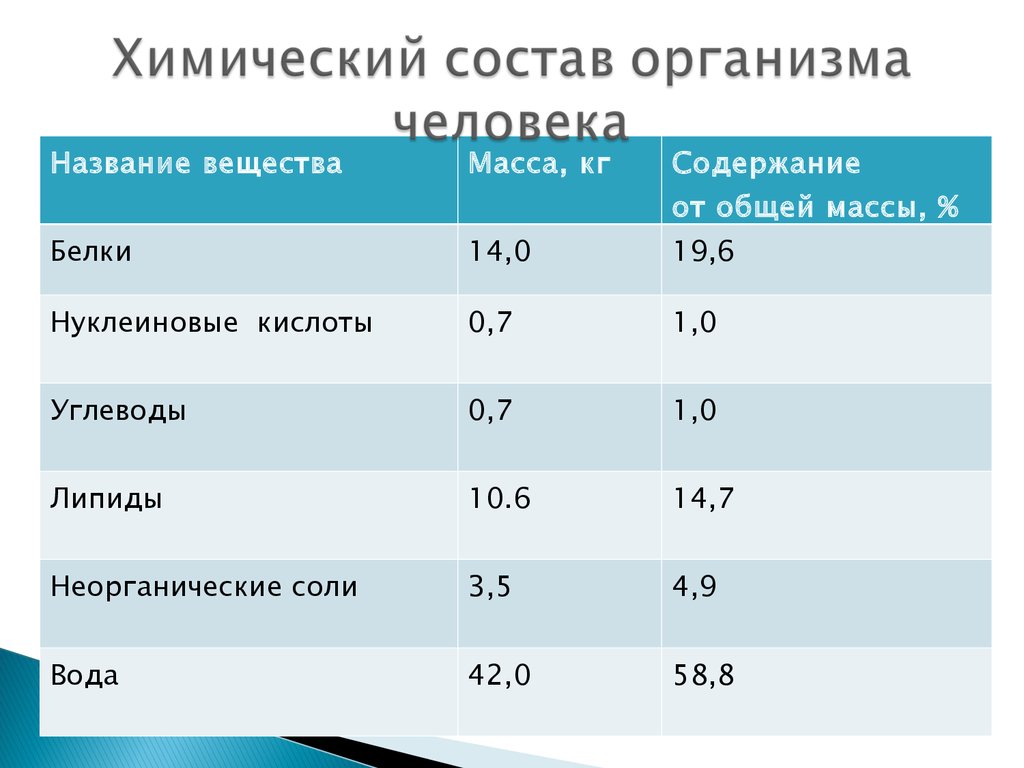
5. Химический состав организма человека
Название веществаМасса, кг
Содержание
от общей массы, %
Белки
14,0
19,6
Нуклеиновые кислоты
0,7
1,0
Углеводы
0,7
1,0
Липиды
10.6
14,7
Неорганические соли
3,5
4,9
Вода
42,0
58,8
6. Функции белков
Структурная (пластическая)Регуляторная
(ферменты, гормоны)
Генетическая
Транспортная
Защитная
Энергетическая
Депонирующая (запас и питание)
Сократительная и двигательная
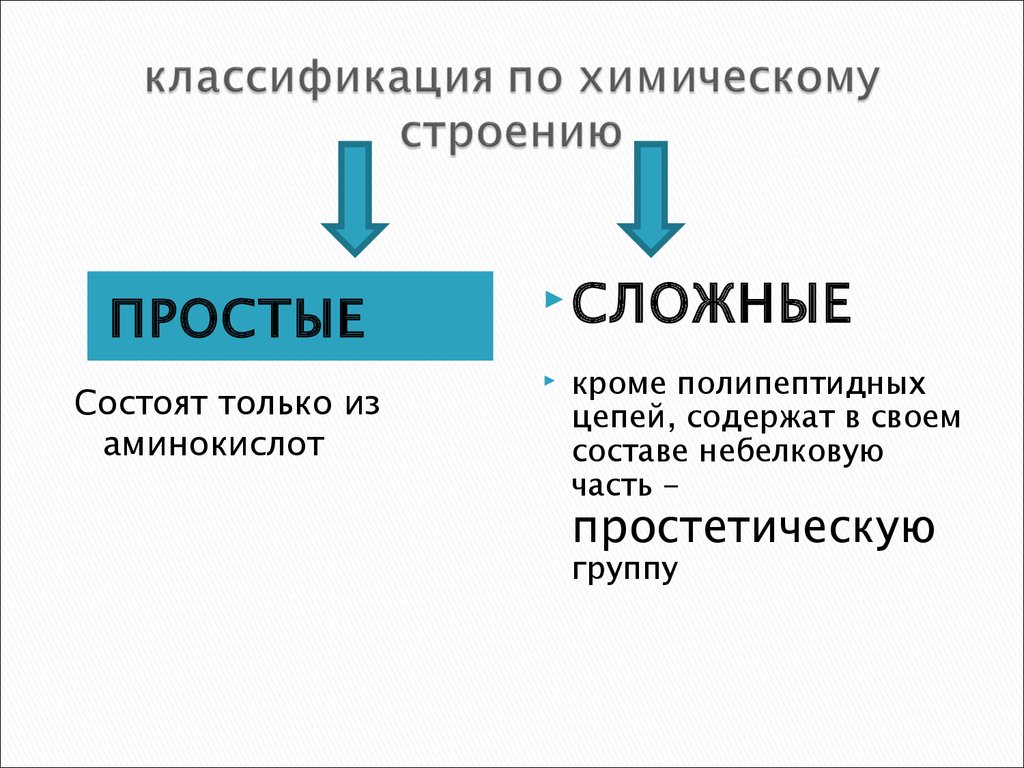
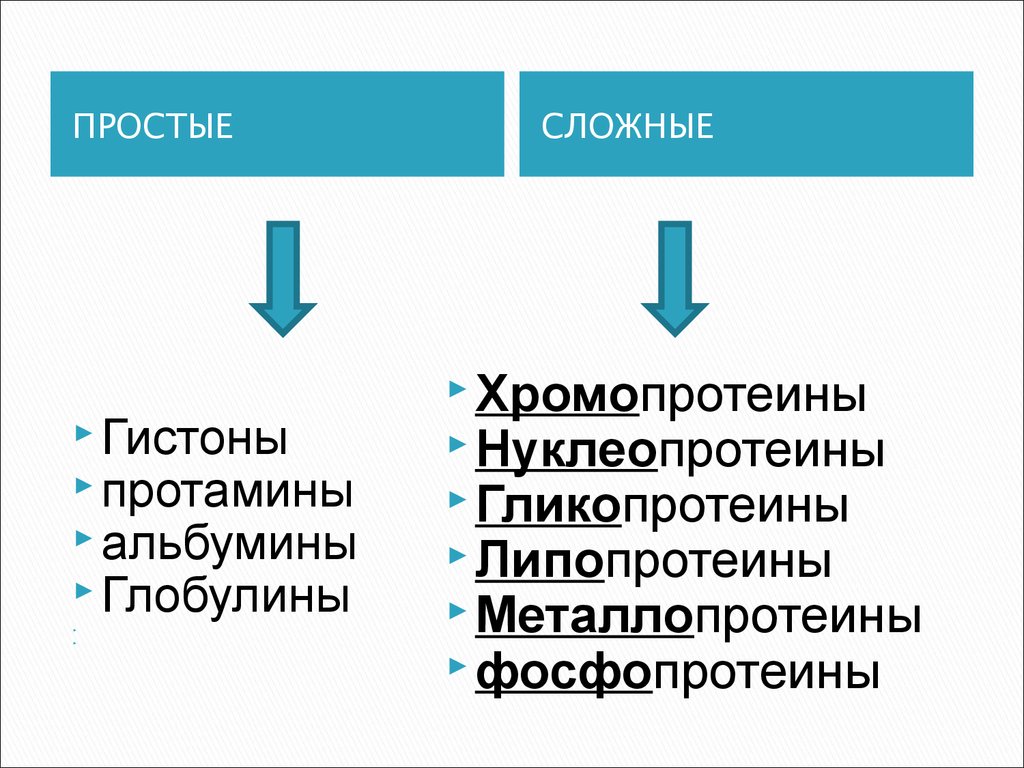
7. классификация по химическому строению
ПРОСТЫЕСостоят только из
аминокислот
СЛОЖНЫЕ
кроме полипептидных
цепей, содержат в своем
составе небелковую
часть -
простетическую
группу
8.
ПРОСТЫЕГистоны
протамины
альбумины
Глобулины
СЛОЖНЫЕ
Хромопротеины
Нуклеопротеины
Гликопротеины
Липопротеины
Металлопротеины
фосфопротеины
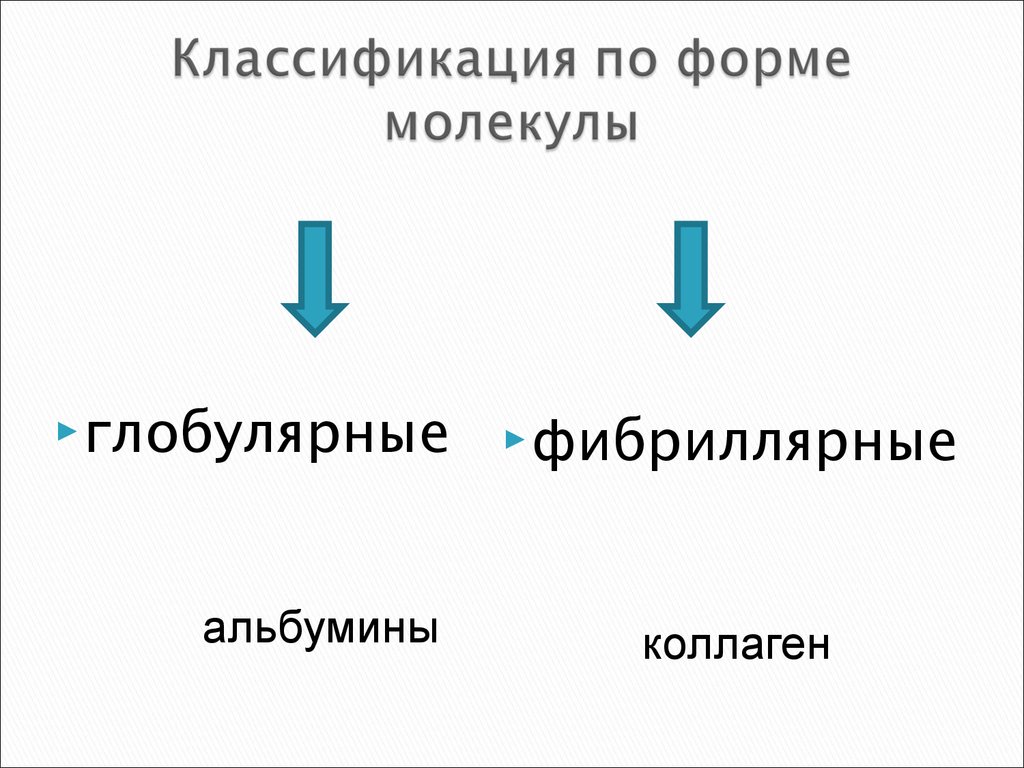
9. Классификация по форме молекулы
глобулярныеальбумины
фибриллярные
коллаген
10. Классификация по функциональному (биологическому) признаку
СократительныеТранспортные
Ферменты
гормоны
11. Классификация по молекулярной массе
Пептидыдо 10 а.к. ММ 1000Да
Олигопептиды
40 а.к. ММ 1000-4000 да
Белки
40 а.к. ММ до 2000 000 Да
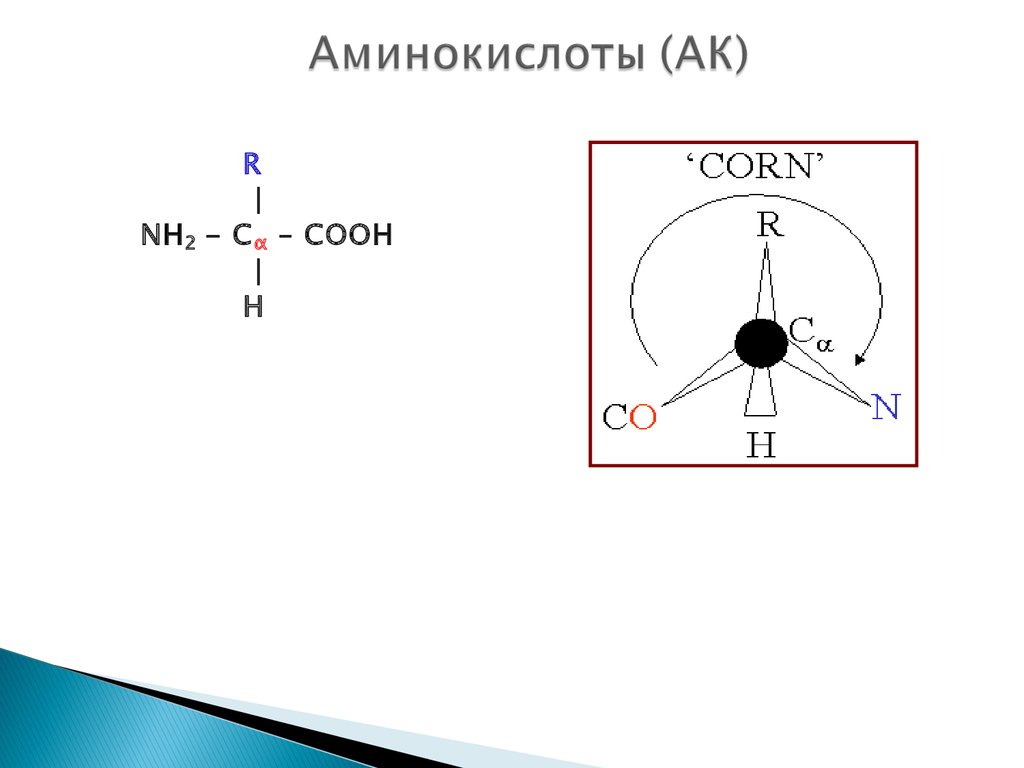
12. Аминокислоты (АК)
R|
NH 2 - C α – COOH
|
H
13.
АМИНОКИСЛОТЫR-CН-CООН
NH2
1.Аминокислоты входящие в состав -20
2.Модифицированные
аминокислоты
оксилизин, оксипролин
3.Аминокислоты
в
свободном
виде,
используются для синтеза углеводов и
жиров
4. Редкие аминокислоты встраивающиеся в
процессе трансляции:
Формилметионин (прокариоты)
Селеноцистеин (в процессе синтеза
белка на рибосоме)
Пирролизин (бактерии -синтез метана).
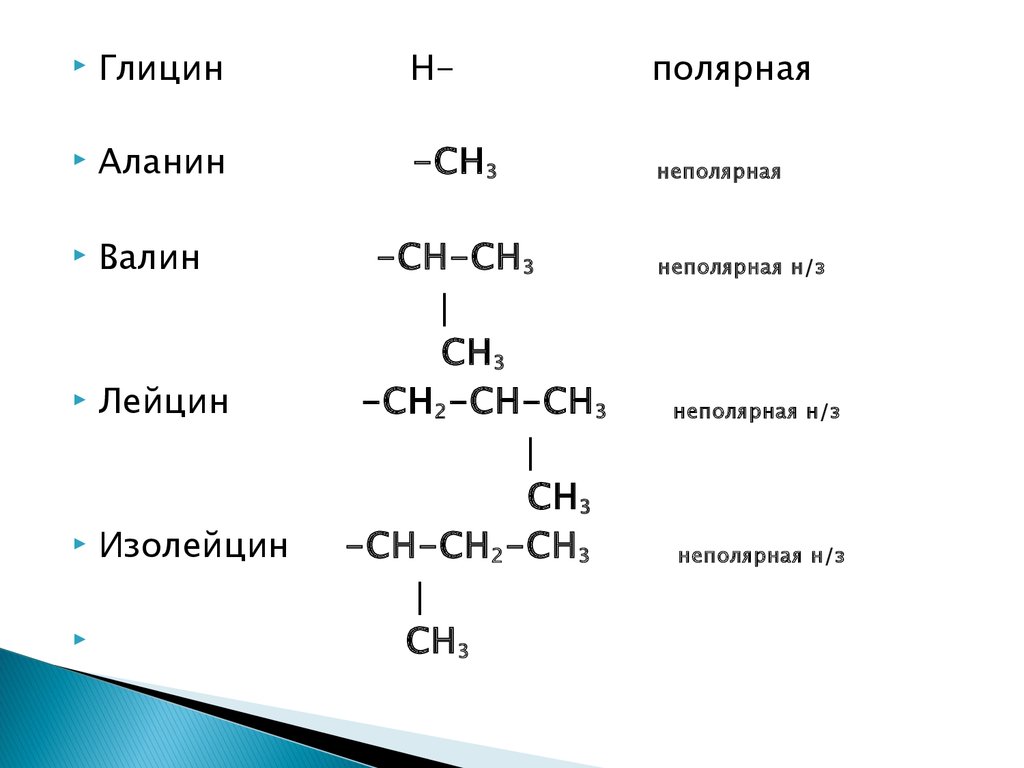
14.
ГлицинН-
полярная
Аланин
-СН 3
неполярная
Валин
Лейцин
Изолейцин
-СН-СН 3
СН 3
-СН 2-СН-СН 3
СН 3
-СН-СН 2-СН 3
СН 3
неполярная н/з
неполярная н/з
неполярная н/з
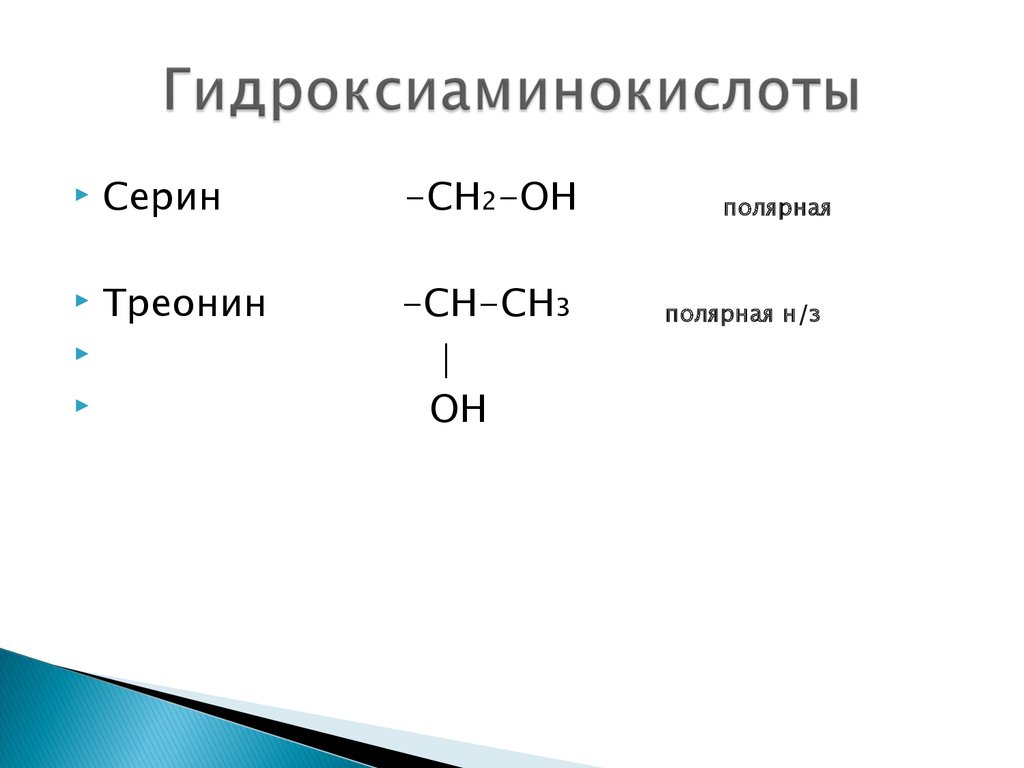
15. Гидроксиаминокислоты
Серин-СН2-ОН
Треонин
-СН-СН3
ОН
полярная
полярная н/з
16. Cеросодержащие
ЦистеинМетионин
-СН2-SH
-СН2-СН2-S-СН3
полярная
неполярная н/з
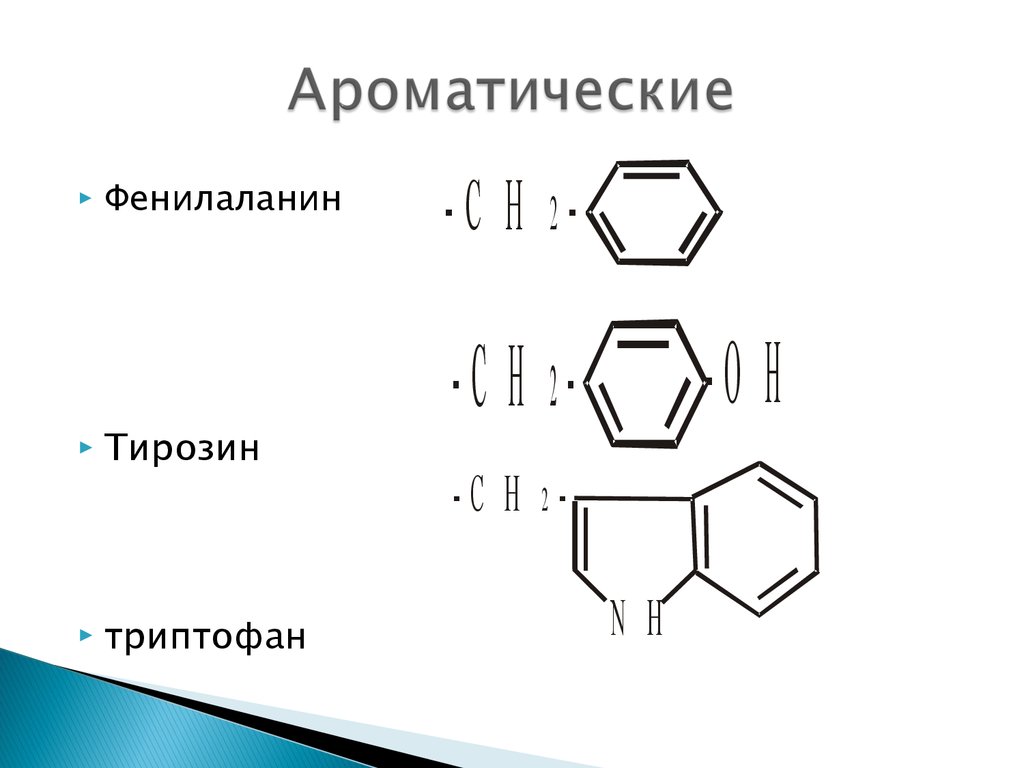
17. Ароматические
ФенилаланинТирозин
триптофан
-С Н 2-
-О Н
-С Н 2-С Н 2N Н
18.
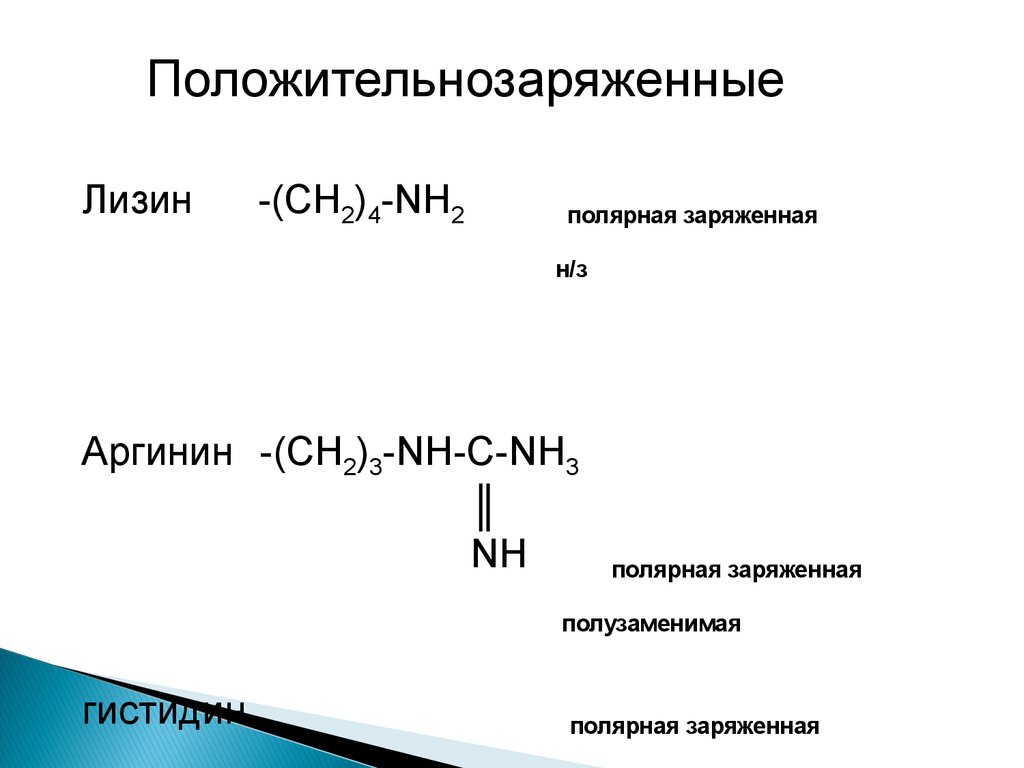
ПоложительнозаряженныеЛизин
-(СН2)4-NH2
полярная заряженная
н/з
Аргинин -(СН2)3-NH-C-NH3
║
NH
полярная заряженная
полузаменимая
гистидин
полярная заряженная
19.
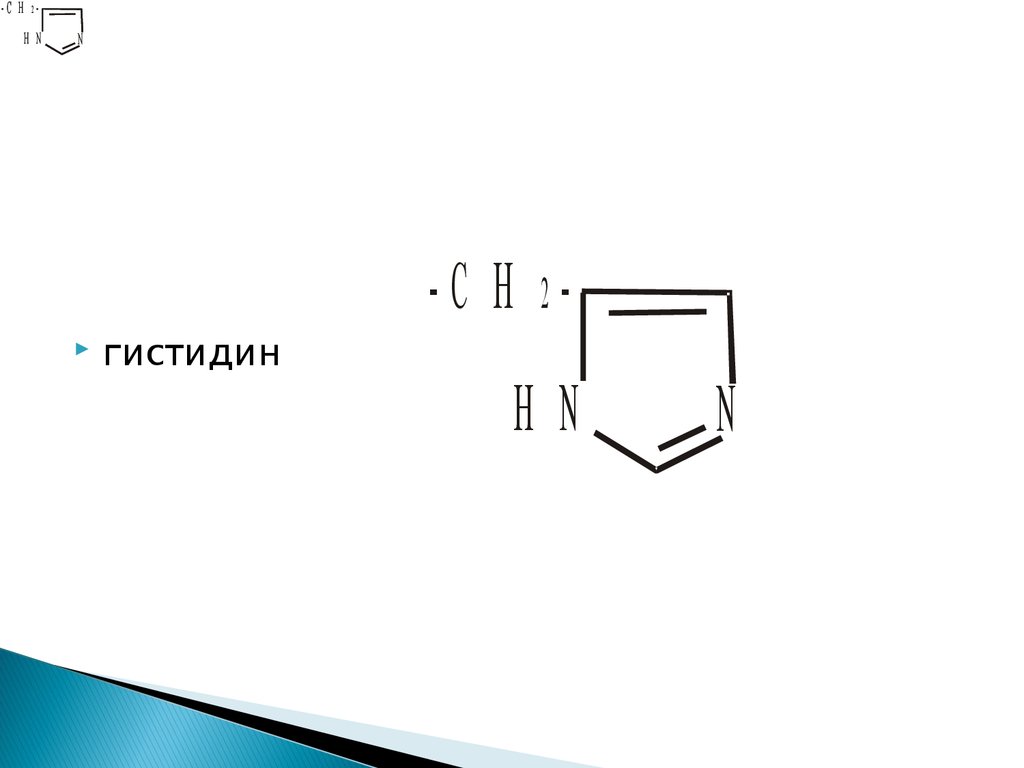
-С Н 2Н NN
-С Н 2
гистидин
Н N
N
20.
ОтрицательнозаряженныеАспарагиновая кислота
Глютаминовая кислота
-СН2-СООН
-СН2-СН2-СООН
АМИДЫ
Аспарагин
неполярная?
глютамин неполярная ?
-СН2-СОNH2
-СН2-СН2-СОNH2
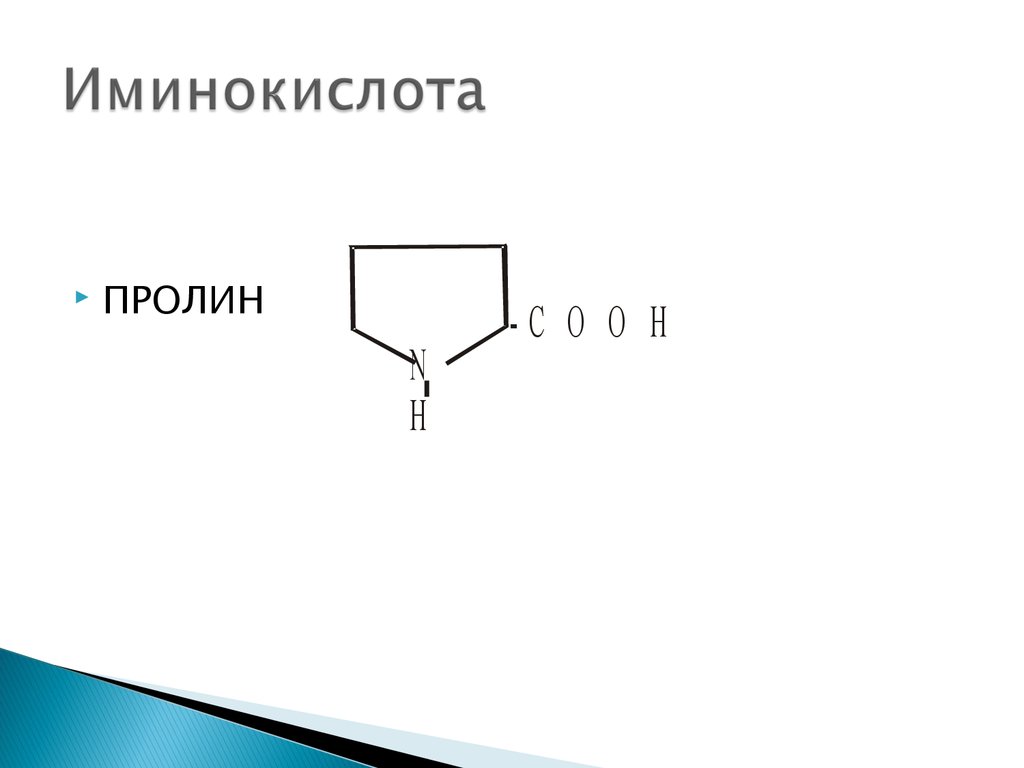
21. Иминокислота
ПРОЛИНN
Н
-С О О Н
22. Классификация по химическому строению
АлифатическиеЦиклические
гетероциклические
23. Классификация по заряду
Заряженные: Кислые, ОсновныеУчаствуют в образовании водородных связей;
Обеспечивают ионные взаимодействия внутри белка;
Обеспечивают ионные взаимодействия с другими
молекулами.
Полярные незаряженные ОН-, SHУчаствуют в образовании водородных связей внутри белка.
Участвуют в образовании водородных связей с другими
молекулами.
Неполярные ала, вал, лей изолей, фен
Формируют компактное внутренне ядро, стабилизирующее структуру
белка;
Участвуют в формировании межсубъединичных контактов;
Организуют гидрофобные контакты с определенными лигандами.
24. По биологическому значению
ЗаменимыеНезаменимые
Для человека незаменимыми являются 8 аминокислот :
Val, Ile, Leu, Thr, Met, Phe, Trp, Lys
(для детей дополнительно необходим His);
Cys и Tyr – зависят от незаменимых аминокислот образуются только из Met и Phe соответственно;
◦ Для белой крысы незаменимыми являются 10
аминокислот, добавляются His и Arg;
◦ E.сoli синтезирует все аминокислоты.
25. По медицинскому значению
Глюкогенные глицин – на синтез углеводовасп,глу аланин,серин,тре, вал, арг гис мет
Кетогенные – на синтез жиров
Лей,илей, тир, фен
26. Обозначения аминокислот
AlanineAla
Arginine
Arg
Asparagine Asn
Aspartic acid Asp
Cysteine
Cys
Glutamine
Gln
Glutamic acid Glu
Glycine
Gly
Histidine
His
Isoleucine
Ile
Leucine
Leu
Lysine
Lis
A
R
N
D
C
Q
E
G
H
I
L
K
Methionine Met
PhenylalaninePhe
Proline
Pro
Serine
Ser
Threonine
Thr
Tryptophan Trp
Tyrosine
Tyr
Valine
Val
M
F
P
S
T
W
Y
V
Asn/Asp
Gln/Glu
B
Z
Asx
Glx
27.
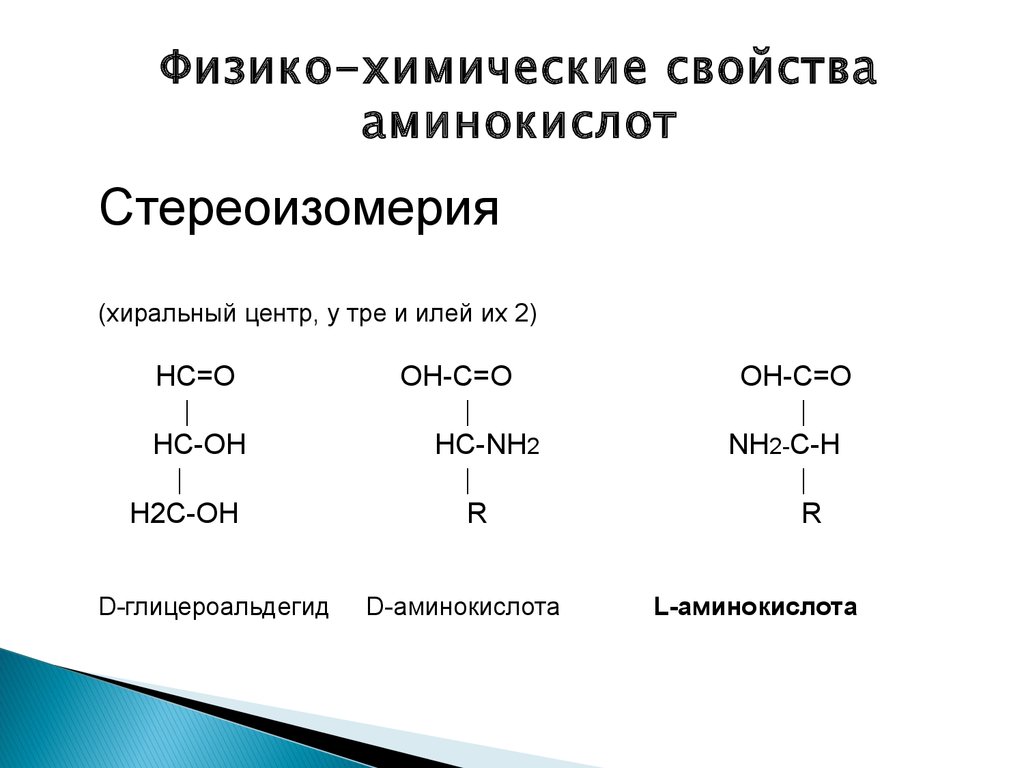
Физико-химические свойствааминокислот
Стереоизомерия
(хиральный центр, у тре и илей их 2)
НС=О
НС-ОН
Н2С-ОН
D-глицероальдегид
ОН-С=О
НС-NH2
R
D-аминокислота
ОН-С=О
NH2-С-Н
R
L-аминокислота
28.
Обладают оптическойактивностью
Левовращающие (-) гис, про,
сер, тре, фен
Правовращающие(+) ала, арг,
глу,илей, лиз
29.
Спектр поглощенияультрафиолетовая область
тир три - 280 нм
Фен
- 260
Цис
- 240
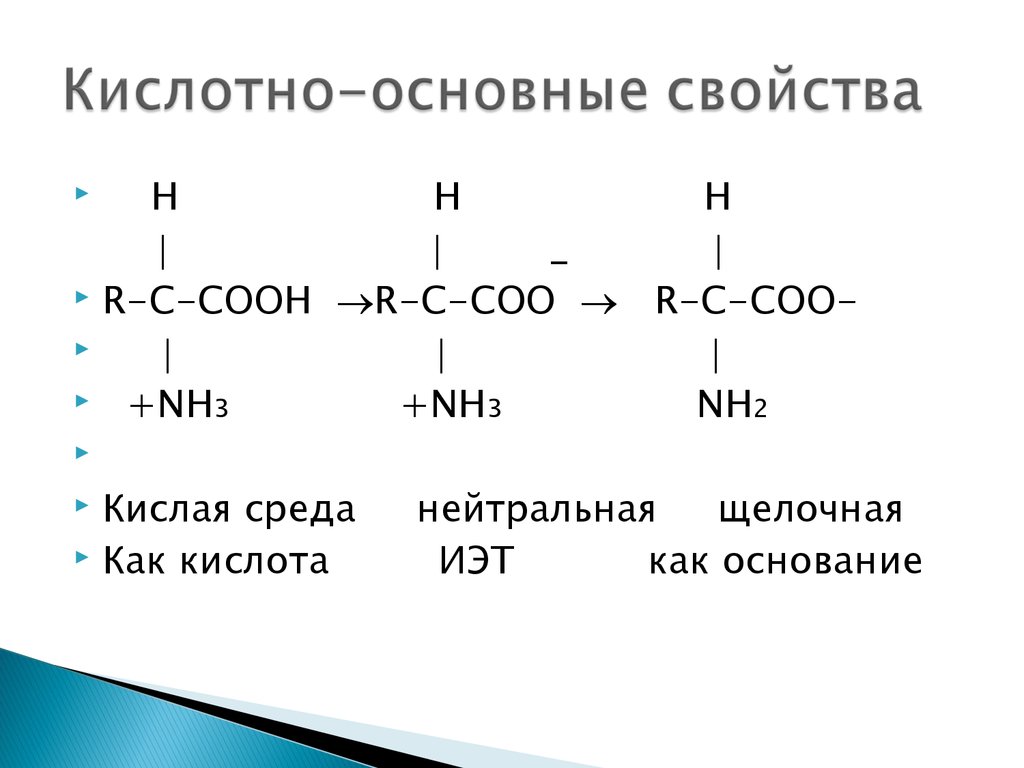
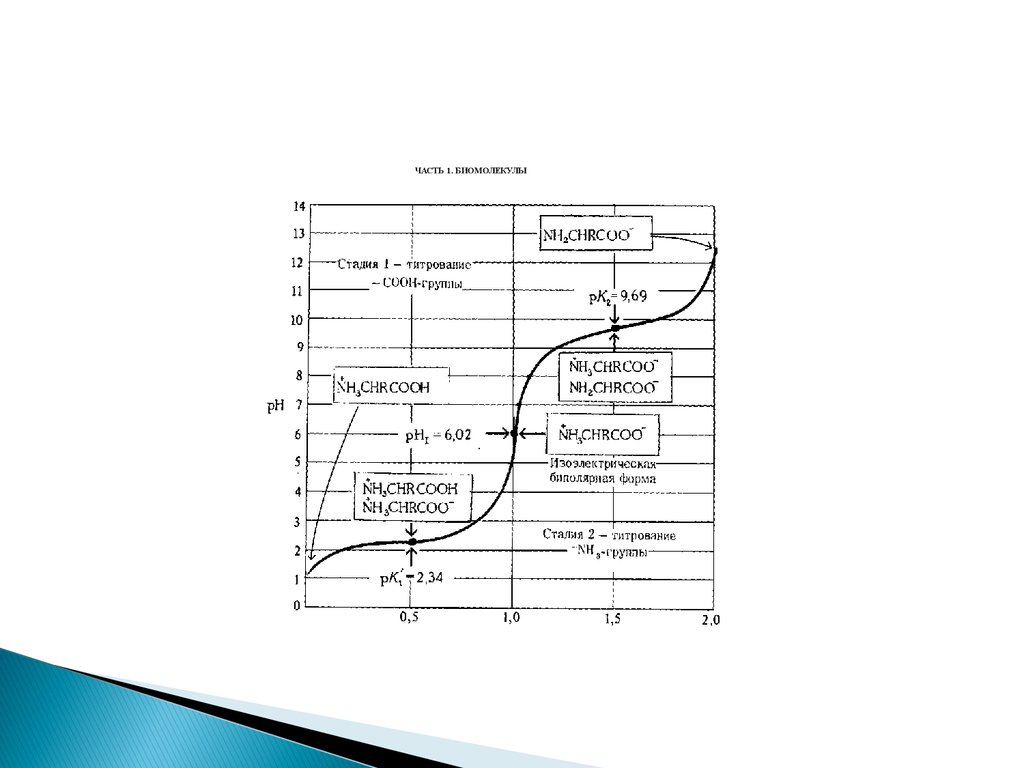
30. Кислотно-основные свойства
НН
Н
_
R-C-CООН R-C-CОО R-C-CОО
+NH3
+NH3
NH2
Кислая среда
Как кислота
нейтральная
щелочная
ИЭТ
как основание
31.
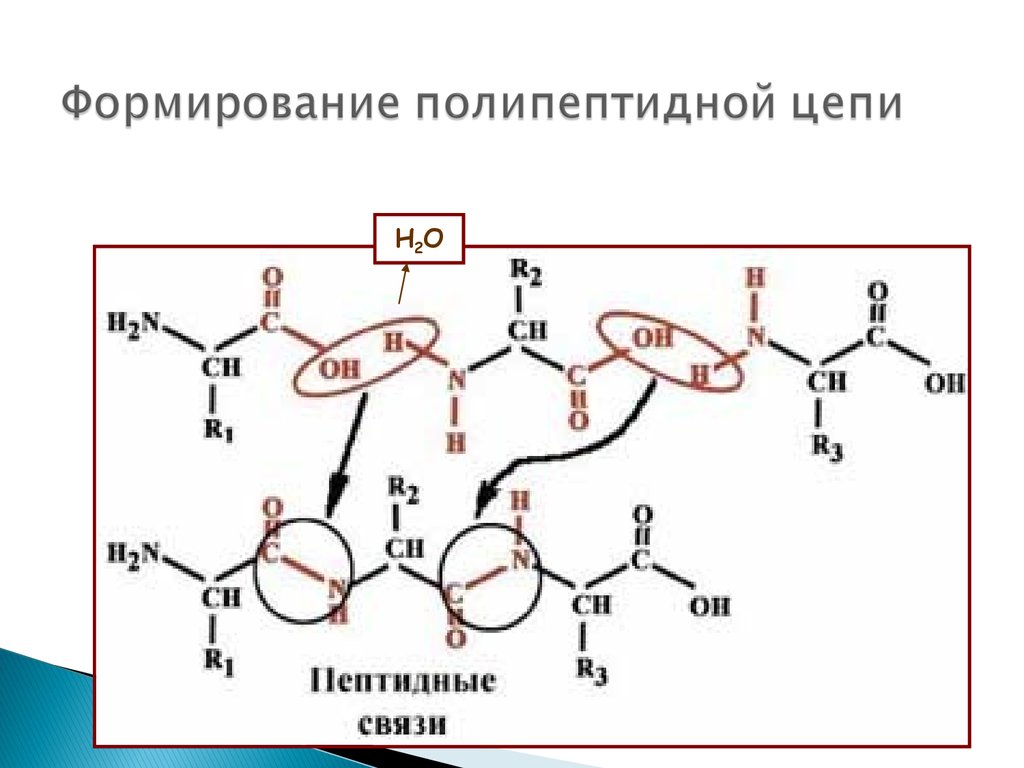
ЧАСТЬ 1. БИОМОЛЕКУЛЫ32. Способность к полимеризации – образование амидной (пептидной) связи
33. Формирование полипептидной цепи
H2O34.
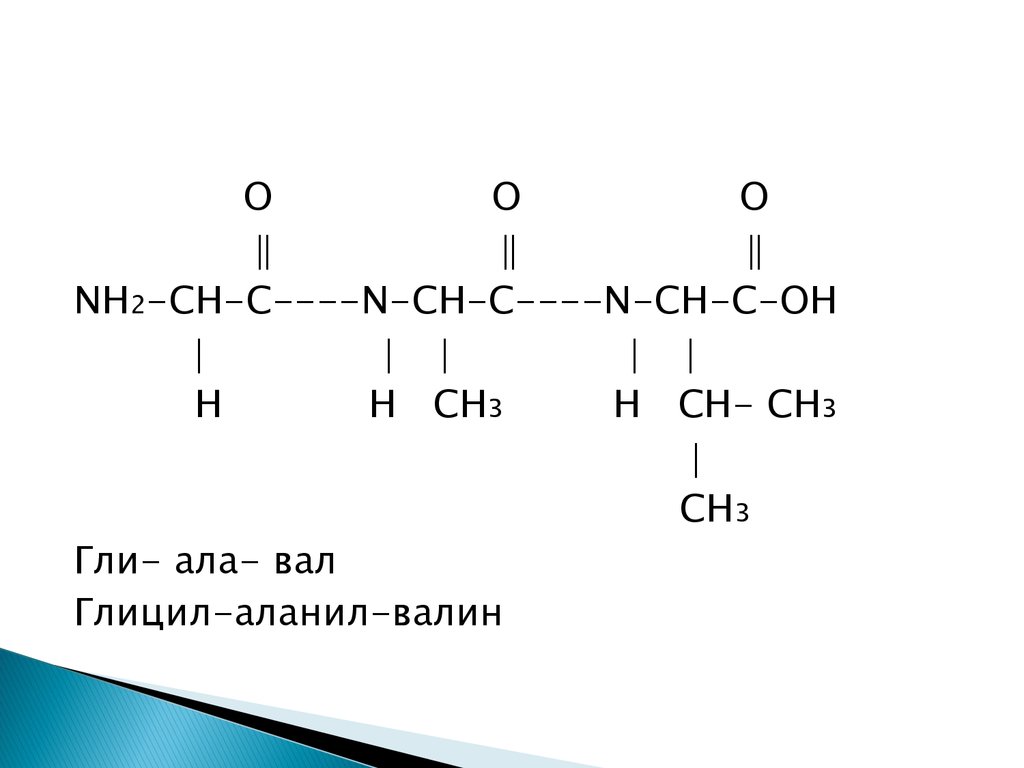
OO
O
NH2-CH-C----N-CH-C----N-CH-C-OH
H
H CH3
H CH- CH3
CH3
Гли- ала- вал
Глицил-аланил-валин
35.
Особенности пептидной связи•Планарная, жесткая
•Транс-конфигурация
•Частично двойная
длина связи С-N
1,49
С=N
1,27
Пептидная
1,32
•Способность к образованию
водородной связи


















 biology
biology chemistry
chemistry