Similar presentations:
Белки. Строение
1. Б Е Л К И
БЕЛКИСтроение
2.
БЕЛКИ = ПРОТЕИНЫ(от греч. protos – первый, главный)
3.
4.
5.
6.
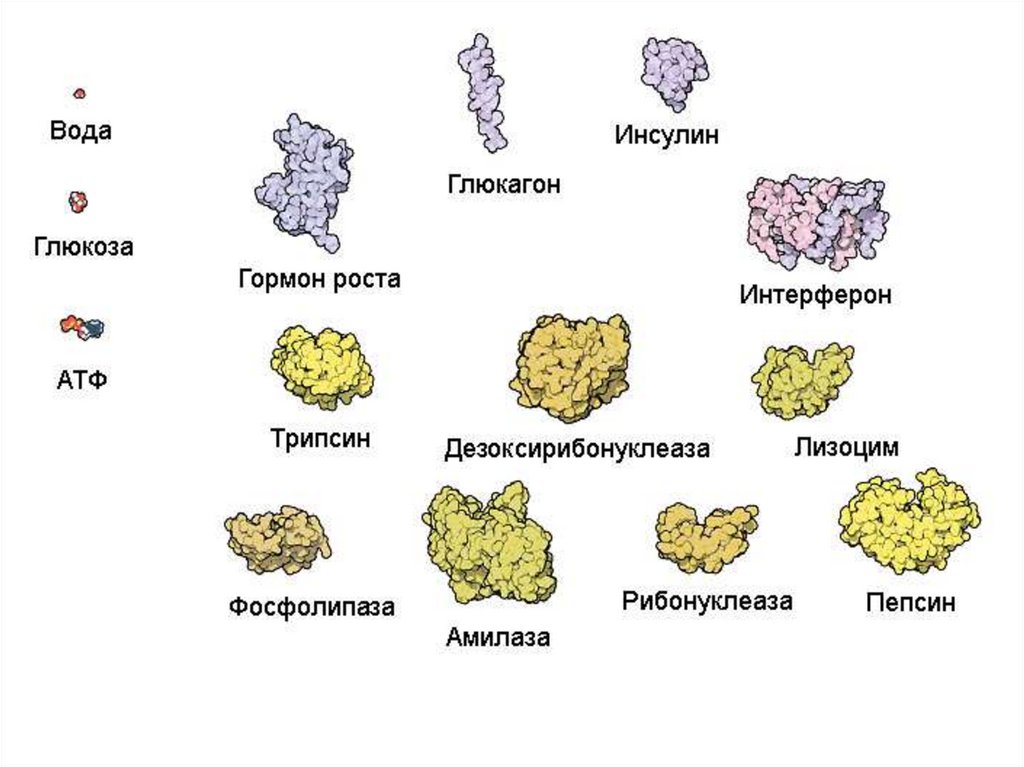
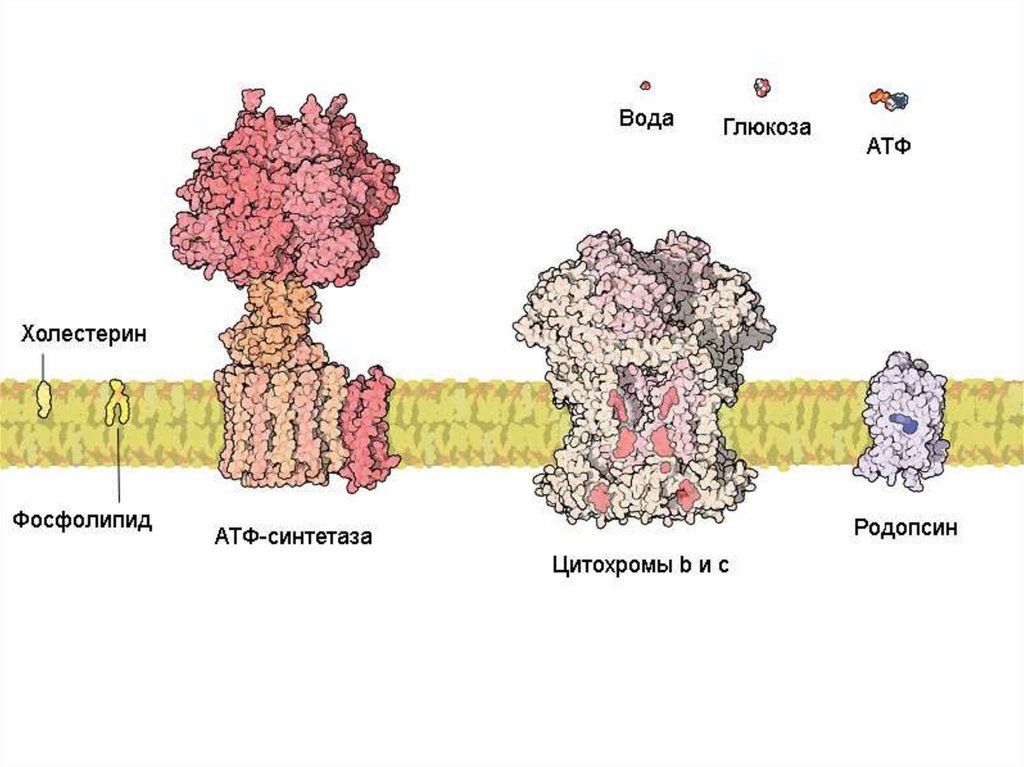
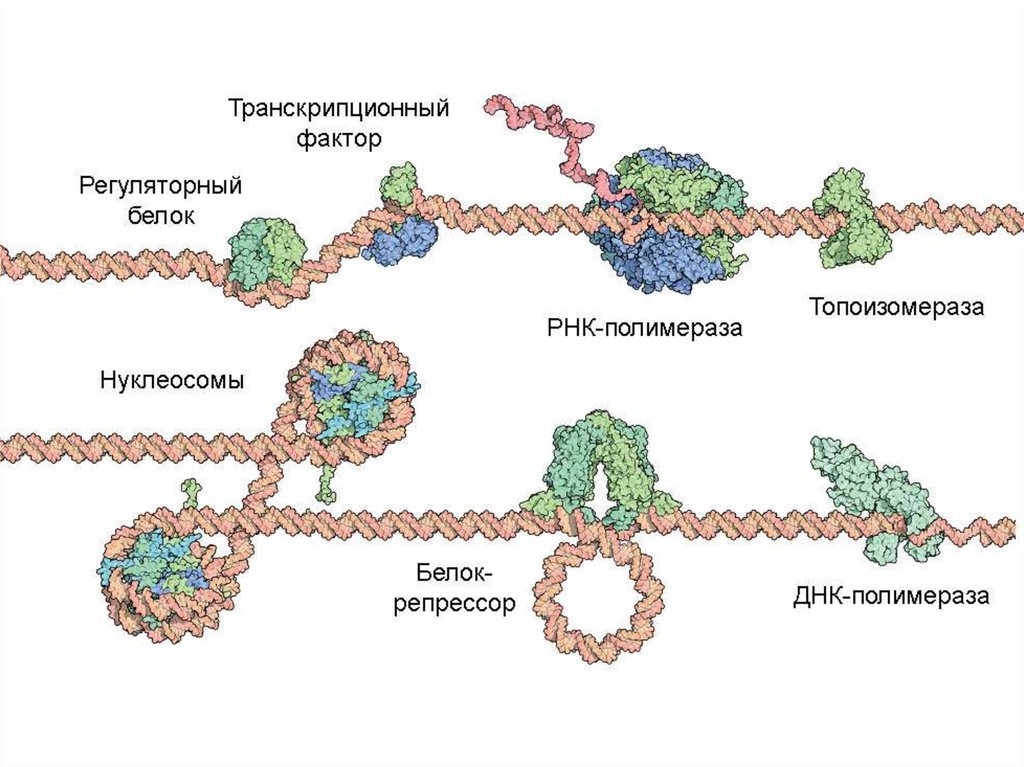
Животная клетка содержитоколо 10 миллиардов молекул
белков (1010)
примерно 10 тысяч видов
7.
Белки – нерегулярные полимеры,мономерами которых являются аминокислоты
неразветвленные
Мономеры –
20 аминокислот
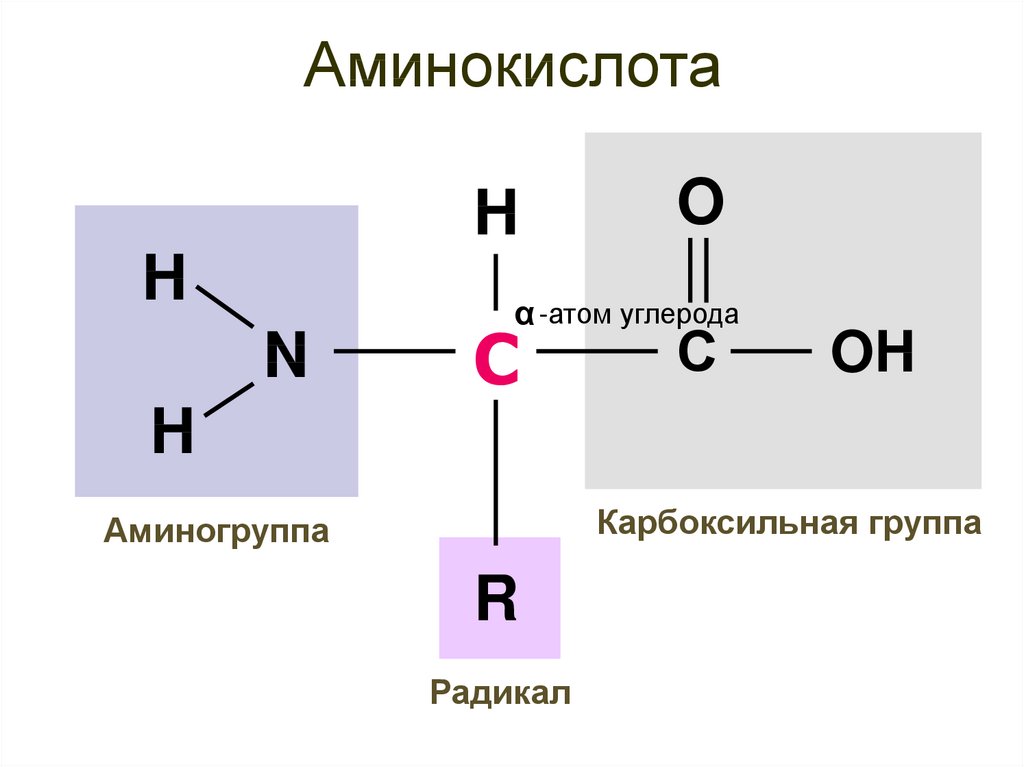
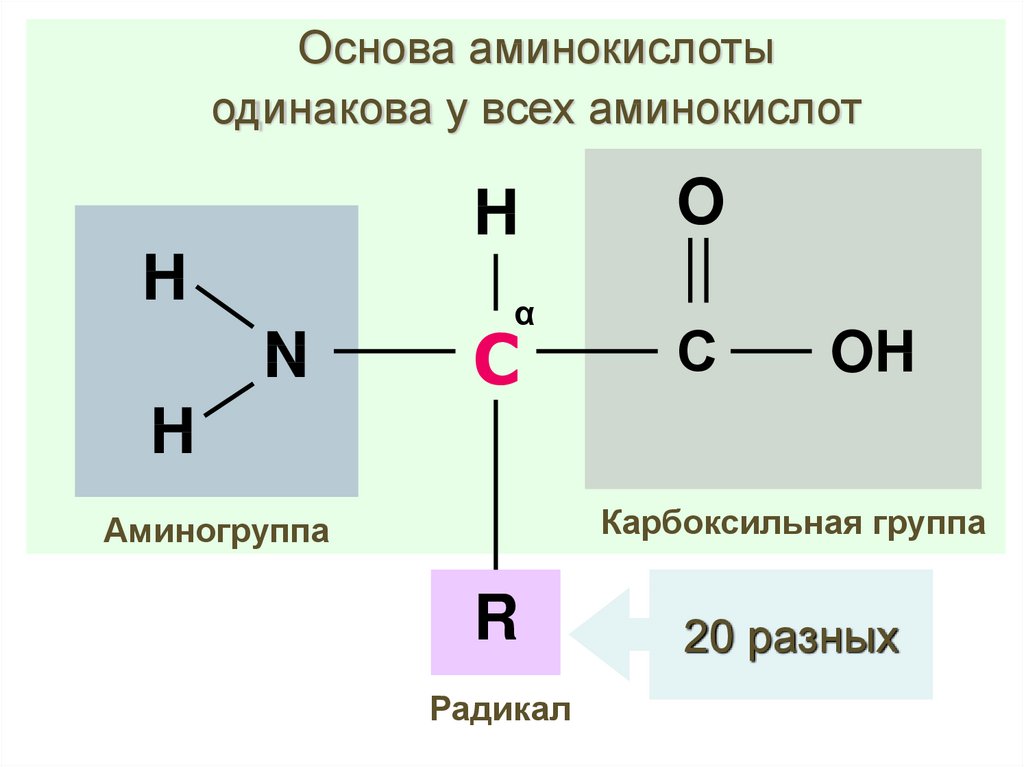
8. Аминокислота
HH
N
O
α -атом углерода
С
С
OH
H
Карбоксильная группа
Аминогруппа
R
Радикал
9.
Основа аминокислотыодинакова у всех аминокислот
H
H
N
α
С
O
С
OH
H
Карбоксильная группа
Аминогруппа
R
Радикал
20 разных
10.
Н+─
разная у разных а.к.
pH = рI изоэлекрическая точка (общий заряд = 0)
– H+
+ H+
─
Кислотность среды ниже и.точки
Н+
Кислотность среды выше и.точки
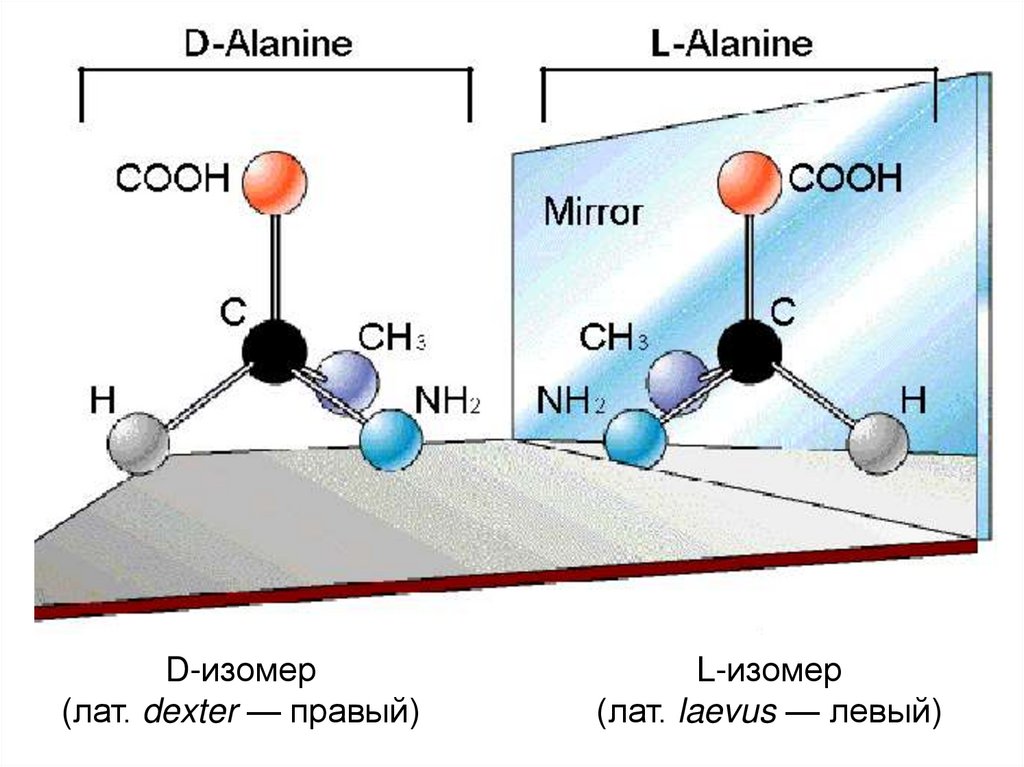
11. Хиральная чистота живого
СтереоизомерыЕсли группы 1, 2, 3 и 4 - разные
Хиральные объекты –
не равны своему
зеракльному отражению
12.
D-изомер(лат. dexter — правый)
L-изомер
(лат. laevus — левый)
13.
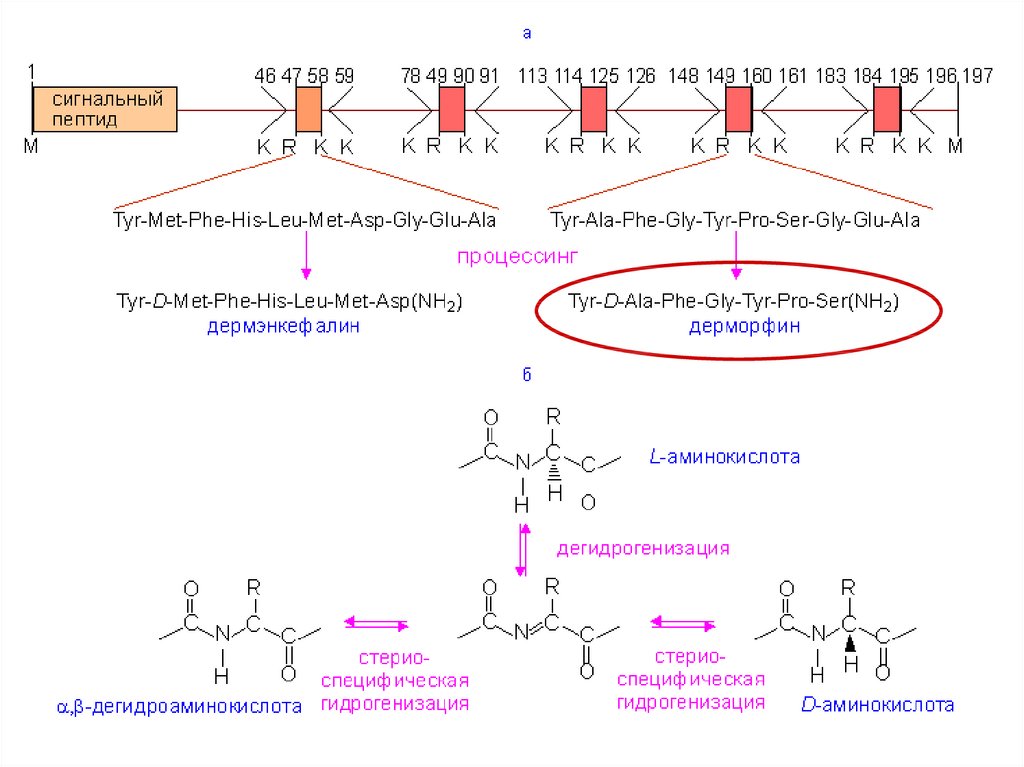
D-аминокислотыD-аминокислоты могут входить в
состав некоторых коротких пептидов
(особенно у бактерий)
Эти пептиды синтезируются не на
рибосомах
По функции это, как правило, яды
14.
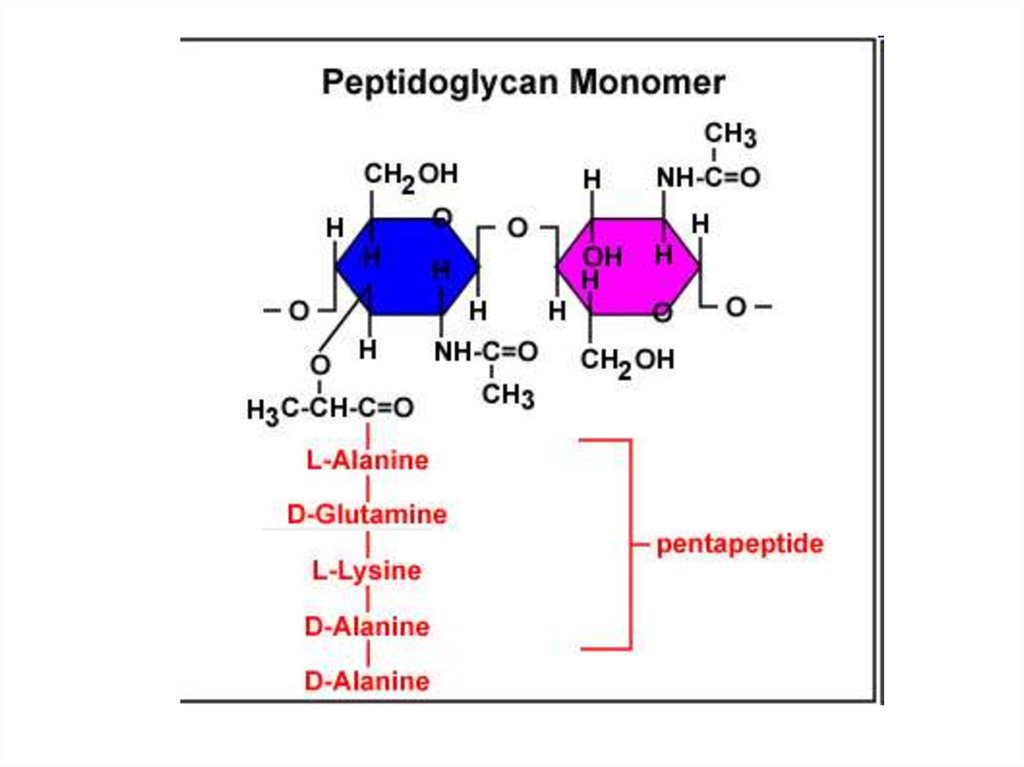
Клеточная стенка бактерий – муреин15.
16.
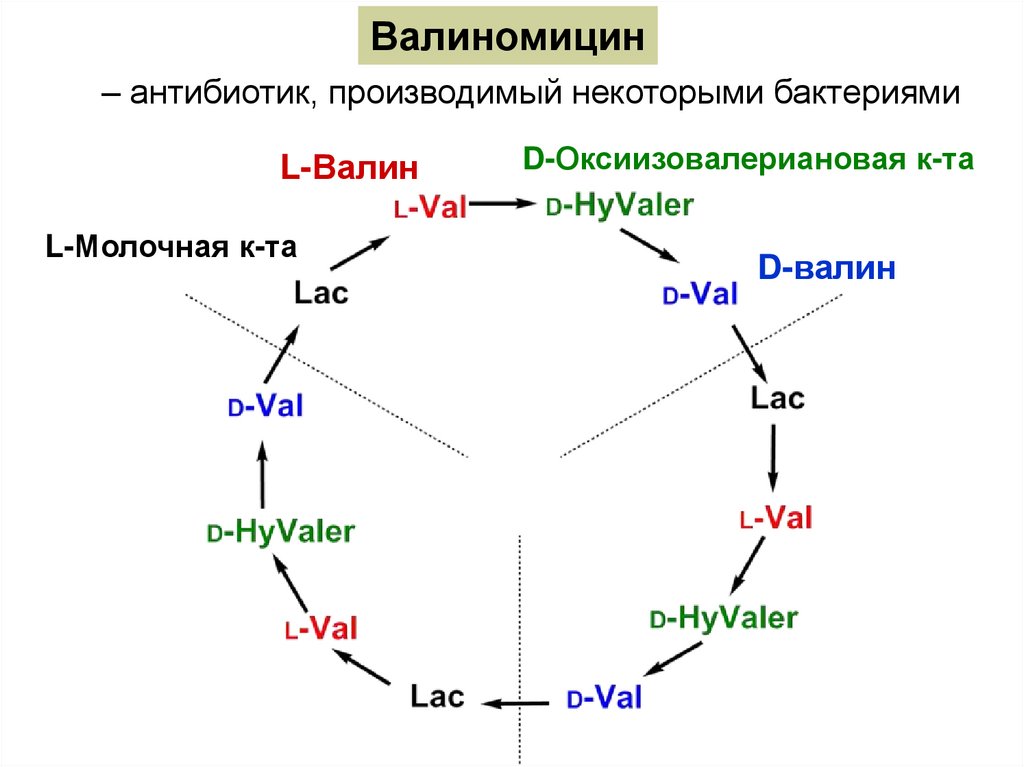
Валиномицин– антибиотик, производимый некоторыми бактериями
L-Валин
L-Молочная к-та
D-Оксиизовалериановая к-та
D-валин
17.
ДерморфинTyr – D-Ala – Phe – Gly – Tyr – Pro – Ser-NH2
Пептид из 7 аминокислот,
включающий D-аланин
Яд
Лягушки рода Phyllomedusa
(Южная Америка)
Синтезируется на
рибосомах, но проходит
посттрансляционную
модификацию
18.
19.
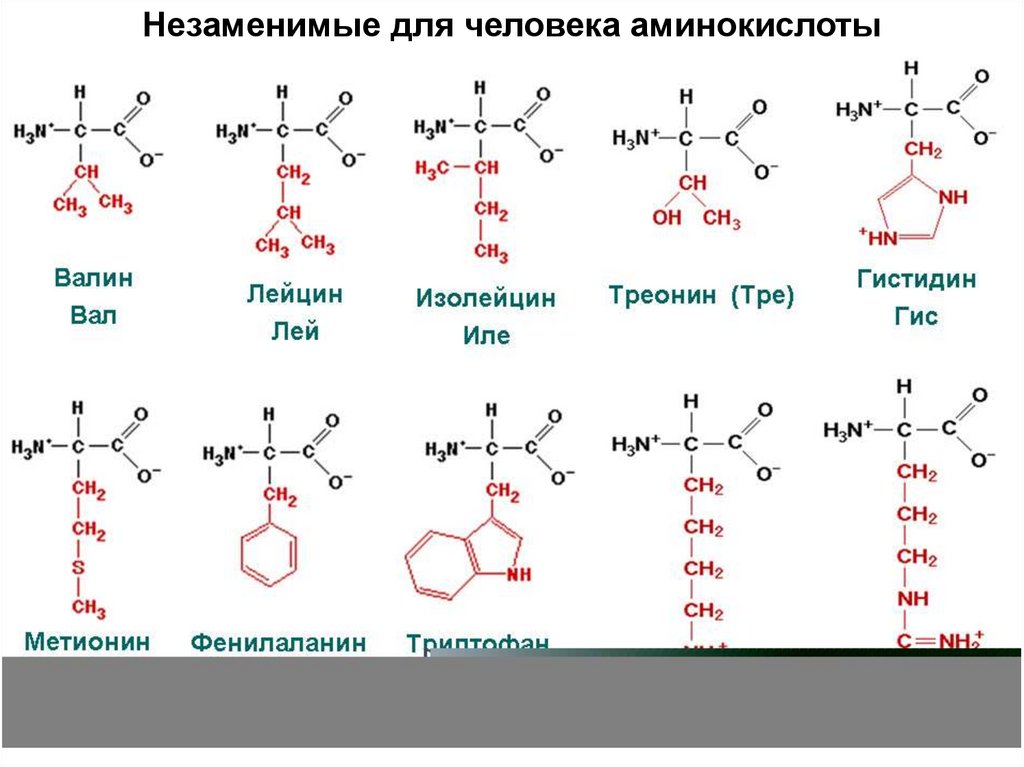
20. Незаменимые аминокислоты
Организм не может синтезировать сам →должны поступать с пищей.
Для человека это 10 аминокислот:
валин, лейцин, изолейцин, треонин, метионин,
фенилаланин, триптофан, гистидин, лизин, аргинин
Хотя аргинин и может синтезироваться в организме, его
относят к незаменимым: у новорожденных и растущих детей
он образуется в недостаточном количестве.
Этот список приблизительно одинаков у
всех позвоночных и даже у насекомых.
21.
Незаменимые для человека аминокислоты22. Радикалы аминокислот
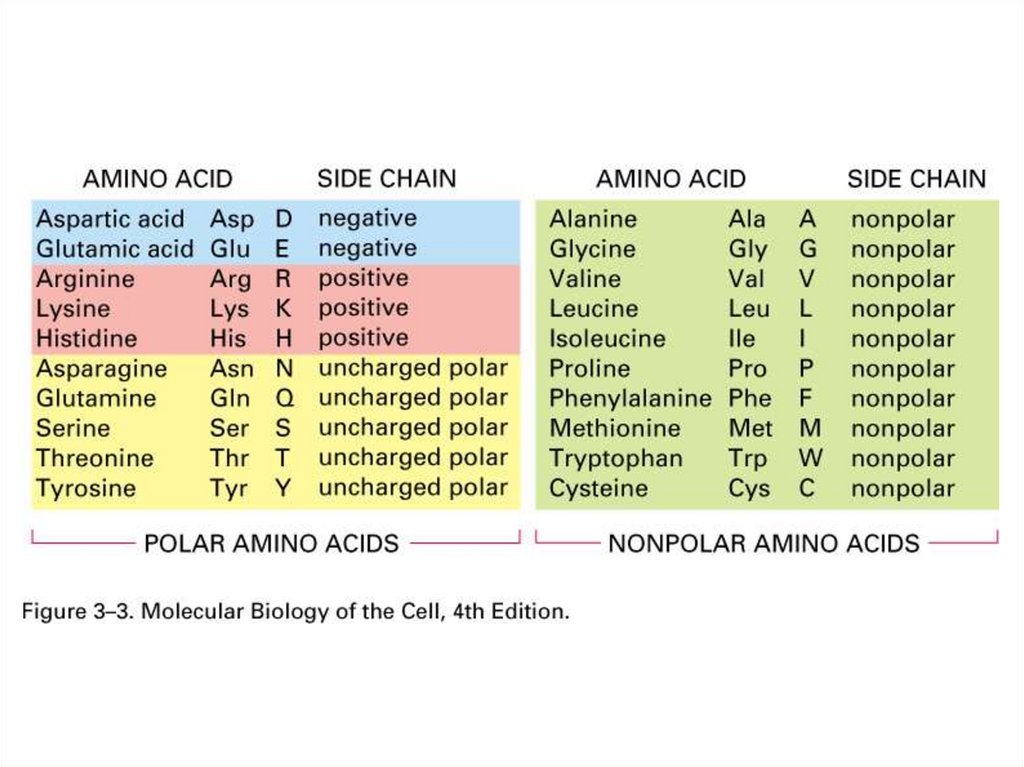
NРадикалы аминокислот
Гидрофобные
(неполярные)
O
Гидрофильные
O
O Полярные O HЗаряженные
CH
C
(ионы)O
2N
Определите Hполярность
радикалов:
CH
C
OH
2N
CH2
CH
H2N C CHOH C
OH
CH2
CH3
CH2
CH2
C
SH
OH─
O
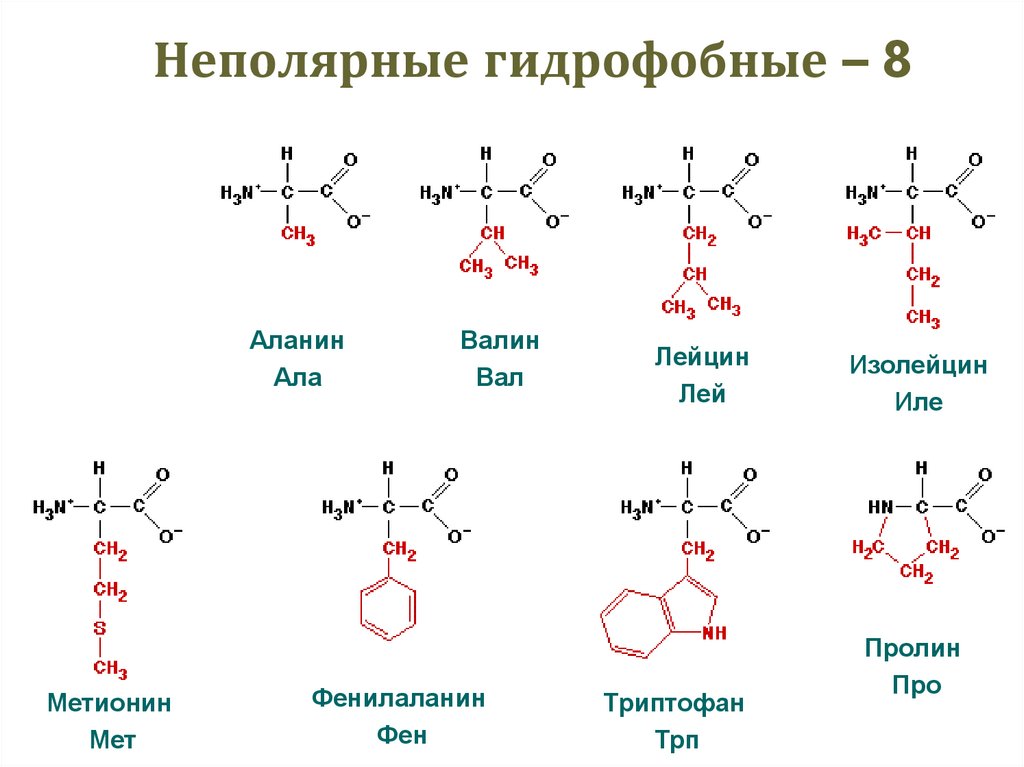
23. Неполярные гидрофобные – 8
ГлицинГли
Метионин
Мет
Аланин
Ала
Валин
Вал
Фенилаланин
Фен
Лейцин
Лей
Триптофан
Трп
Изолейцин
Иле
Пролин
Про
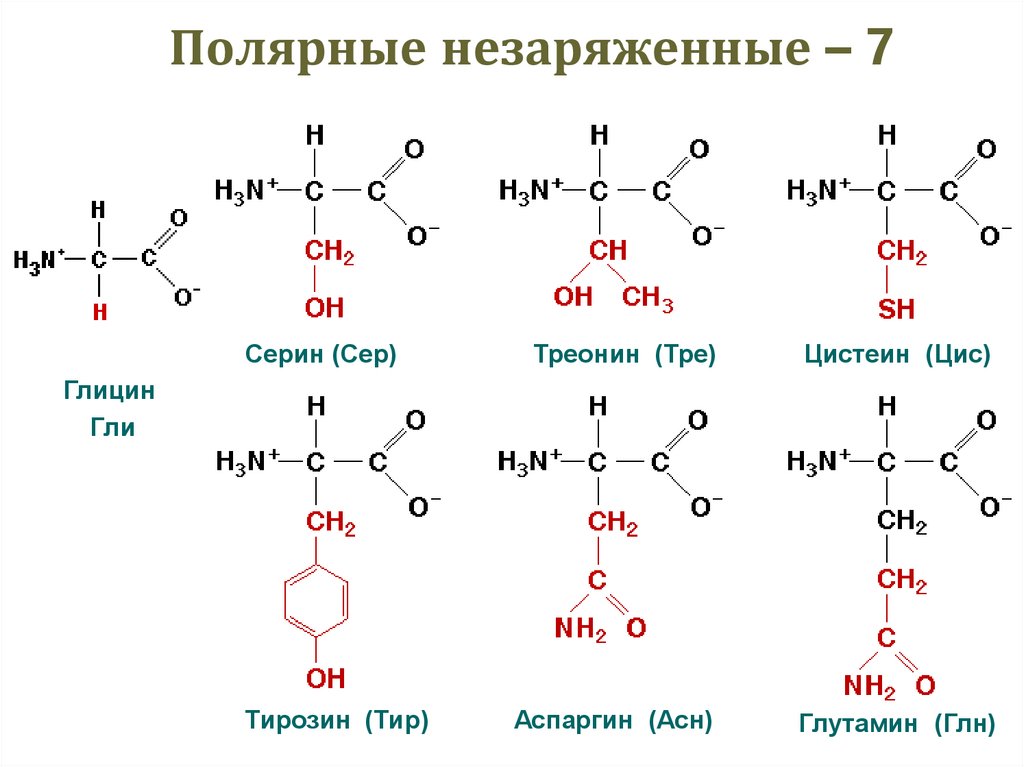
24. Полярные незаряженные – 7
Серин (Сер)Треонин (Тре)
Цистеин (Цис)
Аспаргин (Асн)
Глутамин (Глн)
Глицин
Гли
Тирозин (Тир)
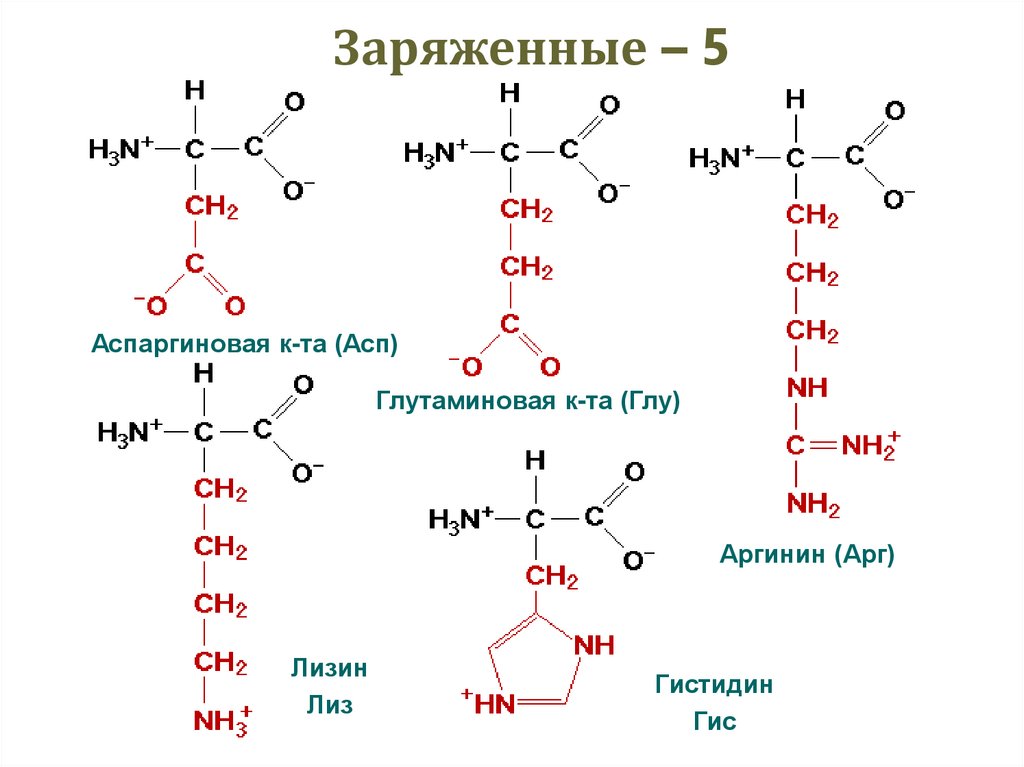
25. Заряженные – 5
Аспаргиновая к-та (Асп)Глутаминовая к-та (Глу)
Аргинин (Арг)
Лизин
Лиз
Гистидин
Гис
26.
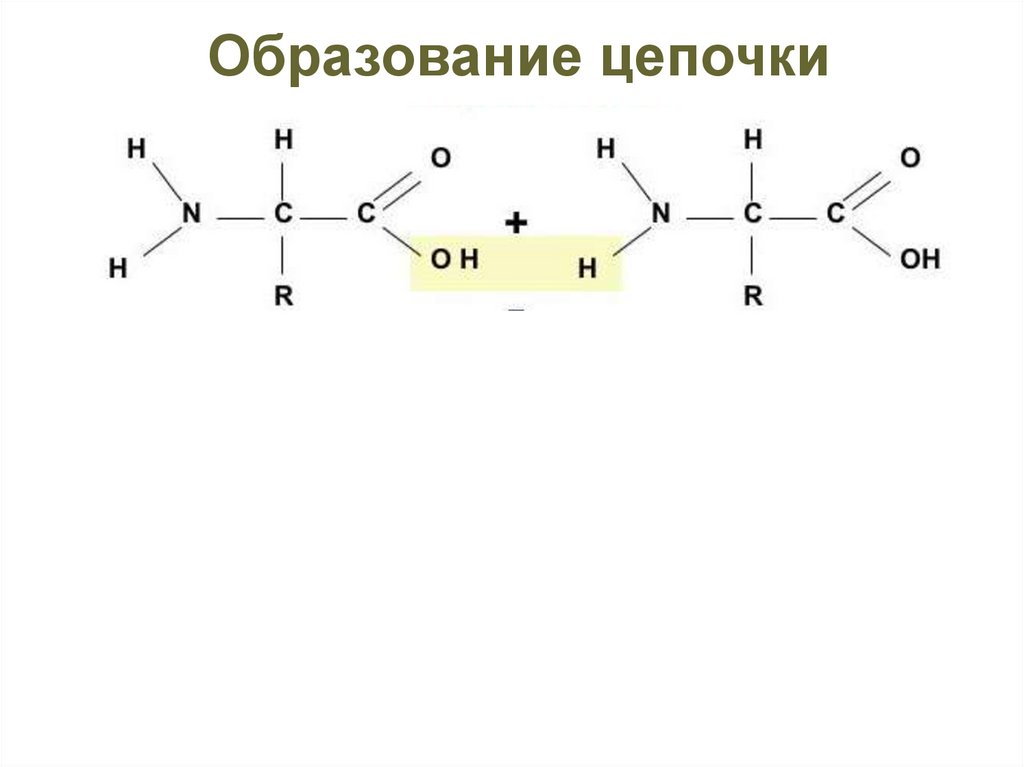
Образование цепочкиЭнергия
N-конец
Пептидная связь
С-конец
27.
28.
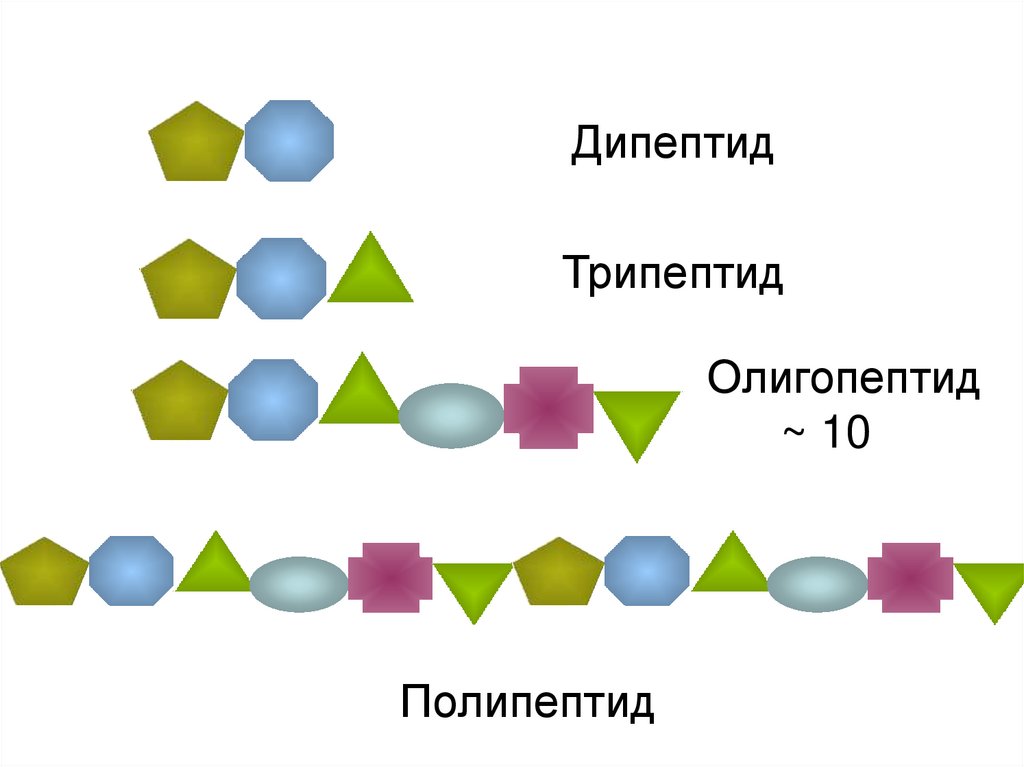
ДипептидТрипептид
Олигопептид
~ 10
Полипептид
29.
Первичная структура белка – этопоследовательность аминокислот в
полипептидной цепочке, записанная в
порядке N……..C.
(соответствует направлению роста цепочки при
ее синтезе в клетке).
N
Ала
1
Глу
Гис
Гис
Ала
Трп
2
3
4
5
6
Цис
7
Вал
8
Иле
9
C
30.
31.
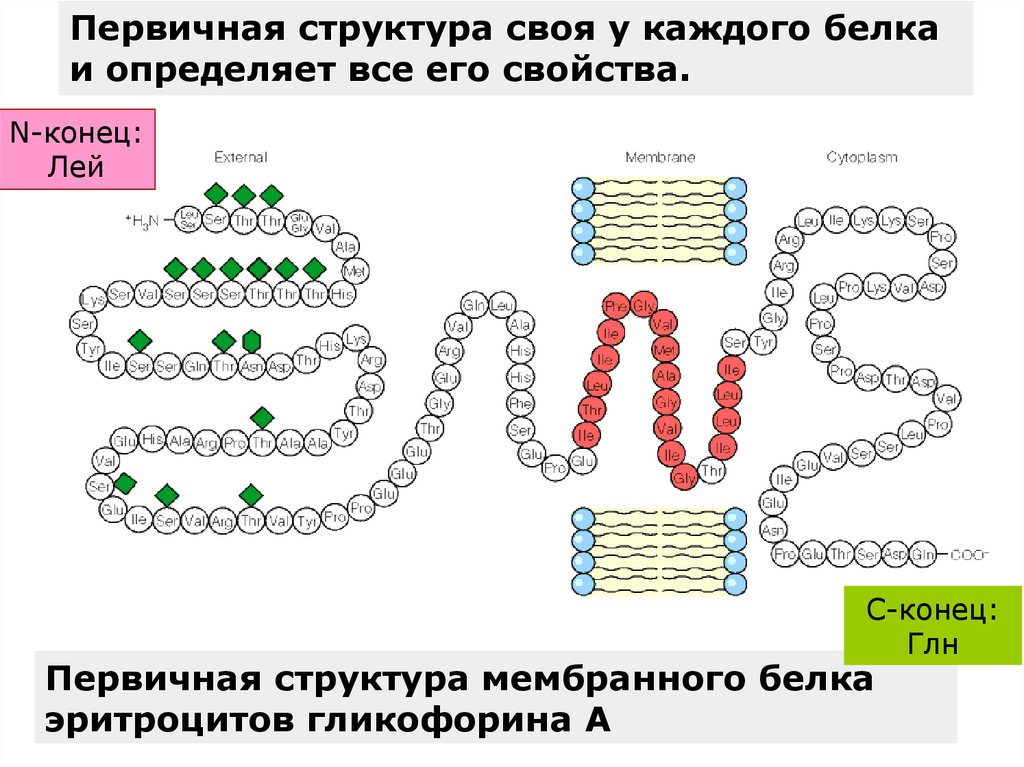
Первичная структура своя у каждого белкаи определяет все его свойства.
N-конец:
Лей
C-конец:
Глн
Первичная структура мембранного белка
эритроцитов гликофорина А
32.
Белки с одной функцией у родственныхвидов имеют сходную I структуру
Количество отличий отражает время их
дивергенции в эволюции
Молекулярная
филогения
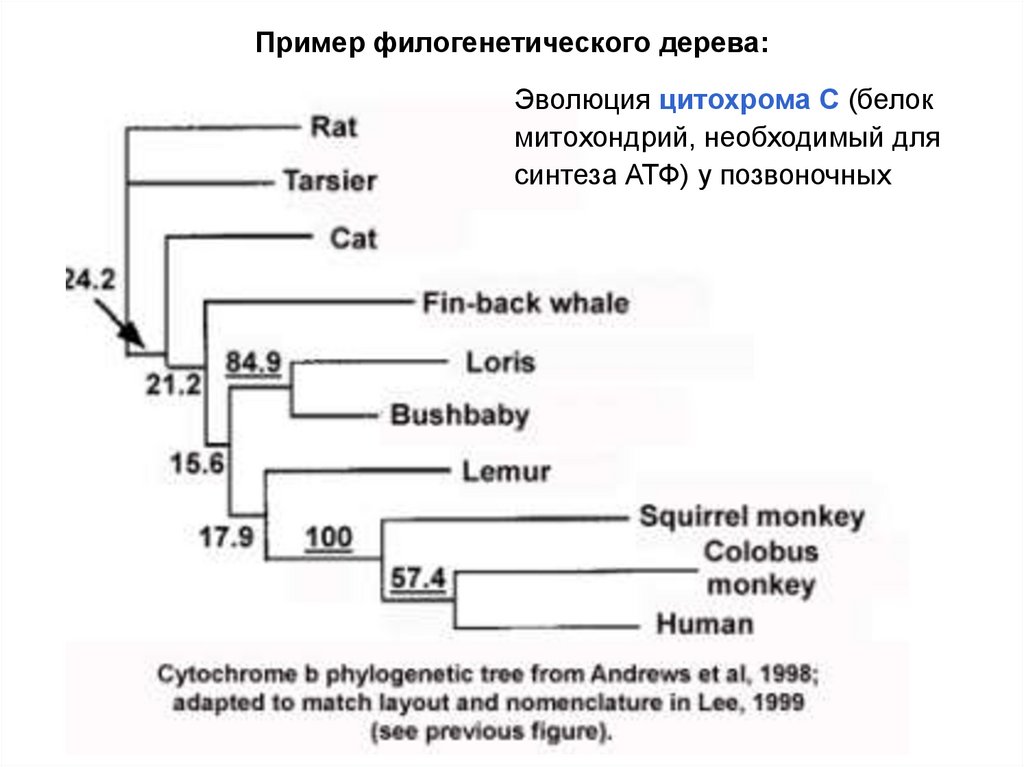
33.
Пример филогенетического дерева:Эволюция цитохрома С (белок
митохондрий, необходимый для
синтеза АТФ) у позвоночных
34. Эволюция шаперонина-60 за ~1.5 млрд.лет
Растенияи грибы
Животные
Простей
шие
Бактерии
Найдите участки белка, эволюционирующие
быстро и медленно
35.
Сколько разных белков длиной в nмономеров можно построить из 20
а.к.?
n
20
Средний белок: 300 а.к.
Длина большинства лежит в
пределах
100 – 2 000 а.к.
36.
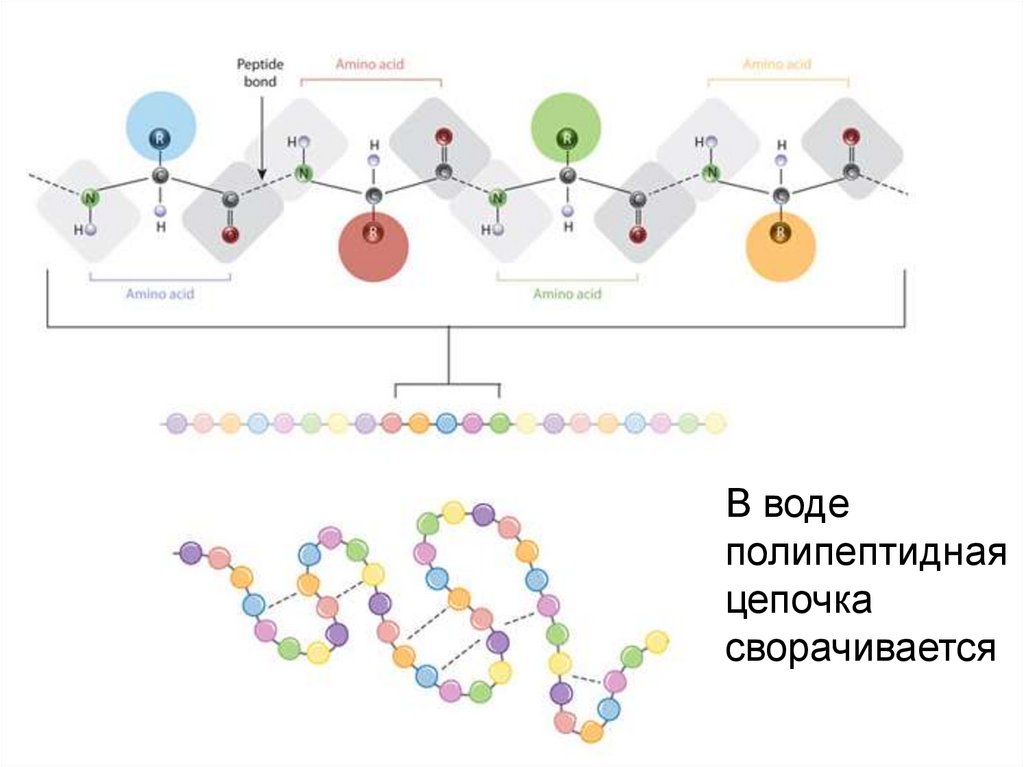
В водеполипептидная
цепочка
сворачивается
37.
Как из линейной цепочки полипептидаполучается глобула?
?
Сворачивание
в несколько этапов:
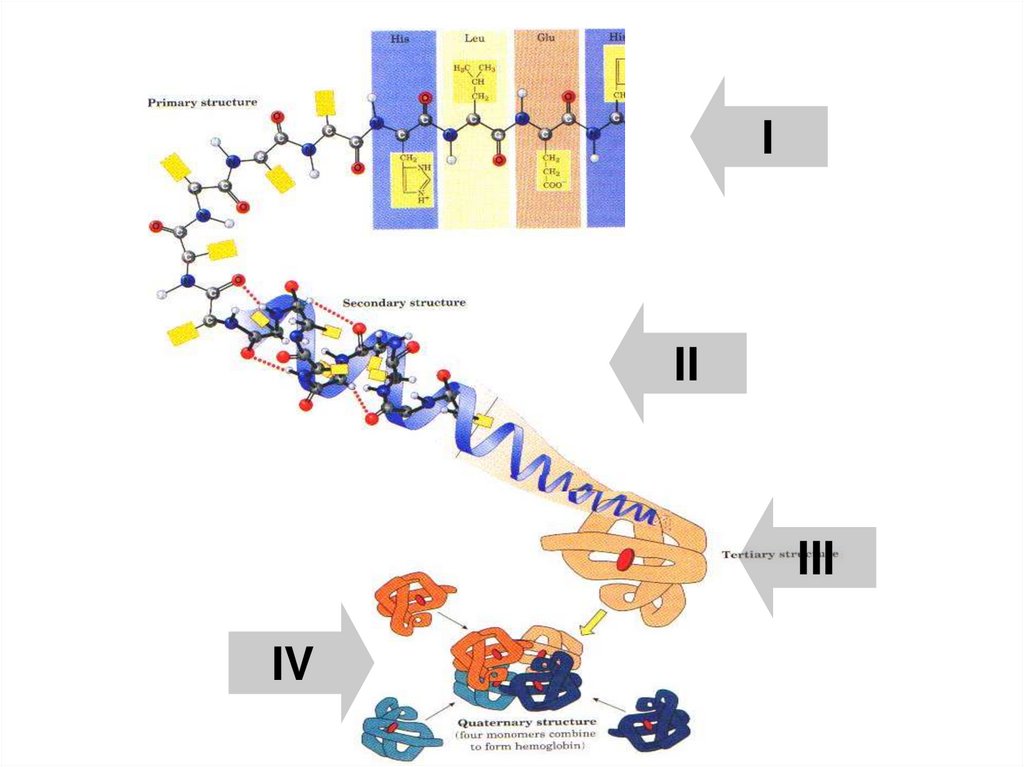
уровни нашего изучения
структуры белка
Первичная
Вторичная
Третичная
Четвертичная
38.
III
III
IV
39.
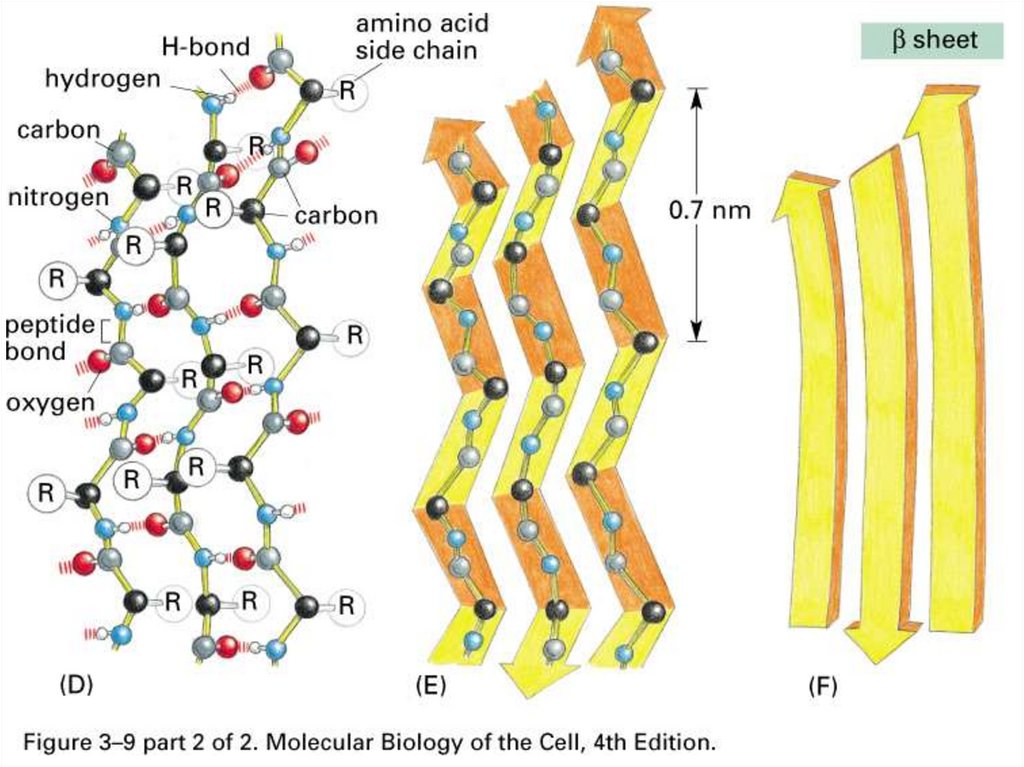
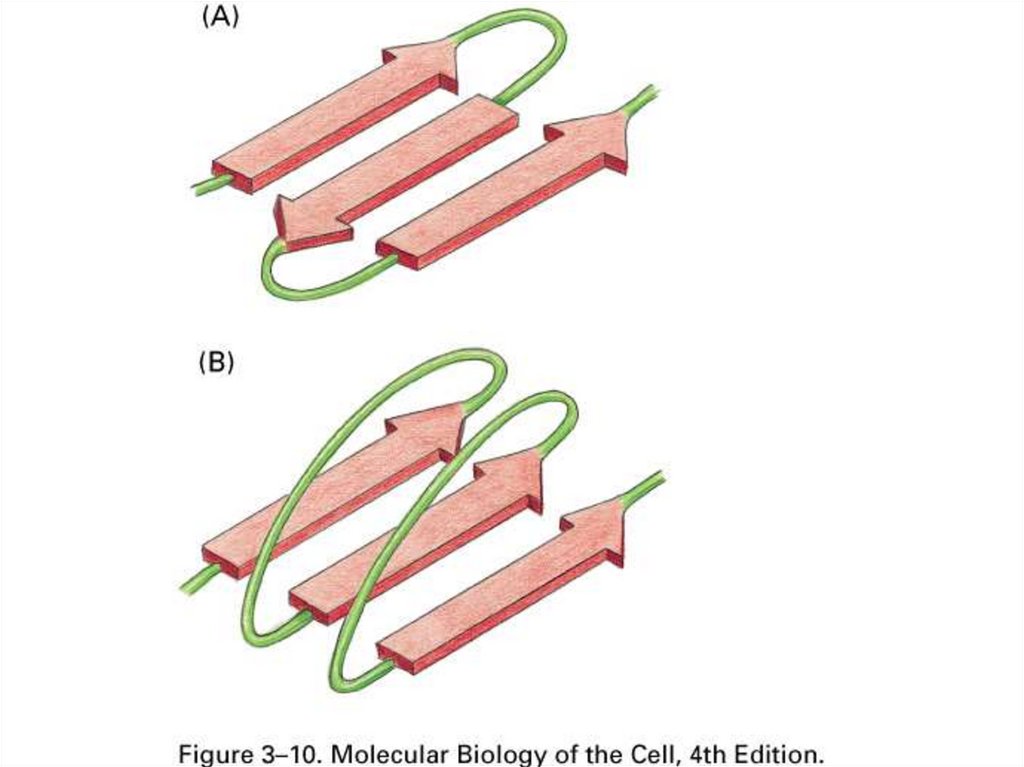
Вторичная структура – это способы укладки,образуемые водородными связями между
атомами основы цепочки С=O и N-H
Поэтому они одинаковы у самых разных белков.
слой
H
O
С
Аминокислоты
C
N
C
C
N
C C
R
O
H
–
δ
О
H
O
C
H
C
+
δ
H
H
O
H
N
O
N
O
C
O
R H
H
N
O
N
O
C
N
C
H
R
C
R H
H
N
C
H
O
C
N
C
H
R
R
C
O
C
C
R
H
C
H
H
H
H C N
O
H
C
C
H
спираль
H
N H C
N
H
O
H
H
O
H
R
C
C
N
N
C C
R
H
N
C
N
C C
R
O H H
O
R
C
H
C
O
H
N
O
C
C
H
C
H
R
H
C
H
C
C C
R
R
R
N
R
R
C
N
O
H
N
R
C
N
R
C
H
O
H
O
H
C
C
R
R
C
N
H
H
H C N
O
O
H
C
C
R
C
N
H
H
H C N
O
40.
41.
42.
43.
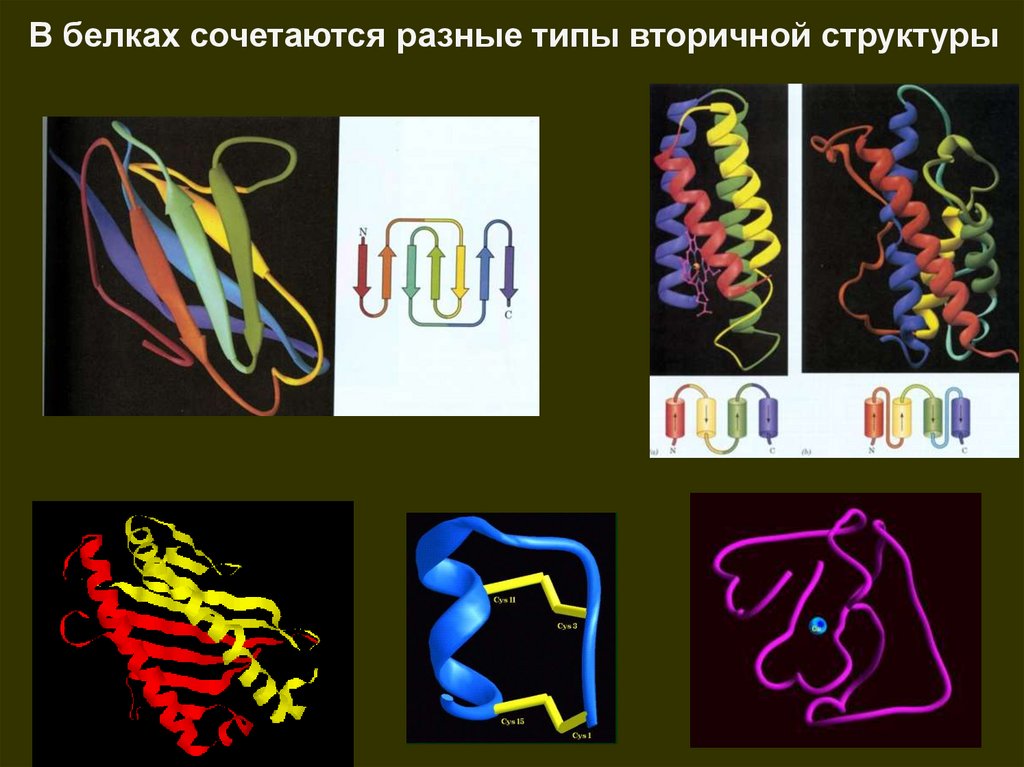
В белках сочетаются разные типы вторичной структуры44.
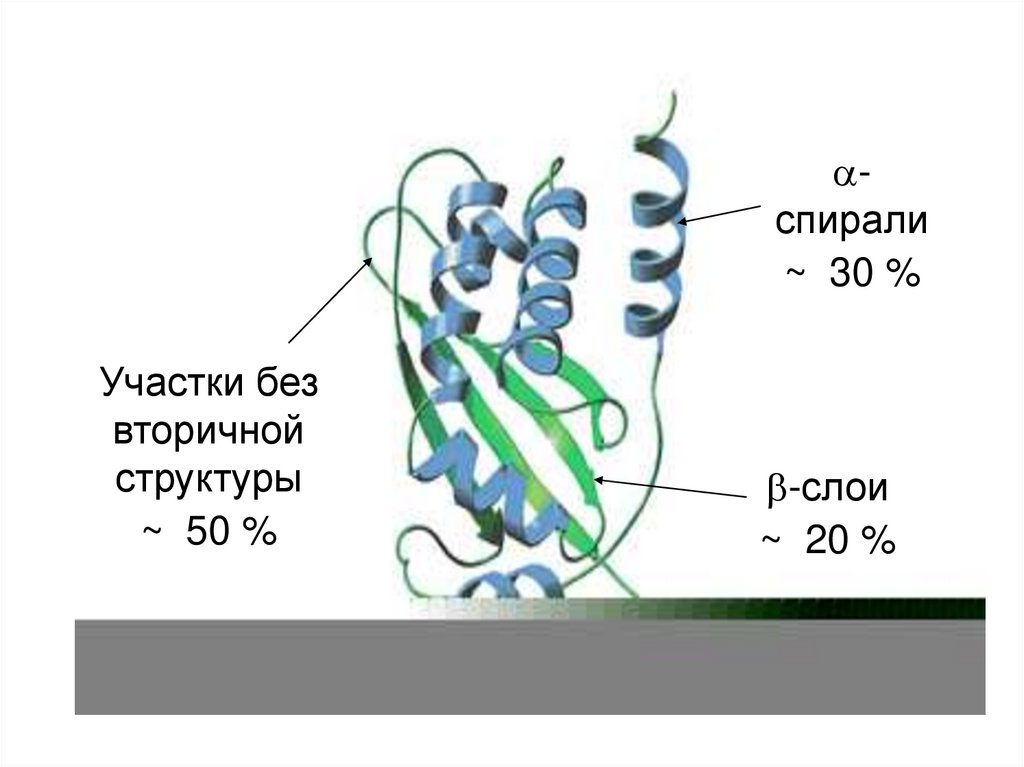
Встречаемость в белках разныхвторичных структур
Нет II структуры
28% – 35%
18% – 26%
40% – 50%
45.
спирали~ 30 %
Участки без
вторичной
структуры
~ 50 %
-слои
~ 20 %
46. Лайнус Полинг
Открытиеα-спирали
в 1951
47.
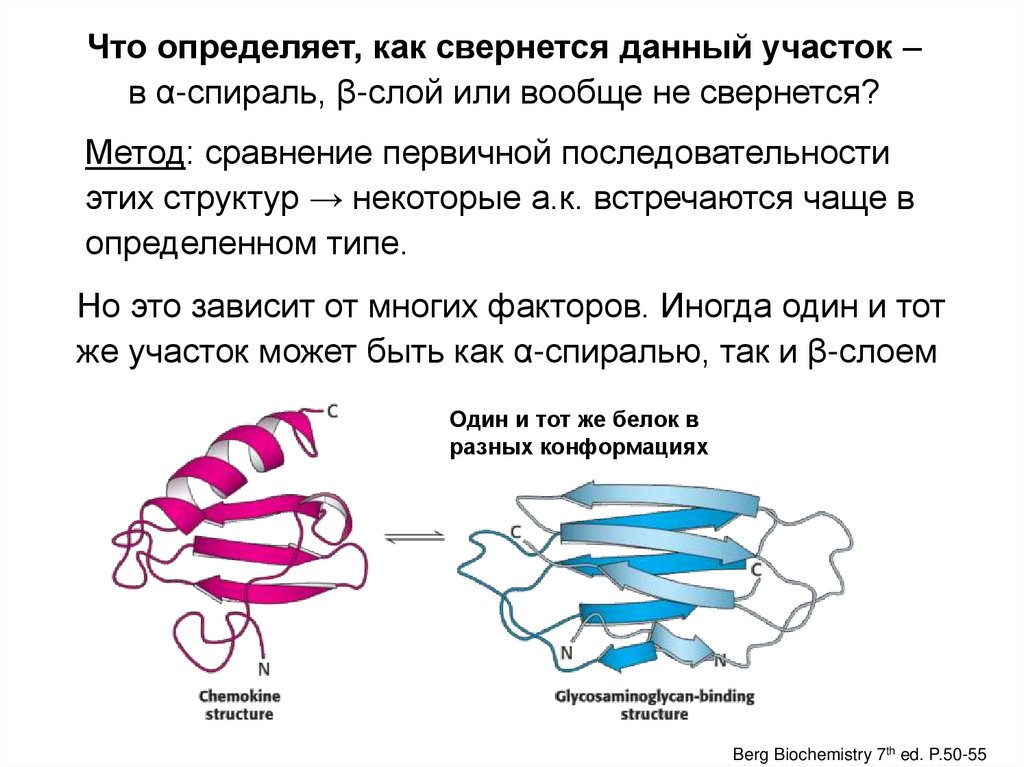
Что определяет, как свернется данный участок –в α-спираль, β-слой или вообще не свернется?
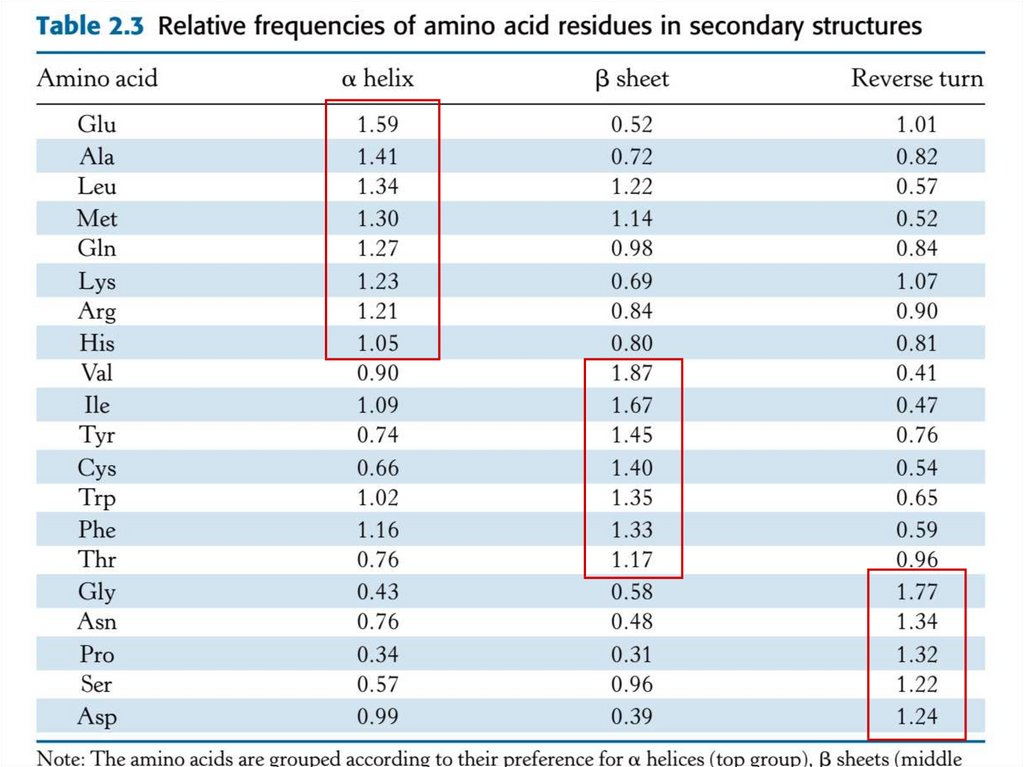
Метод: сравнение первичной последовательности
этих структур → некоторые а.к. встречаются чаще в
определенном типе.
Но это зависит от многих факторов. Иногда один и тот
же участок может быть как α-спиралью, так и β-слоем
Один и тот же белок в
разных конформациях
Berg Biochemistry 7th ed. P.50-55
48.
49.
Итак, у нас есть цепочка сэлементами II структуры
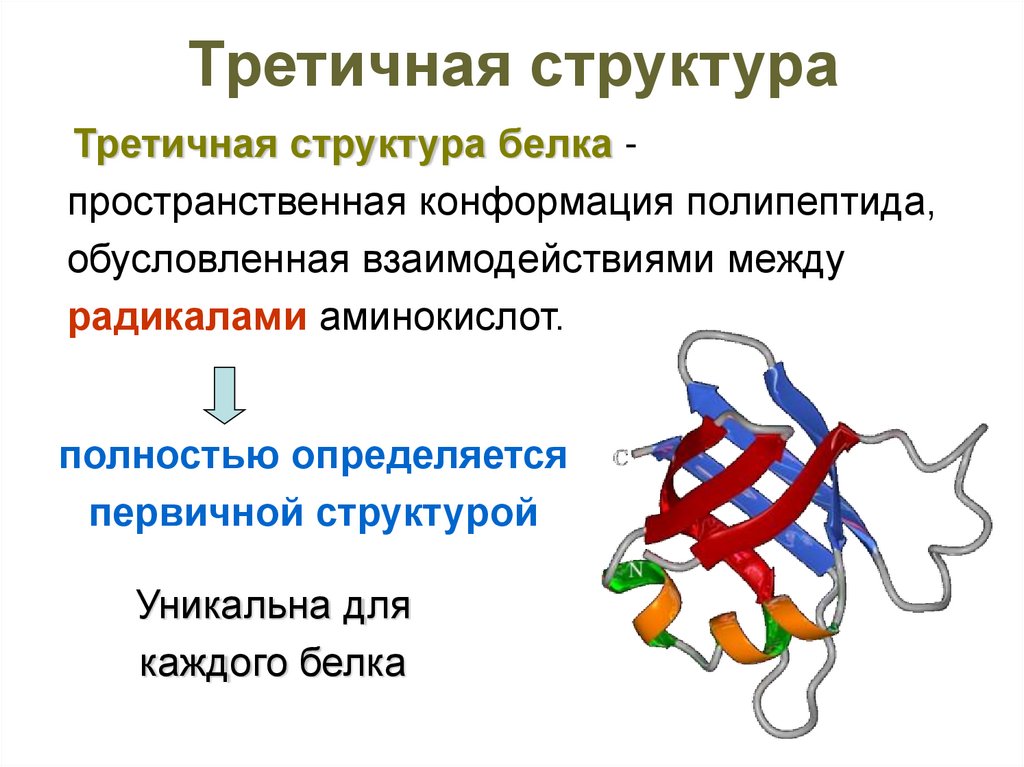
50. Третичная структура
Третичная структура белка пространственная конформация полипептида,обусловленная взаимодействиями между
радикалами аминокислот.
полностью определяется
первичной структурой
Уникальна для
каждого белка
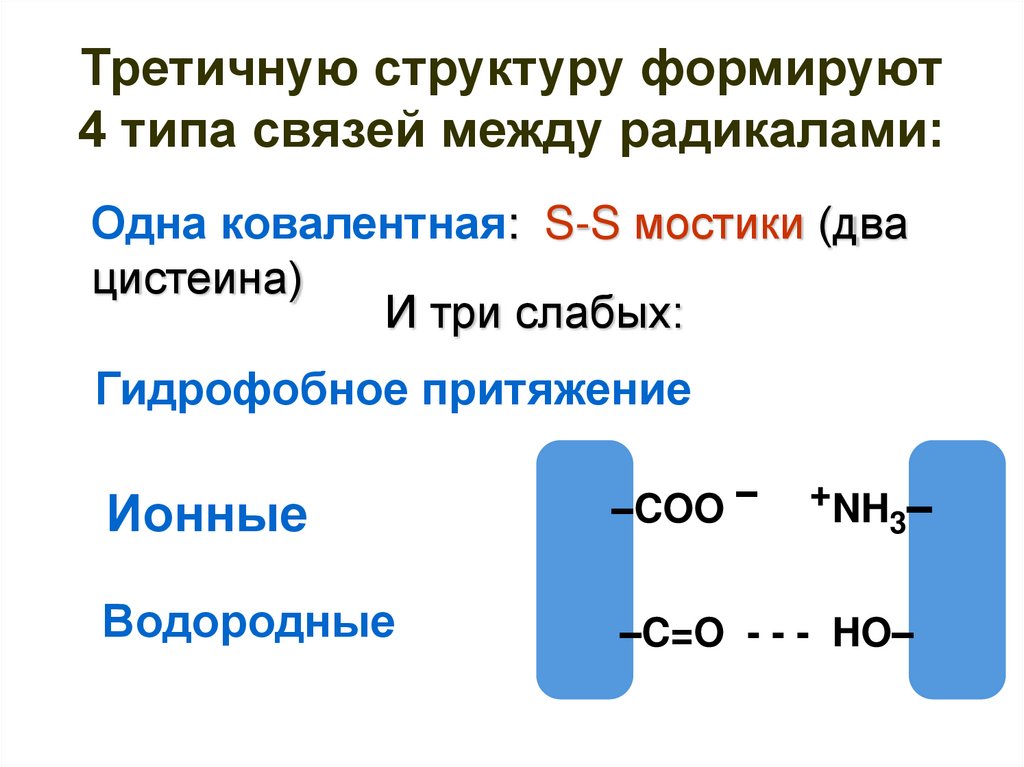
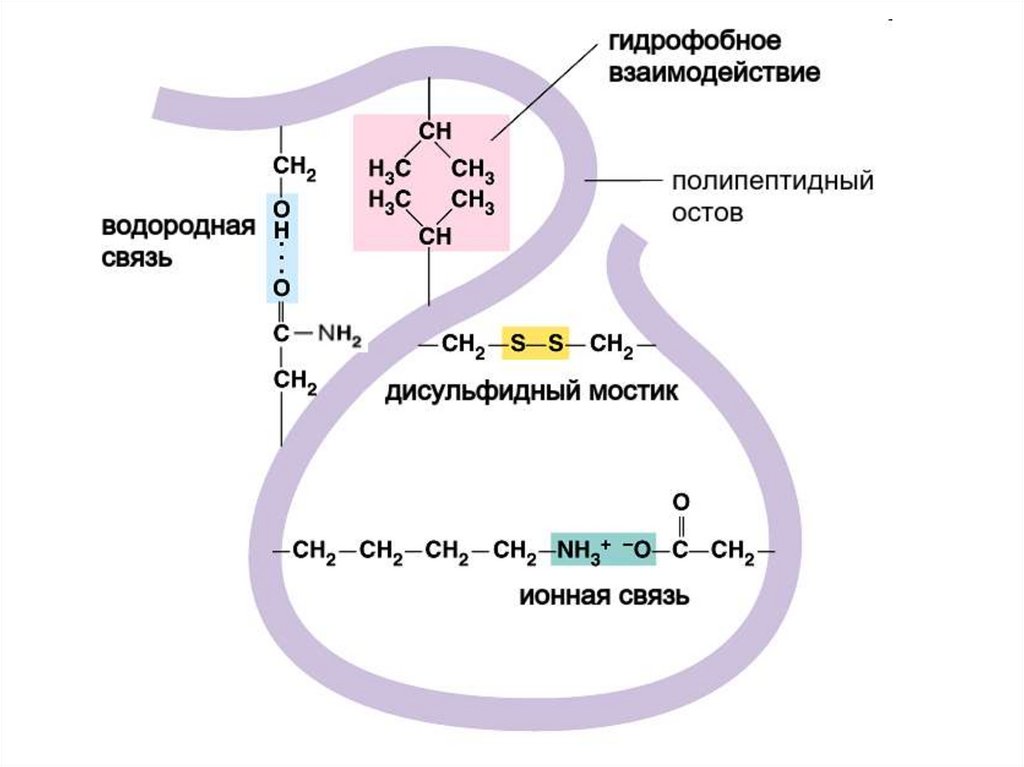
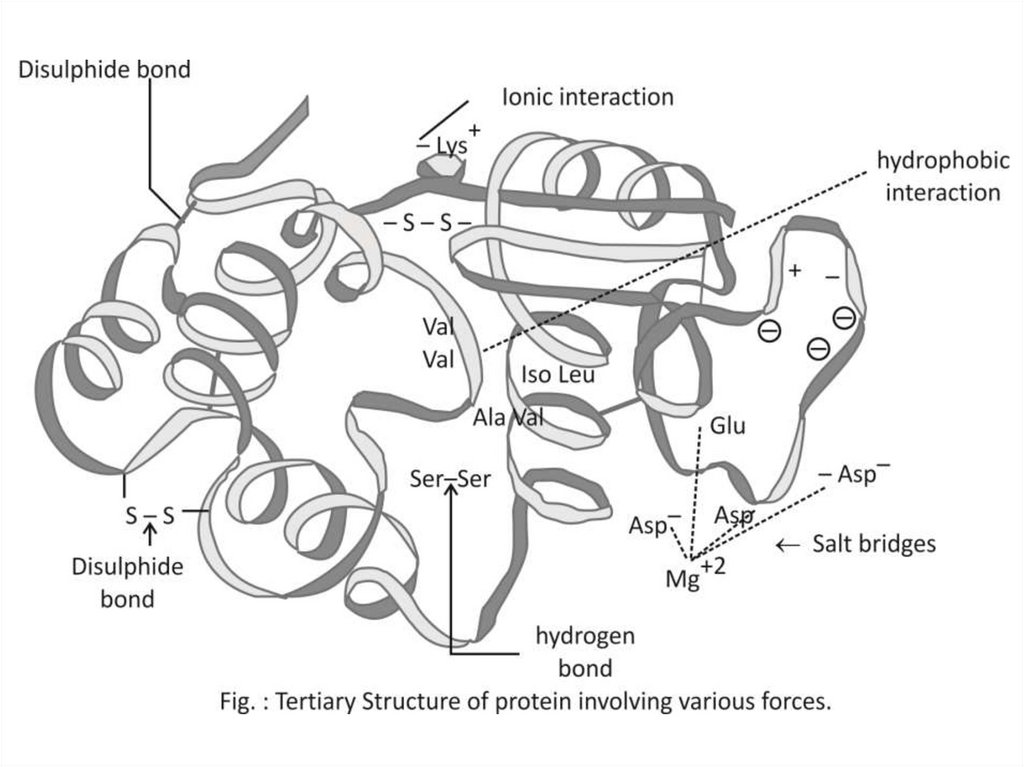
51. Третичную структуру формируют 4 типа связей между радикалами:
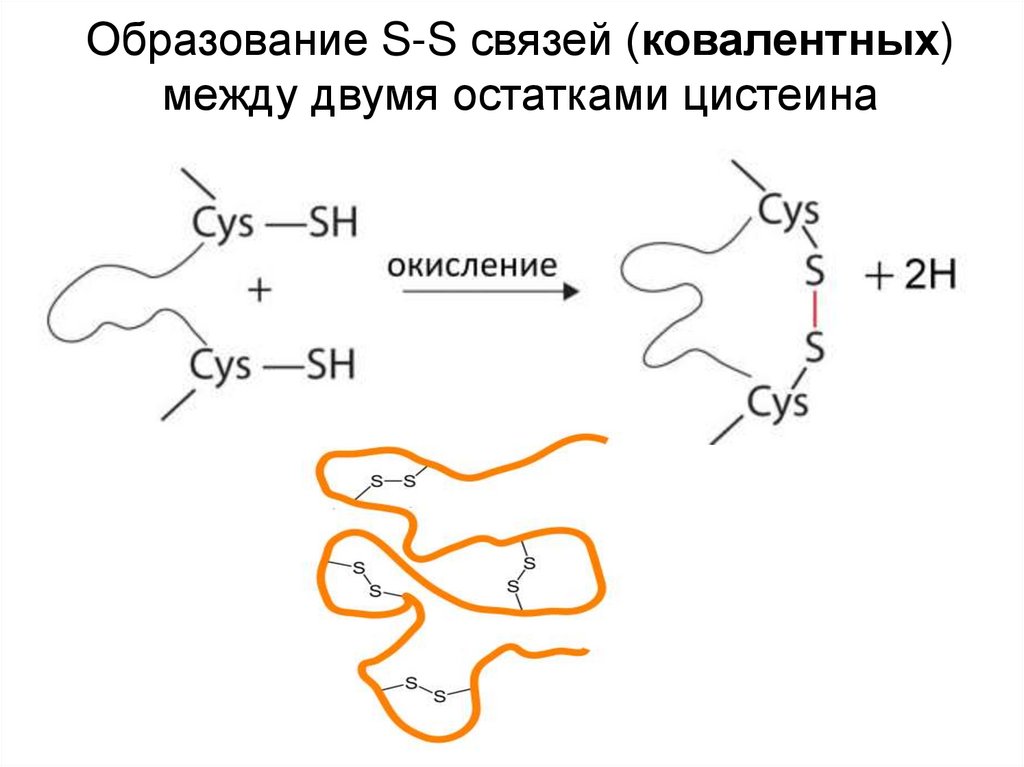
Одна ковалентная: S-S мостики (двацистеина)
И три слабых:
Гидрофобное притяжение
Ионные
–COO –
Водородные
–C=O - - - HO–
+NH
3–
52.
Образование S-S связей (ковалентных)между двумя остатками цистеина
53.
54.
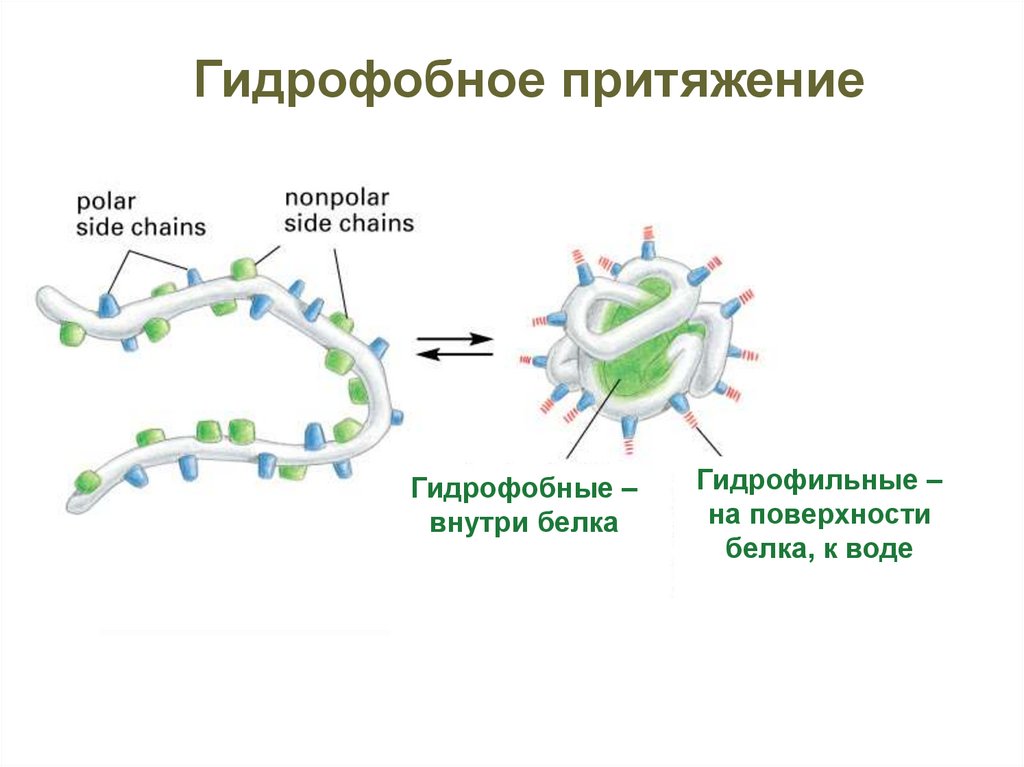
Гидрофобное притяжениеГидрофобные –
внутри белка
Гидрофильные –
на поверхности
белка, к воде
55.
56.
57.
Глобулярный белокГлобула - шарик
Фибриллярный белок
Фибрилла - нить
58.
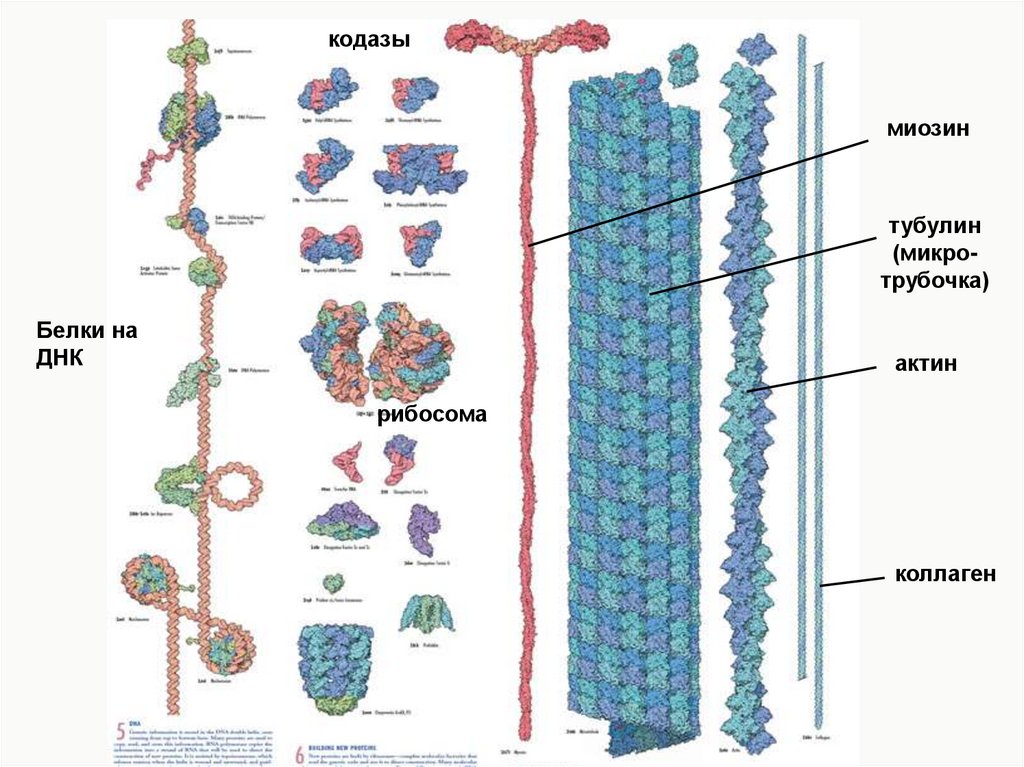
кодазымиозин
тубулин
(микротрубочка)
Белки на
ДНК
актин
рибосома
коллаген
59. Четвертичная структура
IVЧетвертичная структура
Объединение двух и более (до 20)
полипептидных цепочек в один белок.
Одна цепочка = субъединица
Связи – те же, что при
формировании третичной.
Четвертичную структуру
имеют не все белки
(меньше половины)
+
60.
Те же связи формируют и IV структуру– но теперь они между цепочками
61.
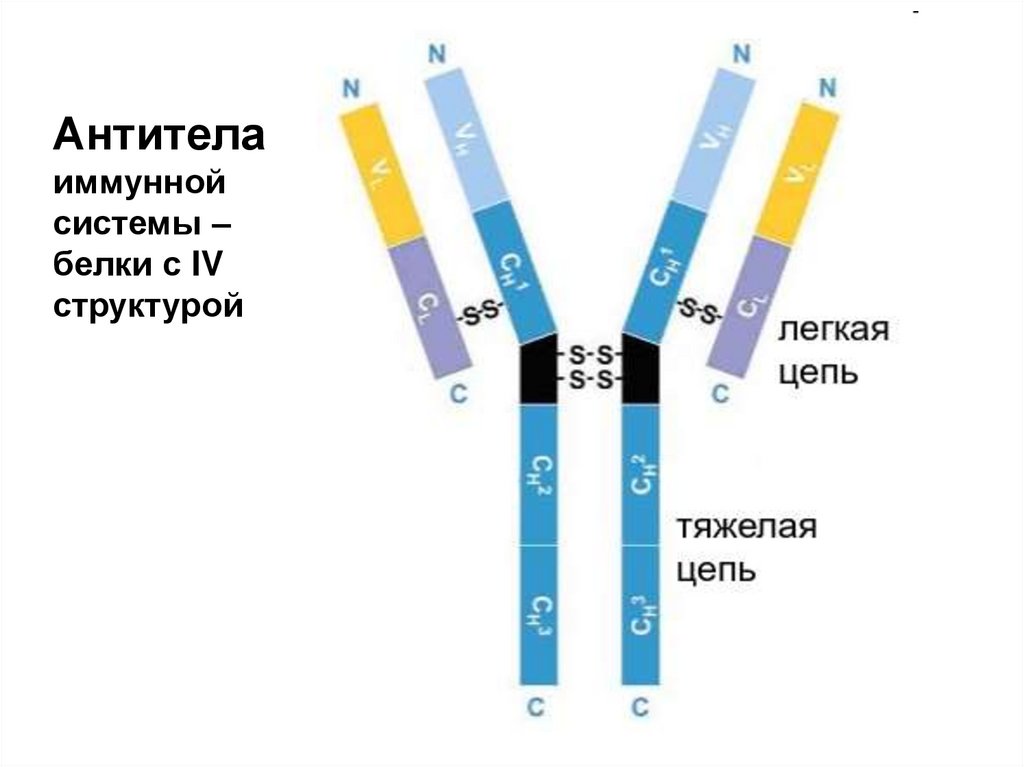
Антителаиммунной
системы –
белки с IV
структурой
62.
IVЧетвертичная структура
Разные цепочки –
разным цветом
63.
ЗадачаВ результате мутации в одном из белков бактерии,
живущей в гидротермальном источнике при t° = 90°C,
произошла замена аминокислоты цистеина на серин.
Какие последствия для нее может иметь такое
изменение?
O
H2N
CH C
CH2
Цис
SH
O
H2 N
OH
CH C
OH
CH2
OH
Сер
Ответ: Цистеин участвует в образовании дисульфидных
мостиков. Отсутствие мостика при высокой температуре
приведет к денатурации белка, что может быть смертельным
для бактерии.
64. Белковые домены
65. Образование третичной структуры из элементов вторичной
ДоменМотив
петля
бочонок
66.
67.
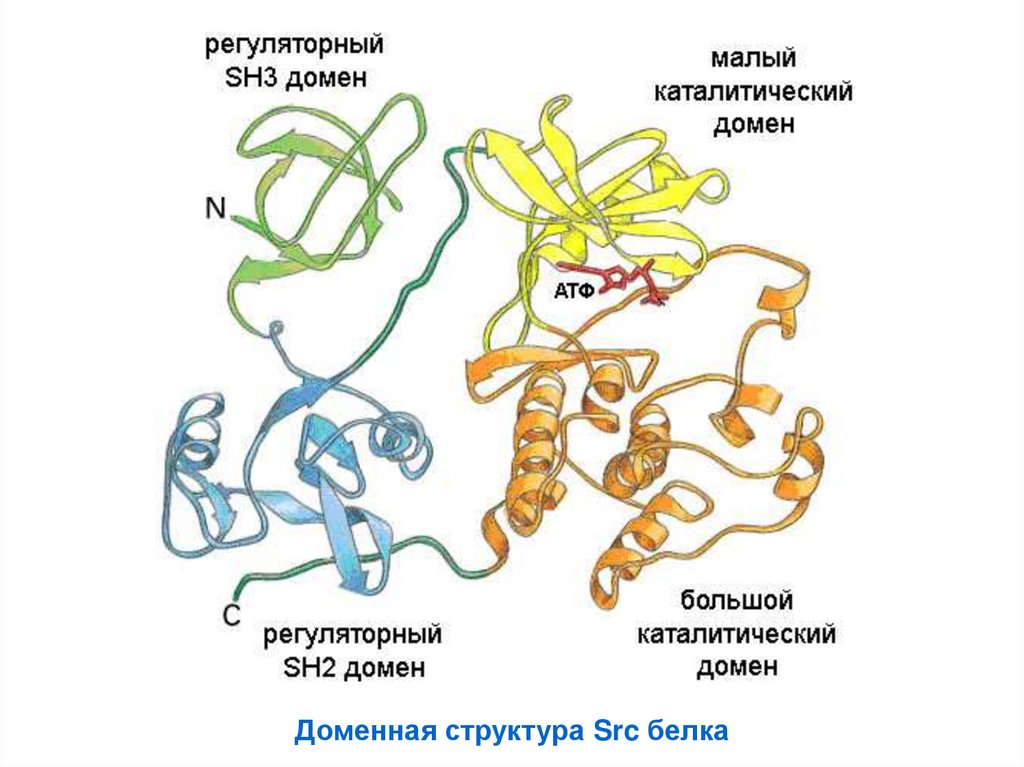
Доменная структура Src белка68.
Домен – часть белкавыделенная структурно
(сворачивается почти независимо)
выполняет одну функцию
В эволюции домены –
функциональные блоки
из которых строятся
новые белки
69.
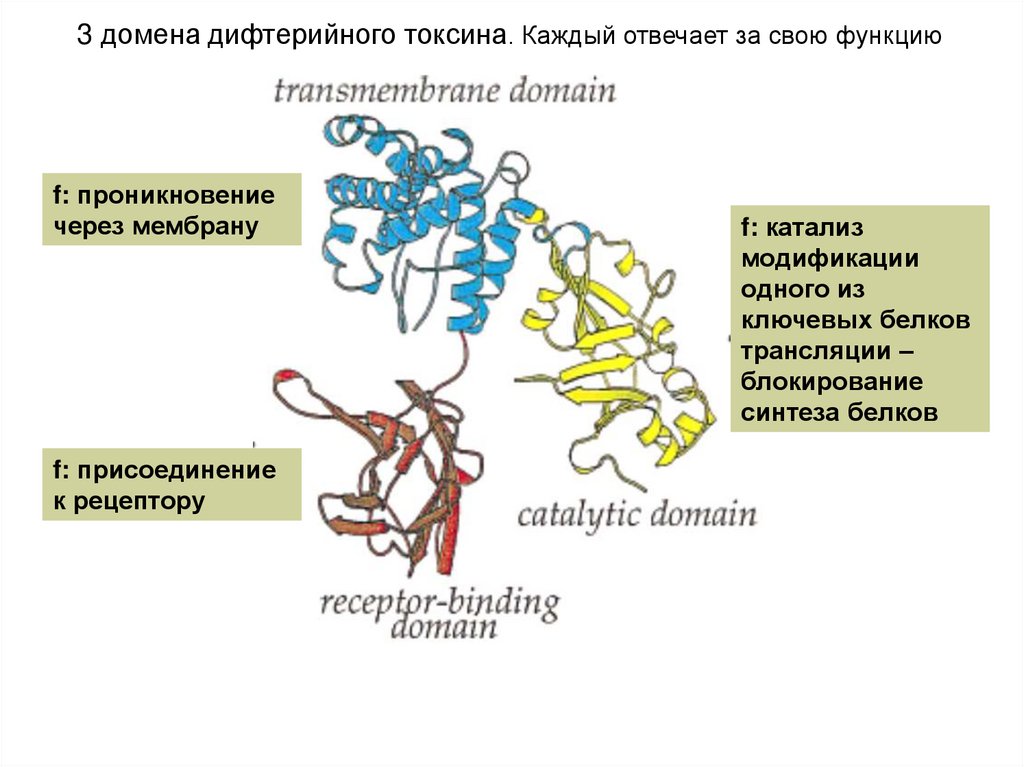
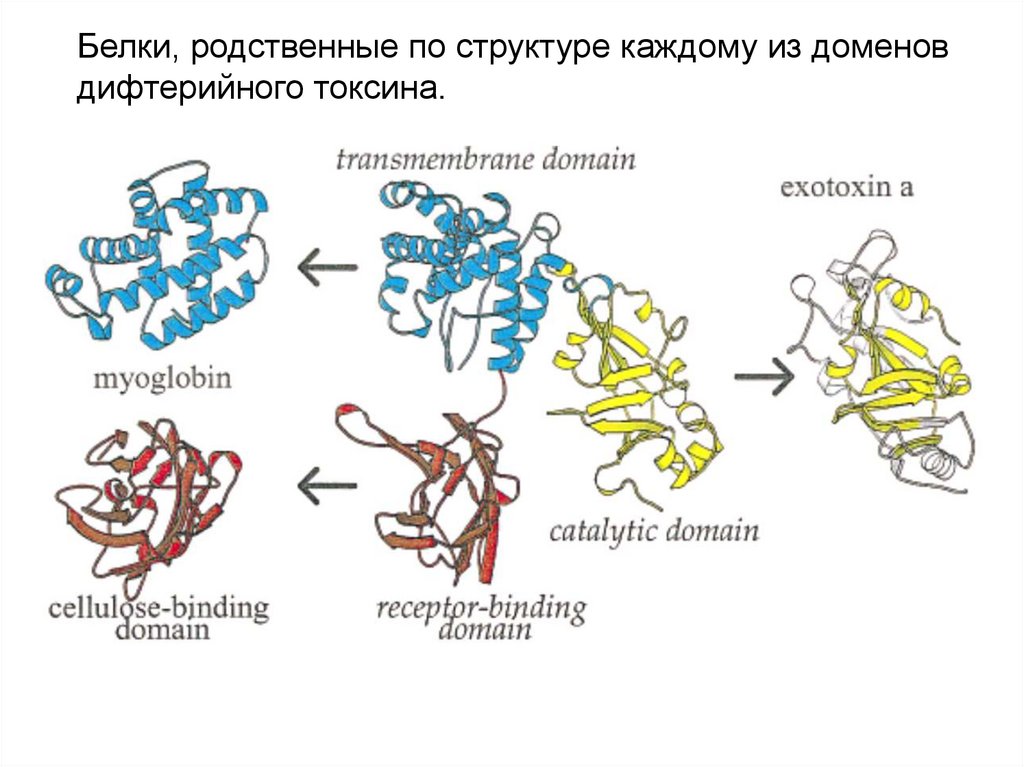
3 домена дифтерийного токсина. Каждый отвечает за свою функциюf: проникновение
через мембрану
f: присоединение
к рецептору
f: катализ
модификации
одного из
ключевых белков
трансляции –
блокирование
синтеза белков
70.
Белки, родственные по структуре каждому из доменовдифтерийного токсина.
71.
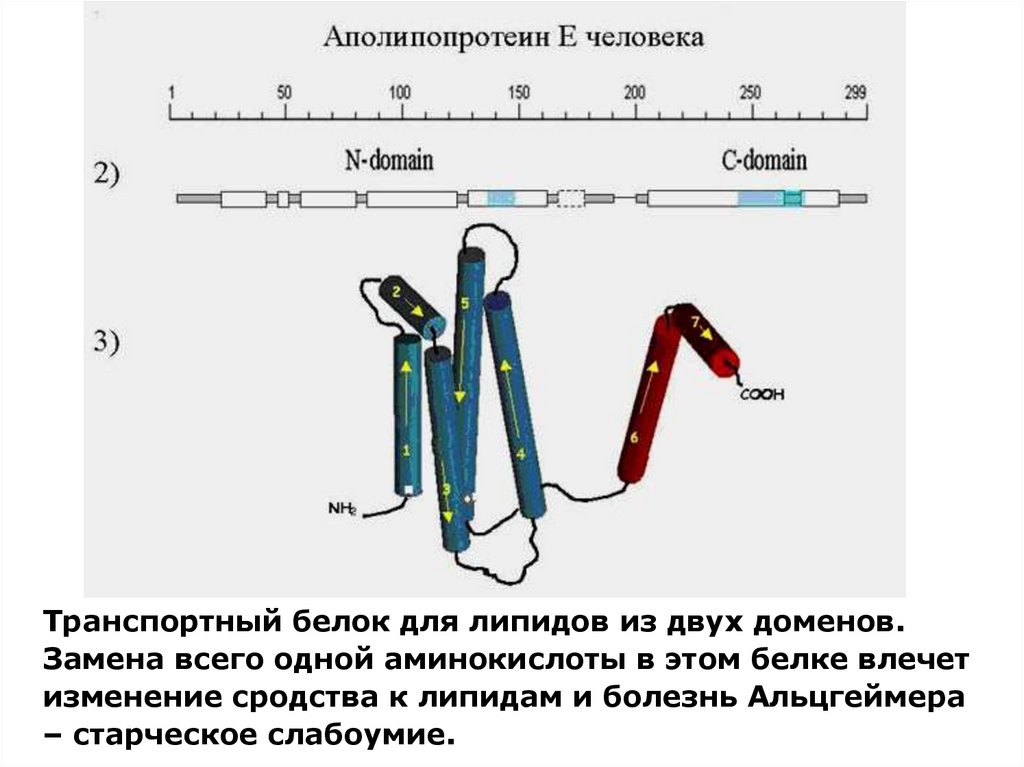
Транспортный белок для липидов из двух доменов.Замена всего одной аминокислоты в этом белке влечет
изменение сродства к липидам и болезнь Альцгеймера
– старческое слабоумие.
72.
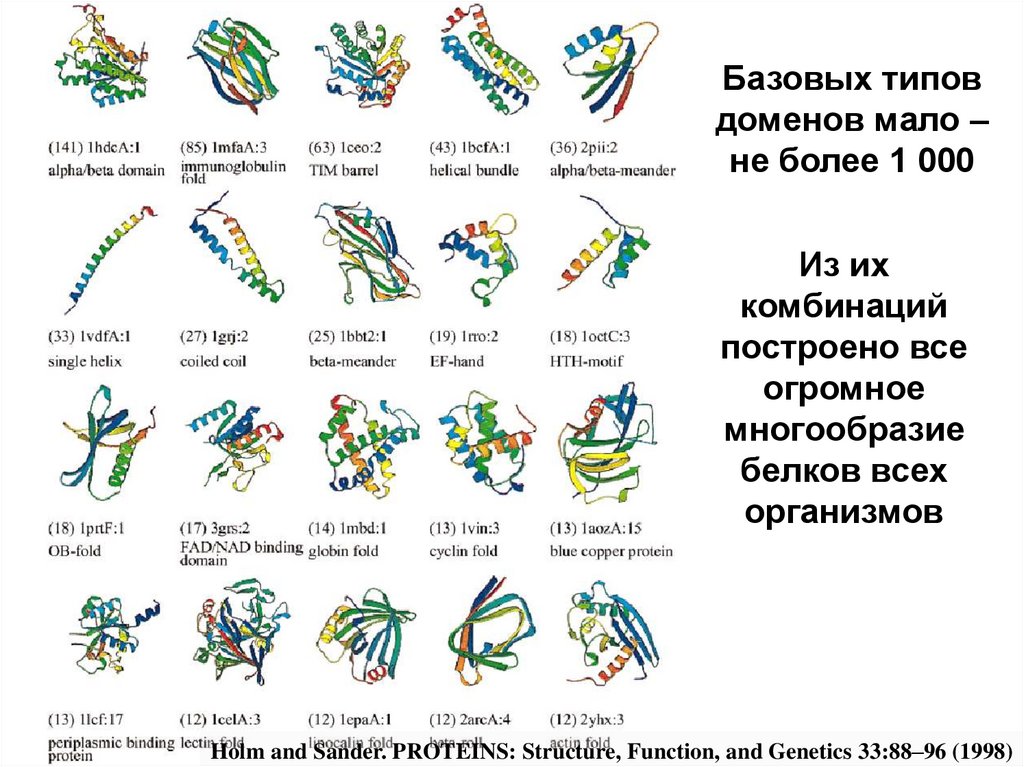
Базовых типовдоменов мало –
не более 1 000
Из их
комбинаций
построено все
огромное
многообразие
белков всех
организмов
Holm and Sander. PROTEINS: Structure, Function, and Genetics 33:88–96 (1998)
73.
Белки разных биологических видовс одной функцией – похожи
по пространственной форме
Хотя первичная последовательность может сильно отличаться
74.
Транспортный белок железа – ферритинчеловека (зеленый) и лошади (голубой)
75. Домашнее задание
Уметь нарисовать аминокислоту ипептидную связь.
Знать, что такое I, II, III и IV
структура
№ 14, 15, 16 задачника
76.
Лишние слайды77.
78.
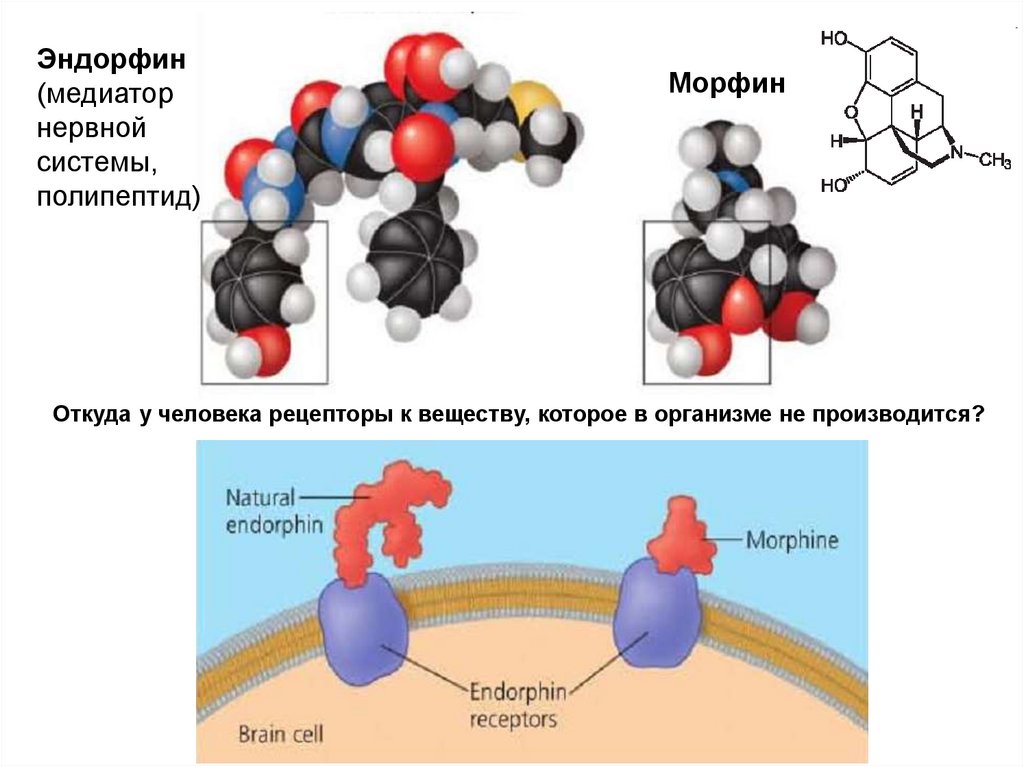
79. Для биологических молекул важны не только химическая формула, но и форма
Узнавание «ключ к замку»80.
Эндорфин(медиатор
нервной
системы,
полипептид)
Морфин
Откуда у человека рецепторы к веществу, которое в организме не производится?
81.
Авторские права сохранены.Вы можете свободно
Вы НЕ имеете права
Использовать данную
Использовать ее в коммерческих
презентацию в образовательных
целях с сохранением авторства.
Использовать рисунки и
целях.
Выкладывать на интернет-сайтах
для скачивания.
отдельные слайды в своих
презентациях и на сайтах со
ссылкой на источник.
Использовать слайды с текстом и
рисунками автора без ссылки на
источник.
© М.А. Волошина 2008
All RIGHTS RESERVED
http://biologii.net








































 chemistry
chemistry








