Similar presentations:
Гниение аминокислот в кишечнике
1. Гниение аминокислот в кишечнике
1.Серосодержащие аминокислоты (цистеин, цистин,метионин) подвергаются распаду с образованием
сероводорода (Н2S) и метилмеркаптана (СН3SН).
2.Диаминокислоты - лизин, орнитин декарбоксилируются с
образованием соответственно кадаверина и путресцина,
обезвреживаются диаминооксидазами в клетках
кишечника, далее всасываются в кровь и экскретируются с
мочой.
2.
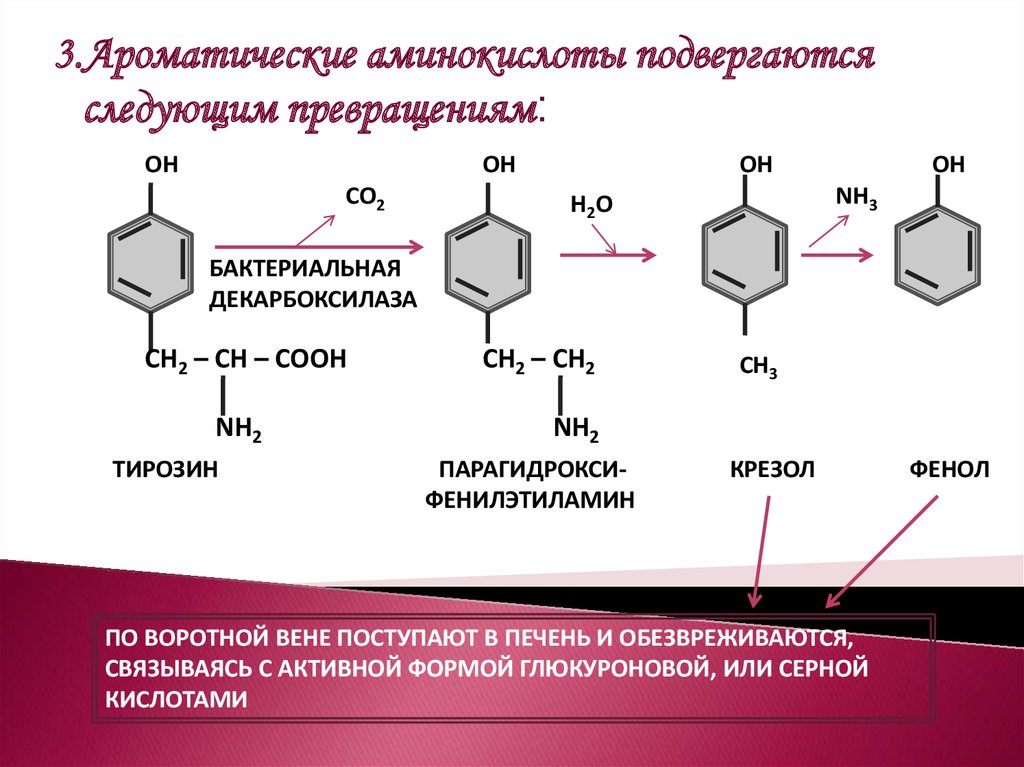
3.Ароматические аминокислоты подвергаютсяследующим превращениям:
ОН
ОН
СО2
ОН
ОН
NН3
Н2О
БАКТЕРИАЛЬНАЯ
ДЕКАРБОКСИЛАЗА
СН2 – СН – СООН
NН2
ТИРОЗИН
СН2 – СН2
СН3
NН2
ПАРАГИДРОКСИФЕНИЛЭТИЛАМИН
КРЕЗОЛ
ПО ВОРОТНОЙ ВЕНЕ ПОСТУПАЮТ В ПЕЧЕНЬ И ОБЕЗВРЕЖИВАЮТСЯ,
СВЯЗЫВАЯСЬ С АКТИВНОЙ ФОРМОЙ ГЛЮКУРОНОВОЙ, ИЛИ СЕРНОЙ
КИСЛОТАМИ
ФЕНОЛ
3. Превращение триптофана
СН2 – СН – СООНТРИПТОФАН
СО2
NН2
N
Н
СН2 – СН2
Н2О
ИНДОЛИЛЭТИЛАМИ
NНН2
N
Н
СН3
СКАТОЛ
NН3
N
Н
N
Н
ПЕЧЕНЬ
ИНДОЛ
4. Обезвреживание токсических веществ в печени включает следующие 3 этапа:
1. Окисление токсических веществ;2. Глюкуронирование или сульфирование с
использованием активных форм глюкуроновой и
серной кислот с образованием эфиров;
3.Образование солей щелочных или щелочноземельных металлов.
5. АКТИВНАЯ ФОРМА СЕРНОЙ КИСЛОТЫ
3-ФОСФОАДЕНОЗИН-5-ФОСФОСУЛЬФАТ (ФАФС)NН2
N
О
N
N
О
N
НО – S – О – Р – О – СН2
О
О
ОН
Н
Н
Н
Н
О- Р ОН
6. АКТИВНАЯ ФОРМА ГЛЮКУРОНОВОЙ КИСЛОТЫ
УРИДИНДИФОСФОГЛЮКУРОНОВАЯ КИСЛОТА (УДФГК)О
СООН
Н
О
Н
Н
ОН
НО
Н
Н
НN
О
О
О
ОН
ОН
О
N
НО
О –Р– О – Р – О – СН2
Н
Н
Н
Н
О- Р ОН
7. Обезвреживание индола в печени
О2 ФАДН2Индол
ФАД Н2О
УДФГК
УДФ
индоксил
МОГ
УДФГК трансфераза
индоксилглюкуроновая кислота
К
животный индикан
8. Обезвреживание индола в печени
О2 ФАДН2индоксил
Н
УДФ
Н
НО
–О
УДФГК трансфераза
К
СООК
ОН
Н
Н
НО
–О
N
Н
Индоксилглукуроновая
кислота
Н
СООН
ОН
Н
ОН
НО
Н
УДФГК
N
Н
МОГ
ОН
НО
Н
индол
N
Н
–ОН
ФАД Н2О
N
Н
ЖИВОТНЫЙ
ИНДИКАН
9. Промежуточный обмен аминокислот
А) Общие пути катаболизма аминокислот:1. Трансаминирование;
2. Дезаминирование:
а) окислительное (прямое, непрямое);
б) восстановительное;
в) гидролитическое;
г) внутримолекулярное;
3. декарбоксилирование;
Б) Специфические пути катаболизма.
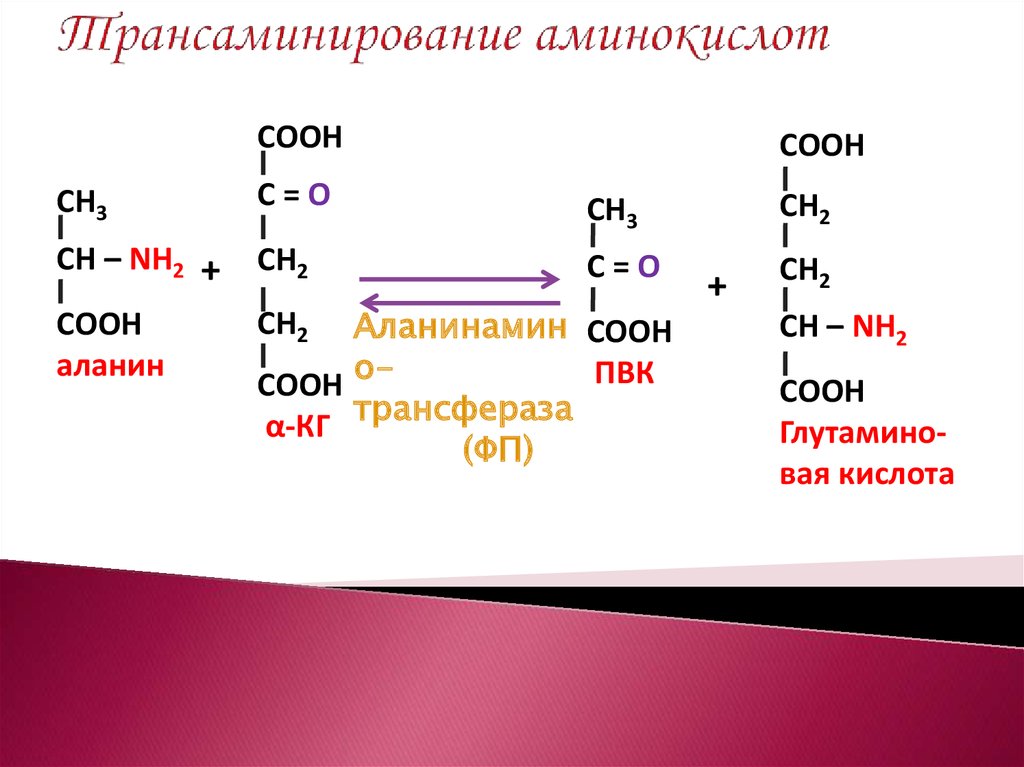
10. Трансаминирование аминокислот
СООНСООН
СН3
С=О
СН3
СН – NН2 +
СН2
С=О
СООН
аланин
СН2
Аланинамин СООН
ПВК
СООН оα-КГ трансфераза
(ФП)
СН2
+
СН2
СН – NН2
СООН
Глутаминовая кислота
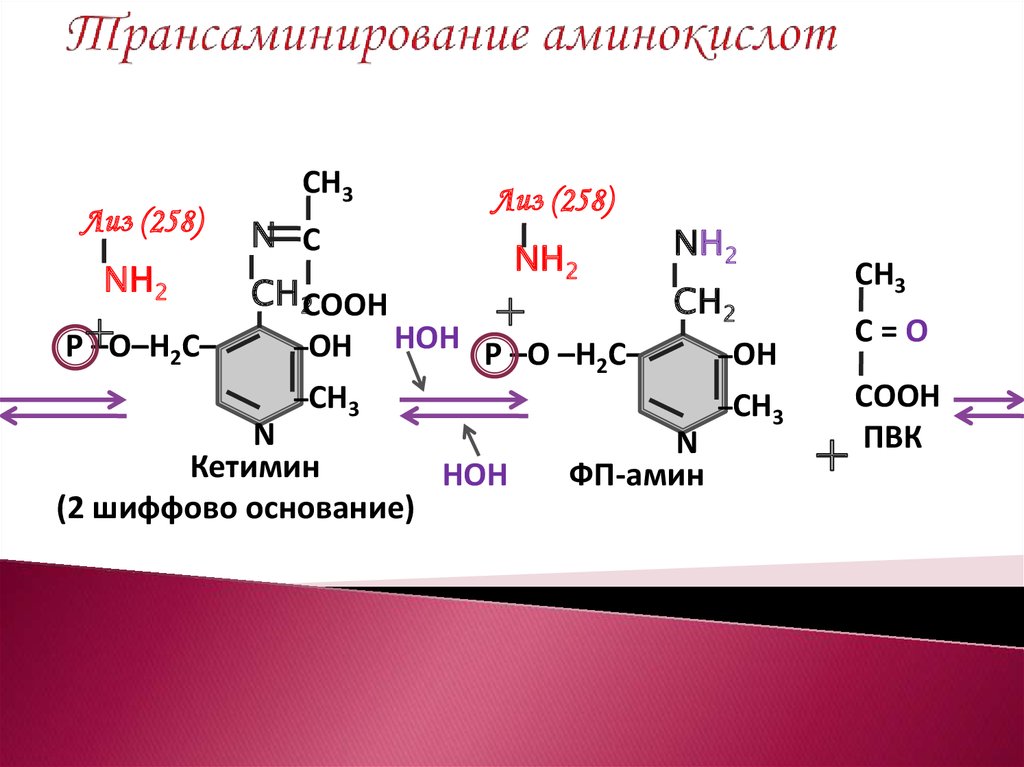
11. Трансаминирование аминокислот
ПЕРВАЯ ПОЛУРЕАКЦИЯЛиз (258)
Лиз (258)
N
СН
Р –О–Н2С–
–ОН
–СН3
N
ФП в активном
центре фермента
(АлАТ)
СН3
+ СН – NН2
СООН
NН2
+
Р – О – Н2С –
СН3
N СН
СН СООН
–ОН
–СН3
N
Альдимин
(1 шиффово основание)
12. Трансаминирование аминокислот
Лиз (258)NН2
Р+
–О–Н2С–
СН3
N С
СН2СООН
–ОН
Лиз (258)
NН2
+
НОН Р –О –Н С–
2
NН2
СН2
–СН3
N
Кетимин
НОН
(2 шиффово основание)
СН3
N
ФП-амин
С=О
–ОН
–СН3
+
СООН
ПВК
13. Трансаминирование аминокислот
ВТОРАЯ ПОЛУРЕАКЦИЯNН2
+
NН2
СН2
Р –О –Н2С–
N
ФП-амин
–ОН
СООН
Лиз (258)
С=О
NН2
СН2
+
–СН3 СН
2
СООН
α-КГ
НОН
Лиз (258)
Р+
–О–Н2С–
СН2–СН2–СООН
N С
СН2СООН
–ОН
–СН3
N
Кетимин
(2 шиффово основание)
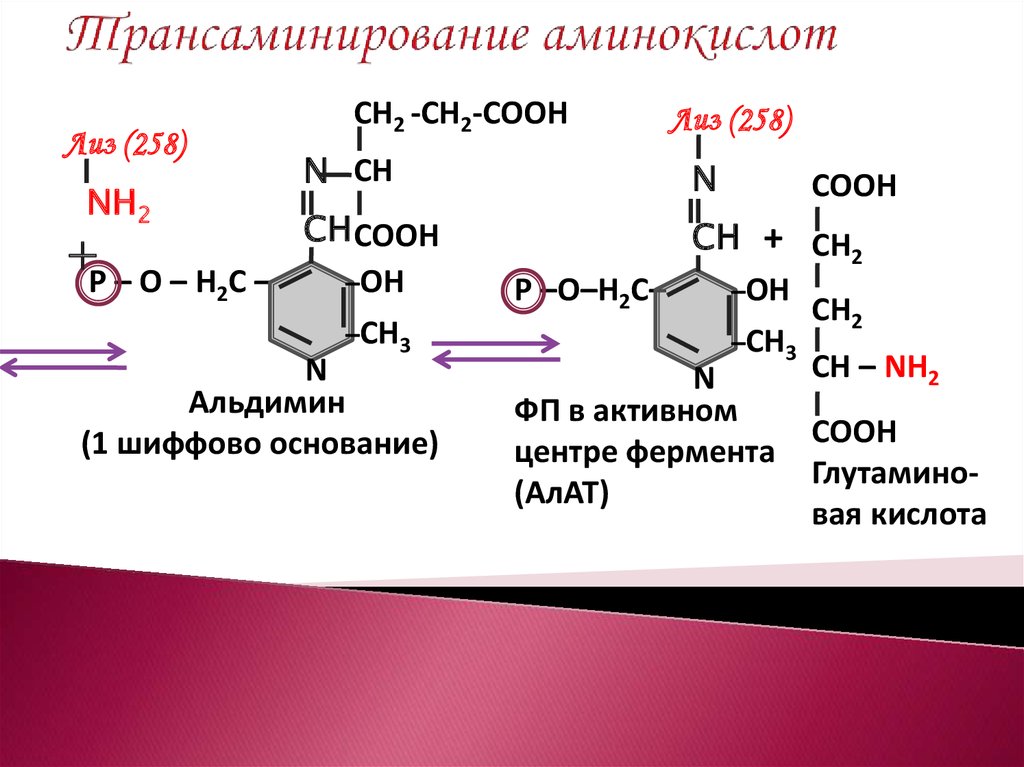
14. Трансаминирование аминокислот
Лиз (258)NН2
+
Р – О – Н2С –
СН2 -СН2-СООН
N СН
СН СООН
–ОН
–СН3
N
Альдимин
(1 шиффово основание)
Лиз (258)
N
СООН
СН + СН2
Р –О–Н2С–
–ОН
СН2
–СН3
СН – NН2
N
ФП в активном
СООН
центре фермента
Глутамино(АлАТ)
вая кислота
15. Лекция Дезаминирование аминокислот. Пути образования и обезвреживания аммиака в организме.
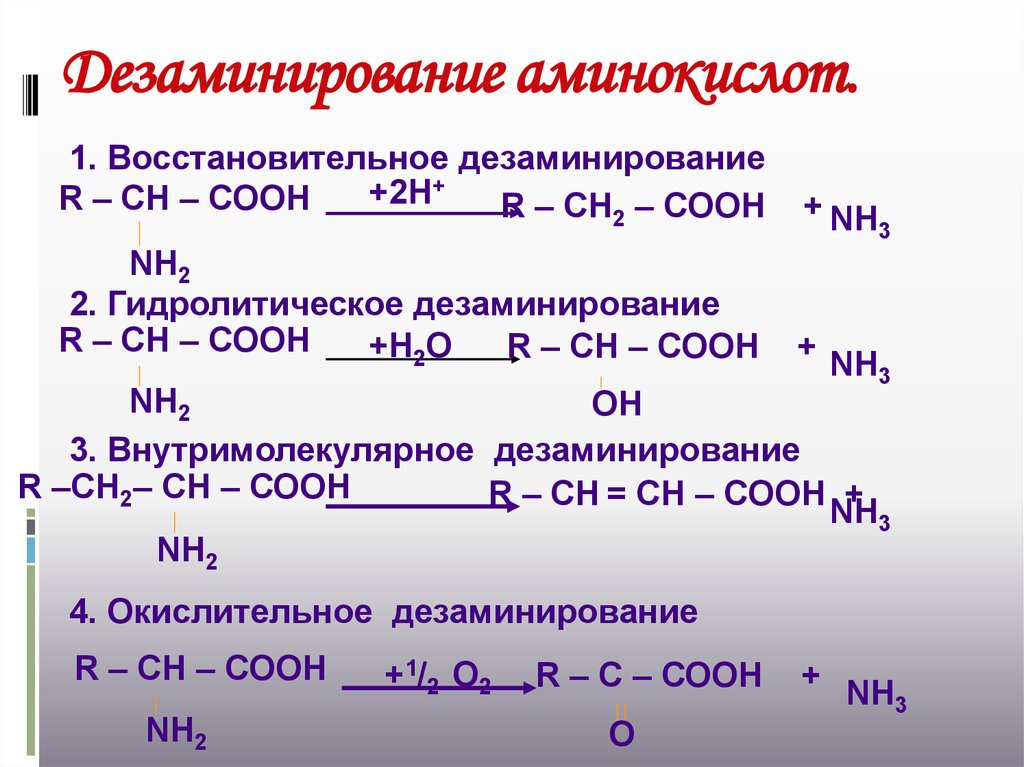
16. Дезаминирование аминокислот.
1. Восстановительное дезаминирование+2Н+
R – СН – СООН
R – СН2 – СООН
+ NН
NН2
2. Гидролитическое дезаминирование
R – СН – СООН
+Н2О
R – СН – СООН
+
3
NН3
NН2
ОН
3. Внутримолекулярное дезаминирование
R –СН2– СН – СООН
R – СН = СН – СООН +
NН3
NН2
4. Окислительное дезаминирование
R – СН – СООН
NН2
+ 1/ 2 О 2
R – С – СООН
О
+
NН3
17.
Дезаминирование аминокислотДезаминирование глицина
СООН
СН2 О ФАД
2
NН2
ГЛИЦИН
ФАДН2
ОКСИДАЗА
Н2О2
Н2О
NН3
О
СН – СООН
С–Н
NН
СООН
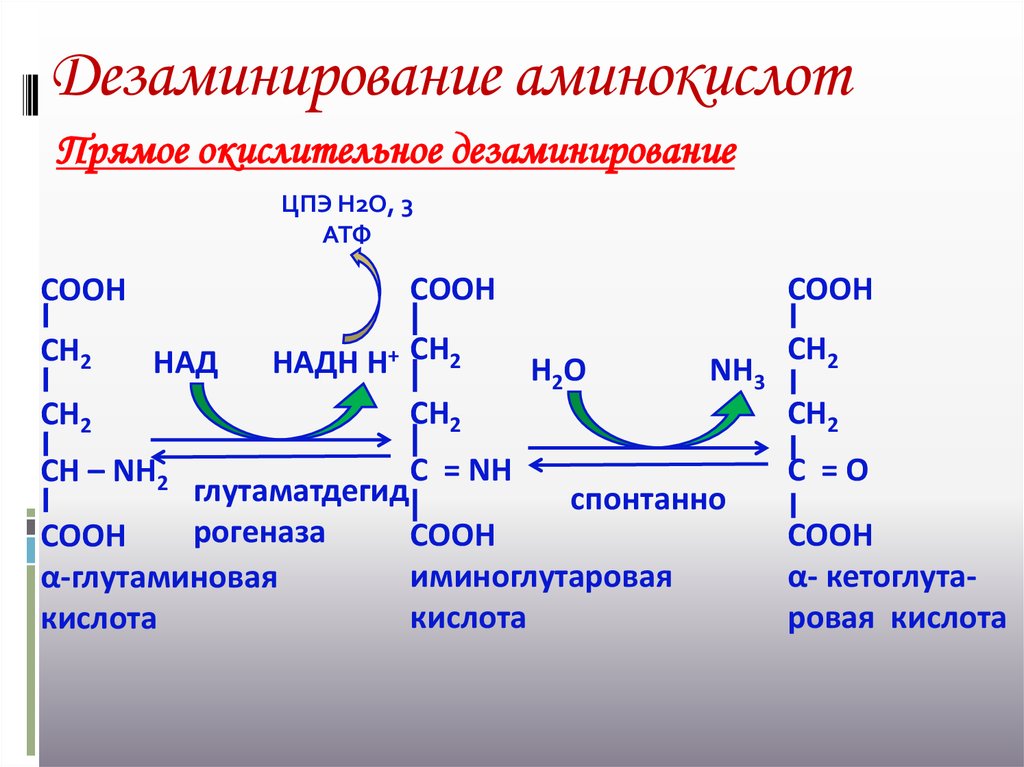
18. Дезаминирование аминокислот
Прямое окислительное дезаминированиеЦПЭ Н2О, 3
АТФ
СООН
СООН
СН2
НАД
СН2
СН – NН2
НАДН Н+ СН2
СН2
С = NН
СООН
Н2О
NН3
глутаматдегид
спонтанно
рогеназа
СООН
СООН
иминоглутаровая
α-глутаминовая
кислота
кислота
СН2
СН2
С =О
СООН
α- кетоглутаровая кислота
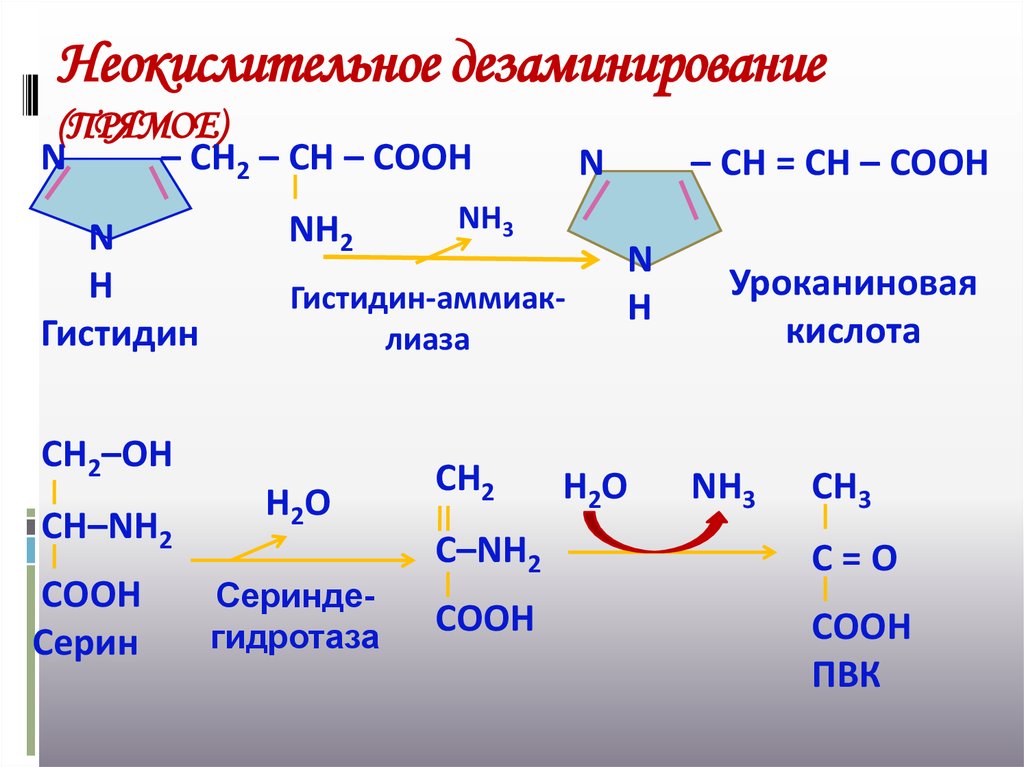
19. Неокислительное дезаминирование (ПРЯМОЕ)
N– СН2 – СН – СООН
N
Н
Гистидин
NН2
СООН
Серин
NН3
Гистидин-аммиаклиаза
СН2–ОН
СН–NН2
N
Н2О
Сериндегидротаза
СН2
– СН = СН – СООН
N
Н
Н2О
Уроканиновая
кислота
NН3
СН3
С–NН2
С=О
СООН
СООН
ПВК
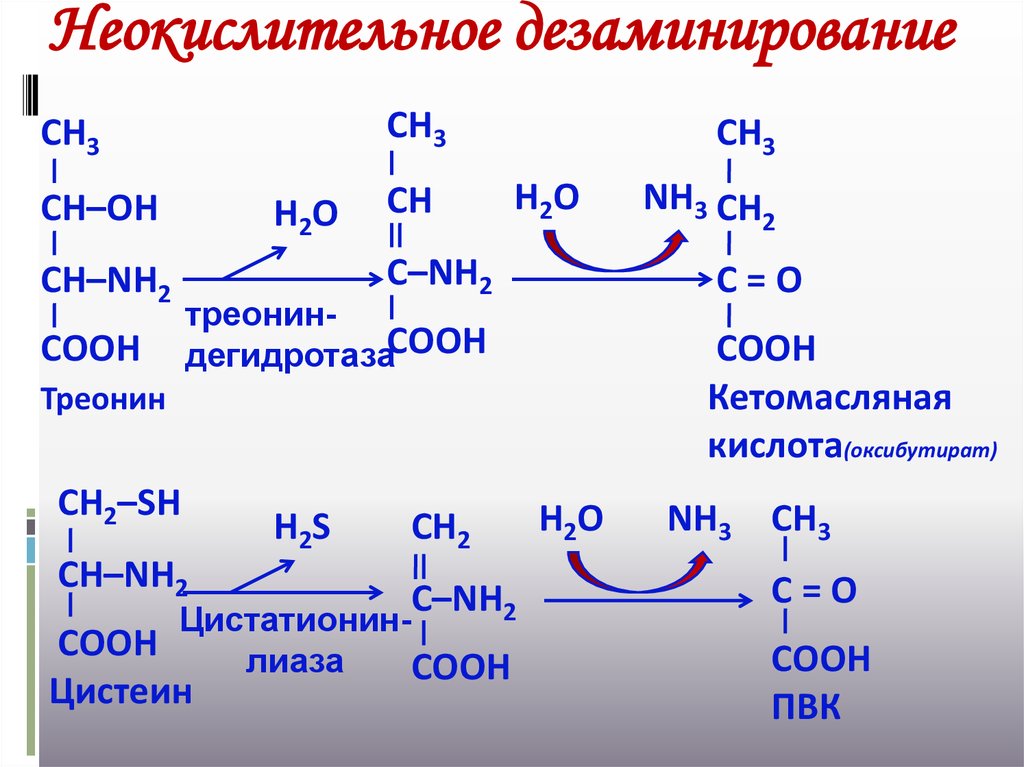
20.
Неокислительное дезаминированиеСН3
СН3
СН–ОН
СН–NН2
СООН
Н2О
СН
СН3
Н2О
С–NН2
СООН
Кетомасляная
кислота(оксибутират)
Треонин
СН–NН2
Н2S
СН2
С–NН2
ЦистатионинСООН
лиаза
СООН
Цистеин
2
С=О
треониндегидротазаСООН
СН2–SН
NН3 СН
Н2О
NН3 СН3
С=О
СООН
ПВК
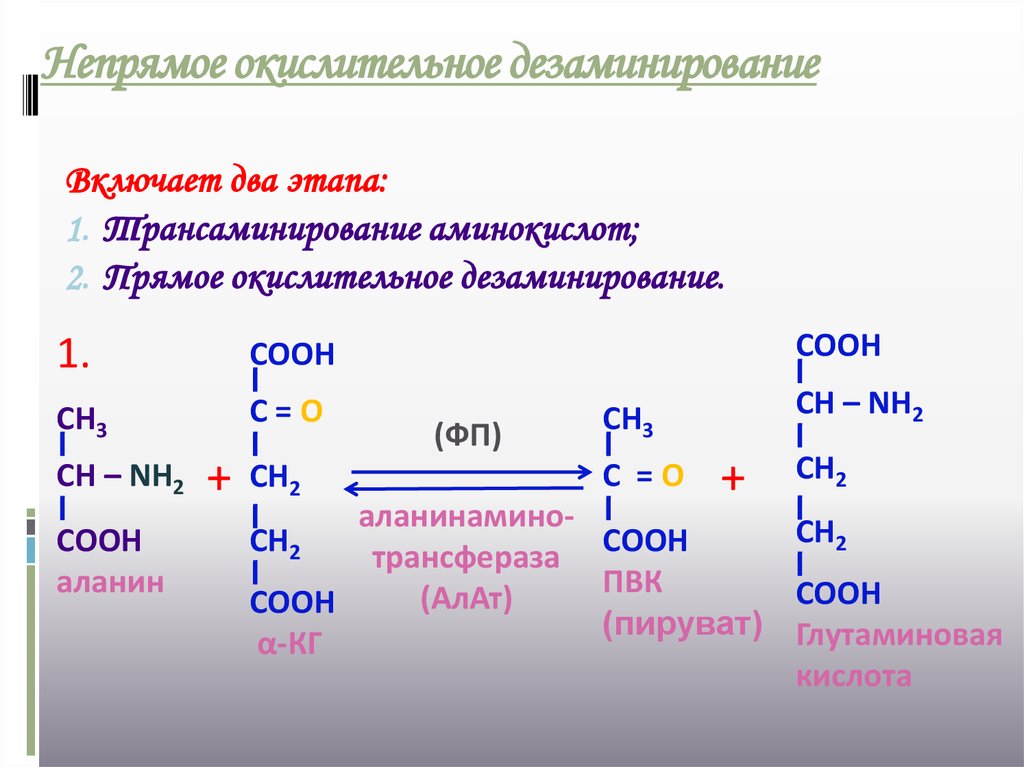
21. Непрямое окислительное дезаминирование
Включает два этапа:1. Трансаминирование аминокислот;
2. Прямое окислительное дезаминирование.
1.
СООН
СН3
С=О
СН – NН2
СООН
аланин
+
СН2
СООН
(ФП)
СН – NН2
СН3
С =О
+
СН2
аланинаминоСН2
СН2
СООН
трансфераза
ПВК
СООН
(АлАт)
СООН
(пируват) Глутаминовая
α-КГ
кислота
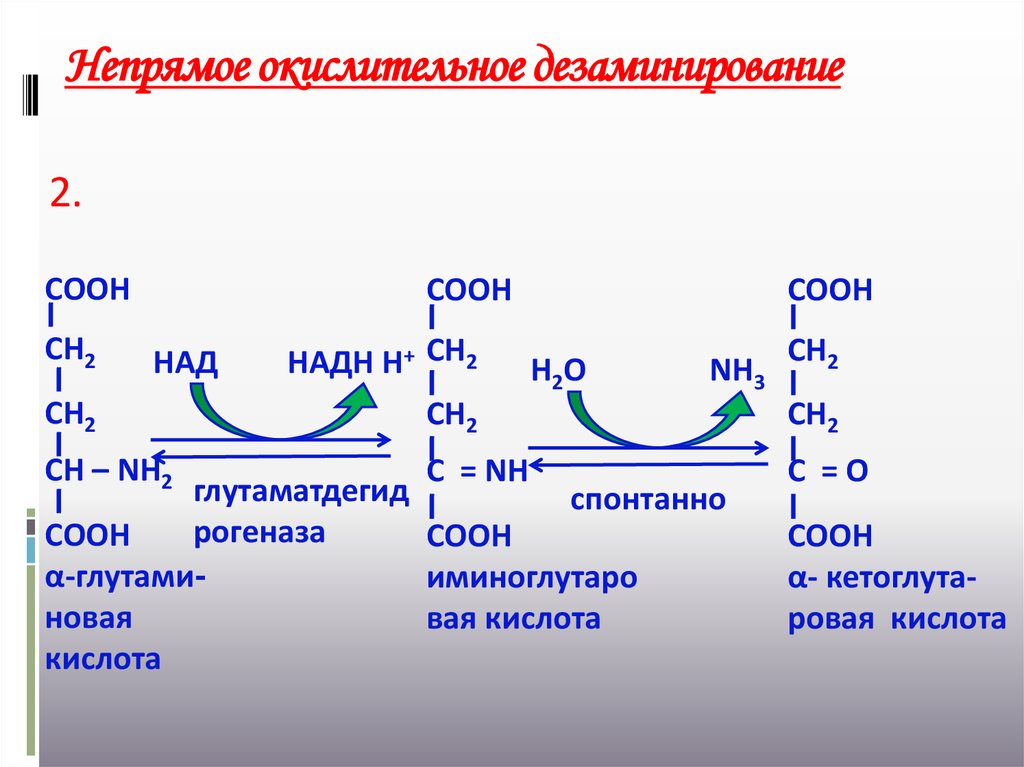
22. Непрямое окислительное дезаминирование
2.СООН
СН2
СООН
НАД
НАДН Н+ СН2
СООН
Н2О
NН3
СН2
СН2
СН2
СН2
СН – NН2
С = NН
С =О
глутаматдегид
спонтанно
рогеназа
СООН
СООН
α-глутамииминоглутаро
новая
вая кислота
кислота
СООН
α- кетоглутаровая кислота
23. Основные источники аммиака
1. Поступление аммиака из кишечника в портальнуювену;
2. Окислительное дезаминирование аминокислот;
3. Трансдезаминирование аминокислот;
4. Дезаминирование биогенных аминов;
5. Дезаминирование пуриновых и пиримидиновых
оснований;
6. Дезаминирование глутамина и аспарагина;
7. Дезаминирование порфобилиногена;
8. Дезаминирование аминосахаров, сложных липидов.
24. Действие аммиака на организм:
1.2.
3.
4.
5.
При восстановительном аминировании α-кетоглутаровая
кислота отвлекается от ЦТК , что может привести к
замедлению регенерации оксалоацетата, накоплению ацетил-КоА,
кетонемии и ацидозу , подавляются процессы окислительного
фосфорилирования (синтез АТФ);
Аммиак обладает сильными основными свойствами и может
вызвать сдвиг рН в щелочную сторону;
В нервной ткани аммиак усиливает синтез глутамина из
глутаминовой кислоты , что может привести к повышению
осмотического давления и вызвать отек мозга;
Нарушается образование ГАМК (тормозной медиатор ЦНС) из
глутаминовой кислоты ,что может привести к судорожному
синдрому;
Аммиак может влиять на процесс генерации возбуждения,
взаимодействуя с ионами натрия и калия и способствовать
развитию коматозного состояния.
25. Пути обезвреживания аммиака:
1. Связывание аммиака с глутаминовой и реже2.
3.
4.
5.
6.
аспарагиновой кислотами свободными и в составе
белков с образованием соответствующих амидов глутамина и аспарагина (временный);
Восстановительное аминирование α-кетоглутарата
и оксалоацетата (в скелетных мышцах и печени)
(временный);
Биосинтез мочевины в печени (окончательный);
Образование аммонийных солей в почках
(окончательный);
Синтез креатина и креатинина (окончательный);
Глюкозо-аланиновый цикл.
26. ВРЕМЕННЫЕ АКЦЕПТОРЫ АММИАКА 1.Восстановительное аминирование
СООНСН2
СООН
Н2О СН2
NН3
СН2
С =О
спонтанно
СООН
α-кетоглутаровая кислота
СООН
НАДФН Н+
НАДФ СН2
СН2
СН2
С = NН
СН – NН2
глутаматдегид
рогеназа
СООН
иминоглутаро
вая кислота
СООН
α-глутаминовая кислота
27. 2.Образование транспортных форм аммиака
СООНNН3 АТФ АМФ +
СН2 Рн
СН2
СН – NН2
Глутаминсинтетаза
СООН
СО – NН2
Н2О
СН2
СН2
NН3
Глутаминаза
СН – NН2
СООН
СООН
глутаминовая
глутамин
кислота
СООН NН3 АТФ АМФ + Рн СО – NН2 Н2О
СН2
СН2
СН – NН2
СООН
глутаминовая
кислота
NН3 СООН
СН2
L-аспарагиназа
СН – NН2
СН – NН2
СН2
СН2
СН – NН2 Аспарагинсинтетаза
СООН
Аспарагиновая кислота
СООН
аспарагин
СООН
Аспарагиновая
кислота
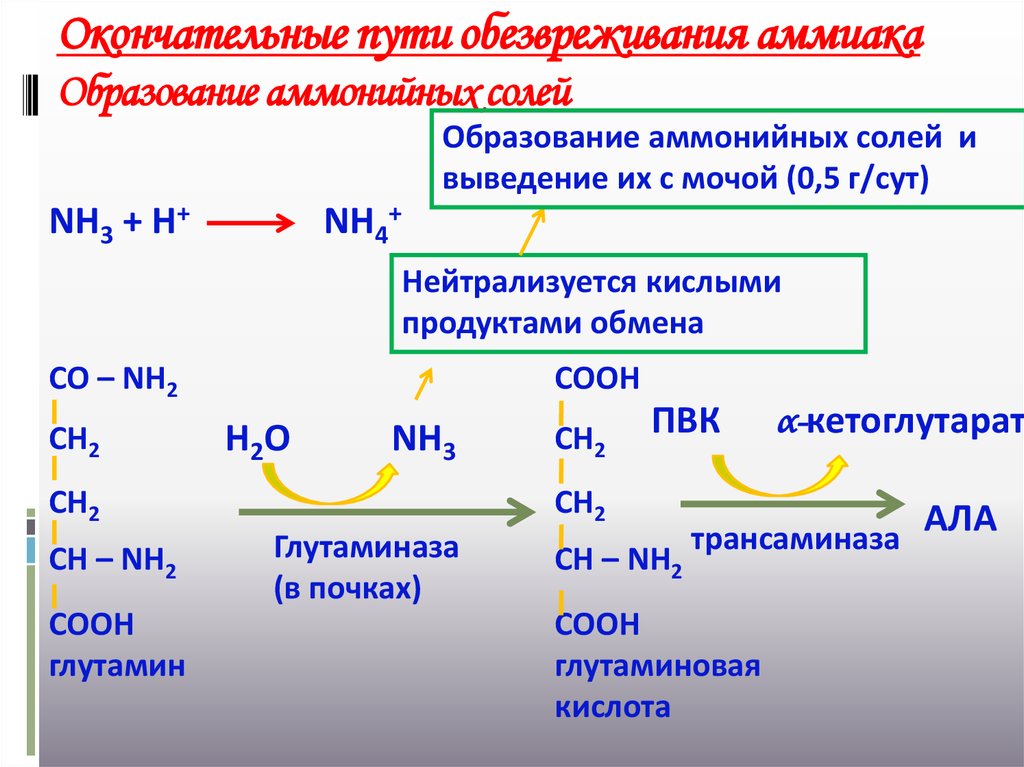
28. Окончательные пути обезвреживания аммиака Образование аммонийных солей
Образование аммонийных солей ивыведение их с мочой (0,5 г/сут)
NН3 + Н+
NН4+
Нейтрализуется кислыми
продуктами обмена
СО – NН2
СН2
СООН
Н2О
NН3
СН2
СН – NН2
СООН
глутамин
СН2
ПВК
СН2
Глутаминаза
(в почках)
СН – NН2
α-кетоглутарат
трансаминаза
СООН
глутаминовая
кислота
АЛА
29. Синтез мочевины (орнитиновый цикл, цикл Кребса -Гензелейта)
NН2В митохондриях
гепатоцитов
2АМФ + Рн С = О
СО2 + NН3 + 2 АТФ + Н2О
Карбомаилфосфатсинтетаза I
О῀ Р
Карбомаилфосфат
NН2
NН2
NН2
С = О + (СН )
2 3
О῀Р
СН – NН2
Карбома
СООН
илфосфат орнитин
Рн
С =О
NН
Орнитинкарбомаил- (СН2)3
трансфераза
СН – NН2
СООН
цитруллин
Цитоплазма
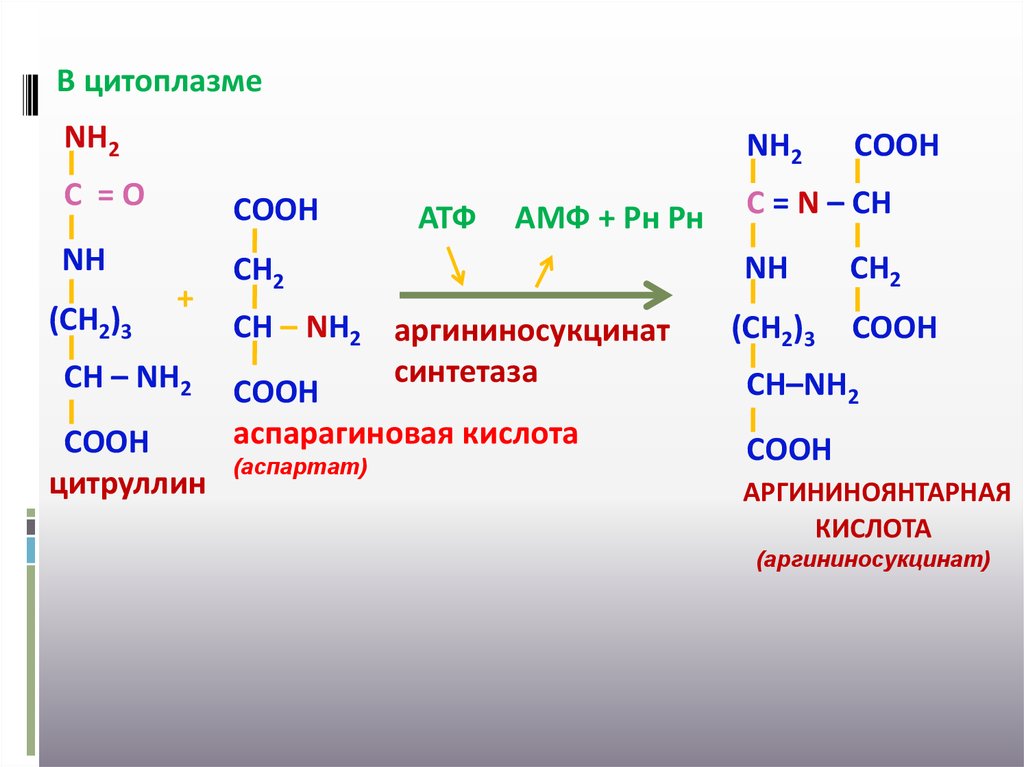
30.
В цитоплазмеNН2
NН2
С =О
СООН
NН
СН2
(СН2)3
+
СН – NН2
СООН
цитруллин
АТФ
АМФ + Рн Рн
СН – NН2 аргининосукцинат
синтетаза
СООН
аспарагиновая кислота
(аспартат)
СООН
С = N – СН
NН
(СН2)3
СН2
СООН
СН–NН2
СООН
АРГИНИНОЯНТАРНАЯ
КИСЛОТА
(аргининосукцинат)
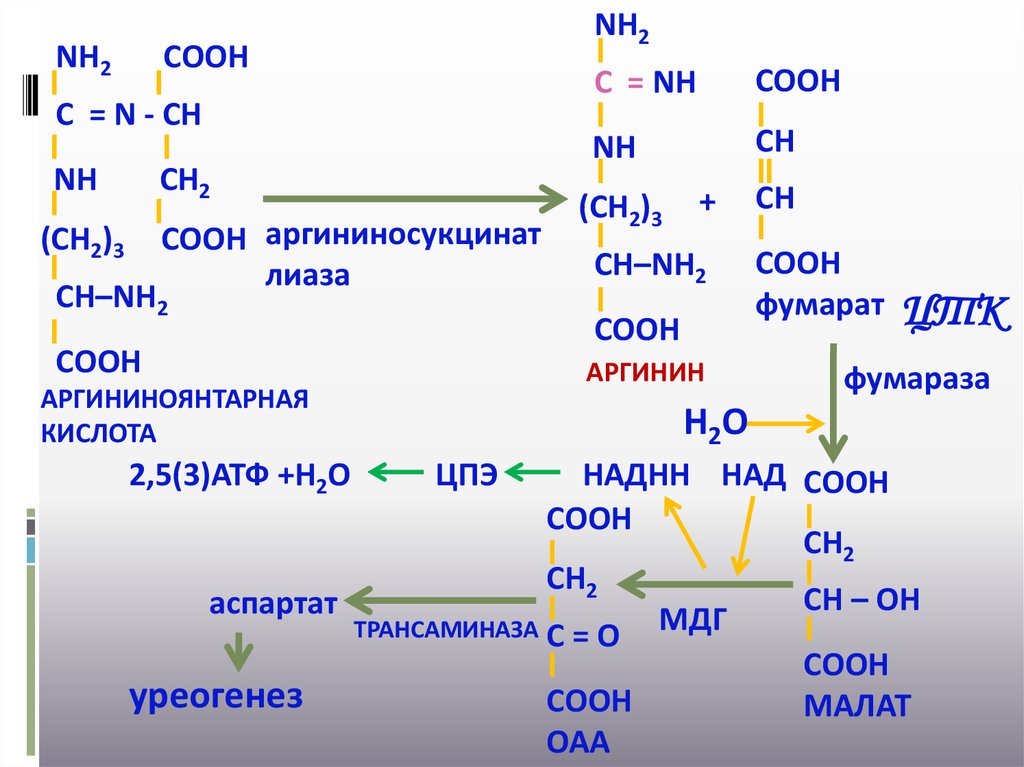
31.
NН2NН2
СООН
С = N - СН
NН
СН2
СООН аргининосукцинат
лиаза
(СН2)3
СН–NН2
СООН
NН
СН
(СН2)3
+
СН–NН2
СООН
СООН
АРГИНИН
АРГИНИНОЯНТАРНАЯ
КИСЛОТА
2,5(3)АТФ +Н2О
С = NН
СН
СООН
фумарат
ЦТК
фумараза
Н2О
ЦПЭ
НАДНН НАД СООН
СООН
СН2
СН2
СН – ОН
аспартат
МДГ
ТРАНСАМИНАЗА С = О
СООН
уреогенез
СООН
МАЛАТ
ОАА
32.
NН2С = NН
NН
Н2О
СН–NН2
СООН
NН2
С =О
(СН2)3
АРГИНАЗА
NН2
+
NН2
МОЧЕВИНА
(СН2)3
СН – NН2
СООН
орнитин
АРГИНИН
В ЦИКЛ
МОЧЕВИНЫ
33.
Содержание мочевины в сыворотке крови составляет3,3- 8,3 ммоль/л
Выделяется с мочой - 333-583 ммоль/сут (20-35 г/сут) .
Часть ее поступает в интерстиций почечной ткани для
поддержания высокой осмолярности.
Фумаровая кислота является общим метаболитом
цикла трикарбоновых кислот. При превращениях в
ЦТК - фумарат - малат - ОАА на стадии окисления
малата малатдегидрогеназой образуется НАДНН,
который в митохондриальной ЦПЭ обеспечивает
образование трех молекул АТФ.
Цикл мочевины переводит токсичный аммиак в
нетоксичную форму мочевину.
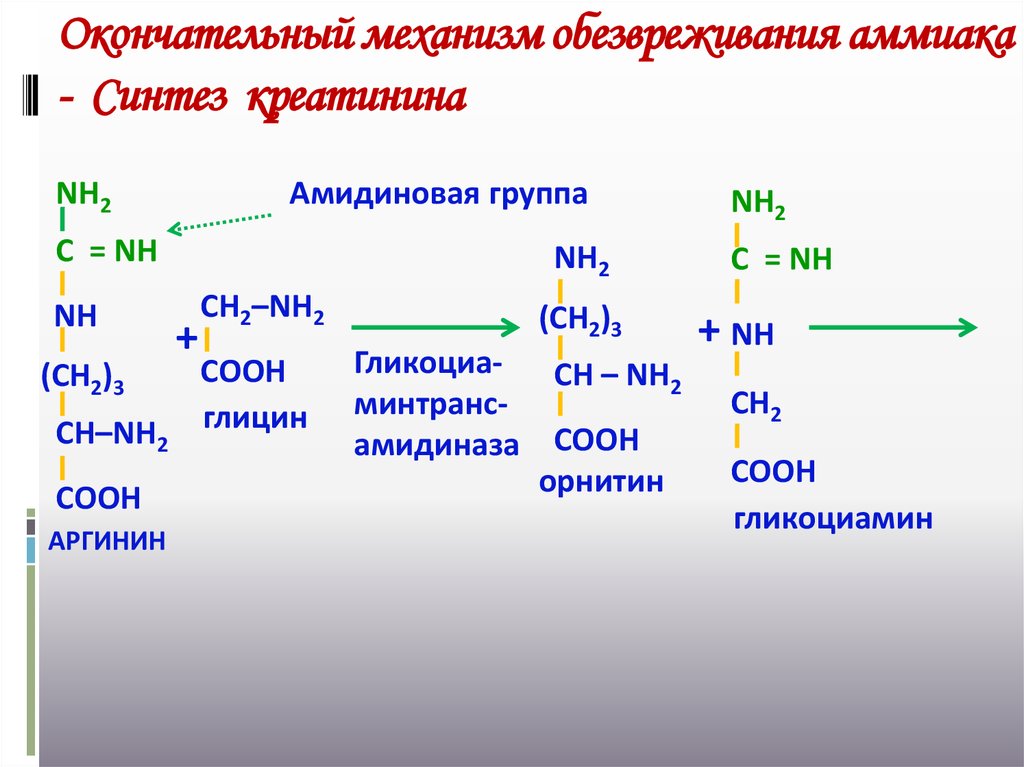
34. Окончательный механизм обезвреживания аммиака - Синтез креатинина
NН2Амидиновая группа
С = NН
NН
(СН2)3
СН–NН2
СООН
АРГИНИН
NН2
+
СН2–NН2
СООН
глицин
(СН2)3
Гликоциа- СН – NН
2
минтрансамидиназа СООН
орнитин
NН2
С = NН
+ NН
СН2
СООН
гликоциамин
35.
Переносится впечень
NН2
С = NН
SAM
В мышечной
ткани
SAГ
NН2
АТФ
АДФ
С = NН
NН ~ Р
С = NН
NН МЕТИОНИНГЛИКОЦИА- N – СН3 КРЕАТИНФОСФО- N – СН3
МИНТРАНСМЕТИЛАЗА
СН2
КИНАЗА (КФК)
СН2
СООН
гликоциамин
СООН
КРЕАТИН
НN = С
Рн
Н3С – N
креатинин
КФК
СН2
СООН
Н
N
КРЕАТИНфосфат
С=О
СН2
36.
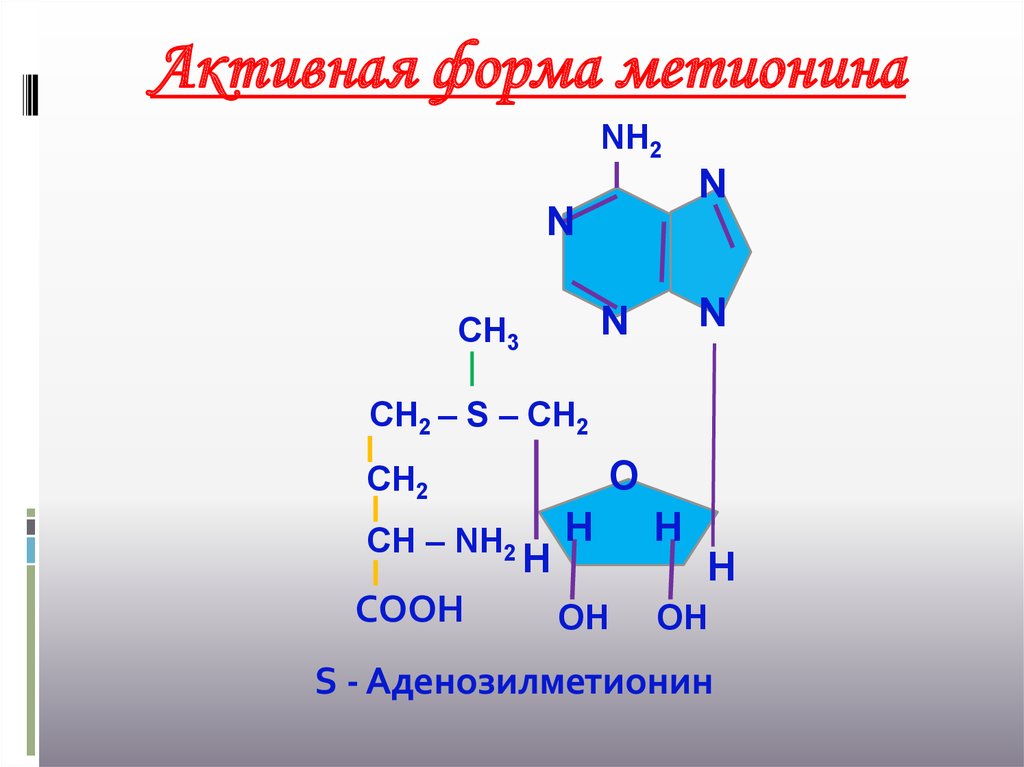
Активная форма метионинаNН2
N
N
N
N
СН3
СН2 – S – СН2
О
СН2
СН – NН2
СООН
Н
Н
Н
ОН
ОН
Н
S - Аденозилметионин
37. Глюкозо-аланиновый цикл
кровьмышца
АК
АЛА + ά-кето
Трансглутарат аминаза
(трансамини
NН2 рование)
ПВК
Глюкоза
ПВК
гликолиз
Аланин
Глюкоза
печень
+ Глутамат
(окислительное
дезаминирование
АЛА
Глюкоза
Глюконеогенез
NН3
Глюкоза Уреогенез
38.
• Нарушение процесса мочевинообразованияприводит к повышению концентрации аммиака в
крови (гипераммониемии).
Причины гипераммониемии:
1. Врожденная недостаточность хотя бы
одного фермента мочевинообразования;
2. Печеночная недостаточность;
3. Избыточное потребление белков;
4. Катаболические состояния (травмы,
опухоли, кахексия);
5. Кишечные кровотечения;
39. Клинические проявления гипераммониемии:
1. Тошнота, рвота;
2. Отвращение к белковой пище;
3. Нарушение координации движения;
4. Раздражительность;
5. Сонливость ;
6. Головные боли, головокружение, судороги;
7. Потеря сознания, отек мозга (в тяжелых
случаях);
• 8. Отставание в умственном развитии (при
хронической врожденной форме ) и др.
40. Гиперазотемия
1. Абсолютная:Гиперазотемия
а) Ретенционная (задержка):
- почечная (нарушение выделительной функции почек,
инфекционные заболевания: гломерулонефрит, пиелонефрит,
туберкулез почек
- внепочечная (нарушение кровоснабжения вообще и почек:
сердечно-сосудистая недостаточность, профузные
кровотечения, или при наличии препятствия оттоку мочи ,
почечнокаменная болезнь)
б) Продукционная (усиление распада белков: опухолевых,
инфекционных заболеваний, тяжелые ранения, лечение
стероидами )
2. Относительная (дегидратационая : рвота, понос, усиленное
потоотделение )
41.
Основная литература:Т.Т. Березов, Б.Ф. Коровкин «Биологическая химия», издание третье, Москва, 2007, стр. 431-434,
446-450
Е.С. Северин «Биохимия», Москва 2003, стр. 472-489.
Е.С. Северин «Биохимия с упражнениями и задачами», Москва, 2008, стр.233-244
Ф.С. Дзугкоева, Л.А.Калоева, Э.А. Каряева, А.Е. Гурина, С.А.Баллаева «Обмен веществ». Учебное
пособие по курсу биологической химии. Владикавказ,2003, стр. 129-140.
Ф.С. Дзугкоева, Э.А. Каряева, А.Е. Гурина, Н.М. Амбарцумянц, С.Г.Дзугкоев «Биохимия основных
процессов обмена веществ и гормональная регуляция» тестовые задания по курсу биологической
химии, Владикавказ 2007, стр. 60-63.
Ф.С. Дзугкоева, Э.А. Каряева, А.Е. Гурина, Н.М. Амбарцумянц, И.В. Можаева, С.Г. Дзугкоев,
Е.А.Такоева «Руководство к практическим занятиям по биологической химии», часть 3,
Владикавказ, 2008, стр. 33-43.
Ф.С. Дзугкоева, Э.А. Каряева, А.Е. Гурина, Н.М. Амбарцумянц, С.Г.Дзугкоев «Биохимия основных
процессов обмена веществ и гормональная регуляция» учебное пособие, Владикавказ 2007, стр
128-135
Дополнительная литература:
У. Мак-Мюррей « Обмен веществ у человека», Москва, из-во «Мир», 1980, стр.278-288
Ленинджер Л. «Биохимия». 1986
Д.М. Зубаирова, Е.А. Пазук «Биохимия» тестовые вопросы, Москва, 2008. стр.227, 231-234
Е.С. Северин, Т.Л. Алейникова, Е.В. Осипов «Биохимия», Москва 2000, стр. 141-146.
Уайт А. и др. Основы биохимии. Москва 1981
Гринстейн Б., Гринстейн А. Наглядная биохимия, Москва 2000, стр. 100-103



























 biology
biology chemistry
chemistry







