Similar presentations:
Решение задач на смеси и растворы
1.
19.12.2014Интегрированный урок математика + химия
1
2. Девиз урока:
«Только из союза двух работающихвместе и при помощи друг друга
рождаются великие вещи»
Антуан де Сент- Экзюпери
2
3. Цель урока
Рассмотреть в сравнении химический иматематический способ решения задач с
использованием понятия концентрация.
2. Применить способы решения задач на
практических опытах.
3. Вывести новый метод решения задач на
смеси и сплавы , рассматривать его
применение на уроках математики и химии.
3
4. Раствор- однородная система, состоящая из частиц растворённого вещества, растворителя и продуктов их взаимодействия.
Концентрация- количество растворенноговещества в единице объёма раствора.
4
5.
1. Уксусная кислота ( СН3СООН)2. Пероксид водорода (Н2О2 )
3. Нашатырный спирт (аммиак)
4. Бриллиантовый зеленый
5. Отбеливающие и дезинфицирующие
растворы
Уксусная кислота
марганцовка
Перекись водорода
Нашатырный спирт-это раствор аммиака 10%-ный
5
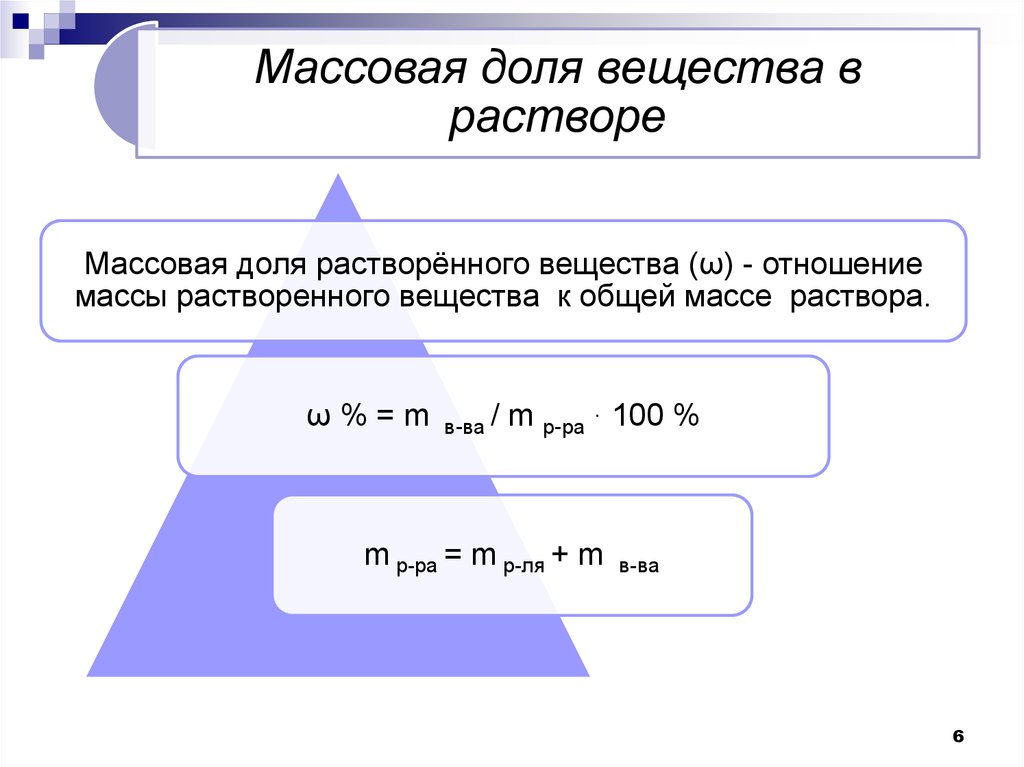
6.
Массовая доля вещества врастворе
Массовая доля растворённого вещества (ω) - отношение
массы растворенного вещества к общей массе раствора.
ω%=m
в-ва /
m р-ра . 100 %
m р-ра = m р-ля + m
в-ва
6
7.
ЗадачаЗадача 1. Смешали 150 г раствора
нитрата калия с массовой долей 12% и
300 г раствора этой же соли с массовой
долей 7%. Какой стала массовая доля
соли в полученном растворе?
Решение:
7
8. К 200г 10%раствора хлорида калия добавили 25 г этой же соли. Массовая доля соли в полученном растворе равна 1)12,5% 2) 20% 3)
22.5% 4)25%8
9. Один раствор содержит 30% по объему HNO3 , а второй 55% HNO3 .Сколько нужно взять первого и второго раствора, что бы получить
100 литров 50%раствора HNO3?
9
10. Имеется два сплава с разным содержанием меди: в первом содержится 70%, а во втором – 40% меди. В каком отношении надо взять
первый и второйсплавы, чтобы получить из них новый
сплав, содержащий 50% меди?
10
11. Задача . Какое количество воды и 80-го раствора уксусной кислоты следует взять для того, чтобы приготовить 200 г столового
уксуса (8%-й растворуксусной кислоты.)
200
80%=0,8
0%=0
8%=0,08
х
200-х
0,08*200
0,8х
0
11
12. Экспериментальная задача
Приготовить х г раствора смассовой долей у.
12
13. Правила взвешивания
--
-
На правую чашку весов положите кусочек
бумаги
Приведите весы в состояние равновесия
На левую чашку весов поставьте разновесы
нужной массы
С помощью шпателя аккуратно добавляйте
отвешиваемое вещество на бумагу
13
14.
Используй формулыω%=
m(в-ва)= m (р-ра) • ω
m(р-ра)= m(в-ва)/ω
m(раствора)=m(р-ля)+m(в-ва)
m(р-ля)=m(раствора)- m(в-ва)
14
15. Расчётная часть
Дано:ω%=5%
m(р-ра)=20г
m(в-ва)=?
V (р-ля) = ?
ω%=
m(в-ва) = m (р-ра) · ω
m(в-ва) = 20 · 0,05 = 1 г.
m(р-ля) = m (р-ра) - m(в-ва)
m(р-ля) = 20 – 1 = 19 г
V (р-ля) = m (р-ля) : ρ= 19г : 1г/мл = 19 мл
Ответ: 1 г соли и 19 мл воды.
15
16. Проверочная работа
Математическая частьХимическая часть
Имеется два сплава.
Первый сплав содержит
При смешивании 15%10% никеля, второй –
го и 8% -го раствора
кислоты получают 70 30% никеля. Из этих двух
сплавов получили третий
г 10%-го раствора
кислоты. Сколько
сплав массой 200 кг, сограммов 15%-го
держащий 25% никеля.
раствора взяли?
На сколько килограммов
масса первого сплава
меньше массы второго?
16
17.
Урок понравилсяи тема понята:
Урок понравился,
но не всё ещё
понятно:
Урок не
понравился и тема
не понятна:
17

















 mathematics
mathematics








