Similar presentations:
Строение вещества. Размеры и массы атомов
1.
Учебники2.
Строение веществаПредставление об атомах. Все тела построены из атомов и
молекул – очень малых частиц. Под атомами понимают
мельчайшую частицу химического элемента. Молекулы – более
сложные частицы, состоят из нескольких атомов. Физические и
химические свойства определяются свойствами атомов и
молекул.
До конца XIX в. атомы
считались простейшими
частицами вещества (атом =
неделимый). Сейчас
установлено, что атомы
довольно сложные
образования.
3.
Строение веществаВ начале XIX в. химики научились различать атомы по
валентности и относительной атомной массе.
Анализ
зависимостей
этих параметров
привел к
открытию
периодического
закона.
4.
Размеры и массы атомов.Размеры атомов и молекул
очень малы. Увидеть их не
удается даже в самый
сильный микроскоп. Из-за
дифракции света.
Дифракция Фраунгофера,
условия минимумов
b sin m
Здесь b – размер объекта, который должен быть больше
длины волны , иначе не будет минимумов и на экране
будет сплошной фон невозможно получить информацию.
5.
Размеры и массы атомов.(
)
выдвинул гипотезу, согласно которой
при одинаковых температуре и давлении в равных объёмах
идеальных газов содержится одинаковое число молекул.
Позже было показано, что эта гипотеза есть необходимое
следствие кинетической теории, и сейчас она известна как
закон Авогадро.
Число структурных элементов в моле вещества определяется
постоянной Авогадро. Число Авогадро – одна из важных
постоянных в физике.
Зная постоянную Авогадро можно найти величины,
характеризующие отдельный атом, размеры, массу, заряд иона.
В 1908 г.
даёт приемлемую оценку NA вычисленной
из параметров Броуновского движения.
6.
Размеры и массы атомов.Методы определения NA; используют: броуновское движение,
радиоактивность, рассеяние света в газах, дифракцию
рентгеновских лучей на кристаллах. В последнем методе
определяют постоянную кристаллической решетки a, на одну
структурную единицу приходится объем: a3 NA = V/a3
Согласие результатов определения NA различными способами
доказывает справедливость атомистической теории строения
вещества.
Масса измеряется в атомных единицах массы а.е.м. – одна
двенадцатая массы атома углерода 6C12. (водород 1.008 а.е.м.)
а.е.м = 1.66·10–27 кг
7.
Размеры и массы атомов.Заряд удобно измерять в величинах элементарного заряда ē
В пользу существования элементарного электрического заряда
свидетельствуют законы электролиза Фарадея. Один моль
одновалентного элемента переносит заряд Fn = 96485 Кл.
Однако в XIX в. оба уравнения Fn = NA·e, и μ = NA·m, были с
двумя неизвестными: NA и e были определены только в
начале XX в.
Из измерений Перрена экспериментально определены
постоянная Больцмана k и постоянная Авогадро NА.
8.
Размеры и массы атомов.Определение размеров
атомов: В жидких и
твердых телах
предполагается, что атомы
располагаются вплотную.
a 3
N A
Линейные размеры всех атомов имеют порядок 10–10 м.
(водород 2.7·10–10 м)
Масса атомов: m = /NA. (водород 1.67·10–27 кг)
9.
Единицы массы заряда и энергии:Роберт Милликен в 1909
году исследовал поведение
масляных капель в
конденсаторе.
Многочисленные измерения
показали, что заряды капель
всегда кратны ē.
Fn
19
e
1.6 10 Кл
NA
Другие опыты подтверждают,
что все существующие в
природе положительные и
отрицательные заряда кратны
величине элементарного
заряда ē.
10.
Единицы массы заряда и энергии:Для измерения массы
используется массспектрограф. Прибор, в
котором заряженные
движущиеся частицы
отклоняются магнитным
полем. По величине (радиусу
кривизны траектории)
определяется отношение
массы к заряду. Для
нахождения скорости
используется метод
задерживающих
потенциалов.
11.
Единицы массы заряда и энергии:Для наблюдения частиц используется фотопластинка.
Частицы, как и свет, вызывают потемнение. По аналогии с
оптикой изображение на пластинке называют спектром.
Вместо распределения по длинам волн здесь распределение
по массам.
Для электронов получается 1 полоса
все электроны имеют одну массу:
me = 0.911·10–30 кг = (1/1823) а.е.м.
Энергия измеряется в электрон-вольтах.
1 эВ – энергия частицы c зарядом ē,
прошедшей разность потенциалов 1 В.
1 эВ = 1.6·10–19Дж.
12.
История открытия электронаИоганн Риттер в 1801 году высказал мысль о дискретной,
зернистой структуре электричества.
В 1859 году Юлиусом Плюккером открыты катодные лучи.
Английский физик Уильям Крукс высказал идею, что
катодные лучи это потоки частичек вещества.
В 1874 году Джордж Стони первым сформулировал теорию
дискретности электричества.
В 1891 году, в одной из теоретических работ Стони предложил
термин «электрон» для обозначения электрического заряда
одновалентного иона при электролизе.
В 1895 году французский физик Жан
Перрен экспериментально доказал, что катодные лучи — это
поток отрицательно заряженных частиц, которые движутся
прямолинейно, но могут отклоняться магнитным полем.
13.
История открытия электронаВ 1883 году Эдиссоном было
открыто явление
термоэлектронной эмиссии. При
повышении температуры металла
отрицательно заряженный
электрод (катод) теряет заряд
Термоэлектронный ток.
Примерно в это время открыто явление фотоэффекта. При
освещении поверхности металла теряется отрицательный
заряд, а положительный сохраняется, несмотря на освещение.
14.
Открытие электронаЭти исследования стали фактической основой для
непосредственного открытия частицы Томсоном в 1897 году.
15.
Открытие электронаОпыт Томсона заключался в изучении пучков катодных
лучей, проходящих через систему параллельных
металлических пластин, создававших электрическое поле, и
систем катушек, создававших магнитное поле.
16.
Открытие электронаС 1895 года Джозеф Джон Томсон в Кавендишской
лаборатории Кембриджского университета начинает
методическое количественное изучение отклонения катодных
лучей в электрических и магнитных полях. Итоги этой
работы были опубликованы в 1897 г. в октябрьском номере
журнала «Philosophical Magazine». В своем опыте Томсон
доказал, что все частицы, образующие катодные лучи,
тождественны друг другу и входят в состав вещества. Суть
опытов и гипотезу о существовании материи в состоянии ещё
более тонкого дробления, чем атомы, Томсон изложил на
вечернем заседании Королевского общества 29 апреля 1897 г.
Извлечение из этого сообщения было опубликовано в
«Electrican» 21 мая 1897 г. За это открытие Томсон
в 1906 году получил Нобелевскую премию по физике.
17.
Открытие электронаОбнаружено, что лучи отклонялись при
действии отдельно обоих полей, а при
определенном соотношении между ними
пучки не изменяли прямой траектории.
Это соотношение полей зависело от
скорости частиц.
Проведя ряд измерений, Томсон
выяснил, что скорость движения частиц
гораздо ниже скорости света — таким
образом было показано, что частицы
должны обладать массой.
Далее было выдвинуто предположение о
наличии этих частиц в атомах и
предложена модель атома.
18.
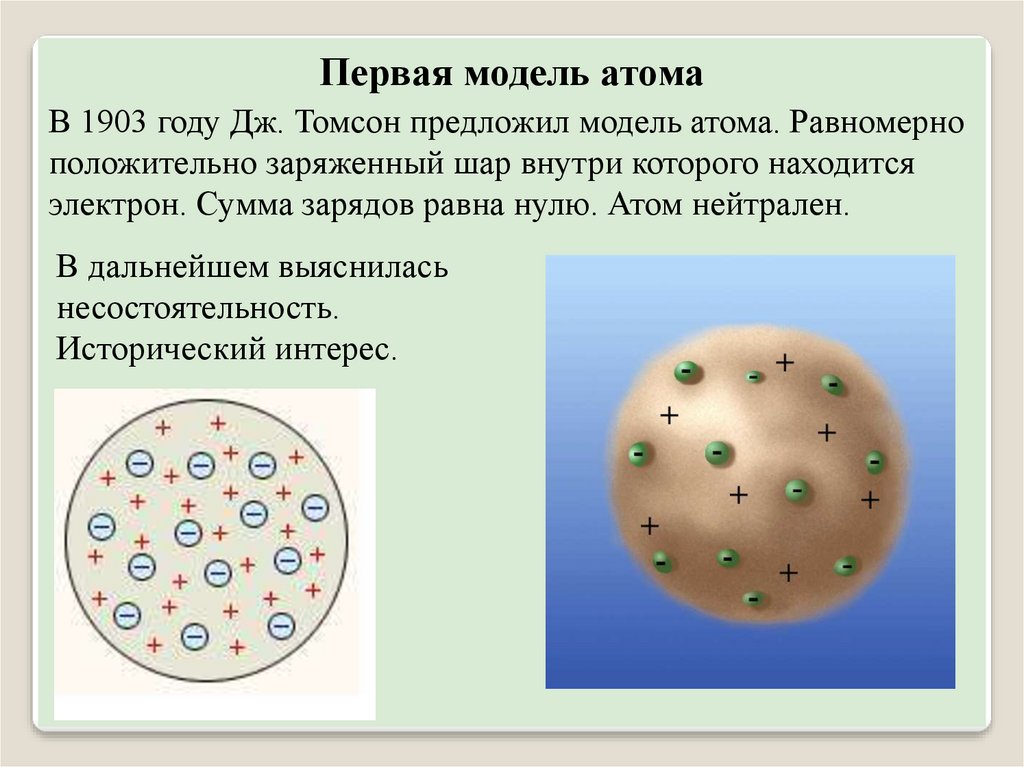
Первая модель атомаВ 1903 году Дж. Томсон предложил модель атома. Равномерно
положительно заряженный шар внутри которого находится
электрон. Сумма зарядов равна нулю. Атом нейтрален.
В дальнейшем выяснилась
несостоятельность.
Исторический интерес.
19.
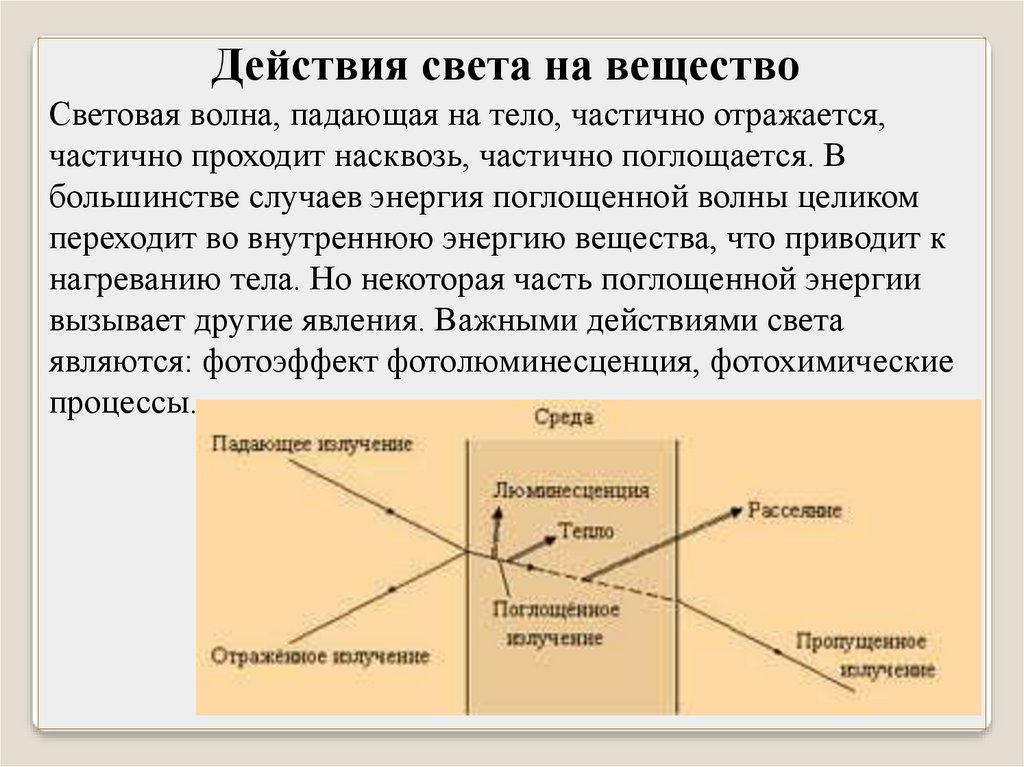
Действия света на веществоСветовая волна, падающая на тело, частично отражается,
частично проходит насквозь, частично поглощается. В
большинстве случаев энергия поглощенной волны целиком
переходит во внутреннюю энергию вещества, что приводит к
нагреванию тела. Но некоторая часть поглощенной энергии
вызывает другие явления. Важными действиями света
являются: фотоэффект фотолюминесценция, фотохимические
процессы.
20.
Спектры излученияСвечение тел тесно связано с процессами, происходящими в
атомах и молекулах, поэтому исследование свечения – важное
средство выяснения строения молекул и атомов.
Совокупность частот (или длин волн), которые содержатся в
излучении какого-либо вещества называют спектром
испускания.
Для получения спектров
используется дифракционная
решетка или призма.
При изучении спектров
светящихся тел были
установлены существенные
различия в характере
свечения.
21.
Спектры излученияНепрерывные спектры
дают тела, находящиеся в
твердом и жидком
состоянии, а также
сильносжатые газы.
22.
Спектры излученияПолосатые спектры испускаются газами в молекулярном
состоянии
Спектр угольной дуги (полосы молекул CN и C2)
Спектр испускания паров молекулярного йода J2)
23.
Спектры излученияЛинейчатые спектры дают вещества в газообразном
атомарном состоянии (пары металлов, инертные газы и
диссоцииранные на атомы молекулы). Изолированные атомы
излучают строго определенные длины волн. Каждый вид
атомов излучает набор электромагнитных волн определенных
частот.
Узкие резкие линии, соответствующие определенной длине
волны, располагаются в видимой, инфракрасной и
ультрафиолетовой областях.
24.
Спектральный анализ.Каждый атом испускает свои определенные спектральные
линии, составляющие его спектр, характерный для этого
элемента. (Могут быть случайно совпадающие линии).
Спектральный метод химического анализа до 10-10 г :
Густав Кирхгоф и Роберт Бунзен 1859 г.
оптический линейчатый эмиссионный спектр азота
25.
26.
Спектры поглощения.Спектр поглощения – совокупность частот, поглощаемых
данным веществом.
Спектры поглощения получают, пропуская свет от источника.
Дающего сплошной спектр, через вещество, атомы которого
находятся в невозбужденном состоянии. В прошедшем свете
отсутствуют участки спектра. Для разных веществ области
поглощения находятся в разных участках спектра, разная
ширина и интенсивность. Анализ раствора.
Пример линейного спектра поглощения
27.
Спектры поглощения.Закон Кирхгофа справедлив и для узких спектральных
участков. Опыты показывают, что раскаленное тело испускает
лишь волны такой длины, какой оно способно при той же
температуре поглощать. Спектры излучения и поглощения
зеркально симметричны.
28.
Спектральный анализ.Спектр поглощения также характерен для атомов и может
использоваться для химического анализа. (Линии Фраунгофера
в спектре Солнца).
Открытие новых элементов (Рубидий, цезий, галлий,).
В 1895 г. в спектре Солнца обнаружен гелий.
29.
Спектральные закономерностиЛинейчатый спектр атома представляет собой совокупность
большого числа линий, разбросанных по всему спектру.
Однако расположение линий следует определенным
закономерностям. Впервые такие закономерность была
установлена в спектре водорода.(монотонное сгущение ).
Швейцарский физик Иоган Бальмер в 1885 году установил,
что частоты отдельных линий водорода выражаются простой
формулой:
1
1
R 2 2
2 m
R – постоянная Ридберга,
m – целое число.
30.
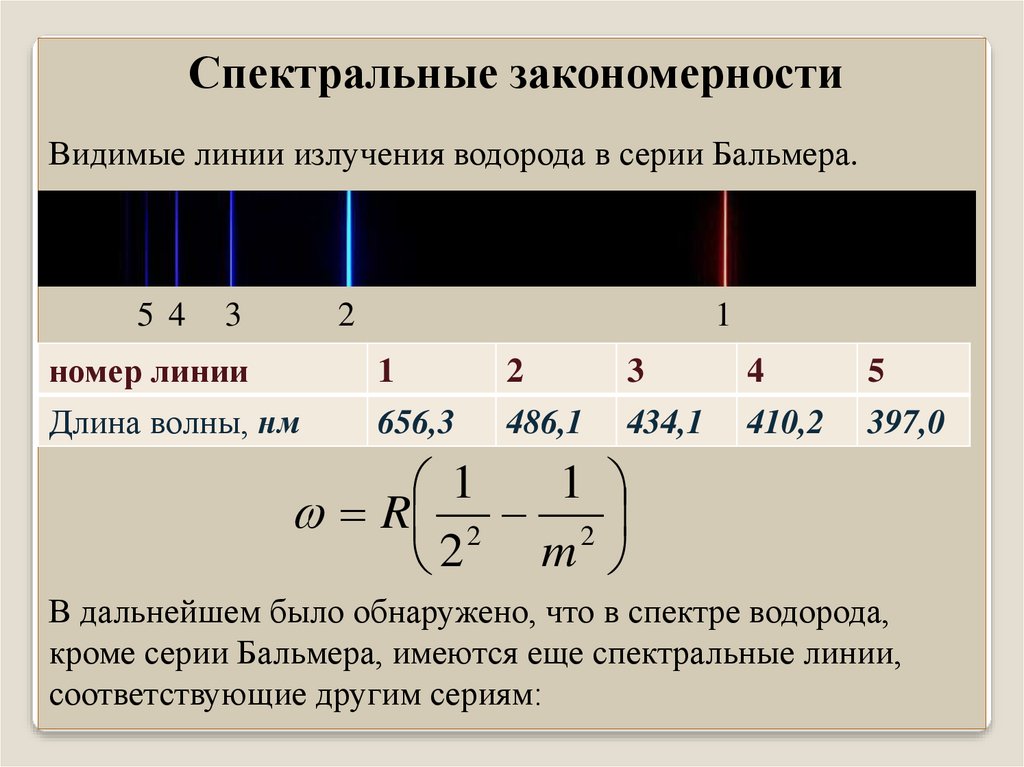
Спектральные закономерностиВидимые линии излучения водорода в серии Бальмера.
5 4
3
2
номер линии
Длина волны, нм
1
1
656,3
2
486,1
3
434,1
4
410,2
5
397,0
1
1
R 2 2
m
2
В дальнейшем было обнаружено, что в спектре водорода,
кроме серии Бальмера, имеются еще спектральные линии,
соответствующие другим сериям:
31.
Спектральные закономерностиЛаймана:
1
1
R 2 2
m
1
1
1
Пашена: R
2
2
m
3
И т. д.
Причем R везде одна и
та же величина.
Обобщенная формула Бальмера:
1
1
R 2 2
m
n
При возрастании частота каждой
серии стремится к предельному
значению. Граница серии.
1
пр R 2
n
32.
Спектральные закономерностиЧастота любой серии спектра
водорода может быть представлена в
виде разности двух чисел ряда.
1
T n R 2
n
Эти числа называются спектральными термами.
Изучение спектров других атомов показало, что частоты
линий во всех случаях могут быть представлены в виде
разности двух термов:
= T1(m) – T2(n).
Закономерности всех атомов могут быть представлены в
форме, подобной формуле Бальмера, причем R имеет всегда
одно и то же значение. R = 2.07·1016 с-1
33.
Представление о квантах.В 1900 г. М. Планк выдвинул гипотезу квантов.
Энергия света данной частоты не может делиться на
произвольные части, а проявляет себя в виде совершенно
определенных равных порций – квантов энергии или фотонов.
Чем больше интенсивность – тем больше порций (квантов).
Представление о квантах было введено
А. Эйнштейном в 1905 г. при выводе
формулы фотоэффекта. Полная энергия,
сообщенная электрону светом, прямо
.
пропорциональна частоте света
W = A + ½mv2 = ħ
ħ– фундаментальная постоянная (постоянная Планка).
ħ = 1.055·10–34 Дж·с
34.
Изменением внутренней энергии атомаАтомы излучают и поглощают свет порциями – квантами
Энергия кванта по закону сохранения энергии равна
разности энергии атома до и после излучения.
ħ = W – W'
Это соотношение связывает изменение энергии атома при
испускании или поглощении света с частой или длиной
волны. Если бы энергия атома могла испытывать все
возможные изменения, то в спектре атома присутствовали все
частоты, и спектр был бы сплошным, как у твердого тела. Но
у атома спектр линейчатый, содержит только характерные для
данного атома частоты. Энергия атома может изменяться
только на определенные значения. Зная спектр или термы
атома, нетрудно найти эти значения.
35.
Изменением внутренней энергии атомаВ результате изучения испускания и поглощения света,
столкновения атомов с электронами и других процессов,
сопровождающихся изменением внутренней энергии атома,
эти своеобразные закономерности, которым подчиняется
внутренняя энергия атомов, подтвердились.
Пример: В опытах по столкновению электронов с атомами
паров ртути оказалось, что передача энергии от электронов к
атомам существенно зависит от энергии электрона. Пока она
4.9 эВ, электроны не теряют энергию совсем. Но при E 4.9
эВ потери сразу становятся большими. При этом электрон
отдает атому ртути всегда одну и ту же порцию энергии 4.9
эВ. Меньшую энергию атом ртути не воспринимает.
Прерывность энергетических состояний характерна и для
других атомов, но порции энергии другие.
36.
Энергетические уровни.Внутренняя энергия атома может принимать не любые, а
только определенные значения. Для каждого вида атомов
характерны свои энергетические уровни. Атом, может
находиться в одном из состояний с определенной энергией,
соответствующей данному состоянию.
Если атом переходит в
состояние с более низкой
энергией, он испускает
соответствующий
квант(фотон). При
поглощении фотона, атом
переходит в состояние с
более высокой энергией.
37.
Энергетические уровни.Расстояния пропорциональны разностям энергий двух
соседних состояний. Пропорциональны частотам квантов,
излучаемого или поглощаемого при переходе.
Состояние с наименьшей энергией является устойчивым
(n = 1).
При Н.у. все атомы находятся в нижних энергетических
состояниях и газы (или пары) не светятся.
Сообщая атому энергию можно возбудить его и перевести из
основного в возбужденное.
В случае водорода энергия первого возбуждения составляет
10.1 эВ, энергия ионизации = 13.5 эВ
Eион = ħR
ħR = 13.5 эВ
ħ = 6.6·10–16 эВ·с
38.
Энергетические уровни.Серия Бальмера
39.
Спектральные закономерностиСпектральные линии всех атомов могут быть распределены в
серии.
Однако терм T(n) имеет обычно более сложный вид, чем терм
атома водорода. Кроме того, первый и второй члены формулы
берутся из разных рядов термов.
В конце XIX в. Ридберг установил, что
термы щелочных металлов можно
представить с помощью эмпирической
формулы:
1
T n R
n
2
Где – ридберговская поправка.
Юхан Ридберг –
шведский физик.
40.
Спектральные закономерностиСпектры атомов щелочных металлов, подобно спектру
водорода, состоят из нескольких серий линий. Наиболее
интенсивные из них получили названия: Главная (principal),
резкая (sharp), диффузная (diffuse) и основная
(fundamental). Эти названия имеют следующее
происхождение. Главная серия: т.к. наблюдается и при
поглощении и значит соответствует переходу атома в
основное состояние. Резкая и диффузная серии состоят
соответственно из резких и размытых линий, а основная
сходна с сериями водорода.
Использование обозначений: p, s, d, f…
Термы, отвечающие соответствующим рядам, обозначают
символами, ns, np, nd, nf
41.
Спектральные закономерностиСогласно формуле частота
спектральной линии равна
разности термов конечного и
начального состояний.
Например: спектральные линии
натрия могут быть представлены в
виде,
Резкая
серия –
главная
серия –
диффузная
серия –
основная
серия –
= 3p – ns
(n = 4, 5, …)
= 3s – np
(n = 3, 4, 5, …)
= 3p – nd
(n = 3, 4, 5, …)
= 3d – nf
(n = 4, 5, …)
42.
Спектральные закономерностиПоправка имеет постоянное значение для данного ряда
термов: p, s, d, f…
Для натрия: s = -1.35, p = -0.87, d = -0.01, f = 0.
Для других щелочных металлов – другие значения.
Определяются экспериментально. Определение частот по
формулам.
43.
ЛюминесценцияЛюминесценция – свечение
после освещения. Свет
люминесценции имеет иной
спектральный состав.
Наблюдения показывают,
что свет люминесценции
характеризуется большей
длиной волны, чем
возбуждающий свет –
правило Стокса.
44.
Фотохимия.Квант света воздействует на одну молекулу или один
атом, производит один акт химического превращения.
Атомы могут ионизироваться
также под действием сильного
электрического разряда или при
нагревании.
45.
Рентгеновские лучиРентгеновские лучи были открыты в 1895 г.
Представляют собой коротковолновое электромагнитное
излучение.
Дифракция на кристаллах, 1912 г., Макс Лауэ,
Измерение длины волны.
Образование рентгеновского излучения связано с остановкой
быстролетящих электронов. тормозное излучение.
При не слишком больших энергиях бомбардирующих
антикатод электронов наблюдается лишь тормозное
рентгеновское излучение со сплошным спектром, не зависящее
от материала антикатода.
Рентгеновские лучи способны вызывать химические
процессы, (потемнение фотопластинки), ионизируют газы.
46.
Коротковолновая граница тормозногорентгеновского излучения
Сложный спектр тормозного рентгеновского излучения.
Коротковолновая граница рассчитывается просто:
h
hc
гр
eU
ускоряющее
напряжение,
hc
гр
eU
квантовая природа, измерение ħ.
47.
РадиоактивностьОткрытие радиоактивности
произошло вслед за
открытием рентгеновского
излучения.
Анри Беккерель 1896 г.
Подобно рентгеновскому,
радиоактивное излучение
невидимо, проникает сквозь
непрозрачные экраны,
оказывает фотографическое
и ионизационное действия.
Свойство самопроизвольного испускания подобного
излучения называется радиоактивностью. Элементы –
радиоактивными, а излучение – радиоактивным излучением.
Радиоактивными оказались все соединения урана.
48.
РадиоактивностьПьер Кюри и Мария
Склодовская-Кюри
исследовали на
радиоактивность множество
элементов и их соединений.
В качестве индикатора
использовалось
ионизирующее действие
излучения.
Все элементы с порядковыми номерами 83 оказались
радиоактивными. Найдены как примеси к урану, торию и
радию, за исключением №85 и № 87.
49.
РадиоактивностьАнри Беккерель исследовал естественную радиацию и в 1900
году показал, что лучи, испускаемые радием, которые Эрнст
Резерфорд назвал бета-лучами, имеют такой же удельный
заряд, что и катодные лучи.
Первые снимки треков отдельных электронов были
получены Чарльзом Вильсоном при помощи созданной
им Камеры Вильсона.















































 physics
physics








