Similar presentations:
Будова атома
1. Будова атома
2. Історія відкриття
Моделі будови атома:1) Модель будови атома Дальтона, 1805 р.:
атоми елементів постають у вигляді
однакових кулеподібних часток (гіпотеза без
експериментальних досліджень)
2) Модель будови атома Томсона, 1904 р.:
атом – це кулеподібна частинка, яка
заряджена додатною електрикою, в
якій рівномірно розподілені негативно
заряджені електрони
3) Модель будови атома Резерфорда,
(планетарна) 1911 р.: атом складається з
позитивно зарядженого ядра та
негативно заряджених електронів, які
обертаються навколо нього у оболонці
атома
Заряд ядра чисельно дорівнює порядковому
номеру елемента в періодичній системі.
3. Історія відкриття
Моделі будови атома:4) Модель будови атома Бора, 1913 р.:
атом складається з позитивно
зарядженого ядра та негативно
заряджених електронів, які мають
певну енергію та без її втрат
можуть рухатися в оболонці атома
лише по певних орбіталях.
Випромінювання виникає при
переході електронів з однієї орбіталі
на іншу
5) Квантово-механічна модель будови атома, 1926 р., яка
описує стан атома за допомогою математичних функцій:
атом складається з позитивно зарядженого ядра та
негативно заряджених електронів. Електрони
знаходяться в атомній оболонці відповідно до рівня їх
енергії у місцях найбільшої вірогідності їх перебування
(на атомних орбіталях).
4.
Атомне ядрооснова атома, що визначає індивідуальність елементів.
Ядро (нуклід) – центральна позитивно заряджена частина атома, в якій
зосереджена практично вся його маса (~ 99,9%). Маса всіх електронів в
атомі менша за масу ядра приблизно в 4∙103 разів, густина ядра ~1014 г/мл.
Ядро складається з протонів і нейтронів
Протон (від грец. рrotos – перший) - стабільна елементарна частинка з
відносною атомною масою 1,00727 а.о.м., додатним зарядом +1.
Нейтрон (від лат. neuter – ніякий), - стабільна електронейтральна
елементарна частинка з атомною масою 1,008665 а.о.м., пов'язаний з
1
протоном співвідношенням: 1
0
n 1 p e
Властивості ядра зумовлені його складом – числом протонів Z та нейтронів
N, які входять до складу ядра і визначають його масове число A:
A Z N
N A Z
A
Z
Нуклонний склад атомних ядер скорочено записується так: E N
означає, що в ядрі атома Полонію міститься 84 протони
209
Ро
84
125
та 125 (209-84) нейтронів.
5.
Маса ядра завжди менша за арифметичну суму мас протонів і нейтронів, яківходять до складу даного нукліду. Різниця між цими величинами
називається дефектом маси: m Z m(11p) N m( 01n) mядр.
Сили, які утримують протони і нейтрони в ядрі – внутрішньоядерні.
Різновиди певного хімічного елемента, що мають різні маси ядер
називаються ізотопами. Ізотопи відрізняються один від одного масою
атомних ядер, але, маючи однаковий заряд ядра, вони в періодичній системі
займають одне місце . 9 Ве,17 F , 23Na, 27 Al, 31Р, 51V , 55Mn, 59Со, 209Bi - моноізотопні.
Атоми з різним числом протонів і нейтронів, але з однаковим масовим числом
(мають однакову масу) називаються ізобарами. Атоми з однаковим числом
нейтронів називаються ізотонами
Кількісна характеристика
Число протонів (заряд ядра Z)
Число нейтронів N
Масове число A = (Z+N)
Приклади
Ізотопи
Однакове
Різне
Різне
39
19
40
K ,19
K;
Ізобари
Різне
Різне
Однакове
40
19
40
40
K , 20
Ca,18
Ar;
Ізотони
Різне
Однакове
Різне
14
6
C8 ,157 N 8 ,168 O8
6.
Як модель стану електрона в атомі у квантовій механіці прийнятоуявлення про електронну хмару, густина відповідних ділянок якої
пропорційна ймовірності перебування там електрона. Простір навколо
ядра, в якому найімовірніше перебування електрона, називається
орбіталлю.
Для характеристики стану електронів в атомі використовують набір
квантових чисел:
n - головне, l - орбітальне, m - магнітне та s - спінове.
Головне квантове число n визначає радіус квантового рівня (середню
віддаль від ядра до ділянки підвищеної електронної густини) або
загальну енергію електрона на певному рівні.
Стан електрона, який характеризується певним значенням головного
квантового числа, називають енергетичним рівнем електрона в
атомі.
Головне квантове число 1 2 3 4 5 6 7
Енергетичні рівні
K L M N O P Q
7.
Для характеристики енергії електрона на підрівні, або формиелектронних орбіталей, введено орбітальне l квантове число, яке
називають також побічним або азимутальним квантовим числом.
Орбітальне квантове число може приймати значення від 0 до n-1.
Орбітальне квантове число
Енергетичні підрівні
0
1
2
3
s p d f
4
g
5
6
h i
Можлива кількість підрівнів для кожного рівня дорівнює номеру цього рівня,
тобто величині головного квантового числа:
n
1
2
3
4
5
0
0; 1
0; 1; 2
0; 1; 2; 3 0; 1; 2; 3; 4
l
s; p ; d s; p ; d ; f s; p ; d ; f ; g
Позначення
s; p
s
Число
енергетичних
1
2
3
4
5
підрівнів на рівні
8.
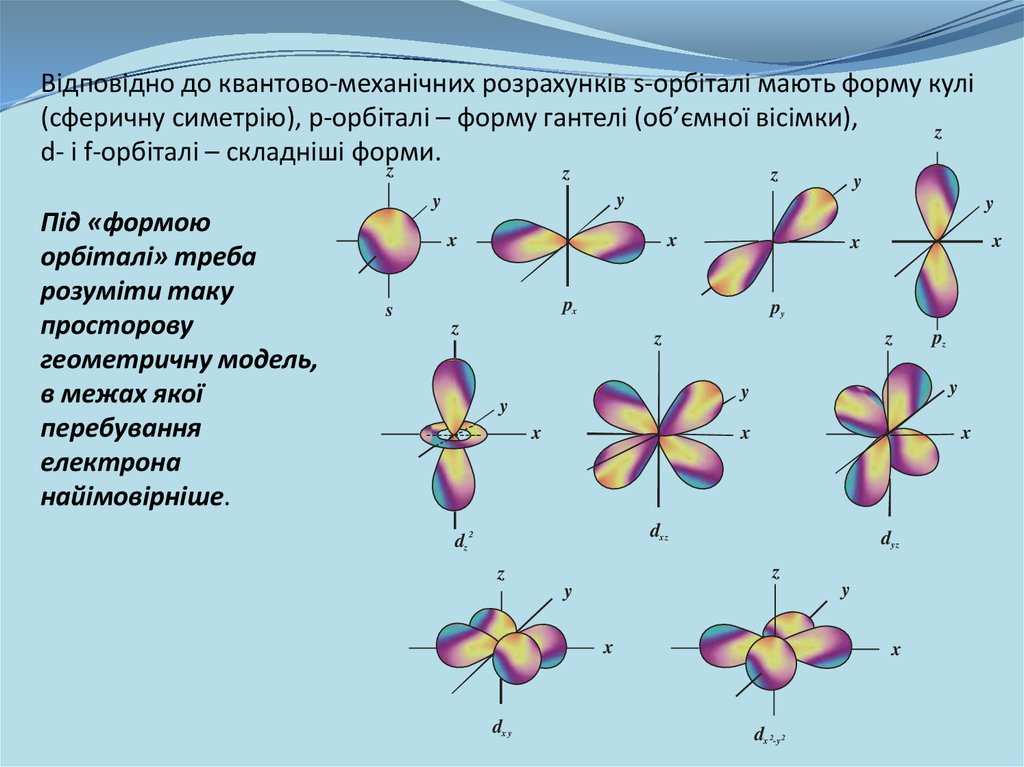
Відповідно до квантово-механічних розрахунків s-орбіталі мають форму кулі(сферичну симетрію), p-орбіталі – форму гантелі (об’ємної вісімки),
z
d- і f-орбіталі – складніші форми.
z
Під «формою
орбіталі» треба
розуміти таку
просторову
геометричну модель,
в межах якої
перебування
електрона
найімовірніше.
z
z
y
y
y
y
x
x
px
s
py
z
z
z
x
x
x
dx z
dz 2
dyz
z
y
y
x
dx y
pz
y
y
y
z
x
x
x
dx 2-y2
9.
Просторове розміщення електронних орбіталей відносно напрямленостімагнітного поля характеризується третім квантовим числом ml , яке
називається магнітним. Магнітне квантове число може приймати цілочислові
значення (додатні і від’ємні від l до l ).
l
Підрівень
ml
Кількість
орбіталей
0
s
0
1
1
p
+1; 0; -1
3
2
d
+2; +1; 0; -1; -2
5
3
f
+3; +2; +1; 0; -1; -2; -3
7
Спінове квантове число. Спін електрона характеризує його обертання
навколо своєї осі ( вправо та вліво), тобто власний магнітний
момент електрона. Тому спінове квантове число може мати тільки два
значення +1/2 або -1/2. Спіни електронів, напрямлені в один бік
називаються паралельними, а в протилежний – антипаралельними.
,
,
.
10.
Будову електронних оболонок атомів відображають за допомогоюелектронних формул, або електронних конфігурацій. Електронні
конфігурації атомів – це умовне зображення розподілу електронів по
орбіталях на енергетичних рівнях і підрівнях.
1s 2 2s 2 2 p 6 3s1 - електронна конфігурація атома Натрію.
Для складання електронних формул слід використовувати три правила.
Перше правило має назву заборони Паулі, принципу виключення або
принципу Паулі: в атомі не може бути двох електронів з однаковими
значеннями всіх чотирьох квантових чисел, тобто на одній орбіталі
можуть знаходитись не більше двох електронів, які мають
антипаралельні спіни:
.
Максимально можливе число електронів (N ) на енергетичному рівні
2
визначають за формулою: N 2n
Друге правило – найменшого запасу енергії (правило Клечковського): при
збільшенні заряду ядра атома послідовне заповнення електронних
орбіталей відбувається від орбіталей з меншим значенням суми головного і
орбітального квантових чисел (n l ) до орбіталей з більшим значенням цієї
суми. При однакових значеннях суми (n l) заповнення орбіталей відбувається
послідовно у напрямі зростання значень головного квантового числа n.
11.
1s 2s 2 p 3s 3 p 4s 3d 4 p 5s 4d 5 p 6s 4 f 5d 6 p 7 s 5 f 6d 7 pВисока
енергія
f
f
d
f
d
d
p
s
p
s
p
Енергія
d
d
s
p
s
p
s
p
s
Низька
енергія
s
n =1
2
3
4
5
6
Рівні енергій орбіталей нейтрального атома
7
12.
На кожному наступному енергетичному рівні енергія електронів більша, ніжна попередньому, а зв'язок з ядром відповідно менший.
Е
d
p
s
Третє правило найбільшого сумарного спінового числа або правило Гунда :
сумарне спінове число певного не повністю заповненого підрівня має бути
максимальним. Звідси випливають такі висновки: 1) під час заповнення
підрівня електрони посідають різні орбіталі доти, доки це можливо; 2) спіни
поодиноких електронів, що знаходяться на різних орбіталях, паралельні.
Наприклад, три електрони в атомі розміщуються наступним чином:
Четвертий, п’ятий та шостий електрони займатимуть вакантні місця на будьякій з цих трьох орбіталей, але з антипаралельними спінами:
,
֏











 physics
physics








