Similar presentations:
Биотехнология изготовления вакцин
1.
Биотехнология изготовлениявакцин
2.
• Вакцины — специфические антигенныебиопрепараты,
полученные
из
микроорганизмов, их компонентов продуктов
жизнедеятельности,
или
вирусов
и
предназначенные для создания активного
иммунитета к инфекционным болезням в
организме животных.
3.
•Все биопрепараты выпускают по единымнормативным документам (ОСТам и ТУ); к
биопрепаратам
обязательно
прилагают
наставления по их применению.
•Биопрепараты
выпускают
несколько
крупных
федеральных
биологических
предприятий (биофабрики и биокомбинаты,
научно-исследовательские
институты),
а
также коммерческие фирмы.
4.
Вакцины готовят на основе производственныхштаммов.
Эти штаммы являются эталонными, или
референтными их хранят и поддерживают на
заданном уровне во ВГНКИ ветер. препаратов.
После
получения
вакцинного
штамма
необходимо сохранить его характеристики по
возможности в неизмененном состоянии.
Практически все микроорганизмы хранят в
лиофилизированном виде.
5.
Требования к производственным вакциннымштаммам:
- наличие остаточной вирулентности;
- достаточная иммуногенность;
- отсутствие возможности реверсии к исходным
свойствам
обладание
стойкими,
наследственно
закрепленными
аттенуированными свойствами.
6.
Изготовление живых бактерийных вакцинвключает:
- получение маточной культуры и наращивание
микробной массы;
- глубинное культивирование бактерий на жидких
средах в условиях активной аэрации;
- за 6—12 ч м.б. получены микробные взвеси с
большой плотностью (40 млрд и более микробных
клеток в 1 мл); - стандартизация микробной массы;
- к вакцинному штамму добавляют протекторы,
расфасовывают,
подвергают
лиофильному
высушиванию и контролю.
7.
Производствопротиворожистой
живой
вакцины. Вакцинный Румынский штамм WR
высевают в бульон из конины с 10 % сыворотки
лошади, инкубируют 48 - 72 ч при t 37°С. После
достижения
надлежащей
концентрации
возбудителя культуры разливают в ампулы по 2
мл, подвергают лиофильной сушке и
запаивают
под
вакуумом.
Сыворотка
способствует росту культур возбудителя рожи и
служит в качестве защитного коллоида при
лиофилизации. Срок хранения в теч-е 2-х лет.
8.
Основные этапы производства анатоксиновАнатоксины получают из бактериальных
экзотоксинов. Культуры бактерий продуцирующих экзотоксины, выращивают в жидких пит.
средах для накопления токсина, фильтруют
через
бактериальные
фильтры.
Для
разрушения токсина к фильтрату добавляют
0,3-0,4 % формалина и термостатируют при t 3740°С
3-4
сут.
Подвергают
очистке
(ионнообменная хроматография или кислотное
осаждение), адсорбируют на адъювантах (ГОА)
Контроль на стерильность, безвредность и
иммуногенность, консервир-т 0,3 % р-р фенола
Разливают по флаконам и хранят до 3-х лет.
9.
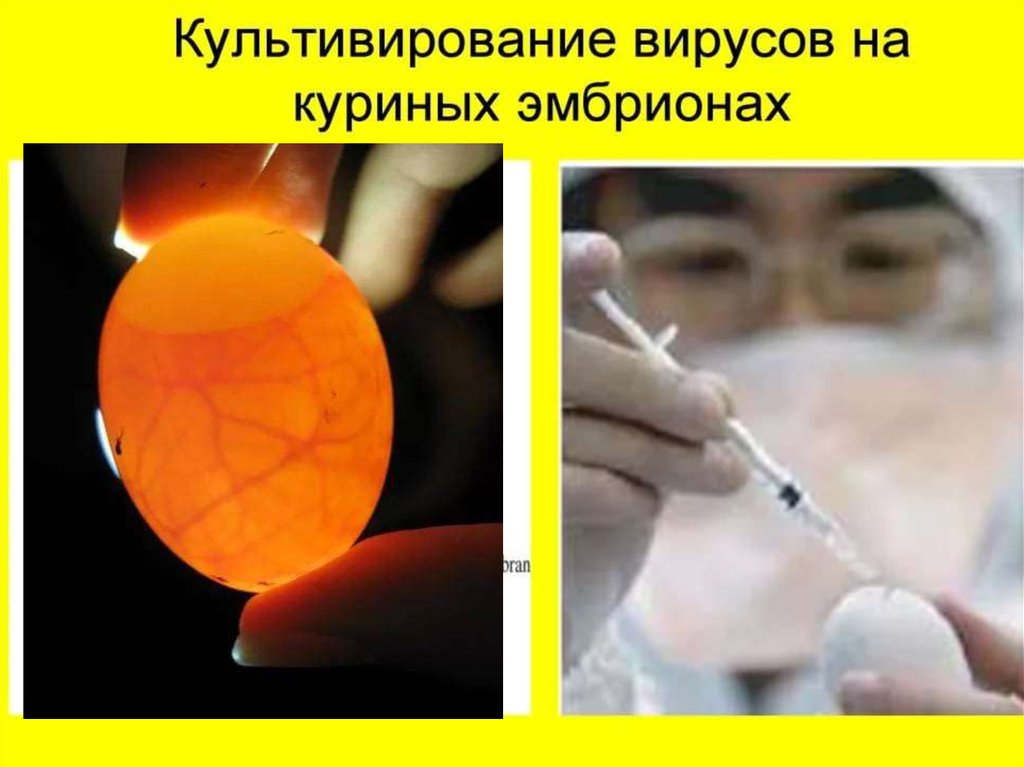
Изготовление живых противовирусныхэмбриональных вакцин против ИЛТ птиц
Изготовление вирус-вакцины против ИЛТ птиц,
включает инфицирование чувствительной
биологической системы вируссодержащим
материалом из аттенуированного штамма
“ВНИИБП”
гомологичного
вируса,
инкубирование зараженной системы, сбор
вируссодержащего материала, добавление к
нему защитной среды, высушивание смеси и
контроль ЦП
10.
Изготовление живых противовирусныхэмбриональных вакцин против ИЛТ птиц
• Для получения матровой расплодки 9-сут
эмбрионы кур заражают авирулентным для
цыплят
производственным
штаммом
«ВНИИБП» на ХАО по 0,2 см3 .
• Зараженные эмбрионы инкубируют
температуре 37,0°С в течение 5 суток.
• Ежедневно овоскопируют.
при
11.
12.
13.
• Из пораженных ХАО готовят 15-30%суспензию, которую замораживают, оттаивают
и освобождают и центрифугируют.
• Матровой расплодкой
эмбрионов SPF-кур.
заражают
9
сут
• Зараженные эмбрионы культивируют при
37,5°С
в течение 5 суток. Ежедневно
овоскопируют, погибших выкладывают на
+2°С, а живых помещают в холодильные
камеры при 2°С на 18 часов для остановки
кровотока.
14.
• эмбрионы вскрывают, извлекают ХАО схарактерными изменениями (специфические
узелки-бляшки или оспины).
• замораживают при температуре минус 40°С,
затем размораживают и гомогенизируют.
15.
Вскрытие заражённых куриных эмбрионови сбор вируссодержащего материала
16.
•вируссодержащий материал смешивают сзащитной средой и контролируют на
стерильность.
•Расфасовывают в стерильные ампулы или
пенициллиновые флаконы на 1/2 высоты.
17.
• Ампулы и флаконы помещают в специальныеметаллические кассеты, которые затем
устанавливают в холодильную камеру с
температурой минус 60°C на 8-24 часа.
• Замороженный
лиофилизации.
полуфабрикат
подвергают
18.
• Продолжительностьполуфабриката составляет
высушивания
56-72 часа в
зависимости от конструкции сублимационной
установки и уровня материала во флаконе или
ампуле. По окончании сушки флаконы с сухой
вакциной
укупоривают
и
закатывают
алюминиевыми колпачками. Ампулы с сухой
вакциной запаивают
19.
20.
• Сухая вирус-вакцина против ИЛТ птиц изштамма «ВНИИБП» представляет собой
однородную пористую в виде таблетки или
аморфную массу светло-коричневого цвета.
Массовая доля влаги - не более 3%.
Биологическая активность вируса в вакцине
должна быть не меньше 6,0 lg ЭИД50/см 3.
21.
Основные этапы производстваинактивированной противоящурной вакцины
Вакцину производят в моно, би или
тривалентной форме из преобладающих типов
вируса
распространенного
на
данной
территории. Вирус репродуцируют в ткани
эпителия ткани языка крс по методу Фленкеля
(1954). Эпителий языка КРС снимают сразу
после
убоя,
измельчают,
отмывают,
суспендируют в поддерживающей среде,
заражают вирусом и после добавления
антибиотиков инкубируют при t 37 °С.
22.
Основные этапы производстваинактивированной противоящурной вакцины
Через 24 ч после заражения достигается
максимальный уровень антигена. Ткани
подвергают замораживанию и оттаиванию,
вируссодержащую суспензию очищают и
концентрируют. Этот метод технологически
хорошо отработан и экономически очень
выгоден.
Но
более
часто
используют
размножение вируса в роллерной однослойной
или суспензионной культуре.
23.
Основные этапы производстваинактивированной противоящурной вакцины
В реакторе объемом 500 л при постоянном
помешивании стерилизуют необходимое колво адсорбента (гель ГОА), охлаждают до 25°С и
забуферивают
стерильным
гликоколовым
буфером. Антиген тщательно перемешивают с
адъювантом и добавляют к приготовленному
адсорбенту. Добавляют раствор этилендиамина
или
формалина
и
полученную
смесь
инактивируют при постоянном перемешивании
в течение 24 ч при t 25 °С. Вакцину разливают в
стерильные флаконы и укупоривают.
24.
Инактивированные вакцины содержат либоубитый целый микроорганизм, либо компоненты
клеточной стенки или других частей возбудителя.
Инактивируют
физическими
(температура,
радиация,
ультрафиолетовый
свет)
или
химическими (спирт, формальдегид) методами.
Преимущества: стабильны, безопасны (не могут
вызвать
реверсию
вирулентных
свойств
возбудителя). Часто не требуют хранения на
холоде, что практично.
Недостатки: содержат инактиватор, стимулируют
более слабый иммунный ответ и требуют введения
нескольких доз (бустерные иммунизации).
25.
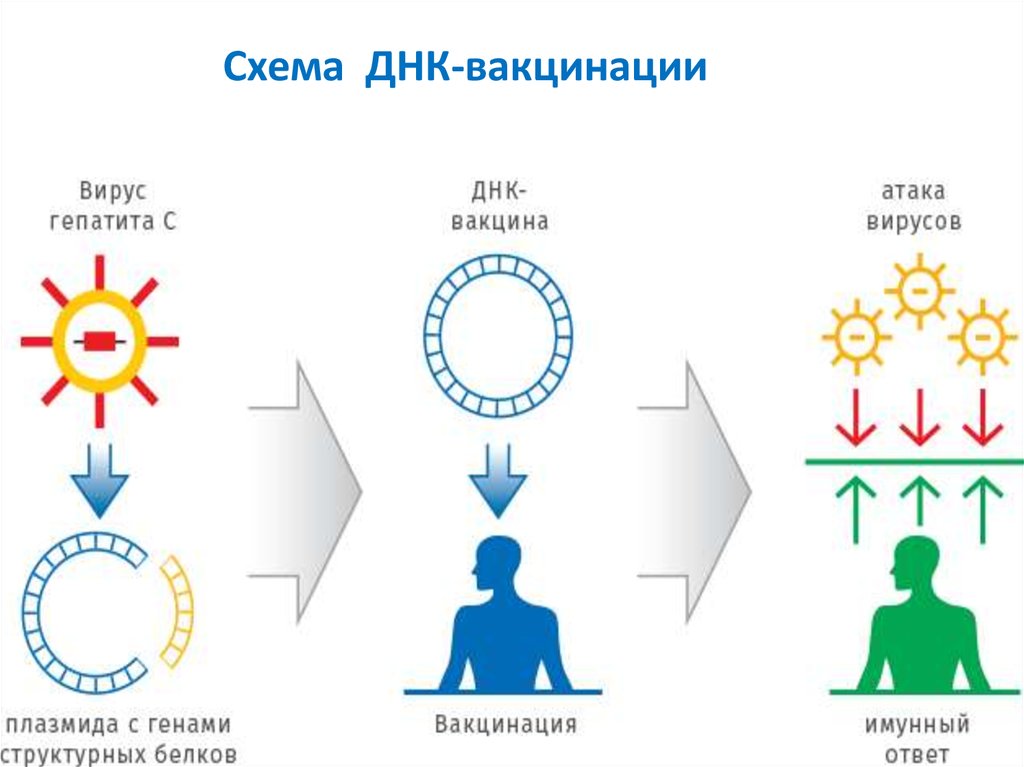
За последние 10 лет сформировалось новоенаправление — ГЕНЕТИЧЕСКАЯ ИММУНИЗАЦИЯ
Это направление называют также ! «ДНКвакцинацией», поскольку в организм вводят не
белок-антиген, а нуклеиновую кислоту (ДНК
или РНК), в которой закодирована информация
о белке, т.е. готовят рекомбинантные вакцины.
Используют также вакцины-антигены.
Новый подход прост, дешев и универсален.
26.
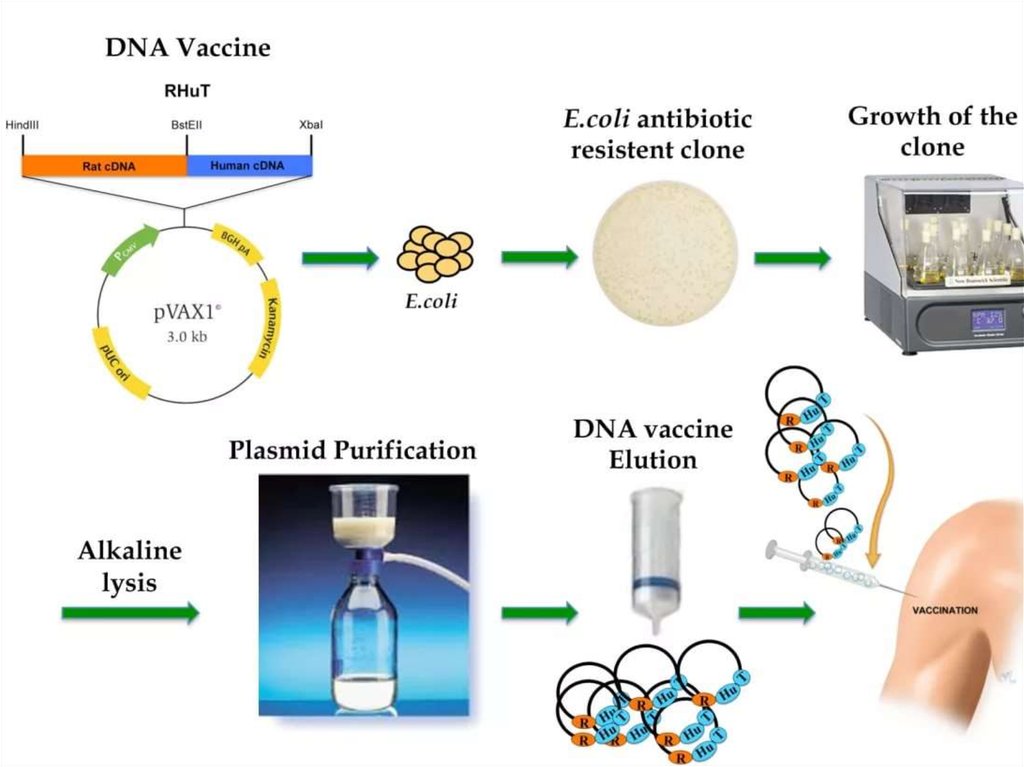
Рекомбинантные вакцины и вакцины-антигеныоснованы на генно-инженерном подходе.
Используют хорошо известный вирус коровьей
оспы (осповакцины) как вектор. В его ДНК
встраивают гены, кодирующие иммуногенные
белки различных возбудителей: гемаглютинин
вируса гриппа, гликопротеин D вируса герпеса,
поверхностный антиген вируса гепатита В,
антиген малярийного плазмодия.
27.
Рекомбинантные вакцины и вакцины-антигеныТакже в качестве вектора используют плазмиду
несущую сильный промотор, вызывающий
экспрессию высокого уровня во многих типах
клеток или другие безопасные вирусы, которые
проникают в клетку и синтезируют нужные
белки.
Введенная плазмидная ДНК не интегрируется с
геномом, а существует в виде эписомы,
способной длительное время реплицироваться
под контролем эукариотических промоторов.
28.
Трансформированная клетка превращается в«фабрику» по производству вакцины прямо
внутри организма.
Используя один и тот же плазмидный или
вирусный вектор, можно создавать вакцины
против различных инфекционных болезней,
меняя
только
последовательность,
кодирующую необходимые белки-антигены.
Возможна
одномоментная
комплексная
иммунизации крс и других видов животных
против всех опасных инфекций данной
местности.
29.
! Вакцины-антигены получают, клонируя геныантигенов возбудителя болезни в Е. coli,
дрожжах,
клетках
насекомых
и
млекопитающих.
В настоящее время клонирован ген поверхностного
антигена НВSag-вируса гепатита, ген белка оболочки
VР1 — вируса ящура (многих серотипов).
Удалось
скомбинировать
иммуногенные
компоненты различных серотипов в одну
вакцину-антигена.
Иммуногенность вакцин-антигенов повышают
добавлением адьювантов, иммобилизацией
вакцин на носителях или их включение в
липосомы.
30.
При этом отпадает необходимость работать сопасными вирусами и бактериями, становится
ненужной
сложная
и
дорогостоящая
процедура очистки белков.
! «ДНК-вакцины» на основе плазмидных
векторов активируют как гуморальный, так и
клеточный иммунный ответ. ДНК-вакцинация
обеспечивает высокий уровень защиты от
вирусной инфекции — до года.
31.
ПрепаратыДНК-вакцин
не
требуют
специальных условий хранения и доставки,
они стабильны длительное время при
комнатной температуре.
Уже разработаны и испытываются ДНКвакцины против бешенства, гриппа, гепатитов
B и C, иммунодефицита человека (ВИЧ),
японского энцефалита, а также
против
сальмонеллеза,
туберкулеза
и
некоторых
паразитарных
заболеваний
(лейшманиоз, малярия).
32.
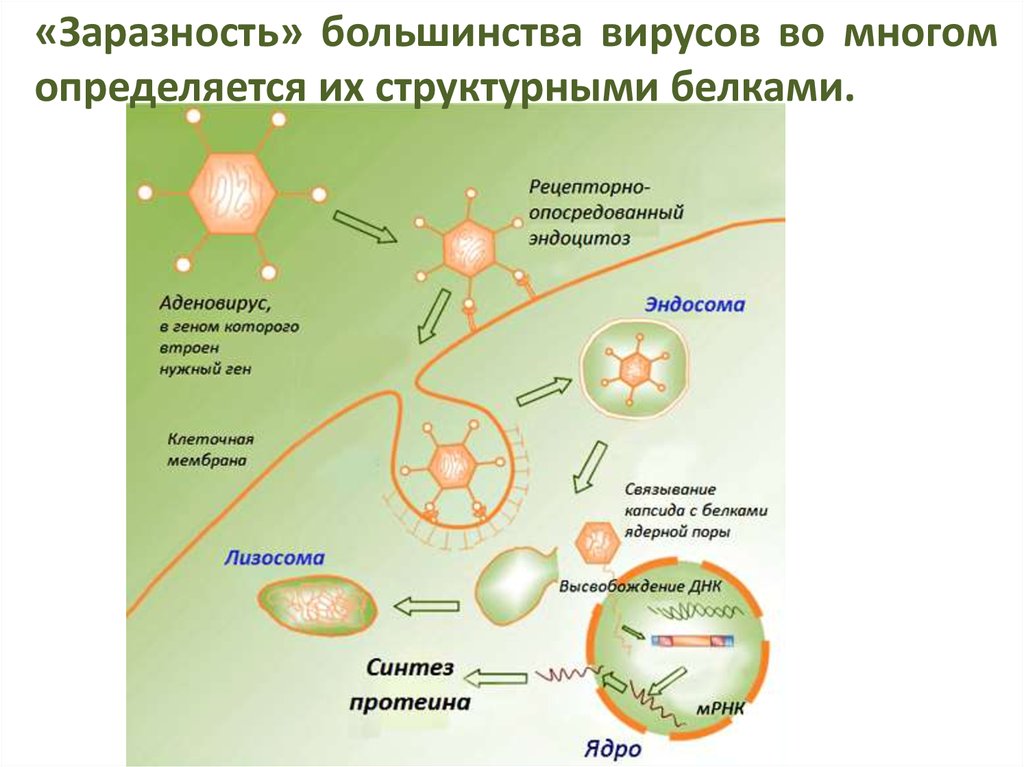
«Заразность» большинства вирусов во многомопределяется их структурными белками.
33.
34.
Схема ДНК-вакцинации35.
• ДНК-вакцинация—
одно
из
самых
перспективных направлений в борьбе с
раком.
• В опухоль можно вводить разные гены: те, что
кодируют раковые антигены, гены цитокинов
и иммуномодуляторов.































 medicine
medicine








