Similar presentations:
Аффинная хроматография. Лекция 1
1. Аффинная хроматография
2. ЛИТЕРАТУРА
• Туркова Я.. Аффинная хроматография, пер. сангл.. М., 1980
http://booksshare.net/index.php?id1=4&categor
y=biol&author=tukova-ya&book=1980;
• П.Дин, У. Джонсон Аффинная хроматография.
Методы. МИР:1988
• Л.А. Остерман Хроматография белков и
нуклеиновых кислот, 1985. 536 С
http://booksonchemistry.com/index.php?id1=3&
category=hromatografia&author=ostermanla&book=1985&page=215.
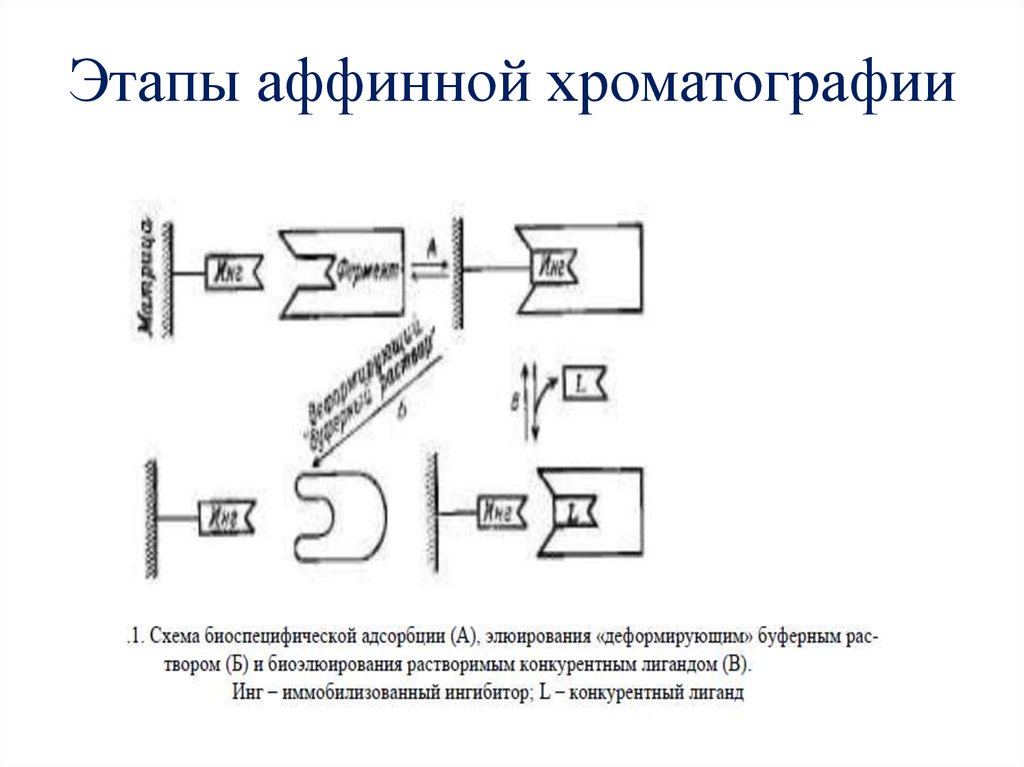
3. Аффинная хроматография (от латинского affinis - родственный) (биоспецифическая хроматография, хроматография по сродству)
• - это метод очистки и разделениябелков, основанный на их
избирательном взаимодействии с
лигандом, ковалентно связанным с
инертным нерастворимым
носителем (матрицей аффинного
сорбента)
4. ЛИГАНДЫ -
ЛИГАНДЫ • соединения, ковалентно связанные сматрицей, биоспецифически
(комплементарно) взаимодействующие с
выделяемыми соединениями.
• Биоспецифическое взаимодействие
основано на стерическом соотвествии
взаимодействующих веществ и связано с
выполнением биологической функции
лиганда и выделяемого соединения.
5. Примеры биоспецифического взаимодействия
• 1. фермент –ингибитор
2. фермент – субстрат
3. фермент –
активатор
4. антиген – антитело
5. комплементарные
нуклеиновые кислоты
• 6. гормонклеточный
рецептор
• 7. нейромедиатор –
рецептор
• 8. убиквитин –
протеасома
• 9. фибронектин –
коллаген
6. Этапы аффинной хроматографии
7. Элюирующие растворы
Элюирующие растворы
1. Буферные растворы со значением рН 2,42,8
2. Буферные растворы со значением рН > 10
3. Буферные растворы с высокой ионной
силой;
4. Буферные растворы с повышенной
температурой (< 56 градусов Цельсия);
5. Буферные растворы с добавлением
органических растворителей;
8.
• 6. Буферные растворы с добавлениемдетергентов;
• 7. Буферные растворы с добавлением
хаотропных соединений (роданид
калия или натрия);
• 8. Буферные растворы с добавлением
денатурирующих агентов ( мочевина
разрушает водородные связи);
9. Виды аффинной хроматографии
• 1. Аффинная хроматография сиспользованием лиганда
индивидуальной специфичности.
• 2. Аффинная хроматография с
использованием лиганда групповой
специфичности
10. Лиганды с индивидуальной специфичностью
• 1. моноклональные и поликлональныеантитела к данному антигену;
• 2. гаптены;
• 3. субстрат фермента
• 4. специфический ингибитор фермента
• 5. специфический активатор фермента
• 6. комплементарная ДНК или РНК
11. Лиганды с групповой специфичностью
• 1. лектины (конканавалин А, специфическисвязывающий молекулы, содержащие -Dманнопиранозил, -D-глюкопиранозил;
лектин из зародышей пшеницы,
специфически связывающий Nацетилглюкозамин);
• 2. сахара;
• 3. коферменты (НАД+, НАДФ+,
коферментом-А);
• 4. иммобилизованные нуклеозидфосфаты;
12.
5. триазиновые красители;
6. гепарин;
7. ингибиторы протеаз;
8. консервативные области ДНК
(например, промоторы);
• 9. желатин;
• 10. хелатирующие агенты
13. Хелатирующий агент (chelating agent) (от греческого chele — клешня) -
Хелатирующий агент (chelating agent) (отгреческого chele — клешня) • - лиганды, обладающие способностью
связывать атомы металлов.
• Содержат химические группы,
содержащие подвижный протон
(например -COOH, -ОН, -SO3H);
• Примером хелатирующих агентов
служит этилендиаминтетрауксусная
кислота (ЭДТА), которая прочно и
обратимо связывает двухвалентные
катионы
14.
• Одним из наиболееперспективных
направлений
развития аффинной
хроматографии
оказалось
использование ее
металохелатного
варианта.
• В рекомбинантные
белки вводится поли гистидиновая
аффинная метка,
способная связываться
с катионами никеля и
других металлов.
• Полученный методом
генной инженерии
белок выделяется
методом метало аффинной
хроматографии. За 1
цикл достигается 95%
очистка.
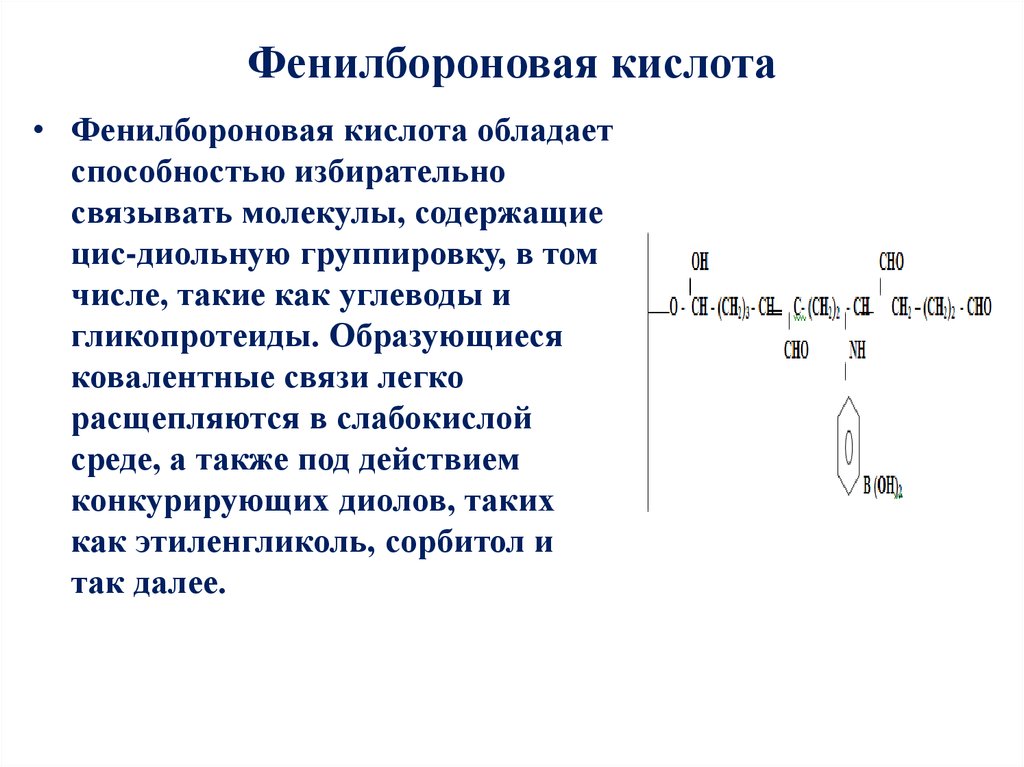
15. Фенилбороновая кислота
• Фенилбороновая кислота обладаетспособностью избирательно
связывать молекулы, содержащие
цис-диольную группировку, в том
числе, такие как углеводы и
гликопротеиды. Образующиеся
ковалентные связи легко
расщепляются в слабокислой
среде, а также под действием
конкурирующих диолов, таких
как этиленгликоль, сорбитол и
так далее.
16. Этапы проведения аффинной хроматографии
• 1. Подготовка ипромывка колонки
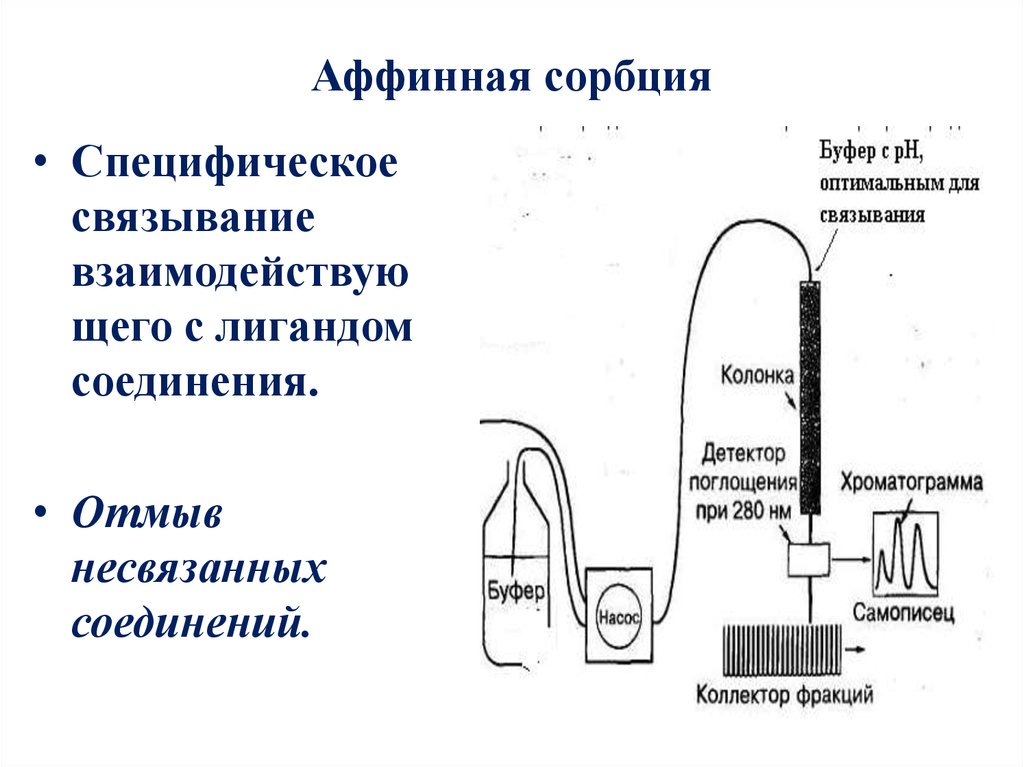
17. Аффинная сорбция
• Специфическоесвязывание
взаимодействую
щего с лигандом
соединения.
• Отмыв
несвязанных
соединений.
18. Элюция – разрыв биоспецифических связей
• Для элюцииприменяется
буферный раствор
с крайними
значениями рН,
или со
специфическими
реагентами
19. Затем элюат нейтрализуется
– На завершающемэтапе определяется
специфическая
активность
выделенного
соединения и его
удельная активность
в расчете на мг белка.
– Например:
20.
• 1. Примерыбиоаффинных
взаимодействий
• 2. Виды аффинной
хроматографии;
• 3. Металлоаффинная
хроматография;
• 4. Свойства идеального носителя
(матрицы) для аффинной
хроматографии;
21.
• 5. Матрицы углеводной природы.Структура. Достоинства и недостатки.
• 6. Полимерные синтетические носители для
аффинной хроматографии. Структура.
Достоинства и недостатки.
• 7. Применение макропористых стекол и
силикагеля для синтеза аффинных
сорбентов. Структура частиц, методы
получения.
• 8. Этапы аффинной хроматографии
(сорбция, промывка, элюция,
нейтрализация, определение удельной
активности)

















 biology
biology








