Similar presentations:
Выделение и очистка целевого продукта биотехнологического процесса (белка)
1. Выделение и очистка целевого продукта биотехнологического процесса (белка)
2. Выделение целевого белка
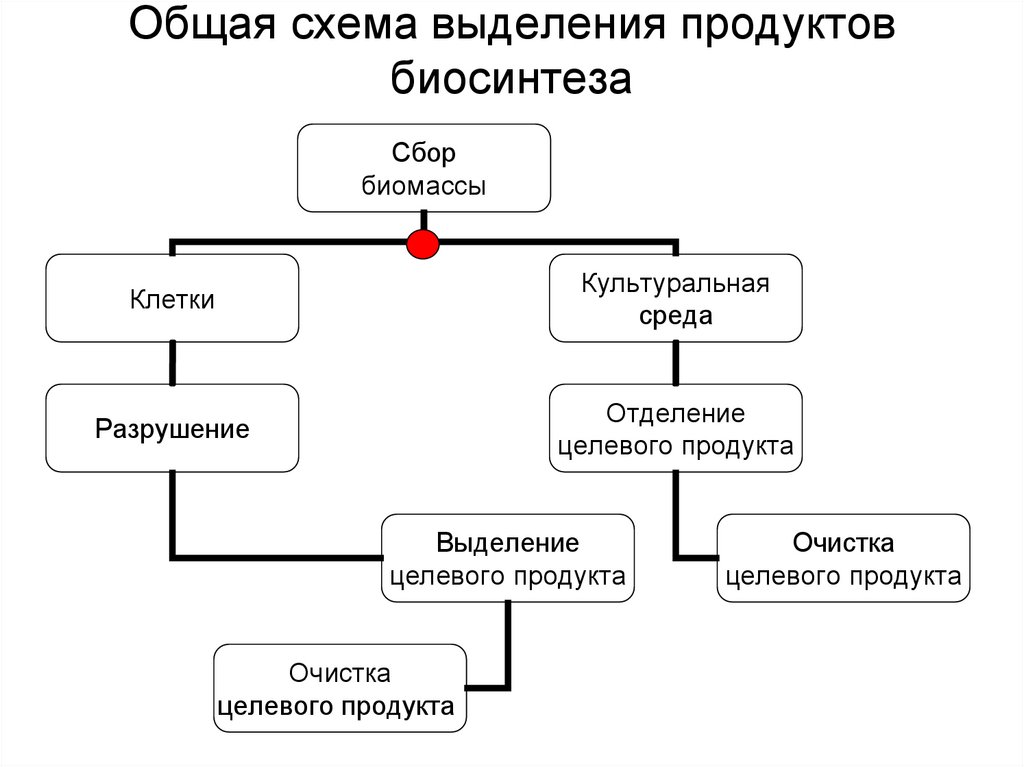
• В настоящем разделе будут рассмотрены общиеподходы к выделению целевого продукта
биосинтеза - белков. Они, в зависимости от
реализуемого процесса могут находиться в клетках
«Выделение и очистка целевого целевого продукта
биосинтеза из клеток») или в культуральной среде
«Выделение и очистка целевого белка из
культуральной среды»), но не в обеих фракциях
одновременно. Поэтому дальнейшая обработка
связана с их разделением и выделение целевого
продукта происходит только из одной из фракций
(красным маркером отмечена узловая точка
разделения технологических схем) (общая схема
процесса на следующем слайде).
3. Общая схема выделения продуктов биосинтеза
Сборбиомассы
Клетки
Культуральная
среда
Разрушение
Отделение
целевого продукта
Выделение
целевого продукта
Очистка
целевого продукта
Очистка
целевого продукта
4. Выделение и очистка целевого продукта.
• На этой стадии производства осуществляется сбор белка изсинтезировавших его клеток либо вне клеток.
• Для выделения белков, находящихся внутри клеток
(внутриклеточные белки), необходимо применение
специальных протоколов. Обычно они включают в себя
разрушение клеток для высвобождения белка, который затем
очищается от прочих внутриклеточных компонентов.
• Получение белков, находящихся вне клетки (внеклеточные
белки), подразумевает отделение их от культуральной
жидкости.
• После сбора белка производится его очистка. Сначала белок
отделяется от других частей клеток, затем производится
многократная очистка (чаще всего на хроматографических
колонках), в результате чего на выходе получается чистый
белок.
• Дополнительные этапы очистки заключаются в удалении
остаточных количеств ДНК, противовирусной очистке и
инактивации вирусных частиц , которые могут присутствовать в
системе.
5. Выделение и очистка целевого белка из культуральной среды
• При нахождении целевого продукта в культуральнойжидкости в большинстве промышленных
производств на первом этапе ее переработки
производят отделение массы продуцента от жидкой
фазы – сепарацию. Жидкость, содержащая
практически ценные метаболиты далее подвергается
переработке.
• В производствах, где целевым продуктом являются
клетки как источник белка, культуральная жидкость
подвергается лишь очистке, позволяющей
использовать водную фазу многократно и снизить
образование сточных вод.
6. Выделение и очистка целевого белка из культуральной среды
• Первым этапом выделения целевого продукта изкультуральной среды является отделение клеточной
массы.
• При переработке культуральной жидкости
используются следующие методы:
• флотация,
• центрифугирование ,
• различные виды микро- и ультрафильтрации (в том
числе и через полимерные мембраны со специально
подобранным размером пор) ,
• экстракция ,
• различные виды хроматографии.
7. Флотация
• Метод может быть применен, если клеткипродуцента в биореакторе из-за низкой
смачиваемости накапливаются в
поверхностных слоях жидкости. Флотаторы
различных конструкций сцеживают,
откачивают или соскребают пену,
состоящую из пузырьков газа с прилипшими
к ним клетками. Повышение эффективности
отбора биомассы в виде концентрированной
суспензии достигается вспениванием
жидкости с последующим отделением ее
верхнего слоя.
8. Центрифугирование
• Метод основан на осаждении взвешенных в жидкостичастиц с применением центробежной
силы. Центрифугирование и фильтрация в некоторых
производственных процессах реализуются в
комбинации — речь идет о фильтрационных
центрифугах.
• Широко применяют центрифуги, где разделение
жидкой и твердой фаз не связано с фильтрацией и
основано лишь на центробежной силе. Используют
центрифуги различных типов, классифицируемые по
скорости вращения сосуда для разделения биомассы
и культуральной жидкости, по способу выгрузки
осевшей биомассы и по другим критериям. Наиболее
перспективны для осаждения биомассы центрифугисепараторы, в которых биомасса оседает на стенках
вращаемого цилиндра или на тарелках специальной
тарельчатой вставки.
9. Фильтрация
• Отделение твердой фазы(мелкодисперсный клеточный материал
и др.) возможно методом фильтрации.
• Фильтрация - это отделение частиц от
среды (жидкости или газа) посредством
пропускания ее через проницаемый
фильтрующий материал.
• Можно выделить два основных типа
фильтрации и, соответственно,
фильтров: «поверхностного типа» и
«глубинного типа».
10. Фильтры «поверхностного типа»
• Через пространство междуволокнами и проходит
фильтруемая жидкость. Если
размер частиц превышает
размер пор или промежутков
в фильтрующем материале,
они удаляются из потока,
задерживаясь
непосредственно в этих
порах на поверхности
фильтра.
• Определяющим для
эффективности фильтрации
является размер частиц.
11. Фильтры для глубинной фильтрации
При глубинном фильтрованиичастицы задерживаются как на
поверхности так и, главным образом,
в толще капиллярно-пористого
фильтра. Механизмы действия
глубинной фильтрации имеют как
механическую, так и адсорбционную
природу. Механически удерживаются
частицы в асимметрической
структуре пустот глубинного
фильтровального средства (плавное
сужение структуры пор в
направлении потока). Путем
адсорбции удерживаются частицы,
размеры которых значительно
меньше, чем поры глубинного
фильтровального средства. Это
обеспечивается положительным
дзета-потенциалом
(электрокинетический потенциал часть общего скачка потенциала на
границе двух фаз), который
адсорбирует отрицательно
заряженные частицы.
12. Фильтры для глубинной фильтрации
• Глубинный фильтр прежде всего выполняет задачунадежного отделения клеток и фрагментов клеток из
культуральных растворов. Типичными примерами
применения являются производственные процессы
промышленных энзимов, которые используются в
пищевой промышленности, в производстве моющих
средств, специальных энзимов, предназначенных для
диагностики или биофармацевтических активных
веществ.
• В производстве фармацевтических промежуточных и
готовых продуктов классический вариант глубинной
фильтрации (грубая) с достаточно большими порами (5
мкм и более) применяется на первом этапе разделения
сред с целью защиты последующей мембранной
фильтрации, ультрафильтрации (которые, строго
говоря, также относятся к глубинной),
хроматографической колонны или системы, которые уже
применяются непосредственно для отделения и очистки
целевых белков.
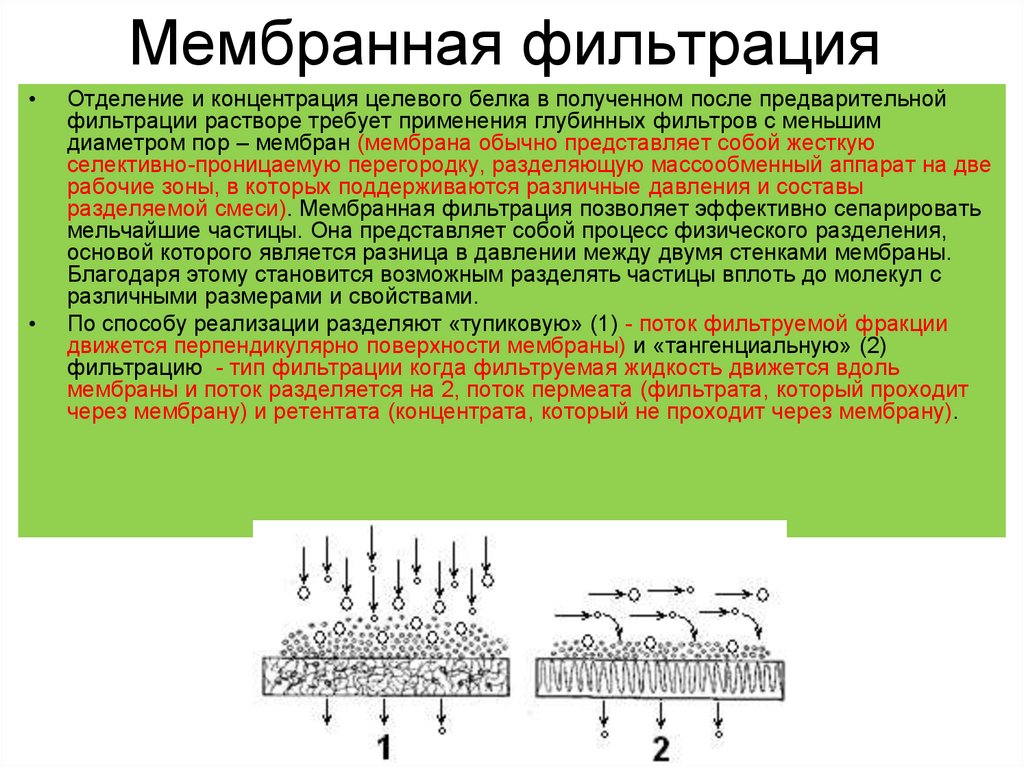
13. Мембранная фильтрация
Отделение и концентрация целевого белка в полученном после предварительной
фильтрации растворе требует применения глубинных фильтров с меньшим
диаметром пор – мембран (мембрана обычно представляет собой жесткую
селективно-проницаемую перегородку, разделяющую массообменный аппарат на две
рабочие зоны, в которых поддерживаются различные давления и составы
разделяемой смеси). Мембранная фильтрация позволяет эффективно сепарировать
мельчайшие частицы. Она представляет собой процесс физического разделения,
основой которого является разница в давлении между двумя стенками мембраны.
Благодаря этому становится возможным разделять частицы вплоть до молекул с
различными размерами и свойствами.
По способу реализации разделяют «тупиковую» (1) - поток фильтруемой фракции
движется перпендикулярно поверхности мембраны) и «тангенциальную» (2)
фильтрацию - тип фильтрации когда фильтруемая жидкость движется вдоль
мембраны и поток разделяется на 2, поток пермеата (фильтрата, который проходит
через мембрану) и ретентата (концентрата, который не проходит через мембрану).
14. Мембранная фильтрация
•Поры мембранного материала чрезвычайно малы и измеряются вангстремах (10–10 м). Соответственно, продавливание жидкости через них
возможно только под давлением. При этом, такого типа фильтрацию, как
правило, осуществляют при небольших перепадах давления (до 0,2 МПа)
на мембране (или мембранном элементе) во избежание значительных
деформаций, которым они подвержены при приложении нагрузки извне.
•В общем, механизм мембранной фильтрации можно описать следующим
образом: жидкость, содержащая частицы, при прохождении через
мембрану образует сложную проточную систему. В порах поток жидкости
дробится на отдельные струи. Первыми в этот процесс естественно
вовлекаются поры большего диаметра, затем средние и после достижения
на мембране определенного перепада давления начинается движение
жидкости и через мелкие поры. Взвешенные в жидкости частицы движутся
в ее потоке. Если их размер меньше размера поры мембраны, то они
проходят сквозь нее и становятся частью фильтрата. Остальные частицы
либо остаются на поверхности мембраны, либо задерживаются внутри ее
матрицы.
При этом вполне понятно, то, что на поверхности мембраны
удерживаются частицы, размеры которых больше размера пор. Но
мембраной извлекаются и частицы, размеры которых меньше размера пор
за счет процессов адсорбции и др.
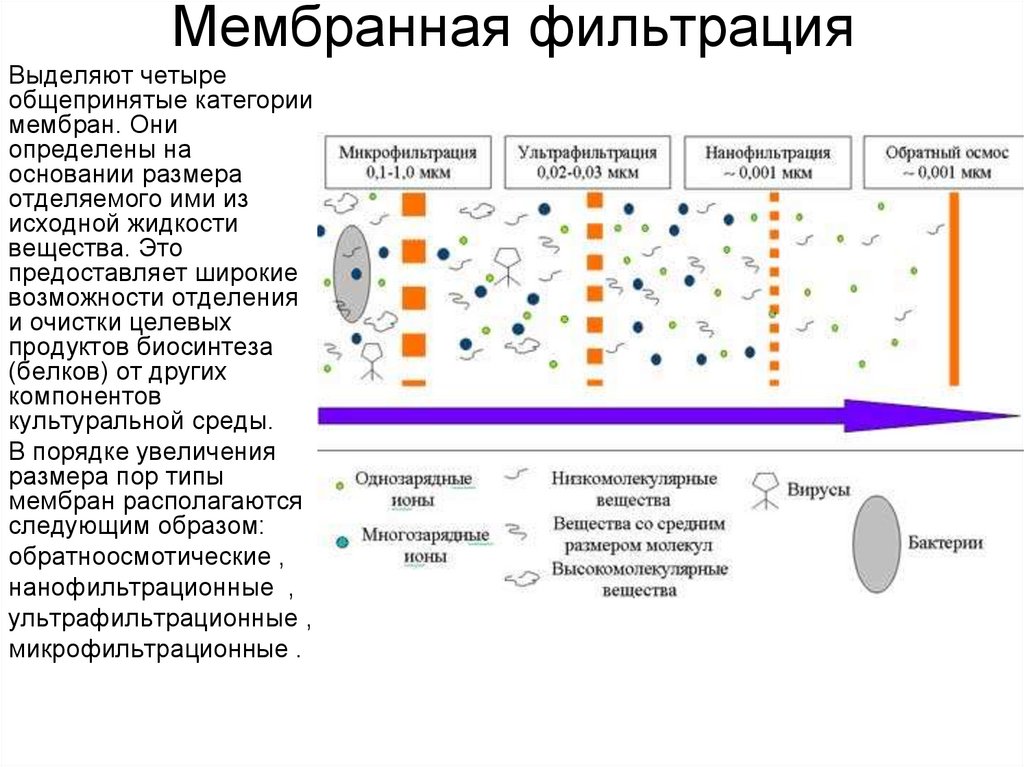
15. Мембранная фильтрация
Выделяют четыреобщепринятые категории
мембран. Они
определены на
основании размера
отделяемого ими из
исходной жидкости
вещества. Это
предоставляет широкие
возможности отделения
и очистки целевых
продуктов биосинтеза
(белков) от других
компонентов
культуральной среды.
В порядке увеличения
размера пор типы
мембран располагаются
следующим образом:
обратноосмотические ,
нанофильтрационные ,
ультрафильтрационные ,
микрофильтрационные .
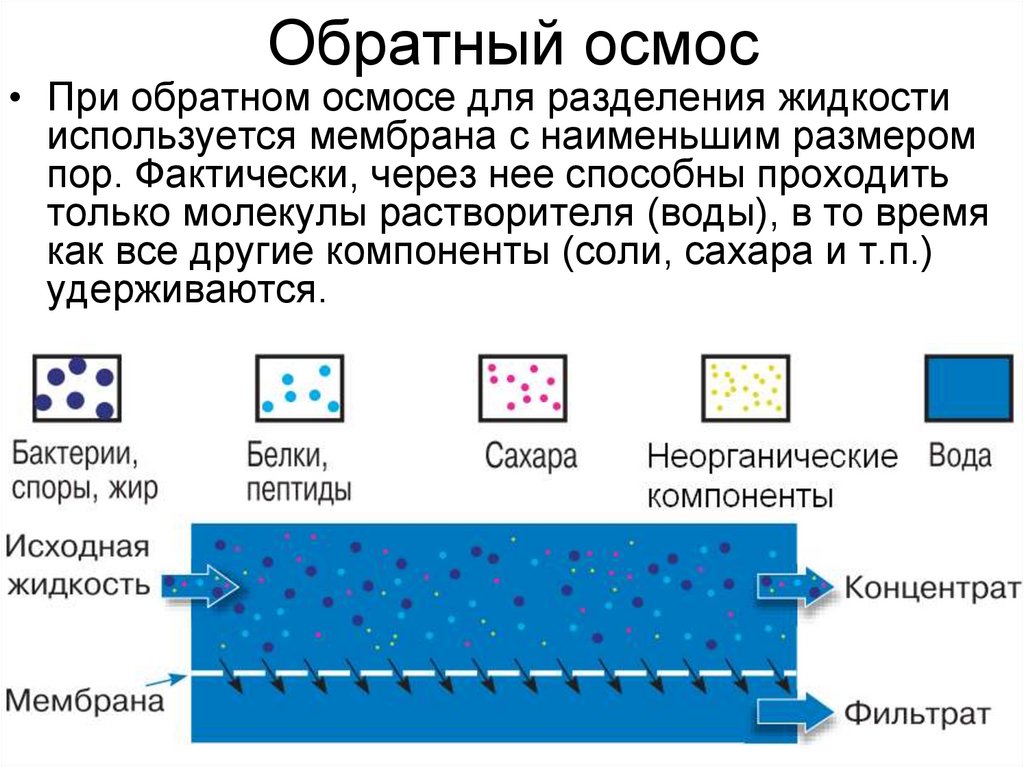
16. Обратный осмос
• При обратном осмосе для разделения жидкостииспользуется мембрана с наименьшим размером
пор. Фактически, через нее способны проходить
только молекулы растворителя (воды), в то время
как все другие компоненты (соли, сахара и т.п.)
удерживаются.
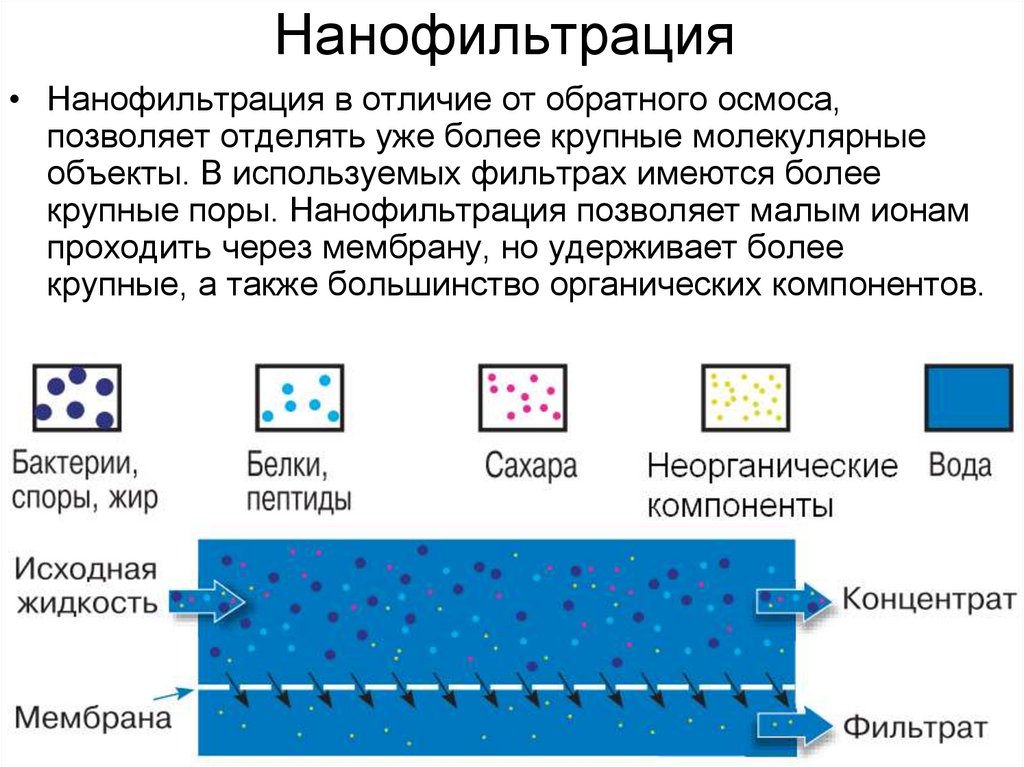
17. Нанофильтрация
• Нанофильтрация в отличие от обратного осмоса,позволяет отделять уже более крупные молекулярные
объекты. В используемых фильтрах имеются более
крупные поры. Нанофильтрация позволяет малым ионам
проходить через мембрану, но удерживает более
крупные, а также большинство органических компонентов.
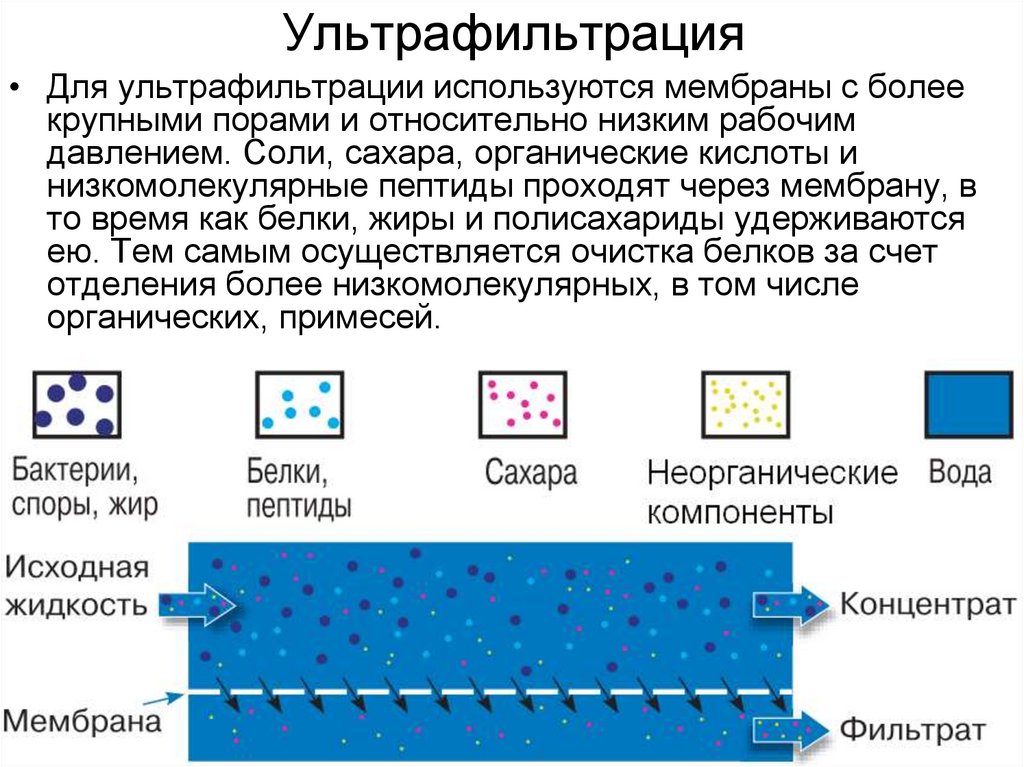
18. Ультрафильтрация
• Для ультрафильтрации используются мембраны с болеекрупными порами и относительно низким рабочим
давлением. Соли, сахара, органические кислоты и
низкомолекулярные пептиды проходят через мембрану, в
то время как белки, жиры и полисахариды удерживаются
ею. Тем самым осуществляется очистка белков за счет
отделения более низкомолекулярных, в том числе
органических, примесей.
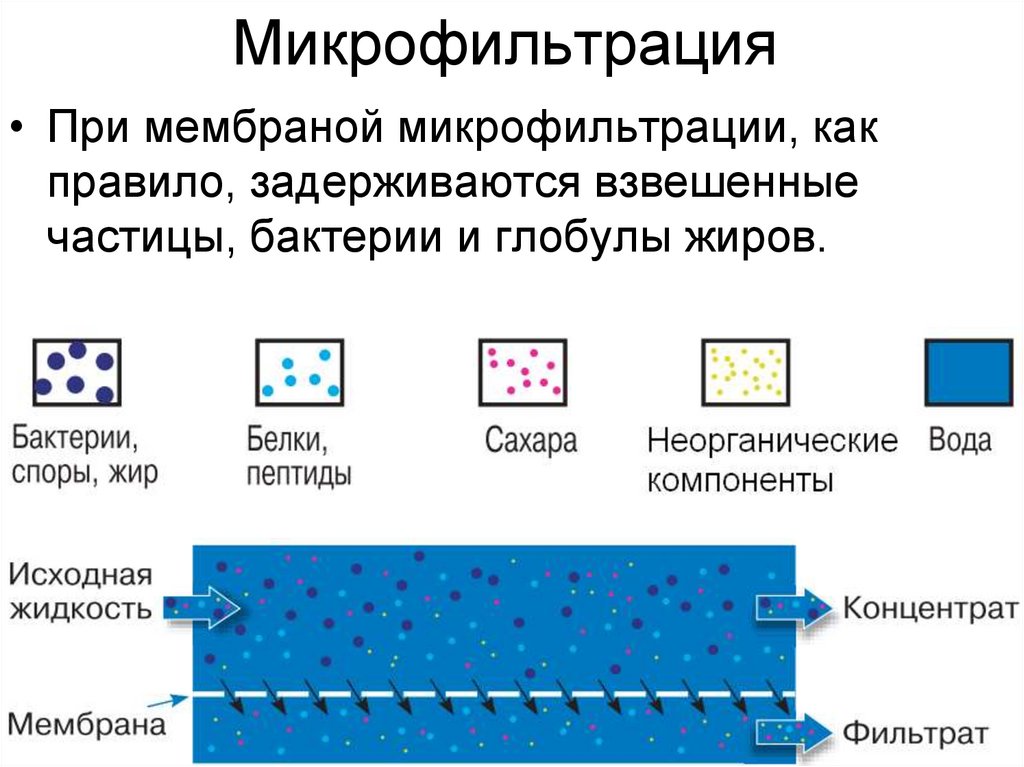
19. Микрофильтрация
• При мембраной микрофильтрации, какправило, задерживаются взвешенные
частицы, бактерии и глобулы жиров.
20. Диафильтрация.
• В процессе «тангенциальной» ультрафильтрациикультуральная среда (либо продукт ее предварительной
обработки) движется вдоль мембраны. В итоге жидкость,
забирая с собой соли и иные вещества, уходит по другую
сторону мембраны. Отделенный и очищенный продукт
биосинтеза отстается перед фильтрующей системой. Для
улучшения степени очистки белка может применяться
метод диафильтрации. Диафильтрация – это введение в
исходную жидкость дополнительного количества воды. Тем
самым концентрация содержащихся в системе солей,
минералов и прочих веществ снижается и они легче
проникают через мембрану. Тем самым достигается
значительное повышение эффективности
ультрафильтрации.
• Как несложно понять, качество получаемой в результате
ультрафильтрации белковой смеси напрямую зависит от
качества мембраны. Чем она лучше – тем меньше
останется жиров, микроэлементов и прочих веществ.
Повысить степень очистки можно повторной
ультрафильтрацией.
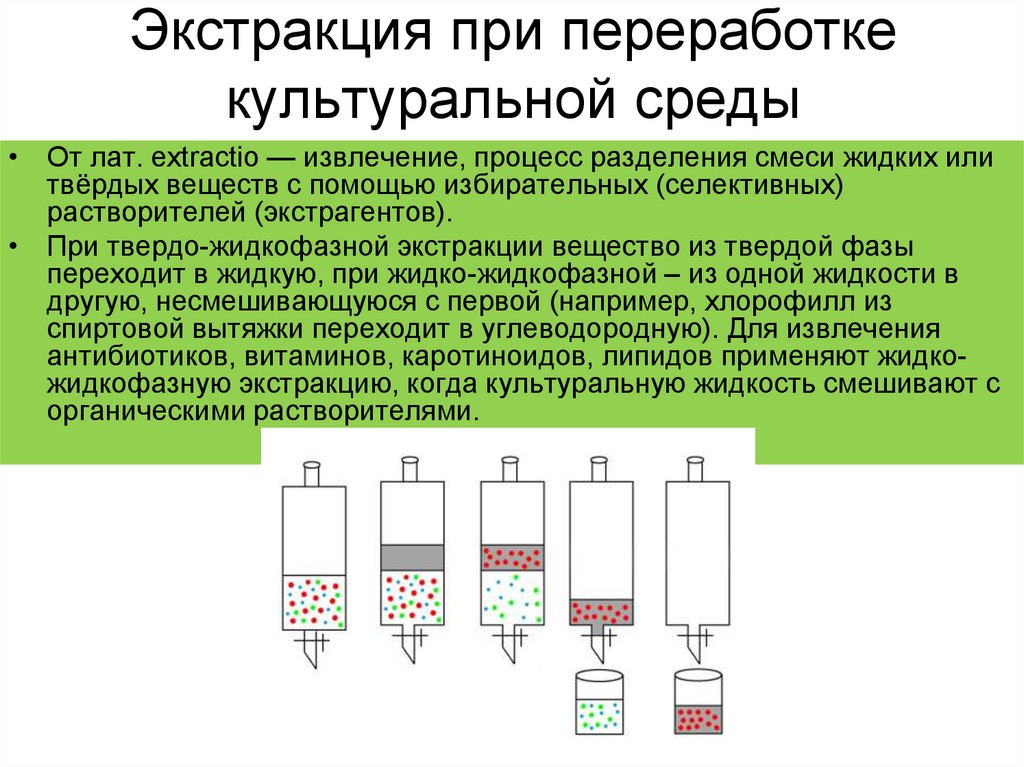
21. Экстракция при переработке культуральной среды
• От лат. extractio — извлечение, процесс разделения смеси жидких илитвёрдых веществ с помощью избирательных (селективных)
растворителей (экстрагентов).
• При твердо-жидкофазной экстракции вещество из твердой фазы
переходит в жидкую, при жидко-жидкофазной – из одной жидкости в
другую, несмешивающуюся с первой (например, хлорофилл из
спиртовой вытяжки переходит в углеводородную). Для извлечения
антибиотиков, витаминов, каротиноидов, липидов применяют жидкожидкофазную экстракцию, когда культуральную жидкость смешивают с
органическими растворителями.
22. Очистка целевого продукта хроматографическими методами.
• Эффективным методом отделения целевогопродукта биосинтеза (Например,белка) является
многократная очистка на хроматографических
колонках. Очистка белковых смесей при помощи
хроматографии на колонках основана на
разделении белков в зависимости от их
физических и химических свойств, таких как
размер, форма и заряд (положительный или
отрицательный).
• Хроматография – динамический метод
разделения смесей веществ, основанный на
многократном распределении веществ между
двумя фазами, одна из которых неподвижная, а
другая подвижная, непрерывно перемещающаяся
вдоль неподвижной фазы.
23. Очистка целевого продукта хроматографическими методами.
• Многообразие вариантов хроматографического метода вызвалонеобходимость их систематизации. Хроматография позволяет решать
как задачи аналитической химии (разделение, идентификация,
определение), так и препаративные проблемы (очистка, выделение,
концентрирование). Поэтому, по целям применения различают:
аналитическую (анализ сложных смесей), препаративную (разделение
компонентов смесей в лабораторных условиях и выделение
компонентов в чистом виде для последующего использования) и
промышленную (разделение смесей в промышленных масштабах и
выделение компонентов для последующего использования)
хроматографию.
Рассмотрим методы, применяющиеся в промышленной
хроматографии для разделения и очистки продуктов химического и
биотехнологического синтеза целевых систем. Прежде всего, следует
отметить, все они относятся к жидкостной хроматографии. Подвижной
фазой в данном случае служит жидкость. В жидкостно-адсорбционной
хроматографии неподвижной фазой является твердый адсорбент, в
жидкостно-жидкостной хроматографии – жидкость, удерживаемая
твердым носителем.
24. Очистка целевого продукта хроматографическими методами.
• В зависимости от механизма, лежащего в основе равновесногораспределения, можно делить белки согласно их:
• заряду (ионообменная хроматография - разделение зависит
от констант равновесия между ионообменной смолой
(неподвижной фазой) и электролитом (подвижной фазой),
• гидрофобности (гидрофобная хроматография - представляет
собой метод разделения, основанный на свойстве
гидрофобности белков),
• размеру (хроматография гель-фильтрацией - деление
веществ обусловлено тем, что молекулы разделяемой смеси
различаются по размеру и, следовательно, обладают разной
способностью проникать в поры геля (неподвижную фазу)
• способности связываться различными химическими группами
(аффинная хроматография - основана на уникальном свойстве
макромолекул – их биологической специфичности ).
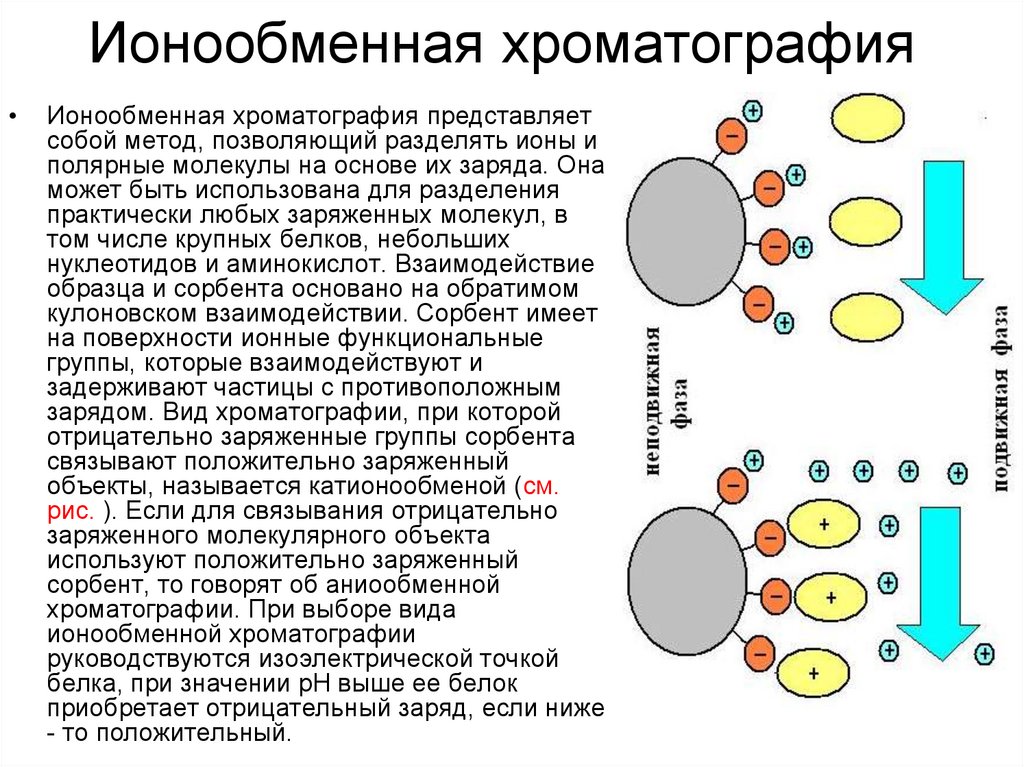
25. Ионообменная хроматография
Ионообменная хроматография представляет
собой метод, позволяющий разделять ионы и
полярные молекулы на основе их заряда. Она
может быть использована для разделения
практически любых заряженных молекул, в
том числе крупных белков, небольших
нуклеотидов и аминокислот. Взаимодействие
образца и сорбента основано на обратимом
кулоновском взаимодействии. Сорбент имеет
на поверхности ионные функциональные
группы, которые взаимодействуют и
задерживают частицы с противоположным
зарядом. Вид хроматографии, при которой
отрицательно заряженные группы сорбента
связывают положительно заряженный
объекты, называется катионообменой (см.
рис. ). Если для связывания отрицательно
заряженного молекулярного объекта
используют положительно заряженный
сорбент, то говорят об аниообменной
хроматографии. При выборе вида
ионообменной хроматографии
руководствуются изоэлектрической точкой
белка, при значении рН выше ее белок
приобретает отрицательный заряд, если ниже
- то положительный.
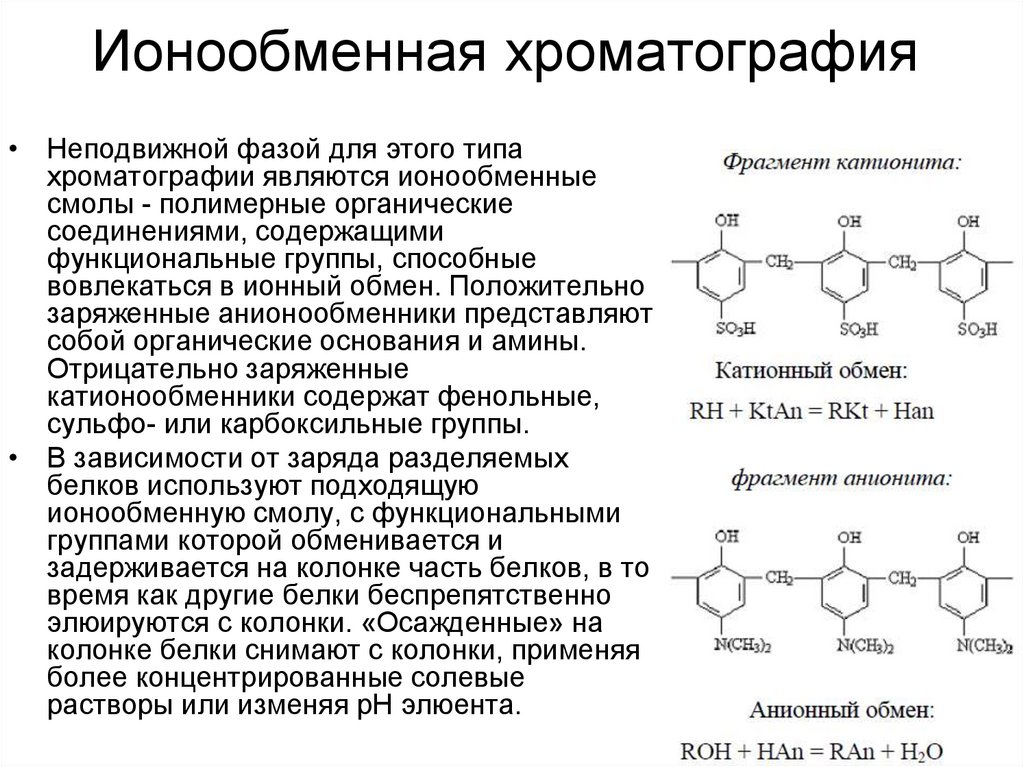
26. Ионообменная хроматография
• Неподвижной фазой для этого типахроматографии являются ионообменные
смолы - полимерные органические
соединениями, содержащими
функциональные группы, способные
вовлекаться в ионный обмен. Положительно
заряженные анионообменники представляют
собой органические основания и амины.
Отрицательно заряженные
катионообменники содержат фенольные,
сульфо- или карбоксильные группы.
• В зависимости от заряда разделяемых
белков используют подходящую
ионообменную смолу, с функциональными
группами которой обменивается и
задерживается на колонке часть белков, в то
время как другие белки беспрепятственно
элюируются с колонки. «Осажденные» на
колонке белки снимают с колонки, применяя
более концентрированные солевые
растворы или изменяя рН элюента.
27. Гидрофобная хроматография
• Гидрофобная хроматография представляет собой методразделения, основанный на свойстве гидрофобности
белков. Поверхность белковой глобулы богата
гидрофильными фрагментами аминокислот, но в то же
время содержит немало (до половины от их общего
содержания) гидрофобных остатков, нередко образующих
целые участки поверхности. Сорбенты для гидрофобной
хроматографии состоят из лиганда, содержащего
алкильные или арильные группы, который связан с
инертной матрицей сферической формы. Матрица
содержит поры для увеличения внутренней поверхности.
Белки, содержащие гидрофобные аминокислоты на
поверхности, могут обратимо связываться с
гидрофобными группами сорбента (фенил-, октил-, бутили др.).
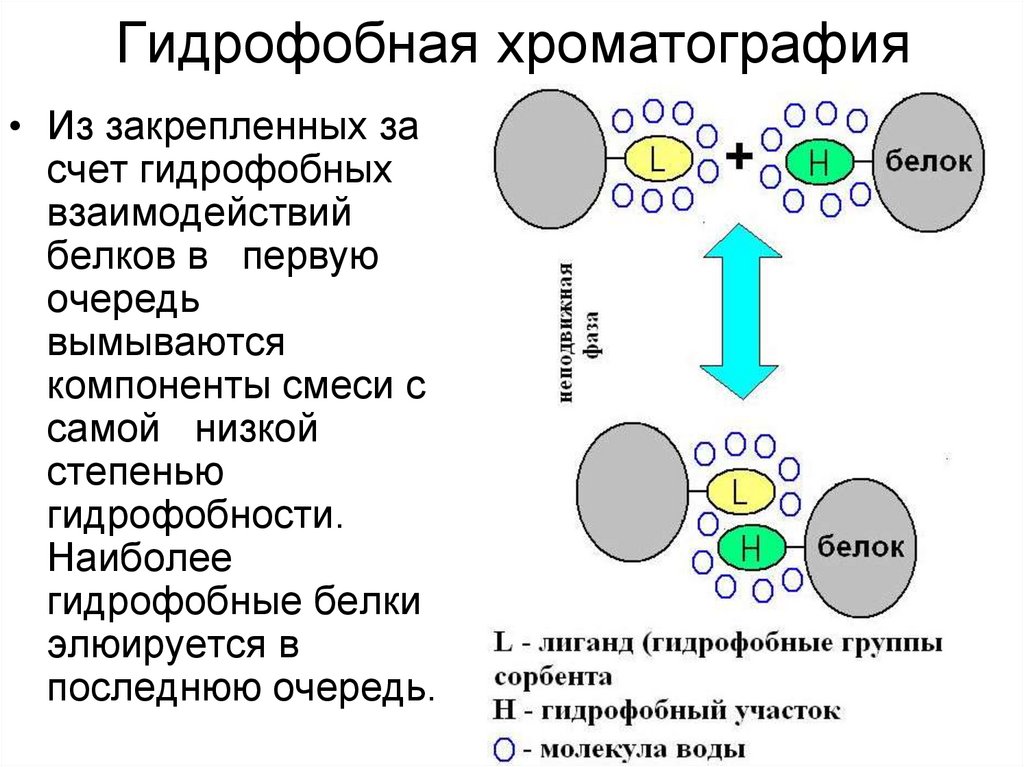
28. Гидрофобная хроматография
• Из закрепленных засчет гидрофобных
взаимодействий
белков в первую
очередь
вымываются
компоненты смеси c
самой низкой
степенью
гидрофобности.
Наиболее
гидрофобные белки
элюируется в
последнюю очередь.
29. Хроматография гель-фильтрацией
• Гель-фильтрация или эксклюзионная хроматография(ситовая, гель-проникающая, гель-фильтрационная
хроматография) представляет собой метод разделения
молекул в соответствии с их размером. В отличие от
ионообменной и аффинной хроматографии молекулы
образца не связываются с сорбентом, таким образом,
состав буфера не влияет на разрешающую способность
метода. Следовательно, важным преимуществом этого
вида разделения молекул является то, что условия среды
могут быть изменены в соответствии с типом образца или
требованиями для дальнейших шагов очистки и хранения.
Гель-фильтрация хорошо подходит для биомолекул,
которые чувствительны к изменениям рН, концентрации
ионов металлов, кофакторов и других условий среды.
Разделение может быть выполнено в присутствии
необходимых компонентов, при высокой или низкой ионной
силе, при достаточно широком диапазоне температур в
соответствии с требованиями процесса.
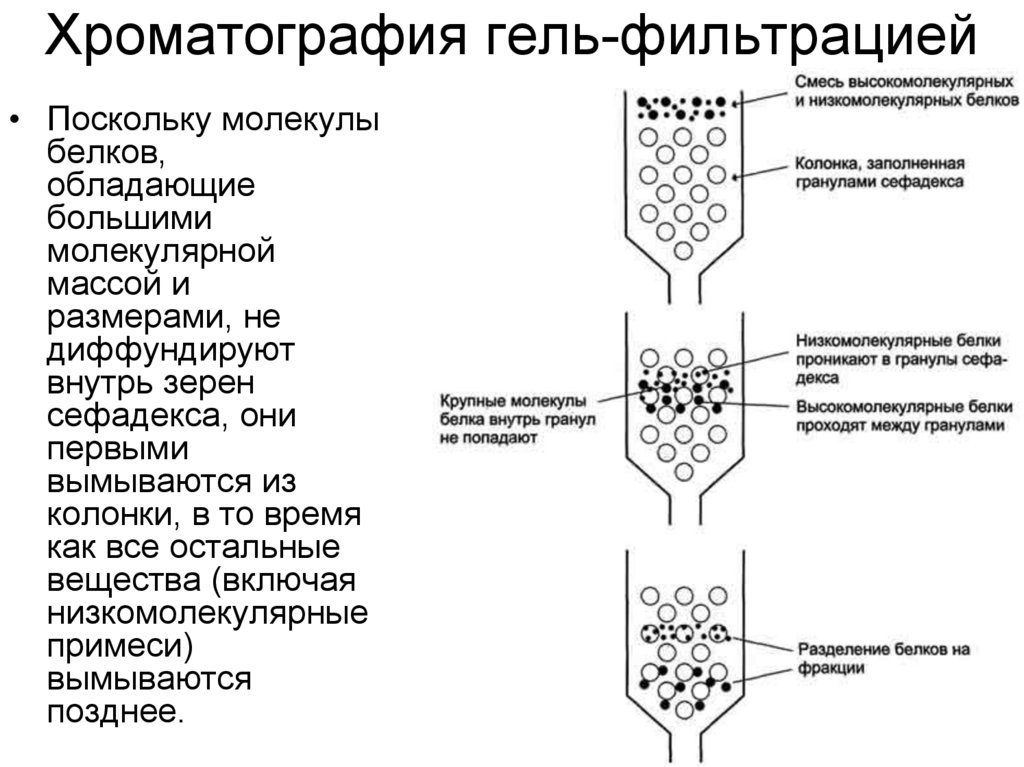
30. Хроматография гель-фильтрацией
• При обработке эпихлоргидрином полисахарида декстранаобразуются различной степени выраженности поперечные связи,
приводящие к формированию крупных гидрофильных зерен,
нерастворимых в воде и называемых сефадексами. Благодаря
большому сродству к воде зерна сильно набухают в водной
среде с образованием геля, которым заполняют
хроматографическую колонку.
• Разделение веществ этим методом основано на том, что
большие молекулы не проникают во внутреннюю водную фазу
геля, являющуюся стационарной, и остаются снаружи, двигаясь
вместе с подвижной фазой вниз вдоль колонки; небольшие
молекулы, напротив, свободно диффундируют внутрь зерен,
образуя равновесную систему между подвижной и стационарной
фазами, и соответственно с меньшей скоростью двигаются
вдоль колонки.
• Крупные молекулы, не проникающие внутрь гранул, будут
выходить из колонки первыми. В то же время мелкие молекулы,
свободно диффундирующие внутрь гранул, часть времени будут
позиционироваться в неподвижной фазе. Таким образом, все
мелкие молекулы выйдут из колонки более или менее
одновременно и заведомо позднее, чем крупные.
31. Хроматография гель-фильтрацией
• Поскольку молекулыбелков,
обладающие
большими
молекулярной
массой и
размерами, не
диффундируют
внутрь зерен
сефадекса, они
первыми
вымываются из
колонки, в то время
как все остальные
вещества (включая
низкомолекулярные
примеси)
вымываются
позднее.
32. Аффинная хроматография
• Аффинная хроматография представляет собой метод разделениябиологических молекул, который основан на специфичных
взаимодействиях между белком (или белковым компонентом) и
специфическим лигандом связанным с матрицей. Техника обладает
высокой селективностью на основе их биологических функций или
химической структуры и следовательно, дает высокое разрешение, а
само вещество может быть очищено в несколько тысяч раз.
Биологическое взаимодействие между лигандом и молекулой мишенью может быть результатом образования водородных связей,
электростатического, Ван-дер-Ваальсового или гидрофобного
взаимодействия. Элюция осуществляется либо специфически – с
использованием конкурентного лиганда, либо неспецифически - путем
изменения рН, ионной силы или полярности.
• Связываемые иммобилизованным субстратом молекулы продуктов
биосинтеза можно элюировать концентрированными растворами
субстрата в свободной форме, а молекулы, связанные с
иммобилизованными антителами, можно элюировать за счет
диссоциации комплекса антитело-антиген концентрированными
растворами соли или растворами низкого или высокого рН. Даже
однократная хроматография на такой колонке позволяет зачастую
достигнуть очень высокой степени очистки препарата.
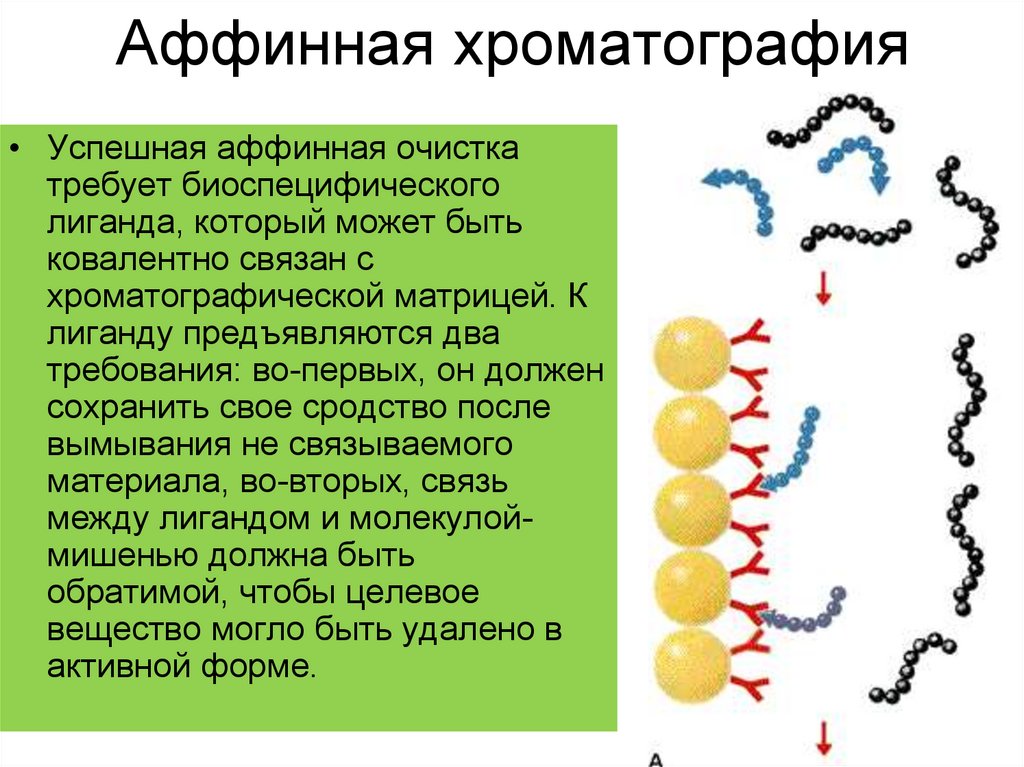
33. Аффинная хроматография
• Успешная аффинная очисткатребует биоспецифического
лиганда, который может быть
ковалентно связан с
хроматографической матрицей. К
лиганду предъявляются два
требования: во-первых, он должен
сохранить свое сродство после
вымывания не связываемого
материала, во-вторых, связь
между лигандом и молекулоймишенью должна быть
обратимой, чтобы целевое
вещество могло быть удалено в
активной форме.
34. Аффинная хроматография
• Некоторые типичные биологические взаимодействия, частоиспользуемые в афинной хроматографии представлены
ниже:
• Фермент - субстрат, ингибитор, кофактор:
• Антитело - антиген, вирус, клетка;
• Лектин - полисахарид, гликопротеин, рецептор на
клеточной поверхности, клетка;
• Нуклеиновые кислоты - комплементарные
последовательности, гистоны, ДНК- или РНКполимеразы, белки связывающие нуклеиновые кислоты;
• Гормон, витамин - рецептор, белок-переносчик;
• Глутатион - глутатион-S-трансфераза или связанный с ней
протеин.
• Ионы металлов - белки с противоположно заряженными
радикалами аминокислот.
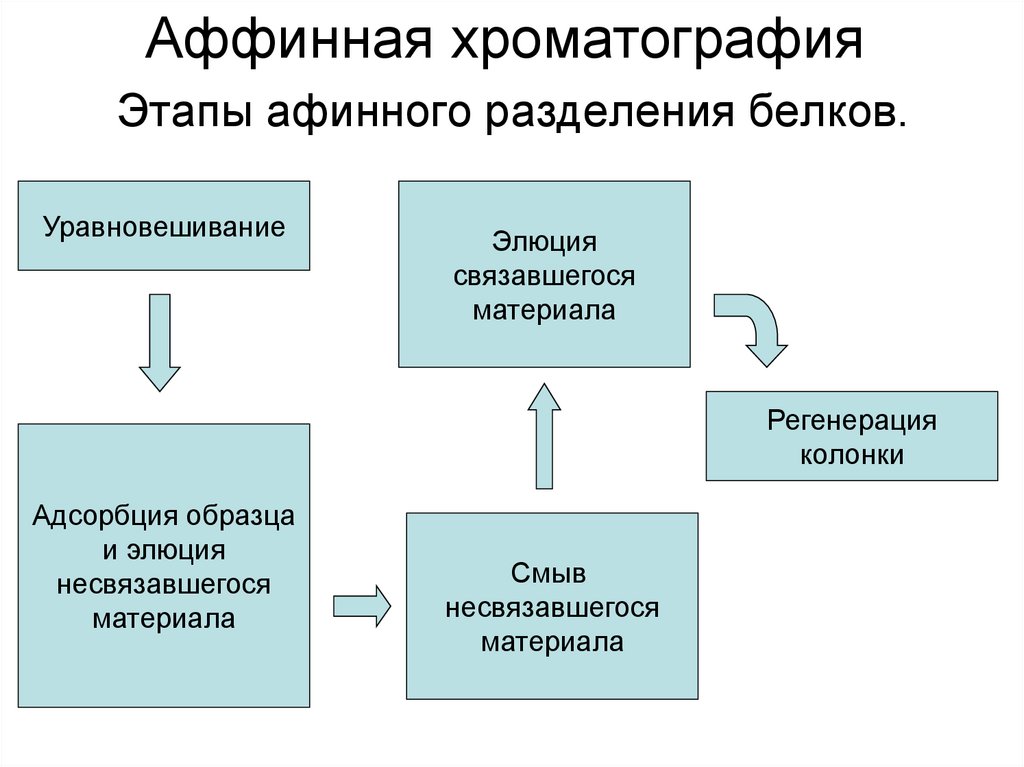
35. Аффинная хроматография Этапы афинного разделения белков.
УравновешиваниеЭлюция
связавшегося
материала
Регенерация
колонки
Адсорбция образца
и элюция
несвязавшегося
материала
Смыв
несвязавшегося
материала
36. Выделение и очистка целевого целевого продукта биосинтеза из клеток
• Для выделения и очистки продуктов, находящихся внутриклеток продуцента (например интерферонов, гормонов)
вводится стадия разрушения клеточных оболочек
(дезинтеграция биомассы). Обычно для этого применяются
физические, химические или комбинированные методы.
• К физическим методам дезинтеграции относятся обработка
ультразвуком, вращение лопасти или вибратора,
встряхивание со стеклянными бусами, продавливание
через узкое отверстие под давлением, раздавливание
замороженной клеточной массы, растирание в ступке,
(сжатие с последующим резким снижением давления
осмотический шок, замораживание-оттаивание,
декомпрессия). Физические способы разрушения более
экономичны, чем химические и химико-ферментативные.
Они осуществляются без применения дорогостоящих и
дефицитных реактивов и ферментных препаратов. В то же
время этим способам дезинтеграции клеток присуща
определенная неизбирательность: обработка может
отрицательно влиять на качество получаемого продукта.
37. Выделение и очистка целевого целевого продукта биосинтеза из клеток
• Осторожное и избирательное разрушениеклеточной стенки возможно при использовании
химических и химико-ферментативных
методов. Клетки могут быть разрушены толуолом
или бутанолом, антибиотиками, ферментами.
• Разрушенные клеточные стенки отделяют
методами сепарации. В большинстве
биотехнологических процессов клеточные стенки
отбрасывают как балласт, но возможно и
промышленное получение компонентов клеточных
стенок как целевого продукта.
38. Выделение и очистка целевого целевого продукта биосинтеза из клеток
• Экстракты разрушенных клеток можно фракционировать,подвергая их высокоскоростному центрифугированию.
Такая обработка делит клеточные компоненты по их
размеру: более крупные частицы при центрифугировании
движутся быстрее. Крупные компоненты экстракта, в том
числе ядра или неразрушенные клетки, быстро оседают
(седиментируют) при относительно низких скоростях и
образуют осадок на дне центрифужной пробирки.
Центрифугирование является, как правило, первым этапом
фракционирования, с его помощью разделяются только
значительно отличающиеся по размеру компоненты. Чтобы
достигнуть более высокой степени разделения фракций,
необходимо гомогенат наслоить тонким слоем поверх
солевого раствора.
39. Выделение и очистка целевого целевого продукта биосинтеза из клеток
• При ультрацентрифугировании различные фракцииседиментируют с различной скоростью и образуют отдельные
полосы. Во избежание перемешивания осажденных компонентов
солевой раствор должен содержать инертный и хорошо
растворимый материал (например, сахарозу), плотность
которого постепенно увеличивается сверху вниз, формируя
градиент плотности. При седиментации сквозь такие градиенты
различные компоненты клетки собираются в отдельные полосы,
которые можно выделить.
• Скорость седиментации каждого из компонентов определяется
его размерами и формой, и обычно выражается с помощью
коэффициента седиментации, обозначаемого S. При скорости
вращения до 80 000 об/мин на разделяемые частицы действуют
силы, превосходящие силу тяготения более чем в 500 000 раз.
Под действием столь больших сил даже сравнительно
небольшие макромолекулы, такие, как тРНК или простейшие
ферменты, разделяются и распределяются в строгом
соответствии со своими размерами.
40. Выделение и очистка целевого целевого продукта биосинтеза из клеток
• Образующуюся жидкость освобождают от сопутствующихрастворимых веществ. Освобождение от растворимых
веществ производят несколькими способами:
• 1. Осаждение – физическое (нагревание, охлаждение,
разбавление, концентрирование) или химическое (с
помощью органических и неорганических веществ).
• Осаждение органическими растворителями (основано на
снижении диэлектрической постоянной среды).
Устойчивость белковых растворов обусловлена наличием
гидратного слоя у молекулы. Если его разрушить, белки
осаждаются. Для этого молекулы добавляемых веществ
должны быть более гидрофильны, чем молекулы белков. В
качестве осадителей используют этанол, метанол, ацетон,
изопропанол. При разных количествах растворителя и
разных значения рН осаждаются разные фракции.
• Высаливание - механизм тот же, что и при действии
органических веществ, гидратируются диссоциирующие
ионы неорганических солей.
41. Выделение и очистка целевого целевого продукта биосинтеза из клеток
• 2. Экстракция. При твердо-жидкофазнойэкстракции вещество из твердой фазы
переходит в жидкую, при жидко-жидкофазной
– из одной жидкости в другую.
• 3. Адсорбция – частный случай экстракции,
когда экстрагирующий агент – твердое тело.
Механизмы аналогичны различным типам
хроматографии.
• Далее выделение целевых продуктов
биосинтеза осуществляется методами,
описанными для культуральной жидкости.
42. Инактивация вирусов и противовирусная очистка
• Необходимым элементом выделения и очистки целевыхбелков является противовирусная очистка. При этом
требования нормативных актов таково, что очистка от
вирусов должна обеспечиваться введением в технологию
как минимум двух ортогональных (базирующихся на
различных принципах) методов, каждый из которых
снижает содержание вирусов как минимум на два порядка.
• Наилучшей методикой для снижения вирусной
контаминации является предотвращение доступа
случайных агентов в биореактор. Это заключается в
интенсивной проверке клеточных линий, сырья (включая
культуральные среды) на отсутствие вирусов.
43. Инактивация вирусов и противовирусная очистка
Вирусная инактивация может быть проведена за счет изменения рН. В кислых
условиях вирусы инактивируются. Чем дольше время воздействия низкими рН,
тем выше эффективность процесса. Некоторые вирусы при низком рН могут
спонтанно денатурировать. Таким образом, низкие значения рН можно
использовать для вирусной инактивации тех белков, которые более устойчивы
в данных условиях, чем вирусы. Данный метод эффективен в отношении
вирусов с оболочкой (капсидом), для других вирусов его нужно совмещать с
увеличением температуры. Как правило, типичными условиями рН-инактивации
является выдерживание раствора белка при рН 4 в течение от 6 часов до 21
дня.
Вирусная инактивация также может быть проведена за счет жесткого
облучения ультрафиолетом, разрушающим генетический материал под
капсидом вируса. УФ лучи могут разрушать ДНК, приводя к образованию
димеров нуклеиновых кислот. Этого практически не происходит в тканях, т.к.
УФ-лучи плохо через них проникают. Однако вирусные частицы достаточно
малы, чтобы УФ смог достичь их генетический материал и разрушить ДНК. В
результате вирус теряет способность к репликации.
Еще вариант - инактивация детергентами. Эффективна только для вирусов с
липидными оболочками, которые разрушаются под действием детергентов.
Другой метод - преципитация. Для преципитации вирусов используются
органические растворители: этанол и проч. Эффективна против капсидных и
некапсидных вирусов. Типичный пример – многократная преципитация
этанолом.
44. Инактивация вирусов и противовирусная очистка
• Применяюются также хроматографические методы.Здесь можно применять аффинную, ионообменную
хроматографию, хроматографию гидрофобных
взаимодействий.
• И наконец, противовирусная нанофильтрация. Это
самый эффективный и наиболее надежный метод.
Фильтрация может быть только в тупиковом режиме
(тангенциальный режим, хотя на практике и
возможен, запрещен по правилам GMP).
Используются фильтры с диаметром пор 20 нм. Это
связано со средним размером вирусных частиц и
позволяет их надежно отделять.
45. КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Общая схема выделения белков как целевого продуктабиотехнологии.
2. Основные принципы выделения внутриклеточных и
внеклеточных белков.
3. Основные этапы выделения и очистки внеклеточных белков.
4. Обработка культуральной жидкости при производстве
внеклеточного и внутриклеточного белка.
5. Методы отделения биомассы от культуральной жидкости.
6. Сущность и условия применения флотации.
7. Характеристика центрифугирования.
8. Отделение биомассы методами фильтрации. Характеристика
поверхностной фильтрации.
9. Характеристика глубинной фильтрации, принцип метода и
механизмы.
10. Виды глубинной фильтрации, используемые в биотехнологии.
46.
КОНТРОЛЬНЫЕ ВОПРОСЫ11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
22.
23.
Общая характеристика мембранной фильтрации.
Сравнение тупиковой и тангенциальной фильтрации.
Категории мембранных фильтров, выделяемых по размеру пор.
Возможности обратного осмоса.
Применение нанофильтрации.
Возможности ультрафильтрации.
Способы повышения эффективиности ультрафильтрации.
Диафильтрация.
Применение экстракции для выделения продукта из
культуральной жидкости.
Принцип хроматографического разделения смеси веществ.
Разнообразие хроматографических методов.
Разнообразие хроматографических методов по целевому
использованию. Особенности промышленной хроматографии.
Физико-химические свойства белков, используемые для их
хроматографического выделения и очистки.
Принцип ионообменной хроматографии. Характеристика
неподвижной фазы. Способы выделения белков, задержанных
неподвижной фазой.
Характеристика гидрофобной хроматографии.
47.
КОНТРОЛЬНЫЕ ВОПРОСЫ24.Гель-фильтрация, преимущества по сравнению с другими видами
Афинная хроматография, принцип и достоинства метода.
25.Требования к лигандам. Примеры биологических взаимодействий,
используемых в аффинной хроматографии.
26.Схема аффинного выделения белков.
27.Методы выделения внутриклеточных компонентов. Преимущества
физических методов, по сравнению с химическими.
28.Методы получения экстрактов клеток и их фракционирования.
29.Отделение нерастворимых компонентов клеточных гомогенатов.
Центрифугирование.
30.Способы выделения растворимого целевого продукта из
экстракта клеток, освобожденного от взвешенных веществ.
31.Защита целевого продукта от вирусов. Требования GMP.
32.Способы инактивации вирусов.
33.Способы очистки целевого продукта от вирусов.
34.хроматографии.
35.Принцип хроматографии гель-фильтрацией.

































 biology
biology








