Similar presentations:
Химическая картина мира
1.
Химическая картина мира35 литров воды, 20 килограмм углерода, 4
литра аммиака, 1.5 килограмма извести,
800 грамм фосфора, 250 грамм соли, 100
грамм селитры, 80 грамм серы, 7.5 грамм
фтора,
5 грамм железа, 3 грамма кремния и 15
других элементов в небольших дозах.
- Что это?
Презентация к курсу лекций по КСЕ. Лекция № 5 Химическая картина мира Автор: Шаяхметова Л.А.ПГГПУ 2016
год
2.
Период от начала медного века до 4 в. н. э. вистории познания веществ можно назвать преднаучным.
Алхимический период ( IV-XVIв.) – представляет
собой «первую попытку рационализировать совокупность знаний на
основе общего принципа» (М. Джуа).
Макрокосм (мир),
европейских
алхимиков состоял
из элементов:
соль,
сера, ртуть.
Взаимная
превращаемости
элементов.
Цель алхимии найти
«философский камень».
3.
Периоды становления научной химии (XVI-XVIII вв.)-
иатрохимия
(греч. iatros – врач) – раздел
медицинской химии,
где в 16-17. вв. прославились Т. Парацельс,
Я.Б. Ван Гельмонт;
- пневматическая химия – химия
газов (17-18 вв.) (Р. Бойль,
Дж. Пристли и др.);
тело человека состоит
из различных веществ,
их изменения могут
вызывать болезни,
излечение которых
возможно путем
применения лекарств,
восстанавливающих
химическое равновесие.
Поэтому «настоящая
цель химии заключается
не в изготовлении
золота, а в
приготовлении
лекарств»
Ученые, работавшие в области пневматической химии, открыли ряд простых газов и их
соединений.
Бойль сформулировал важный для дальнейшего развития физики закон, установивший
зависимость объема газа от давления, закон, на основе которого Д.Бернулли и вслед за
ним М.В. Ломоносов развивали молекулярно-кинетическую теорию вещества.
Дж. Пристли обнаружил свойствозеленых растений исправлять воздух, испорченный
дыханием, т.е.открыл газ, названный позднее кислородом.
Флогистонная теория
(И. Бехер, Г. Шталь, большинство
химиков 18 в.).
Одной из главных проблем химии 17-18 вв. была проблема
горения. При горении выделяется некое летучее вещество,
образующее пламя. Немецкие химики И. Бехер и Г.Э. Шталь
трактовали горение как процесс выделения горючим веществом
особой материи – флогистона, в результате чего вещество
дефлогистируется.
4.
Учение об элементах. Концепция атомизма.(соотносится с механистическим периодом в физике).XVII-XIXв.Химический элемент
– мельчайшие порции (частицы) простого вещества, сохраняющей его
свойства при переходе из одного вещества в другое.
Корпускулярная концепция описания природы
-описания явлений природы как состоящих из
множества дискретныхединиц. Именно химии принадлежит приоритет в научном
обосновании идеи атомизма
Стехиометрические законы
– законы, выражающие количественные соотношения
веществ, вступающих в реакцию
закон постоянства состава веществ: качественный и количественный состав сложного вещества
не зависит от способа его получения (закон Пруста, 1801 г.);
закон простых кратных отношений: весовые отношения простых веществ, образующих
сложное вещество, выражаются целыми числами типа 1:2:3…(закон Дальтона, 1803 г.);
- закон простых объемных отношений: объемы вступающих в реакцию газов, находящихся
при одинаковых условиях, относятся как целые числа (закон Гей-Люссака, 1808 г.);
- в равных объемах газов при одинаковых условиях содержится
одинаковое число молекул (закон Авогадро, 1811 г.).
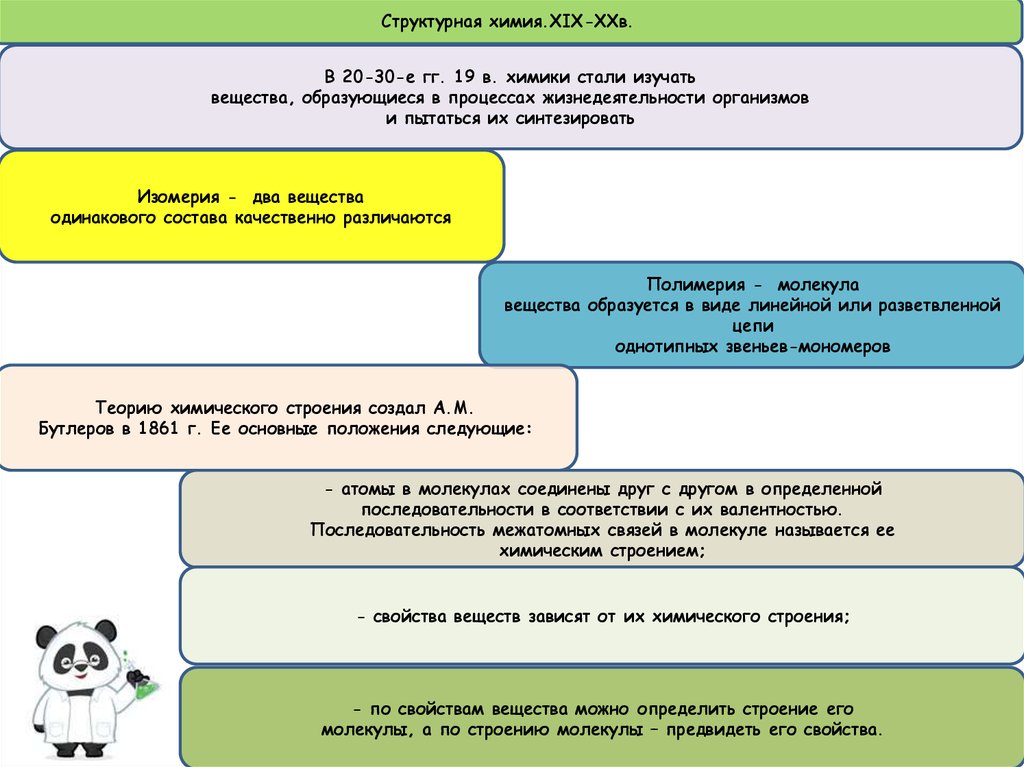
5.
Структурная химия.XIX-XXв.В 20-30-е гг. 19 в. химики стали изучать
вещества, образующиеся в процессах жизнедеятельности организмов
и пытаться их синтезировать
Изомерия - два вещества
одинакового состава качественно различаются
Полимерия - молекула
вещества образуется в виде линейной или разветвленной
цепи
однотипных звеньев-мономеров
Теорию химического строения создал А.М.
Бутлеров в 1861 г. Ее основные положения следующие:
- атомы в молекулах соединены друг с другом в определенной
последовательности в соответствии с их валентностью.
Последовательность межатомных связей в молекуле называется ее
химическим строением;
- свойства веществ зависят от их химического строения;
- по свойствам вещества можно определить строение его
молекулы, а по строению молекулы – предвидеть его свойства.
6.
Кинетические теории.изучение химических процессов, условий
их протекания, механизмов и скоростей химических реакций
Химические реакции зависят от ряда факторов: температуры, давления, концентрации реагентов.
В середине 19 в. была создана
химическая термодинамика
(термохимия), предметом
которой стали закономерности
химических процессов в
зависимости от
термодинамических условий
(энергия, температура,
давление, концентрация и
др.). Ее основоположниками
являются Г.И. Гесс и Я.Х.
Вант-Гофф.
Г.И.Гесс
тепловой эффект химической
реакции зависит только от
природы
исходных веществ и продуктов
реакции и не зависит от
промежуточных химических
превращений.
Химический катализ
- избирательное ускорение одного из возможных термодинамически разрешенных
направлений химической реакции под действием катализатора(ов), который многократно вступает в
промежуточное химическое взаимодействие с участниками реакции и восстанавливает свой химический состав
после каждого цикла промежуточных химических взаимодействий.
Валентность - это свойства атомов одного химического элемента присоединять определённое число
атомов другого.
7.
Биохимия.Химический подход к явлениям
жизнедеятельности организмов
обмен веществ, наследственность, строение белка,
высшая нервная деятельность
Учение о катализе стало ключом к познанию
функционирования клетки как структурной единицы живого.
Учение о катализе стало ключом к познанию
функционирования клетки как структурной единицы
живого.
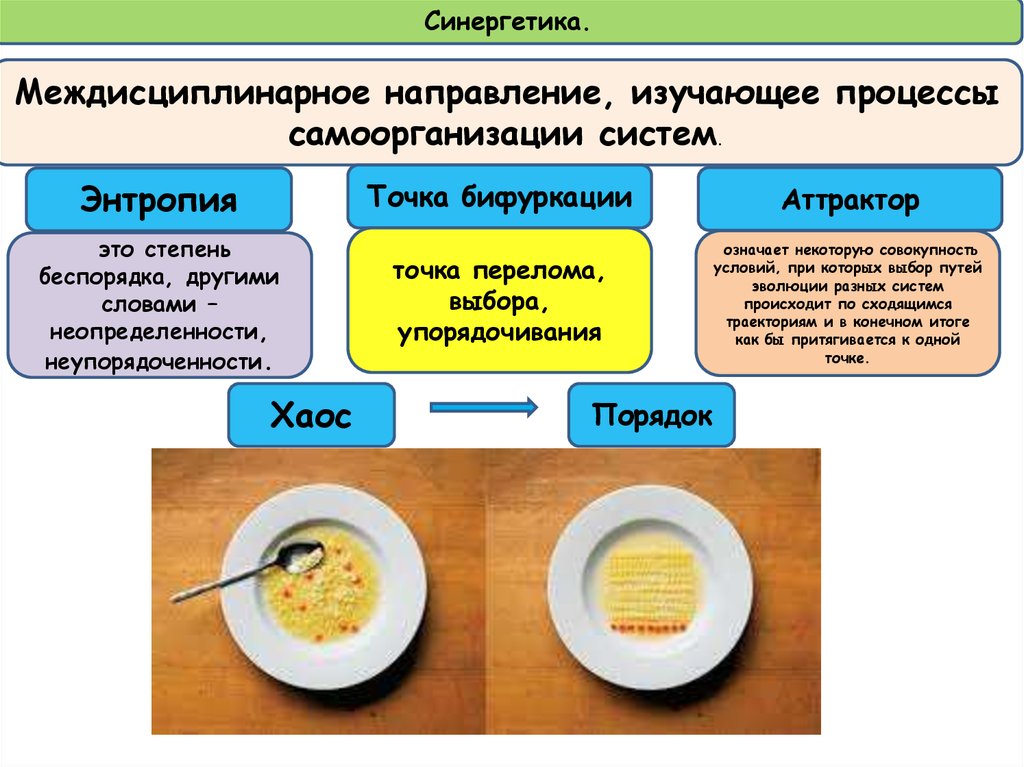
8.
Синергетика.Междисциплинарное направление, изучающее процессы
самоорганизации систем.
Энтропия
это степень
беспорядка, другими
словами –
неопределенности,
неупорядоченности.
Хаос
Точка бифуркации
Аттрактор
точка перелома,
выбора,
упорядочивания
означает некоторую совокупность
условий, при которых выбор путей
эволюции разных систем
происходит по сходящимся
траекториям и в конечном итоге
как бы притягивается к одной
точке.
Порядок






 chemistry
chemistry








