Similar presentations:
CRISPR/Cas9 система. История, возможности и риски
1. CRISPR/Cas9 система
История, возможности и риски«Это самый крупный технологический прорыв в экспериментальной
биологии с момента изобретения ПЦР» (комментарий в журнале
“Nature”, 2015 г.)
2.
CRISPR — Clustered Regularly Interspaced Short Palindromic RepeatsКластеры регулярно прерывающихся коротких палиндромных повторов
• 1987 – открытие странных участков в геноме E. coli, состоящих из
чередований повторов и уникальных спейсерных последовательностей (Японцы). Случайно, статья вообще не про это.
• 1995-2002 – обнаружение широкой распространенности CRISPR у
бактерий и архей. Использовали в качестве «штрих-кода» для
опознания видов и штаммов микроорганизмов.
21-35 п.о.
21-35 п.о.
3.
• 2002 – введено название CRISPR, идентифицированы сцепленные белки,названные Cas, установлено их родство с хеликазами.
• 2003 – (быстрое расширение баз данных по секвенированным геномам)
обнаружено соответствие спейсерных последовательностей фрагментам
геномов фагов (вирусов) и некоторых плазмид.
• 2006 – показано, что CRISPR вместе с группой белков Cas обеспечивают
противофаговую защиту у микроорганизмов.
• 2008-2010 – расшифрован механизм работы системы CRISPR/Cas
противофагового иммунитета.
• 2011 – в экспериментах на E.coli установили минимальный необходимый
набор компонентов системы (группа из Литвы, рук. Шикшнис): CRISPR + Cas9
• 2012 – Дженифер Дудна с коллегами (Калифорния) разработали технологию
модификации генома на основе системы CRISPR/Cas. Одновременно
аналогичную технологию предложила и группа из Литвы, но Калифорнийская
система оказалась компактнее.
• С 2013 – быстрое появление все новых модификаций этой технологии и ее
адаптация под решение широкого круга экспериментальных задач в области
молекулярной биологии клеток, биологии онтогенеза, генетических
заболеваний и др.
4.
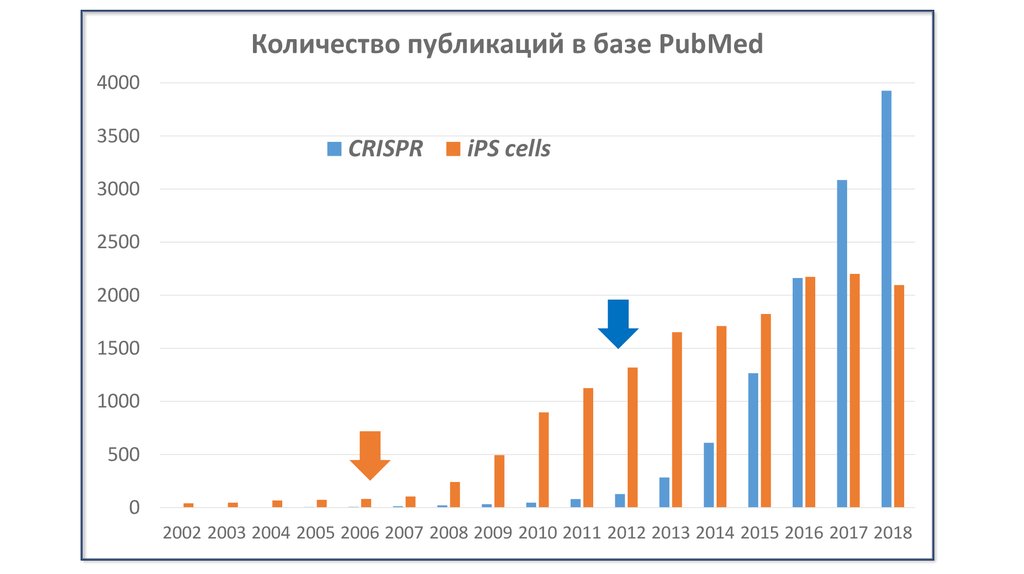
Количество публикаций в базе PubMed4000
3500
CRISPR
iPS cells
3000
2500
2000
1500
1000
500
0
2002 2003 2004 2005 2006 2007 2008 2009 2010 2011 2012 2013 2014 2015 2016 2017 2018
5.
Streptococcus pyogenesCas9
6.
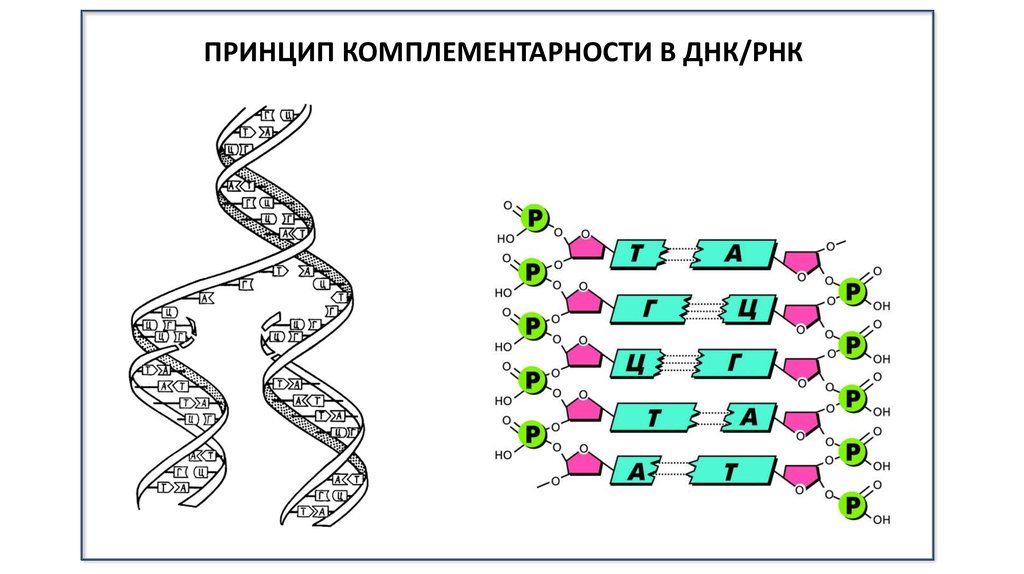
ПРИНЦИП КОМПЛЕМЕНТАРНОСТИ В ДНК/РНК7.
Как система адаптирована под задачи геннойинженерии?
1. Сконструирована цельная гидРНК (gRNA),
которая совмещает в себе функции crRNA
(комплементарное спаривание с целевой
последовательностью) и tracrRNA (привлечение
эндонуклеазы Cas). Эта гидРНК кодируется одним
геном длиной около 100 п.о. и экспрессируется с
промоторов для РНК полимеразы III.
2. Созданы искусственные варианты гена
эндонуклеазы Cas9 c нуклеотидной
последовательностью, адаптированной под
систему трансляции целевого организма
(оптимизированные наборы кодонов) + пришит
сигнал ядерной локализации.
3. Создаются разнообразные варианты гена с
измененными функциями и характеристиками.
Дженнифер Дудна (статья за 2012 год)
8.
9.
РАМКА СЧИТЫВАНИЯСдвиг рамки
считывания
10.
Какие организмы уже удалось изменить при помощиCRISPR/Cas?
Позвоночные:
Лягушка
Аксолотль
Рыбы
Мышь
Крыса
Обезьяна
Кролик
Человек
Беспозвоночные:
Дрозофила
Водяная блоха
Аскарида
Шелкопряд
Растения:
Кукуруза
Рис
Сорго
Апельсин
Табак
Пшеница
Свинья
Арабидопсис
Томат
11. Группы вопросов и применений
• Медицинские исследования: поиск значимых (вредных)мутаций, создание моделей для изучения генетических
заболеваний.
• Медицинское применение: диагностика, лечение
инфекционных, генетических, онкологических заболеваний.
• Биотехнологическое применение: создание новых белков,
животных и растений с новыми полезными для человека
свойствами.
• Борьба с вредителями (генный драйв).
• Функциональные исследования: расшифровка функции генов,
изучение поведения клеток в организме.
• Эволюционные исследования: поиск значимых (полезных)
мутаций, благодаря которым адаптировались разные виды.
12. Создание модельных животных Цели: 1) Отработка технологии 2) Проверка гипотез о патогенности определенных мутаций. 3) Отработка
возможных подходов к лечению (лекарства,стволовые клетки, реверсия к норме при помощи
редактирования CRISPR/Cas и пр.)
В настоящее время ряд фирм делает мышей и крыс с нужными
мутациями под заказ.
13.
Danio rerioПолучены наследуемые
мутации по 162 локусам
Мыши с внесенной поломкой в ген
тирозиназы.
Тирозиназа – фермент,
необходимый для синтеза
меланина.
Починив ген обратно, из
альбиносов получили темных
мышей.
14.
Обезьянки-дистрофикиПоросята-гемофилики
15. Испытания возможностей использования CRISPR для лечения генетических заболеваний 2014-2018
16. Болезни, вылеченные или облегченные при помощи редактирования на модельных животных:
Болезни, вылеченные или облегченные при
помощи редактирования на модельных животных:
Гипертрофическая кардиомиопатия
Гиперхолестеринемия (Ген PCSK9)
Гемофилия
Мышечная дистрофия
Прогерия (преждевременное старение)
Атрофия сетчатки глаз
Тирозинемия (нарушение синтеза белка, истощение)
Болезнь Хантигтона (атрофия нейронов мозга)
Аутизм
Муковисцидоз
Серповидно-клеточная анемия, талассемия
Катаракта
Онкологии
17. Мышей вылечили от гемофилии, восстановив поломанный ген фактора свертывания крови (2016)
• Обнаружили новую мутацию, связанную с тяжелой формой семейнойгемофилии B – в факторе 9 системы свертывания крови.
• Получили мутантную больную мышь, при помощи модификации
одноклеточного эмбриона с использованием CRISPR/Cas.
• Молодым и взрослым мышам вводили внутривенно плазмиды или
аденовирусные векторы для экспрессии гидРНК, белка Cas9 под
специфичным для печени промотором и нормальный вариант
последовательности F9. Ген встраивался в заданную область генома.
• Редактирование прошло примерно в 1% клеток печени (при введении
голых плазмид).
• Получили устойчивую нормализацию свертываемости крови.
18. CRISPR в клинических испытаниях
С 2016 г – в Китае. Терапия опухолей. Отключение гена-подавителяиммунитета в лимфоцитах (ex vivo). 86 пациентов (большинство уже
умерли от диагностированного рака).
C 2017 – аналогичные испытания в США.
С октября 2018 – в Европе. Терапия серповидно-клеточной анемии –
патологии эритроцитов из-за мутации в гене гемоглобина. 12 пациентов.
С 2019 – планируется в США. Терапия врожденных дефектов сетчатки
(потеря зрения) из-за мутации в генах LCA10, USH2A, RPE65 или CEP290.
Рассчитывают привлечь по 10-20 пациентов. Особенность – проведение
in vivo (введение компонентов системы CRISPR/Cas напрямую в сетчатку).
Система названа EDIT-101.
19. Проблемы в контексте медицинского применения
• Обеспечить достаточно высокую специфичность редактирования.• Обеспечить достаточно высокую эффективность.
• Не навредить по недостатку знаний.
Варианты применения:
1) Лечение взрослых редактированными клетками (ex vivo).
2) Лечение взрослых введением системы для редактирования в
определенные участки организма (in vivo).
3) Раннее лечение введением системы в эмбрион внутри матки.
4) Редактирование генома на стадии одноклеточного зародыша.
20.
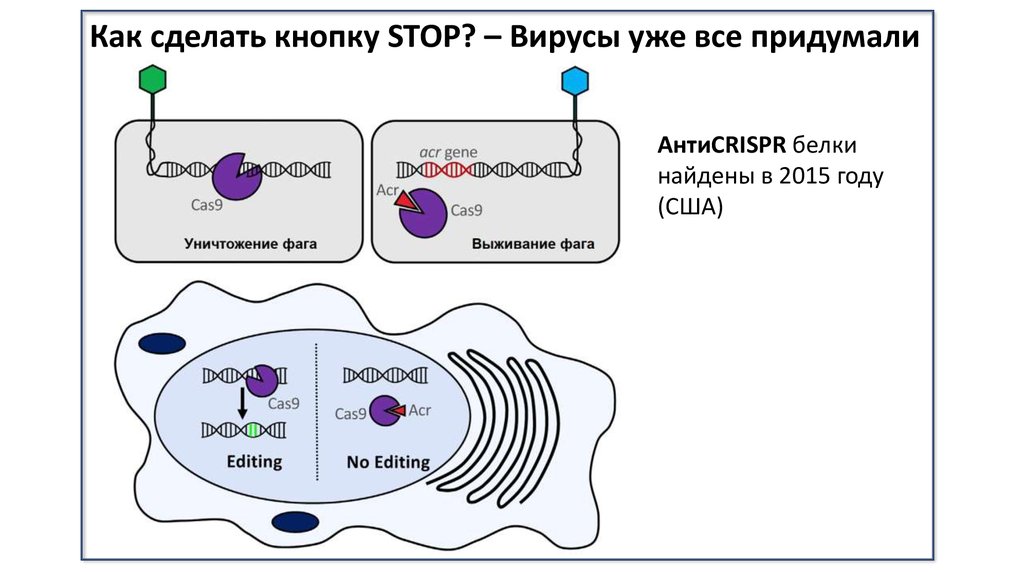
Как сделать кнопку STOP? – Вирусы уже все придумалиАнтиCRISPR белки
найдены в 2015 году
(США)
21.
KamiCas9Самоликвидирующийся Cas9
Применен в мышиной модели
для лечения болезни
Хантингтона
(генетически обусловленная
нейродегенерация).
Из-за мутантного гена
накапливается вредный белок в
нейронах, вызывая их гибель.
22.
Решение проблемы повышения точности действияПолучены телята с повышенной устойчивостью
к туберкулезу (вводили дополнительный ген,
обеспечивающий иммунитет к туберкулезу).
2016 г.
Разрез со «ступенькой» существенно повышает вероятность репарации по
механизму гомологичной рекомбинации!
23. Можно точечно редактировать ДНК и без внесения разрезов (разработка 2016 г.)
Эффективность замещения в эксперименте составила 15-85%.Повреждение ДНК – не чаще 1%. Как пример – в гене PCSK9 мышей.
24. Горячие новости (21 февраля): открыт новый вариант Cas9 – короче, точнее и с большим выбором сайтов
3 варианта фермента из менингококка Neisseria meningitidisНоворожденных мышат: 5
Альбиносы – 2
Мозаики (серо-белые) – 3
Токсичность – 0
Редактированной ДНК 84-100%
25. Редактирование эмбрионов человека В Великобритании официально разрешено в исследовательских целях с 2015 г. В настоящее время
проводится также в Китае,США, России.
Максимальная продолжительность разрешенных экспериментов
– 14 дней.
Цели:
1) отработка технологии (с перспективой на применение в
будущем);
2) изучение роли генов и их мутаций в ранних событиях
эмбрионального развития человека. Поиск причин женского
бесплодия (выкидыши).
26.
CRISPR/Cas9-mediated gene editing in humantripronuclear zygotes Protein and Cell, April 2015
Оплодотворение
In vitro
Материал на
выброс (2-5 %)
Развивается до стадии
бластоцисты
Микрошприцем вводили в оплодотворенную
яйцеклетку:
• мРНК Cas9
• мРНК Gfp
• gRNA, нацеленную на ген бета-гемоглобина (HBB)
• ssDNA с областями гомологии и некоторыми заменами
Результаты:
1. Эффективность введения – 71 из 86 (83%)
2. Внесение надреза в гене HBB – 28 из 54 (52%)
3. Внесение ожидаемых замен – 4 из 28 (14%)
4. 6 из 6 проверенных эмбрионов были мозаиками,
содержали мутации HBB типа indel, и имели
дополнительные мутации в неспецифичных
участках генома.
27.
CRISPR/Cas9-mediated gene editing in human zygotesusing Cas9 protein Molecular genetics and genomics, март 2017
(статья представлена в июле 2016) Китай
Эксперименты проводили на здоровых 2N зиготах; гены HBB и G6PD,
исправляли мутации, связанные с талассемией и фавизмом.
Зиготы получали оплодотворением яйцеклеток с нормальным вариантом
спермой от гетерозиготного мужчины.
Микрошприцем вводили в оплодотворенную яйцеклетку в G2 фазе:
• белок Cas9; gRNA, нацеленную на ген-мишень
• ssDNA с нужным участком гена (нормальный аллель)
Результаты:
1. Эффективность введения – 6 из 6 (100%)
2. Разрез и редактирование – 6 из 6 (100%)
3. Редактирование по пути HDR – 1 из 4 для гена HBB; 2 из 2 для GAPDH
4. Полное секвенирование проведено для 1 эмбриона, при этом
неспецифических изменений генома в нем не обнаружено.
28.
Correction of a pathogenic gene mutation inhuman embryos (2017, Миталипов, США)
Зиготы получали оплодотворением яйцеклеток с нормальным вариантом
спермой от больного мужчины.
Мутация в гене MYBPC3 вызывает в гетерозиготном состоянии
гипертрофическую кардиомиопатию.
Всего использовали 22 зиготы (и 10 контрольных).
Ожидаемое число нормальных зигот – 50%
По результатам эксперимента – 72%.
Гомологичная рекомбинация прошла с материнской хромосомой.
Эффективность редактирования около 50%.
Мозаицизма и неспецифических мутаций не выявлено.
Октябрь 2018 – российская статья о редактировании CCR5 у эмбрионов
Ноябрь 2018 – заявление Хе о рождении детей с редактированным CCR5.
29. Возможности совмещения технологий CRISPR/Cas и стволовых клеток
30.
Редактирование при помощи CRISPR позволило создать изиндуцированных стволовых клеток человека органоиды
почек для тестирования лекарств от почечной болезни (2018)
Аналогичные исследования начаты с органоидами мозга, сосудов для
моделирования болезни Паркинсона, ишемии.
31. Получены универсальные стволовые клетки, невидимые для иммунной системы (18 февр. 2019)
Каждая клетка предъявляет иммунной системе «паспорт»(молекулы MHC I и MHC II) по которым иммунная система
может отличить свои клетки от чужих.
Чужие клетки уничтожаются Т лимфоцитами;
«Беспаспортные клетки» - естественными киллерами (NK).
В результате привитые чужие клетки отторгаются. Приходится
подавлять иммунную систему и пациент становится уязвимым
для инфекции.
При помощи CRISPR были сломаны два гена, необходимые для
предъявления MHC I и MHC I, а обычной модификацией
добавлен ген, отменяющий срабатывание клеток NK.
Результат: у мышей приживались стволовые клетки от других
мышей! Без подавления иммунной системы!
А что, если так получать клетки, вырабатывающие инсулин
для пациентов с аутоиммунным диабетом???
НО: берегитесь рака!!!
32.
Идея получения химерных «гуманизированных» животных длявыращивания органов для трансплантации
https://www.karger.com/Article/FullText/480370
33.
Почему свинья, а не шимпанзе?1) Сложно и дорого
2) Неэтично
Ген SALL1 – контролер формирования зачатка почек.
Если в свиных клетках ген будет отключен (при помощи CRISPR), зачаток почек разовьется
из клеток человека, в которых ген SALL1 рабочий.
Обоснование: регуляция развития внутренних органов млекопитающих почти идентична.
НО: некоторые части почки (напр. кровеносные сосуды) все равно будут содержать
клетки свиньи!
На практике получалось использовать такой подход в экспериментах с химерами из клеток
крыс и мышей. Но не всегда. С сердцем почему-то не получилось.
34.
ДиагностикаНа основе Cas13a создан сверхчувствительный высокоспецифичный тест SHERLOCK на
присутствие малых количеств РНК (вируса).
Схожая система DETECTR для детекции ДНК, с ферментом Cas12a (2017).
35. Даешь вкусные помидоры! (18 февр. 2019)
Искусственная селекция помогла создать культуры с массой замечательныхсвойств. Но попутно появились и не такие приятные свойства, от которых сложно
избавиться.
Выход: зная, какие гены ответственны за нужные признаки, заново начать с
диких растений и изменить гены только там, где требуется.
20 продуктов готовят к выпуску
на рынки США в ближайшие годы.
36. EvolvR: система для «прицельной эволюции» (2018)
Результат: в 8 миллионов разповышенный шанс появления
мутации с изменением заданного
признака (окно можно делать от 20 до
350 нуклеотидов – в зависимости от
конкретной версии белка).
Тест на частоту
появления
устойчивых
бактерий
37.
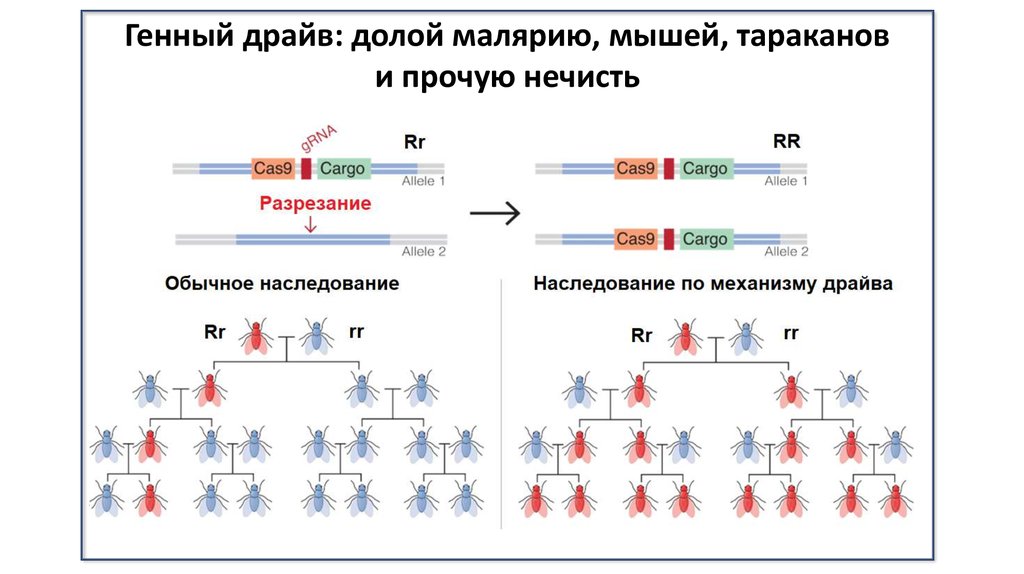
Генный драйв: долой малярию, мышей, тараканови прочую нечисть
38. Эволюционные исследования
Старые гены ⟹ новые геныНовые гены ⟹ старые гены
39.
Баркодирование клеток и отслеживаниеих истории в теле животного
• Развитие эмбриона
• Развитие раковой опухоли
40.
Использование CRISPR/Cas для мечениявнутриклеточных белков
Nock-in
Белок-GFP
Тубулин (иммуноокраш.) DAPI
Ядерный белок
Белок цитоплазмы
41.
Использование CRISPR/Cas для активации илиподавления работы генов
42.
Итак, чем же так хороша система CRISPR/Cas?1. Простота дизайна, высокая эффективность и специфичность генной
модификации клеток и организмов, а следовательно, экономия денег и
времени.
2. Возможность работы с множеством различных биологических
объектов, в том числе тех, которые не являются классическими
модельными объектами.
3. Возможность ориентации одновременно на большое число геномных
локусов.
4. Гибкая адаптация системы под решение широкого круга научных и
практических задач: модификация генома, регуляция активности генов,
прижизненное наблюдение за компонентами клетки и др.
43.
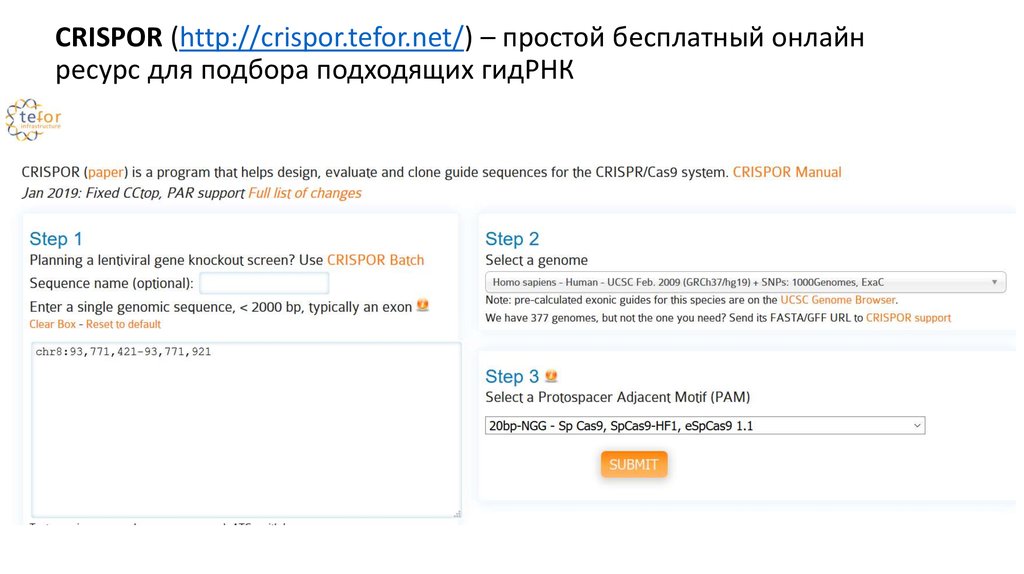
CRISPOR (http://crispor.tefor.net/) – простой бесплатный онлайнресурс для подбора подходящих гидРНК
44.
45. Риски
Слишком простая система. Можно сделать все без шума достаточнодешево и незаметно. А соблазн поиграться в Бога велик.
Риск грубых ошибок или злонамеренного вредительства действительно
есть, и вопрос о механизмах контроля действительно серьезный.
Здоровье
Сельское хозяйство
Биоразнообразие









































 biology
biology