Similar presentations:
Лабораторная оценка расстройств обмена углеводов
1. Лабораторная оценка расстройств обмена углеводов
доц. А.Н. Чернов,2.
Основным углеводом для клетокорганизма человека является
глюкоза. Она представляет собой
важнейший энергетический
субстрат для клеток всех органов и
тканей. В качестве энергетического
субстрата углеводы по сравнению с
другими соединениями
(аминокислотами, липидами) имеют
ряд преимуществ
3.
Во-первых, для перевариванияполисахаридов и дисахаридов в
желудочно-кишечном тракте
требуется минимальное количество
амилолитических ферментов (αамилазы, лактазы, мальтазы, изомальтазы и сахаразы).
4.
Во-вторых, образующаяся вкишечнике при переваривании
крахмала и дисахаридов глюкоза
всасывается при помощи простого
механизма- Na+-глюкозного
котранспортера.
5.
В-третьих, в крови глюкозанаходится в свободной форме.
6.
В-четвертых, в клетках глюкозаможет подвергаться нескольким
механизмам окислительного
метатаболизма.
7.
В –пятых, для окисления глюкозы вклетках до СО2 и Н2О требуется
минимальное количество кислорода.
8.
В-шестых, только глюкоза можетокисляться с образованием АТФ в
анаэробных условиях.
9.
В –седьмых, конечный продуктполного окисления глюкозы СО2
выделяется очень легко через легкие
с выдыхаемым воздухом без потери
воды.
10.
Кроме энергетической роли углеводыявляются пластическим материалом
для синтеза различных клеточных и
тканевых структур: гликопротеинов,
гликолипидов, нуклеиновых кислот,
гликозамингликанов и других
соединений.
11.
Метаболиты глюкозы в клеткахиграют роль предшественников
многих органических соединенийаминокислот, высших жирных кислот,
триацилглицеринов, фосфолипидов,
гексуроновых кислот и гексозаминов
12.
Обладая преимуществом в качествеэнергетического субстрата по
сравнению с аминокислотами и
липидами, глюкоза имеет и ряд
недостатков, в частности, при её
высокоё концентрации во
внеклеточной жидкости она
оказывает токсическое действие на
различные белки клетки.
13.
Являясь важнейшим энергетическимсубстратом для клеток и
одновременно обладая в
повышенных концентрациях
глюкозотоксичностью, содержание
глюкозы во внеклеточной жидкости и
в клетках должен поддерживаться в
относительно узком диапазоне
концентраций (3,5- 6,2 ммоль/л).
14.
Содержание глюкозы во всем объёмеводного пространства (42 л у мужчин
массой тела 70 кг) составляет 147-256
ммоль или 26 -46 г, а во всем объёме
крови (5 л), соответственно, 17,5-50,5
ммоль или 3,15 – 5,5 г. Такое количество
глюкозы в организме человека
обеспечивает, с одной стороны,
энергетические потребности органов и
тканей, но не оказывает токсического
действия.
15.
Наиболее важными потребителямиглюкозы являются:
- головной и спинной мозг (до 180
г в сутки);
- эритроциты (до 50 г/сут);
-скелетная мускулатура: при
физической нагрузке потребление
глюкозы мышцами увеличивается в
20-30 раз по сравнению с состоянием
покоя.
16.
Содержание глюкозы вовнеклеточной жидкости на
постоянном уровне является основой
нормального функционирования
органов и систем и регулируется
различными механизмами.
17.
Наиболее важными механизмамиобеспечения эугликемии являются:
-поступление глюкозы в кровь из
пищеварительного тракта в процессе
переваривания сложных углеводов и
всасывания моносахаридов. Этот
механизм функционирует периодически
после приема углеводов с пищей и
обеспечивает в физиологических условиях
поступление большей части глюкозы
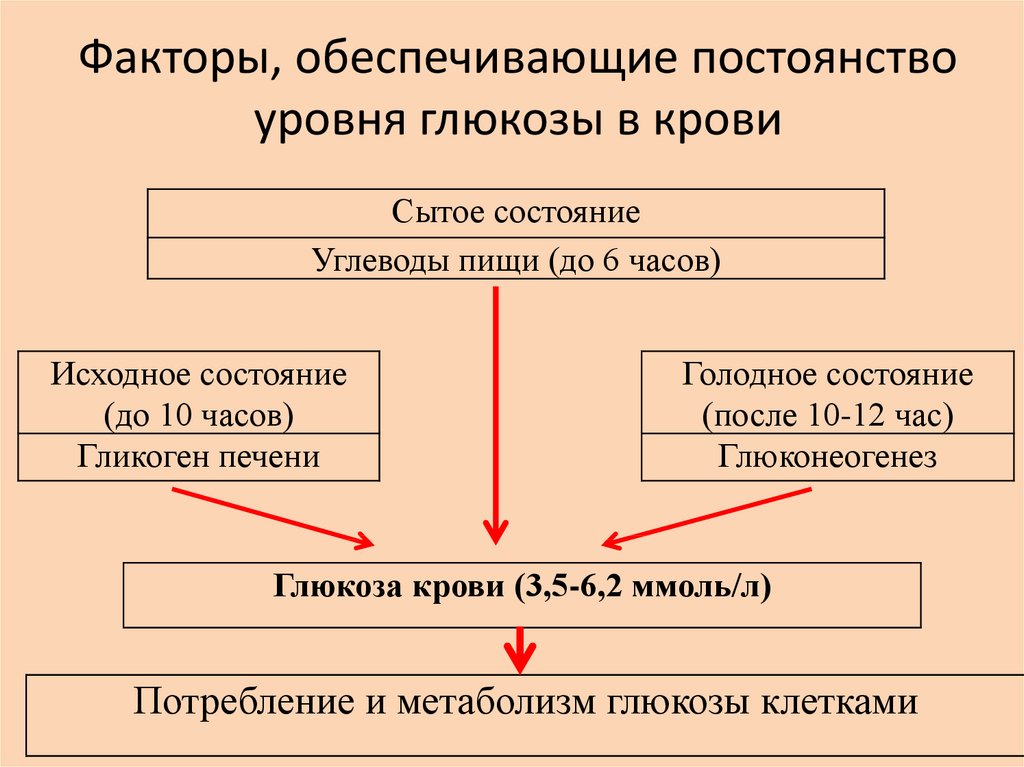
(сытое состояние организма).
18.
В периоды между приемами пищипостоянство уровня глюкозы в крови
обеспечивается в процессе
расщепления запасенного в сытом
состоянии гликогена печени
(гликогенолиза) до глюкозы и
выходом её в кровь (исходное
состояние).
19.
Гликогенолиз в печени определяетсясодержанием глюкозы в крови и
регулируется различными гормонами:
распад гликогена в печени с
образованием глюкозы повышают
адреналин и глюкагон, тормозит этот
процесс инсулин.
20.
В голодном состоянии постоянствоконцентрации глюкозы в крови
обеспечивается глюконеогенезом-синтезом
глюкозы из неуглеводных
предшественников, главным образом из
аминокислот. Эндогенная продукция
печенью глюкозы у здоровых людей
составляет около 300 г в сутки. У детей
интенсивность глюконеогенеза зависит
прежде всего от возраста; чем меньше
возраст ребенка, тем меньше скорость
глюконеогенеза.
21.
Глюконеогенез (ГНГ) как механизмподдержания концентрации глюкозы
в крови на постоянном уровне
регулируется различными гормонами,
в частности, глюкагон,
глюкокортикостероиды,
соматотропин усиливают, а инсулин
тормозит глюкогеногенез.
22.
Таким образом, постоянство концентрацииглюкозы в крови достигается с одной
стороны за счет поступления извне или
образования её в организме, и потребления
клетками органов и тканей, с другой
стороны, т.е. сбалансированностью
поступления (и продукции) глюкозы в кровь
и расходованием её клетками. Только
равновесие поступления и потребления
глюкозы крови тканями обеспечивает
постоянство её уровня в крови (рис.1)
23.
Факторы, обеспечивающие постоянствоуровня глюкозы в крови
Сытое состояние
Углеводы пищи (до 6 часов)
Исходное состояние
(до 10 часов)
Гликоген печени
Голодное состояние
(после 10-12 час)
Глюконеогенез
Глюкоза крови (3,5-6,2 ммоль/л)
Потребление и метаболизм глюкозы клетками
24.
Большая часть углеводов пищипредставлена крахмалом и в меньшей
степени дисахаридами и
моносахаридами. Для детей грудного
возраста основным углеводом пищи
является лактоза.
25.
Переваривание крахмала начинаетсяв ротовой полости ферментом
слюнной амилазой, однако большого
значения этот процесс не имеет, так
как в кислой среде желудка после
поступления пищевого комка
активность фермента полностью
исчезает.
26.
Основное переваривание полисахаридовпроисходит в тонкой кишке под
действием панкреатической α-амилазы с
образованием дисахаридов мальтозы и
изо-мальтозы. Дисахариды (лактоза,
сахароза, мальтоза и изо-мальтоза)
окончательно расщепляются до
соответствующих моносахаридов
ферментами щеточной каймы и
цитоплазмы энтероцитов (лактазой,
сахаразой, мальтазой и изо-мальтазой).
27.
Образованные при перевариваниидисахаридов моносахариды (глюкоза,
галактоза, фруктоза) всасываются в
кровь в основном при участии Na+глюкозного котранспортера 1 типа.
Этот белковый мембранный белок
осуществляет одновременный
транспорт ионов натрия и глюкозы.
28.
Ионы натрия проникают в энтероциты поградиенту концентрации с высвобождением
свободной энергии, которая используется для
переноса из просвета кишечника в клетки
моносахарида против градиента концентрации.
Такой механизм всасывания глюкозы называется
вторично активным; K+,Na+-АТФаза
базолатеральной цитоплазматической мембраны
энтероцитов восстанавливает калий-натриевый
градиент путем выведения из клеток трех ионов
натрия в обмен на два иона калия. Благодаря
такому механизму клетки тонкой кишки способны
поглощать глюкозу и другие моносахариды даже
при очень низкой их концентрации в химусе.
29.
Нарушения абсорбции моносахаридов вкишечнике относятся к наследственным
аутосомно- рецессивным ферментопатиям.
Выделяют синдромы мальабсорбции
углеводов, обусловленные недостатка
котранспортера моносахаридов, дефицитом
дисахаридаз, а также вызванные
нарушениями начальных стадий
метаболизма моносахаридов в энтероцитах.
Кроме этого имеется и смешанный синдром
мальабсорбции.
30.
При всех типах мальабсорбцииуглеводов характерными
симптомами являются бродильный
понос, эксикоз, вторичная
гипотрофия.
31.
Понос вызывают негидролизованныедисахариды или невсосавшиеся
моносахариды дистальных отделов
кишечника. Повышение осмотического
давления за счет моносахаридов, а также
образованных кислых продуктов их
бактериального сбраживания вызывает
усиленную перистальтику кишечника,
увеличение объёма кишечного
содержимого, нарушение всасывания воды
и формирования каловых масс.
32.
При глюкозо-галактозноймальабсорбции дефицит натрийглюкозного котранспортера приводит
у детей к водянистому поносу после
приема пищи. С возрастом
толерантность к этим моносахаридам
улучшается.
33.
При врожденном отсутствии лактазы (βгалактозидазы) клинические проявленияпоявляются уже после первых кормлений
ребенка грудью, а при врожденном
недостатке мальтазы или сахаразы
симптоматика мальабсорбции появляется
при переходе на искусственное
вскармливание, т.е. с введением в питание
крахмала и сахарозы.
Нелеченные синдромы мальабсорбции
осложняются хроническим дисбактериозом
и задержкой физического развития.
34.
При наследственных нарушенияхобмена гликогена (гликогенозах),
вызванных ферментными дефектами
распада гликогена до глюкозы,
возникают расстройства по
поддержанию её уровня в крови в
исходном и голодном состояниях.
35.
В зависимости от органа, в котором внаибольшей степени проявляются признаки
энзимопатии, гликогенозы патогенетически
делятся на печеночные, мышечные и
смешанные.
Особое место среди различных гликогенозов
занимают печеночные, в частности гликогеноз
1 типа (болезнь Гирке). Молекулярной основой
его является дефект глюкозо-6-фосфатазы в
печени и почках. Недостаточность фермента
приводит к накоплению гликогена в
гепатоцитах и нефроцитах.
36.
Неспособность клеток печени превращатьглюкозо-6-фосфат путем гидролитического
отщепления фосфатного остатка в
свободную глюкозу приводит к развитию
гипогликемии после приема пищи, вначале
к повышению содержания инсулина, а
затем к быстрому его снижению в
организме. Гипоинсулинемия способствует
повышенному липолизу
триацилглицеринов в жировых клетках,
развитию метаболического ацидоза,
кетонурии, гиперлипопротеинемии 1 типа.
37.
Для больных характерны низкий уровеньглюкозы в крови натощак, малый подъём её
концентрации в ответ на введение
адреналина или глюкагона. Обычным
является высокий уровень в крови лактата,
ТАГ, холестерина и мочевой кислоты. Уже в
молодом возрасте формируется подагра и
уролитиаз. В тяжелых случаях даже
непродолжительное голодание приводит к
гипогликемии, к судорогам, к замедлению
роста из-за хронически низкого уровня
инсулина.
38.
Потребление глюкозы клеткамизависит от их энергетических
потребностей. Критической стадией
использования глюкозы клетками
является транспорт её через
цитоплазматические мембраны;
глюкоза как осмотически
эффективное вещество не способна
путем простой диффузии проникать
через клеточные мембраны.
39.
По способности клеток различных органовпоглощать глюкозу из внеклеточной
жидкости они делятся на
инсулинонезависимые и
инсулинозависимые ткани. Перенос
глюкозы в клетки инсулинонезависимых
тканей происходит без участия инсулина;
скорость такого транспорта определяется
главным образом концентрационным
градиентом глюкозы между кровью и
клеточным пространством.
40.
К инсулинонезависмым клеткамотносятся клетки сосудистой системы,
нервной ткани, почек, сетчатки,
хрусталика, печени, эритроциты.
Инсулинозависимыми являются
клетки скелетной и сердечной
мышцы, жировой ткани; поглощение
глюкозы такими клетками возможен
только при определенной
концентрации инсулина в крови.
41.
Поглощение глюкозы клеткамиразличных органов осуществляется
путем облегченной диффузии с
помощью специальных белков –
переносчиков (транспортеров).
Выделяют два класса транспортеров
глюкозы: Na+- глюкозный
котранспортер и 6 изоформ
собственно транспортеров глюкозы.
42.
Собственно глюкозные транспортеры(ГЛЮТ) представляют собой мембранные
белки, многократно пронизывающие
плазматические мембраны и
осуществляющие транспорт глюкозы по
градиенту концентрации путем
облегченной диффузии; они участвуют в
транспорте глюкозы не только из
внеклеточной жидкости в клетки, но в
обратном направлении.
43.
Среди участвующих в переносе черезмембраны глюкозы транспортеров
наиболее важными являются
печеночный (ГЛЮТ-2) и мышечножировой (ГЛЮТ-4) переносчики.
44.
ГЛЮТ-2 обнаружен в клетках, выделяющихглюкозу в кровь (гепатоцитах,
энтероцитах, нефроцитах), а также в
цитоплазматических мембранах α- и βклетках островков Лангерганса. Этот
транспортер двунаправленного действия
обеспечивает перенос глюкозы из крови в
гепатоциты после потребления углеводов с
пищей и противоположный транспорт из
гепатоцитов в кровь при снижении уровня
глюкозы в крови.
45.
ГЛЮТ -2, осуществляя поступление глюкозыв β-клетки островков, стимулирует секрецию
инсулина, а поступление в α-клетки
тормозит секрецию глюкагона. Изменения
количества ГЛЮТ -2 снижает поступление в
β-клетки глюкозы, что вызывает снижение
секреции инсулина даже при высокой
концентрации глюкозы в крови и
повышенной секреции глюкагона. Это
наблюдается при сахарном диабете 2 типа.
46.
ГЛЮТ-4 (мышечно-жировой тип) содержитсяв клетках инсулинозависимых тканей.
Экспрессия транспортера регулируется
инсулином. В отличие от других
транспортеров глюкозы ГЛЮТ-4 изначально
локализуется в цитоплазматических
везикулах; при воздействии на клетки
инсулина происходит транслокация его в
цитоплазматическую мембрану и только в
таких случаях происходит поглощение
глюкозы мышечными и жировыми
клетками.
47.
Количество выставляемых вцитоплазматическую мембрану молекул
переносчика глюкозы зависит от
содержания в них гликогена: при
увеличении содержания гликогена в
мышечных клетках количество ГЛЮТ-4 в
их мембранах уменьшается в результате
обратного перехода в цитоплазму
(ретранслокации).
48.
Предполагается, что одной из причинрезистентности клеток мышечной
ткани к инсулину при ожирении и СД
2 типа является угнетение синтеза
ГЛЮТ-4 или нарушение транслокации
из цитоплазмы в мембраны. Инсулин
и физическая активность вызывают
транслокацию ГЛЮТ-4 в
цитоплазматические клетки
мышечной ткани.
49.
Равновесие поступления глюкозы вкровь за счет экзогенных углеводов
или эндогенной продукции в
процессе гликогенолиза и
глюконеогенеза и потребления
глюкозы клетками тканей может быть
нарушено самыми различными
причинами. Все эти расстройства
проявляются либо гипергликемией,
либо гипогликемией.
50.
В клетках поступившая глюкоза подвергаетсяразличным метаболическим превращениям,
как окислительным, так и неокислительным.
Окислительными внутриклеточными
превращениями глюкозы являются:
- гликолитическое окисление;
-гексозомонофосфатное (пентозофосфатное)
окисление;
-глюкуронатное окисление;
-сорбитоловый (полиоловый) путь
превращения.
51.
Гликолитический путь превращенияглюкозы является одним из главных
механизмов образования
биологической энергии АТФ. Кроме
того, гликолиз является механизмом
образования многочисленных
промежуточных продуктов, которые
служат исходными молекулами для
синтеза различных биомолекул
(аминокислот, фосфолипидов,
триацилглицеринов).
52.
Гексозомонофосфатный путь превращенияглюкозы играет роль поставщика
восстановленного кофактора NADPH
(никотинамидаденинди-нуклеотидфосфата),
необходимого для многочисленных
биосинтетических и окислительновосстановительных процессов (синтеза
высших жирных кислот, холестерина,
стероидных гормонов, оксида азота и т.п.).
Кроме того, таким метаболическим
превращением глюкозы обеспечивается
синтез пентоз для образования нуклеотидов.
53.
Глюкуронатный путь катаболизмаглюкозы приводит к образованию
глюкуроновой кислоты, компонента
гликозамингликанов, а также для
реакций конъюгации
многочисленных токсических
соединений эндогенного
(билирубина) и экзогенного
происхождения (лекарств, токсинов).
54.
Сорбитоловый (полиоловый) путьпревращения глюкозы заключается в
её ферментативном восстановлении
в шестиатомный спирт сорбитол. Доля
сорбитолового пути окисления
глюкозы при нормальной
концентрации не превышает 1%, зато
при гипергликемии она достигает 1015%.
55.
Сорбитол представляет собой полярноегидрофильное осмотически эффективное
соединение, которое не способно
проникать через клеточные мембраны и
очень медленно превращающееся во
фруктозу. Повышение образования в
клетках сорбитола при гипергликемии
приводит к повышению в них
осмоляльности, увеличению их объёма,
формы и функций.
56.
Метаболизм глюкозы в клетках и еёсодержание в крови регулируются
различными гормонами. Наиболее
важным гормоном-регулятором
обмена углеводов является инсулин.
Он также регулирует обмен липидов,
белков, нуклеиновых кислот,
аминокислот, электролитов и воды.
57.
Инсулин обладает анаболическим иантикатаболитным действием. Он регулирует
поступление в клетки мышечной и жировой
тканей глюкозы, повышая её окисление.
Энергетическое обеспечение анаболических
процессов, стимулируемых инсулином
(биосинтез гликогена, высших жирных кислот и
триацилглицеринов, белков) осуществляется
преимущественно окислением глюкозы.
Одновременно гормон снижает использование
других энергетических субстратов (ВЖК,
аминокислот).
58.
Основной биологической функцией ворганизме инсулина является
предотвращение развития гипергликемии.
Дефицит инсулина приводит к нарушению
транспорта глюкозы в клетки
инсулинозависимые ткани. Клиниколабораторным проявлением такого
расстройства обмена глюкозы является
постпрандиальная гипергликемия и
снижение толерантности к глюкозе.
59.
Выраженный дефицит инсулинахарактеризуется активизацией
гликогенолиза и глюконеогенеза,
повышением липолиза ТАГ в жировых
клетках, повышением концентрации в крови
неэтерифицированных жирных кислот,
ускорением кетогенеза. Следствием
выключения контролирующего влияния
инсулина является гипергликемия натощак,
кетонемия, кетоз, кетоацидоз, кетонурия,
снижение массы тела.
60.
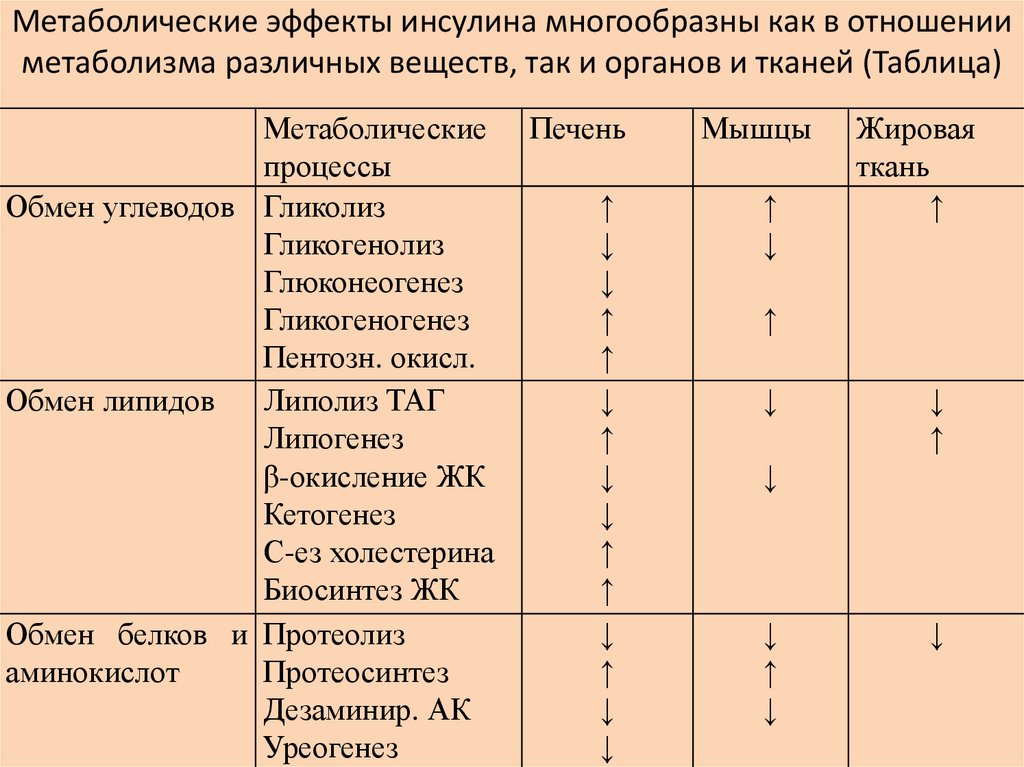
Метаболические эффекты инсулина многообразны как в отношенииметаболизма различных веществ, так и органов и тканей (Таблица)
Метаболические
процессы
Обмен углеводов Гликолиз
Гликогенолиз
Глюконеогенез
Гликогеногенез
Пентозн. окисл.
Обмен липидов
Липолиз ТАГ
Липогенез
β-окисление ЖК
Кетогенез
С-ез холестерина
Биосинтез ЖК
Обмен белков и Протеолиз
аминокислот
Протеосинтез
Дезаминир. АК
Уреогенез
Печень
↑
↓
↓
↑
↑
↓
↑
↓
↓
↑
↑
↓
↑
↓
↓
Мышцы
↑
↓
Жировая
ткань
↑
↑
↓
↓
↑
↓
↓
↑
↓
↓
61.
Другим гормоном, регулирующимметаболизм углеводов и уровень
глюкозы в крови является глюкагон.
Он секретируется α-клеткми
островков Лангерганса и его основное
функциональное значение состоит в
предотвращении развития
гипогликемии и дефицита глюкозы
как энергетического субстрата для
клеток.
62.
Поджелудочная железа человека содержитболее 1 миллиона панкреатических островков,
состоящих из клеток различных типов: β (В)клетки до 70%, α (А) клетки около 20%, δ (Д)
клетки-5-10%.
В островках А-, Б- и Д-клетки, располагаются в
тесной близости и контактируют друг с другом,
образуя гетероклеточные зоны. Между
цитотипами островков действует система
паракринного взаимовлияния друг на друга.
Иначе говоря, панкреатические островки
представляют собой сообщество паракринно
регулируемых клеток.
63.
Секретируемый А-клетками глюкагонпаракринно стимулирует образование
и секрецию В-клетками инсулина и Дклетками соматостатина , а
секретируемый В-клетками инсулин
паракринно тормозит образование и
секрецию глюкагона. Соматостатин,
синтезируемый Д-клетками
паракринно угнетает секрецию и
инсулина , и глюкагона.
64.
В физиологических условияхсинтетическая и секреторная
активность А-клеток контролируется
одновременными тормозными
влияниями инсулина и соматостатина;
контроль активности А-клеток
эффективен, если он бигормонален.
65.
Прогрессирующая гибель В-клеток при СД 1типа вызывает изменения соотношения Аи Д- клеток: доля А-клеток возрастает до
75% (вместо 20%), а доля Д-клеток-до 25%.
Количество В-клеток прогрессивно
сокращается и к моменту развития явного
диабета 1 типа становится менее 10%.
Бигормональная регуляция глюкагона
утрачивается, поэтому его содержание
прогрессивно увеличивается.
66.
Глюкагон по своему метаболическомудействию является антагонистом инсулина,
так как :
-ускоряет гликогенолиз в печени;
-стимулирует глюконеогенез;
-тормозит поглощение клетками глюкозы и
ее метаболические превращения;
-активирует липолиз ТАГ жировых клеток,
стимулирует кетогенез и окисление жирных
кислот.
67.
Наиболее частой причиной нарушений обменавеществ, в том числе углеводного, является
инсулиновая недостаточность или низкая
чувствительность мышечных клеток к инсулину.
Ключевым звеном патогенеза СД 1типа
является прогрессирующая гибель В-клеток
панкреатических островков. Это приводит к
изменению соотношения цитотипов островков,
к инсулинопении и избыточной продукции
глюкагона. В результате утилизация глюкозы
клетками снижается и возникают нарушения
всех видов обмена.
68.
Инсулиновая недостаточностьпроявляется тяжелыми расстройствами
метаболизма. Наиболее выраженными из
них являются нарушения обмена
углеводного обмена.
Одним из наиболее важных лабораторных
симптомов сахарного диабета является
гипергликемия натощак или после еды
(постпрандиальная гипергликемия).
69.
Патогенез гипергликемии при сахарномдиабете представлен на схеме:
Инсулиновая недостаточность
Низкая скорость
транспорта глюкозы крови
в клетки и торможение её
метаболизма
Высокая скорость синтеза
глюкозы из аминокислот
(ГНГ)
Гипергликемия
70.
Гипергликемия при инсулиновой недостаточностииграет важную роль в патогенезе осложнений
сахарного диабета, так как глюкоза при её высокой
концентрации обладает выраженной
токсичностью.
Продолжительная гипергликемия у больных СД
вызывает повышенное поступление глюкозы в
клетки инсулинонезависимых тканей. Высокая
концентрация глюкозы в клетках вызывает
повреждения различных структур клеток, органов
и тканей. Такое действие длительной высокой
гипергликемии получило название
глюкозотоксичности.
71.
Глюкозотоксичность проявляется:1. неферментативным гликированием белков и других,
содержащих свободные аминогруппы соединений,
вызывающие необратимые структурно-функциональны
ковалентные модификации;
2. сопряженным с гликированием белков
свободнорадикальным окислением органических
компонентов клеток, приводящим к повышению
свободных радикалов, в частности,
кислородсодержаних и активных форм кислорода. Все
они обладают высокой токсичностью и снижают
антиоксидантный потенциал клеток.
Такое, обусловленное гипергликемией нарушение
баланса оксидантной и антиоксидантной систем
организма называют окислительным стрессом
72.
Проявлением глюкозотоксичностиявляется также активизация
сорбитолового пути окисления
глюкозы.
73.
Гликирование белков осуществляетсянеферментативным путем; интенсивность
этого процесса определяется
выраженностью гликемии и её
продолжительностью.
Биохимическая сущность процесса состоит
во взаимодействии альдегидной группы
глюкозы со свободными аминогруппами
белков с образованием сначала альдимина
(шиффова основания), затем в результате
перегруппировки кетимина.
74.
Гликированные белки это ковалентномодифицированные белки отличаются от
нативных белков физико-химическими
свойствами и функциональными
характеристиками.
Например, гликированный гемоглобин А1
(HbA1c) отличается от HbA1 увеличением
отрицательного заряда, изменением
изоэлектрической точки, более высоким
сродством к кислороду.
75.
Гликированный оксигемоглобин А1 труднеедиссоциирует в тканевых капиллярах на
кислород и гемоглобин при
физиологическом парциальном давлении
кислорода в тканях. Кривая диссоциации
гликированного HbA1c смещена влево. В
крови сохраняется нормальная
кислородная емкость, но отдача кислорода
тканям затруднена, артерио-венозная
разница по кислороду снижается, т.е.
развивается гемическая гипоксия тканей.
76.
У здорового человека уровень HbA1cне превышает 6,1% от общей
концентрации гемоглобина. У
больных СД 1 типа концентрация
гликированного гемоглобина, равная
6,1 – 7,5% является показателем
эффективности проводимой терапии,
а при концентрации свыше 7,5%неэффективной терапии.
77.
При декомпенсации углеводногообмена у больных СД уровень
гликированного гемоглобина может
достигать 12-20%. При таком уровне
нарушается оксигенация тканей;
особенно страдают органы и ткани с
высокой потребностью в кислороде
(головной мозг, почки, сердце).
78.
Гликированный гемоглобин находитсяв эритроцитах весь срок их
существования, т.е. 90-120 дней.
Повышение уровня гликированного
гемоглобина свидетельствует о
нарушениях обмена глюкозы и уровня
гликемии как минимум в последние 45
- 60 дней, времени полуобновления
популяции эритроцитов в крови.
79.
Ценность определения уровнягликированного гемоглобина состоит
в том, что его концентрация в отличие
от концентрации глюкозы в крови, не
зависит от времени суток, приема
пищи и лекарств, от эмоционального
состояния пациента и физических
нагрузок.




















































































 medicine
medicine biology
biology








