Similar presentations:
I закон термодинамики, его применение для расчёта тепловых эффектов
1. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
ТИХООКЕАНСКИЙ ГОСУДАРСТВЕНЫЙ УНИВЕРСИТЕТКАФЕДРА ХИМИИ
В.А. Яргаева
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Мультимедийные лекции по физической химии
@ В.А. Яргаева
Хабаровск
2016
2. Содержание
1. I закон термодинамики, егоприменение для расчёта тепловых
эффектов.
2. II и III законы термодинамики.
Энтропия и её расчёт в различных
процессах.
3. Энергия Гиббса, энергия
Гельмгольца, их практическое
значение.
3. Библиографический список
1. Стромберг А. Г. Физическая химия / А. Г. Стромберг, Д.П. Семченко – М.: Высш. шк., 2001. – 527 с.
2. Эткинс П. Физическая химия. В 3-х ч. Ч. 1.: Равновесная
термодинамика / П. Эткинс, Дж. де Паула. – М.: Мир, 2007.
– 494 с.
3. Евстратова К. И. Физическая и коллоидная химия / К. И.
Евстратова, Н. Н. Купина, Е. Е. Малахова. – М.: Высш.
шк., 1990. – 487 с.
4. Краткий справочник физико-химических величин / Под
ред. А. А. Равделя, А. М. Пономаревой. – СПб., 2003. – 238 с.
5. Химия – Википедия. [Электронный ресурс] – Режим
доступа: https://ru.wikipedia.org/wiki/Химия.
6. Презентации по химии. [Электронный ресурс] – Режим
доступа: https:// 900igr.net/prezentacii-po-khimii.html
4. I закон термодинамики, его применение для расчёта тепловых эффектов
1.2.
3.
4.
5.
Основные понятия термодинамики.
I закон (начало) термодинамики.
Закон Гесса, следствия из закона.
Расчёт тепловых эффектов различных процессов.
Влияние температуры на величину теплового эффекта.
5. Предмет термодинамики
Термодинамика изучает положения и законы,описывающие обмен энергией между изучаемой системой
и внешней средой, превращения одних форм энергии в
другие.
Химическая термодинамика применяет законы и
положения общей термодинамики к изучению
химических и физико-химических процессов, например,
определению теплового эффекта, направления
протекания процесса и др.
Термодинамика (Т/Д) базируется на трёх началах или
законах термодинамики (постулатах), установленных на
основе анализа множества экспериментальных данных.
6. Основные понятия термодинамики
Система (С.) − тело или группа тел, находящихся вовзаимосвязи и мысленно обособленных от окружающей среды.
Окружающая среда (обычно большого размера) − всё, что
находится в прямом или косвенном контакте с системой.
С. изолированная − не обменивается веществом и энергией с
окружающей средой.
С. открытая − обменивается веществом и энергией с
окружающей средой.
С. закрытая − не обменивается веществом, но обменивается
энергией с окружающей средой.
С. гомогенная − состоит из одной фазы.
С. гетерогенная − состоит из двух и более фаз.
7. Основные понятия термодинамики
Фаза − часть системы, одинаковая по составу, физическими химическим свойствам и отделённая от других частей
системы видимой поверхностью раздела.
Компоненты − вещества, из которых состоит система.
Состояние системы − совокупность физических и
химических свойств, характеризующих систему.
Термодинамические (Т/Д ) параметры:
T – температура;
P – давление;
V – объём;
C – состав (концентрация).
8. Основные понятия термодинамики
Т/Д параметры − характеризуют состояние системы.Различают экстенсивные параметры (аддитивны):
m – масса; V – объём; U – внутренняя энергия и др.,
и интенсивные параметры (не обладают свойством
аддитивности, при контакте систем выравниваются):
T – температура; P – давление; C – концентрация и др.
Термодинамический (Т/Д) процесс − всякое изменение
в системе, связанное с изменением хотя бы одного
параметра.
Различают круговой, изобарный (Р = const), изохорный (V =
const), изотермический (T = const), адиабатический
(Q(теплота) = const) и др. процессы.
9. Основные понятия термодинамики
Функции состояния (U, H, S, G, A) − Т/Д функции,значения которых зависят только от начального и
конечного состояний системы и не зависят от пути
процесса.
Стандартное состояние − при Р = 101325 Па и любой Т.
Стандартные условия − при Р = 101325 Па и Т = 298 К.
Обратимый Т/Д процесс − равновесный, протекает
бесконечно медленно, без изменений в окружающей среде.
Необратимый Т/Д процесс − неравновесный, в
результате его протекания происходят энергетические
изменения в окружающей среде.
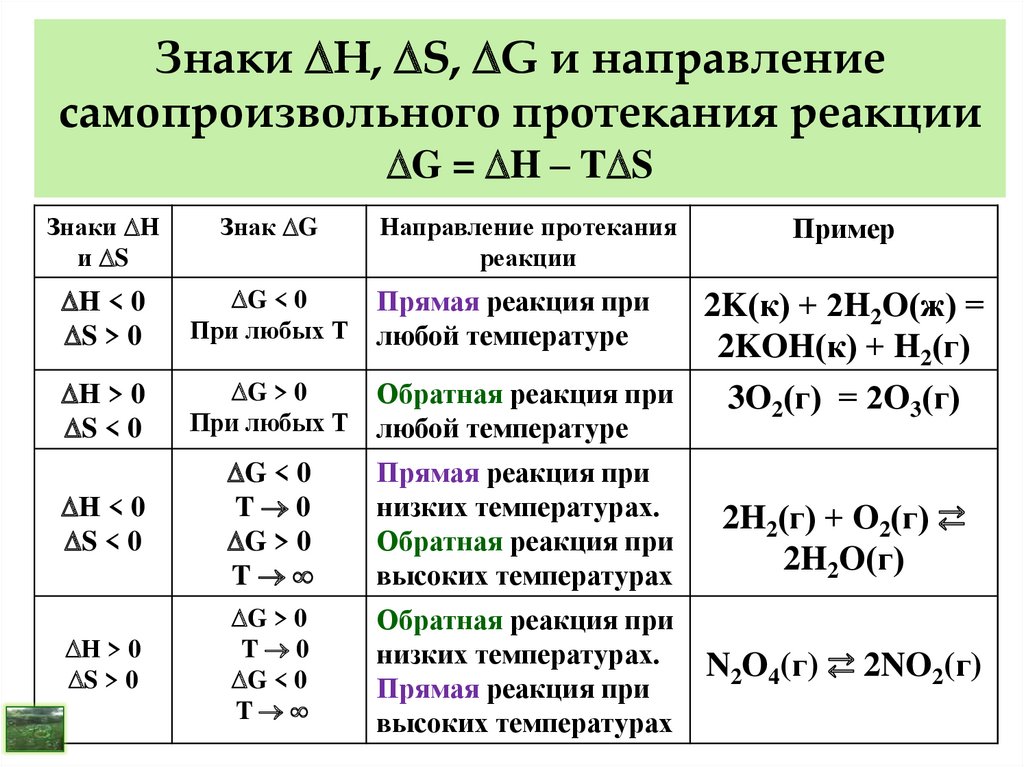
10. I закон (начало) термодинамики (закон сохранения энергии)
- В любой изолированной системе общий запас энергиипостоянен.
- Разные формы энергии переходят друг в друга в строго
эквивалентных количествах.
- Вечный двигатель первого рода невозможен, т. е.
невозможно построить машину, которая давала бы
механическую работу без подвода энергии извне.
Теплота Q, полученная системой извне, расходуется на
изменение внутренней энергии U и работу W.
Математическая формулировка I
закона термодинамики
Q = U + W
Для физико-химических процессов:
dW = PdV или W = Р V – работа расширения
Q = U + Р V
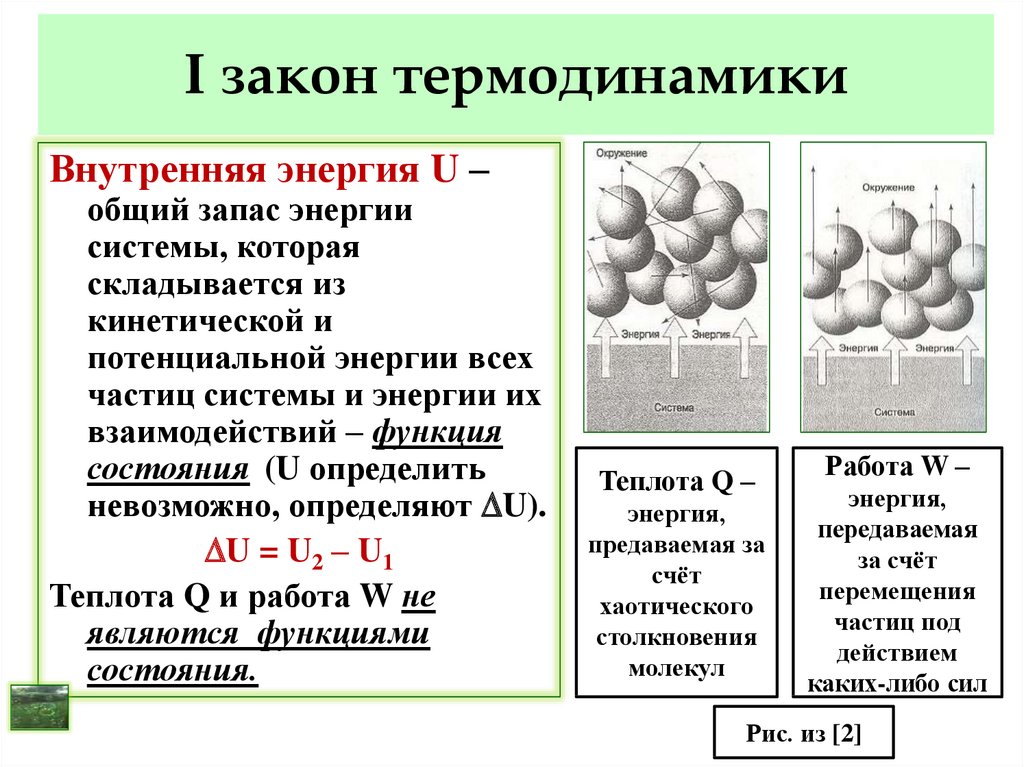
11. I закон термодинамики
Внутренняя энергия U –общий запас энергии
системы, которая
складывается из
кинетической и
потенциальной энергии всех
частиц системы и энергии их
взаимодействий – функция
состояния (U определить
невозможно, определяют U).
U = U2 – U1
Теплота Q и работа W не
являются функциями
состояния.
Теплота Q –
энергия,
предаваемая за
счёт
хаотического
столкновения
молекул
Работа W –
энергия,
передаваемая
за счёт
перемещения
частиц под
действием
каких-либо сил
Рис. из [2]
12. Применение I закона термодинамики
Термохимия – раздел, посвящённый изучению тепловыхэффектов химических и физико-химических процессов.
Тепловой эффект – теплота, выделяемая или
поглощаемая в результате протекания процесса.
Q = U + Р V (I закон Т/Д для физико-химических процессов)
Изохорные процессы (V = const): V= 0; Q = U;
U (изменение внутренней энергии) – изохорный тепловой
эффект.
Изобарные процессы (Р = const): H = U + PV; Q = H;
H (изменение энтальпии) – изобарный тепловой эффект.
Энтальпия Н – функция состояния, как и внутренняя энергия
характеризует общий запас энергии системы (включает энергию,
которая тратится на работу расширения).
13. Применение I закона термодинамики
В термодинамике теплота, поглощённая системой,считается положительной, а выделенная – отрицательной!
Эндотермический
процесс
(с поглощением
теплоты)
Эндотермический процесс
CaCO3(к) → CaO(к) + CO2(г)
H = 178 кДж/моль,
U > 0; H > 0.
поглощается 178 кДж теплоты
Экзотермический
процесс
(с выделением
теплоты)
Экзотермический процесс
C(графит) + O2(г) → CO2(г)
H = – 394 кДж/моль,
U < 0; H < 0.
выделяется 394 кДж теплоты
14. Применение I закона термодинамики
Связь между изобарным и изохорным тепловыми эффектами:H = U + Р V или H = U + nRT
(следует из уравнения Менделеева-Клапейрона Р V = nRT)
n – изменение числа моль газообразных веществ в результате
протекания реакции (процесса); R = 8,314 Дж/(моль· К).
Пример 1: Определить n в реакциях:
а) 2NO2(г) + O3(г) = O2(г) + N2O5(г);
б) CH4(г) + 2H2S(г) = CS2(ж) + 4H2(г);
в) 2CrCl3(к) + 3H2(г) =2Cr(к) + 6HCl(г).
Решение. а) n = (1 + 1) – (2 + 1) = – 1; б) n = 4 – (1 + 2) = 1;
в) n = 6 – 3 = 3.
При расчёте n число моль жидких и твёрдых веществ
не учитывают!
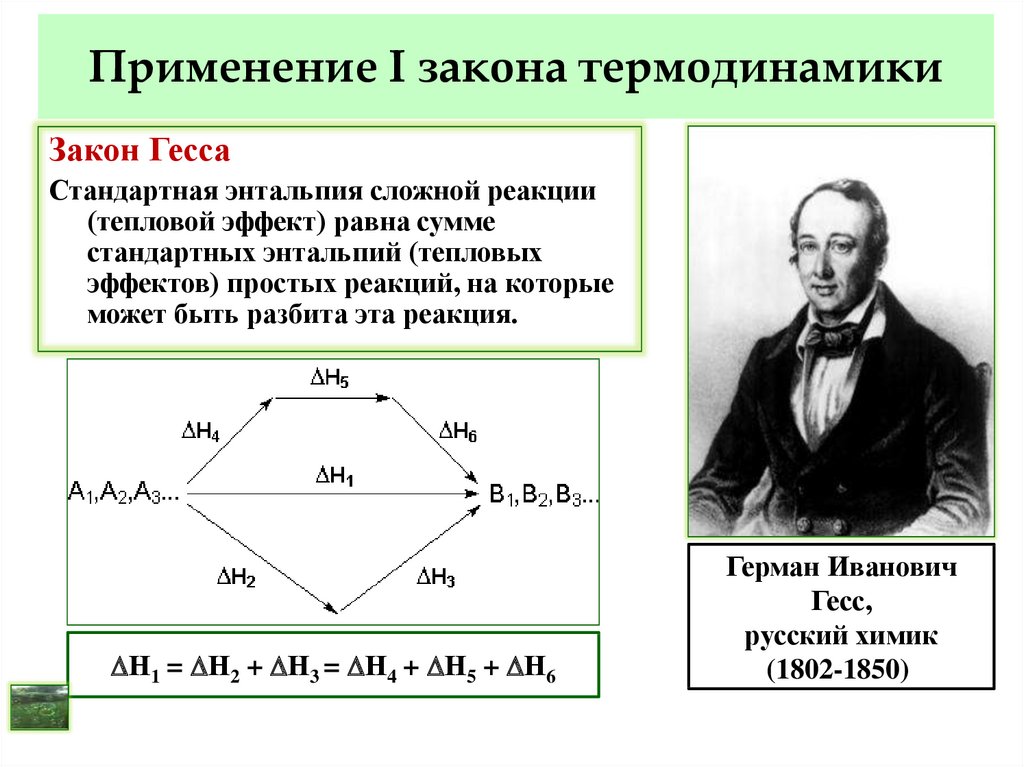
15. Применение I закона термодинамики
Закон ГессаСтандартная энтальпия сложной реакции
(тепловой эффект) равна сумме
стандартных энтальпий (тепловых
эффектов) простых реакций, на которые
может быть разбита эта реакция.
Н1 = Н2 + Н3 = Н4 + Н5 + Н6
Герман Иванович
Гесс,
русский химик
(1802-1850).
16. Применение I закона термодинамики
Расчёты любого процесса основаны на свойствеэнтальпии являться функцией состояния!
1) Расчёт тепловых эффектов химических реакций r 0
или процессов, например, фазовых переходов trs 0: плавления,
испарения и др.
Для расчёта необходимы стандартные энтальпии (теплоты)
образования веществ f 0(298) – справочные величины.
f 0(298), кДж/моль – это тепловой эффект образования 1 моль вещества
из простых веществ, устойчивых при стандартных условиях
(Т = 298 К; Р = 101325 Па).
f 0 для устойчивых простых веществ принимают равной нулю.
Например, для углерода устойчивой формой считают графит.
f 0(С(графит)) = 0, но f 0(С(алмаз)) = 1,83 кДж/моль.
r 0 – стандартная энтальпия химической реакции (тепловой
эффект химической реакции при стандартном давлении и данной
температуре).
17. Применение I закона термодинамики
trs 0 – стандартная энтальпия фазового перехода (тепловойэффект фазового перехода при стандартном давлении и данной
температуре).
Следствия из закона Гесса:
1) Тепловой эффект реакции (процесса) равен разности суммы энтальпий
(теплот) образования продуктов реакции (процесса) и суммы
энтальпий (теплот) образования исходных веществ с учётом
стехиометрических коэффициентов в уравнении реакции (процесса).
r 0 = i f 0(прод) – i f 0(исх) или
trs 0 = i f 0(кон) – i f 0(исх),
прод (кон) – продукты реакции (конечные вещества);
исх – исходные вещества;
i – стехиометрические коэффициенты в уравнении реакции (процесса).
r 0 рассчитывают, по уравнению, записанному в особой
термодинамической (термохимической) форме.
18. Применение I закона термодинамики
Особенности термодинамического уравнения:Указываются агрегатные состояния веществ.
Допускаются дробные коэффициенты.
С термодинамическими уравнениями можно выполнять такие же
действия, как с любыми математическими уравнениями.
Для реакций, протекающих в водных растворах электролитов с участием
ионов, тепловые эффекты рассчитывают таким же способом,
используя стандартные энтальпии образования ионов в водных
растворах (справочные величины).
-
2) Тепловой эффект прямой реакции (процесса) равен тепловому эффекту
обратной реакции (процесса) с противоположным знаком
r (прямой) = – r (обратной),
trs (испарения) = – trs (конденсации),
trs (плавления) = – trs (кристаллизации).
19. Применение I закона термодинамики
Пример 2.Определить при Т = 298 К тепловой эффект реакции разложения
воды по уравнению
2H2О(г) = 2Н2(г) + О2(г),
если известно, что для реакции
Н2(г) + 0,5О2(г) = H2О(г), r = –241,81 кДж.
Решение.
Если удвоить коэффициенты второго уравнения, то полученное
уравнение реакции
2Н2(г) + О2(г) = 2H2О(г)
отражает реакцию получения 2-х моль воды. Она является обратной для
реакции разложения 2-х моль воды. Откуда,
r (прямой) = – 2 r (обратной) = – 2· (–241,81) = 483,62 кДж.
Так как r > 0, реакция разложения воды является эндотермической,
т. е. протекает с поглощением теплоты.
20. Применение I закона термодинамики
Для реакций с участием органических веществ тепловой эффектможно рассчитывать по стандартным энтальпиям
(теплотам) сгорания с 0 (справочные величины) – это
тепловые эффекты полного окисления 1 моль органических
соединений с образованием определённых продуктов: СО2(г), Н2О(ж),
N2(г), HCl(г), HBr(г), НI(г).
Например, с 0(C6H5О2N(ж)) представляет собой тепловой эффект
реакции
C6H5О2N(ж) + 6,25О2(г) = 6СО2(г) + 2,5Н2О(ж) + 0,5N2(г).
Из справочной таблицы с 0(C6H5О2N(ж)) = –3091,2 кДж/моль.
Расчёт тепловых реакций по теплотам сгорания проводят по формуле
r 0 = i с 0(исх) – i с 0(прод),
исх – исходные вещества; прод – продукты реакции;
i – стехиометрические коэффициенты в уравнении реакции.
21. Применение I закона термодинамики
2) Тепловые эффекты процессов растворенияИнтегральная энтальпия (теплота) растворения s 0 зависит
от моляльной концентрации вещества в растворе.
s 0 ( m), кДж/моль – теплота, которая выделяется или поглощается
при растворении 1 моль вещества в таком количестве растворителя,
чтобы образовался раствор определённой моляльной концентрации
(справочная величина).
3) Расчёт тепловых эффектов процессов разбавления или
концентрирования
Для расчёта необходимы величины интегральных энтальпий (теплот)
растворения исходных и конечных растворов.
Тепловым эффектом разбавления (концентрирования) называют теплоту
, которая выделяется или поглощается при разбавлении
(концентрировании) раствора, содержащего 1 моль растворённого
вещества, от концентрации Сm(1) до концентрации Сm(2).
Раствор 1(Сm(1)) → Раствор 2(Сm(2))
= s 0(2) – s 0(1) или = m(2) – m(1).
22. Влияние температуры на тепловой эффект (уравнение Кирхгофа)
Характер влияния температуры на тепловойэффект в соответствии с уравнением Кирхгофа
определяется знаком
изменения молярной теплоёмкости
СР (изобарной) или СV (изохорной)
в результате протекания
соответствующего процесса.
Уравнение Кирхгофа
в дифференциальной
форме
Густав Роберт
Кирхгоф,
немецкий физик
(1824-1887)
23. Анализ уравнения Кирхгофа
1) если СР > 0, то d /dТ > 0, т. е. с увеличениемтемпературы тепловой эффект увеличивается;
2) если СР < 0, то d /dТ < 0, т. е. с увеличением
температуры тепловой эффект уменьшается;
3) если СР = 0, то d /dТ = 0, = const, тепловой эффект
не зависит от температуры.
24. Расчёт теплового эффекта при любой температуре
Уравнение Кирхгофав интегральной форме
r 298 = i f 0(прод) – i f 0(исх),
СР = i СР(прод) – i СР(исх),
i – стехиометрические коэффициенты в уравнении реакции;
СР = a + bT + c'/T2 – изобарная молярная теплоёмкость для
неорганических веществ, уравнение зависимости СР от
температуры;
СР = a + bT + cT2 – изобарная молярная теплоёмкость для
органических веществ, уравнение зависимости СР от температуры;
а, b, c', c – эмпирические коэффициенты веществ (справочные
величины в указанном интервале температур).
25. Расчёт теплового эффекта при любой температуре
Расчёт r Т с различными приближениямиПервое приближение: СР = С0Р,298;
С0Р,298 – стандартная изобарная молярная теплоёмкость
(справочная величина).
С0Р,298 = i С0Р,298(прод) – i С0Р,298(исх).
Второе приближение: СР = a + bT;
Третье приближение: СР = a + bT + c'/T2 + cT2
– наиболее точный расчёт.
а = iаi(прод) – iаi(исх).
Расчёт b, c', c – аналогичен.
i – стехиометрические коэффициенты в уравнении
реакции.
26. Влияние температуры на тепловой эффект
Пример 3.Определить тепловой эффект реакции
С2Н5ОН(г) + 3О2(г) = 2СО2(г) + 3Н2О(г)
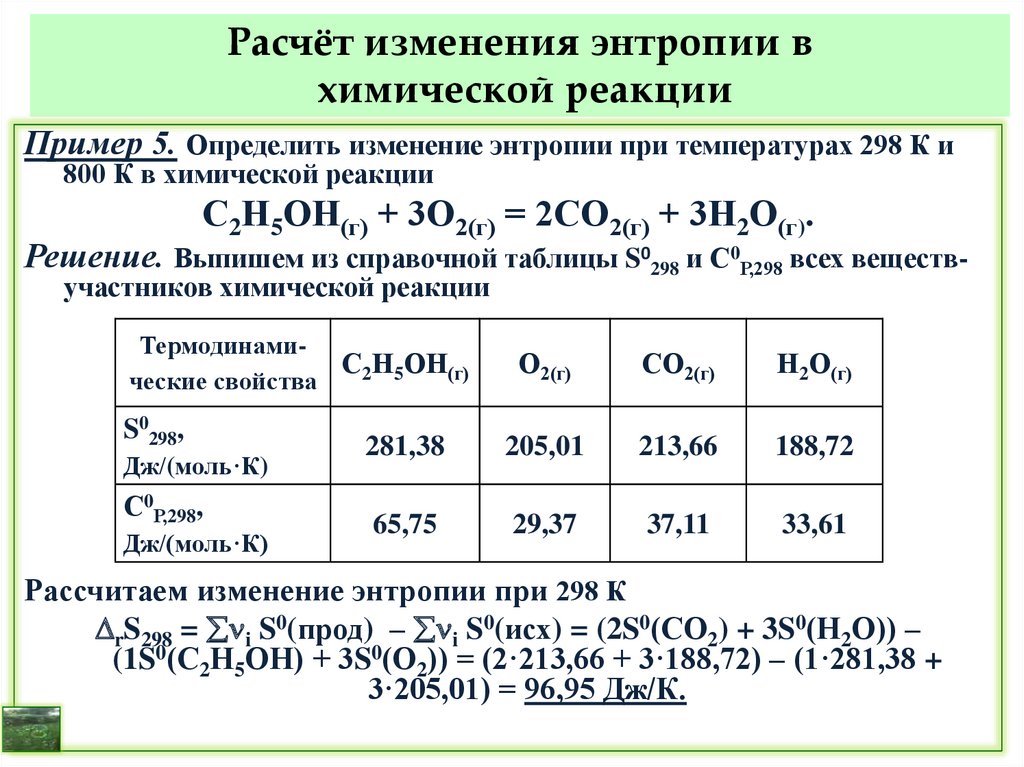
при температурах 298 и 800 К.
Решение.
Для расчета r при 298 К находим справочные значения стандартных
энтальпий образования (кДж/моль) веществ-участников реакции:
f 0(С2Н5ОН(г)) = – 234,80; f 0(СО2(г)) = – 393,51;
f 0(Н2О(г)) = –241,81; для простого вещества О2 f 0(О2(г)) = 0.
r 298 = i f 0(прод) - i f 0(исх) =
(2 fH0(СО2) + 3 fH0(Н2О)) – ( fH0(С2Н5ОН) + 3 fH0(О2)) =
(2·(–393,51) + 3·(–241,81)) – ((–234,80) + 3·0) = –1277,62 кДж.
Т. к. r 298 < 0, реакция экзотермическая, протекает с выделением
теплоты.
Для расчета r при 800 К используем уравнение Кирхгофа и первое
приближение при определении СР:
СР = С0Р,298 = iС0Р,298(прод) – iС0Р,298(исх) = const.
27. Влияние температуры на тепловой эффект (уравнение Кирхгофа)
r Т = r 298 += r 298 + СР,298· (Т – 298).
Для расчета СР,298 выпишем справочные значения стандартных
изобарных молярных теплоёмкостей (Дж/(моль·К)) веществучастников реакции:
СР,298 (С2Н5ОН(г)) = 65,75; СР,298 (СО2(г)) = 37,11; СР,298 (О2(г)) = 29,37;
СР,298(Н2О(г)) = 33,61.
СР,298 = (2СР,298(СО2) + 3СР,298(Н2О)) – (СР,298(С2Н5ОН) + 3СР,298(О2)) =
= (2·37,11 + 3·33,61) – (65,75 + 3·29,37) = 21,19Дж/К = 0,02119 кДж/К.
Рассчитаем r Т при Т = 800 К.
r 800 = –1277,62 + 0,02119 · (800 – 298) = –1266,98 кДж.
При 800 К реакция по-прежнему – экзотермическая, но теплоты
выделится несколько меньше, чем при 298 К.
28. Качественная оценка тепловых эффектов различных процессов
С выделением теплоты ( rH < 0, trs < 0, s < 0) протекают:– реакции горения (взаимодействие веществ с кислородом), например,
C2H4(г) + 3O2(г) = 2CO2(г) + 2H2O(г);
– реакции соединения (образование сложных веществ из более
простых), например,
2C(графит) + 3H2(г) = C2H6(г);
– процессы растворения кислот и щелочей в воде, например,
Н2SO4 + nН2O = 2Н+ ·aq + SO42− ·aq (aq - молекулы Н2O);
– процессы конденсации и кристаллизации, например,
H2O(г) = H2O(ж).
С поглощением теплоты ( rH > 0, trs > 0) протекают:
– реакции разложения (образование простых или менее сложных
веществ из более сложных), например,
CaCO3(к) = CaO(к) + СО2(г);
– процессы испарения и плавления, например,
H2O(к) = H2O(ж).
29. II и III законы термодинамики. Энтропия и её расчёт в различных процессах
1. II закон (начало) термодинамики.2. Энтропия как критерий протекания
самопроизвольного процесса.
3. Расчёт изменения энтропии в различных процессах.
4. III закон (начало) термодинамики.
30. II закон (начало) термодинамики
I закон термодинамики позволяет определятьтеплоту и работу, но не даёт ответа на вопрос: в
каком направлении и до какого предела будет
протекать самопроизвольный процесс. Ответ
на этот вопрос даёт II закон термодинамики.
Формулировка Клаузиуса (1850 г.)
- Теплота не может самопроизвольно
переходить от более холодного тела к
горячему.
Формулировка Томпсона
- Никакая совокупность процессов не
может сводиться только к превращению
теплоты в работу, тогда как
превращение работы в теплоту может
быть единственным результатом
процесса.
Рудольф Клаузиус,
немецкий физик
(1822-1888)
Томас Томпсон,
шотландский химик
(1773-1852)
31. II закон (начало) термодинамики
Формулировка Оствальда- Невозможно создание вечного
двигателя второго рода, т. е.
невозможно построить машину,
которая превращала бы всю
теплоту в работу без передачи
части её холодильнику.
Формулировка Кельвина
- Не существует циклического
процесса, единственным
результатом которого было бы
получение теплоты от нагревателя
и полное превращение её в работу.
Вильгельм Оствальд,
немецкий физико-химик
(1853-1932)
Томсон Кельвин,
английский физик
(1824-1907)
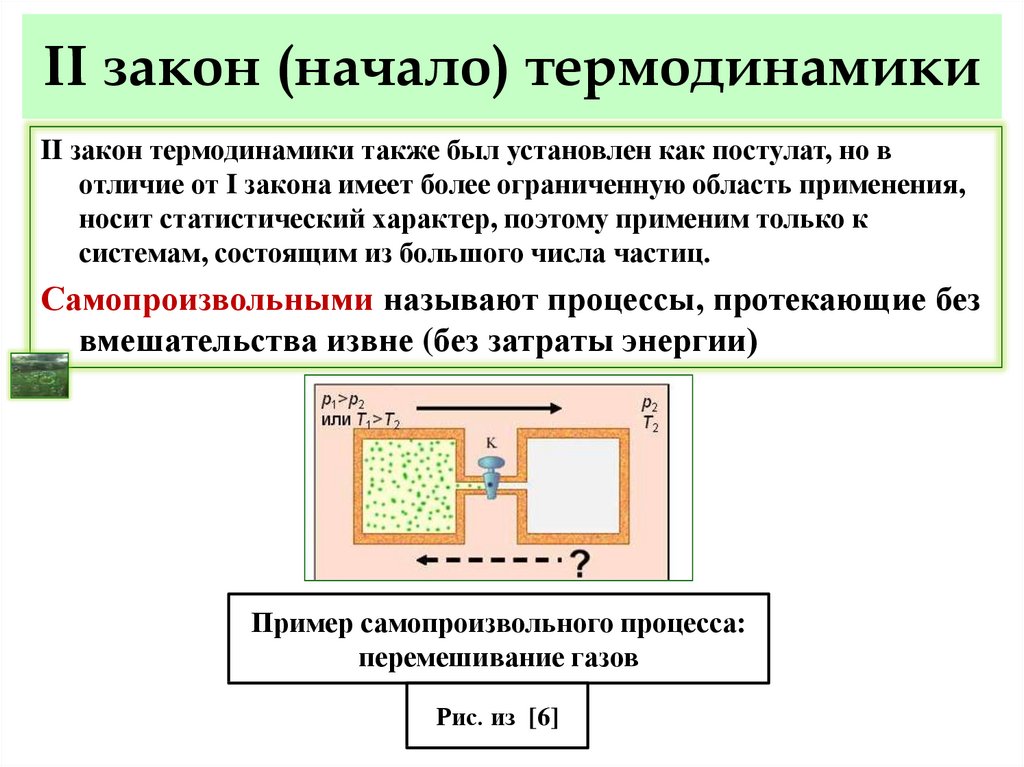
32. II закон (начало) термодинамики
II закон термодинамики также был установлен как постулат, но вотличие от I закона имеет более ограниченную область применения,
носит статистический характер, поэтому применим только к
системам, состоящим из большого числа частиц.
Самопроизвольными называют процессы, протекающие без
вмешательства извне (без затраты энергии)
Пример самопроизвольного процесса:
перемешивание газов
Рис. из [6]
33. II закон (начало) термодинамики
Накопленный человечеством опыт показывает, чтосамопроизвольное протекание процессов в системе
возможно только в направлении выравнивания фактора
интенсивности (температуры, давления, концентрации и
т. д.). Пределом самопроизвольного протекания процесса
является достижение одинакового значения фактора
интенсивности во всех частях системы.
Но это утверждение не применимо к однородным системам,
в частности, к химическим реакциям.
Это требует введения новой функции состояния –
энтропии.
Её ввёл Р. Клаузиус (1865 г.), обозначил S.
34. II закон (начало) термодинамики
II закон (начало) термодинамики особенно нагляднопроявляется в работе тепловых машин, для которых и
был сформулирован.
В настоящее время этот закон вводят в рассмотрение путём
анализа работы тепловых машин (цикл Карно).
Второй закон термодинамики можно сформулировать
без анализа работы тепловых машин
(принцип Каратеодори).
II закон термодинамики – всеобщий закон природы, по своей
фундаментальности уступающий место только I закону
термодинамики – закону сохранения энергии!
35. II закон (начало) термодинамики
Пусть система переходит из состояния 1 всостояние 2 с поглощением теплоты.
Предположим, что система может вернуться из
состояния 2 в состояние 1 без теплообмена
(адиабатически). В соответствии с I законом
термодинамики:
Q = U + W(1) (для прямого процесса);
0 = – U + W(2) (для обратного процесса).
В результате кругового процесса: Q = W(1) + W(2), т. е. вся теплота
должна превратиться в работу, а это невозможно согласно I закону
термодинамики.
Принцип Каратеодори: в непосредственной близости от
любого состояния имеются такие состояния, которые
недостижимы адиабатическим путём, т. е. без передачи теплоты.
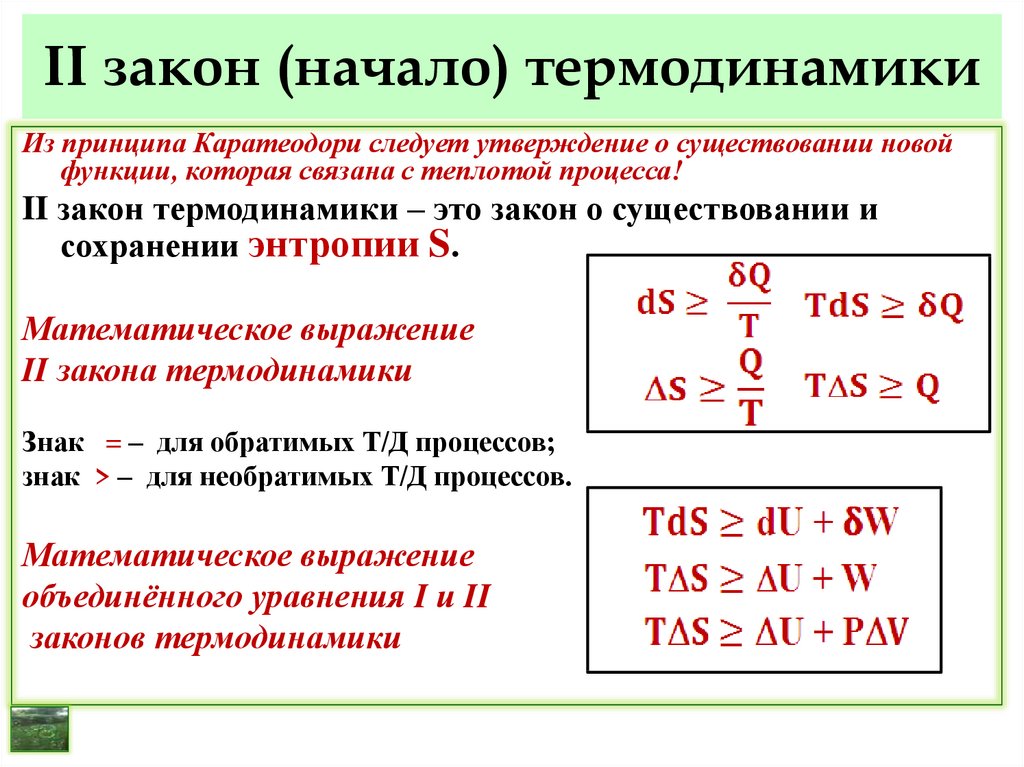
36. II закон (начало) термодинамики
Из принципа Каратеодори следует утверждение о существовании новойфункции, которая связана с теплотой процесса!
II закон термодинамики – это закон о существовании и
сохранении энтропии S.
Математическое выражение
II закона термодинамики
Знак = – для обратимых Т/Д процессов;
знак > – для необратимых Т/Д процессов.
Математическое выражение
объединённого уравнения I и II
законов термодинамики
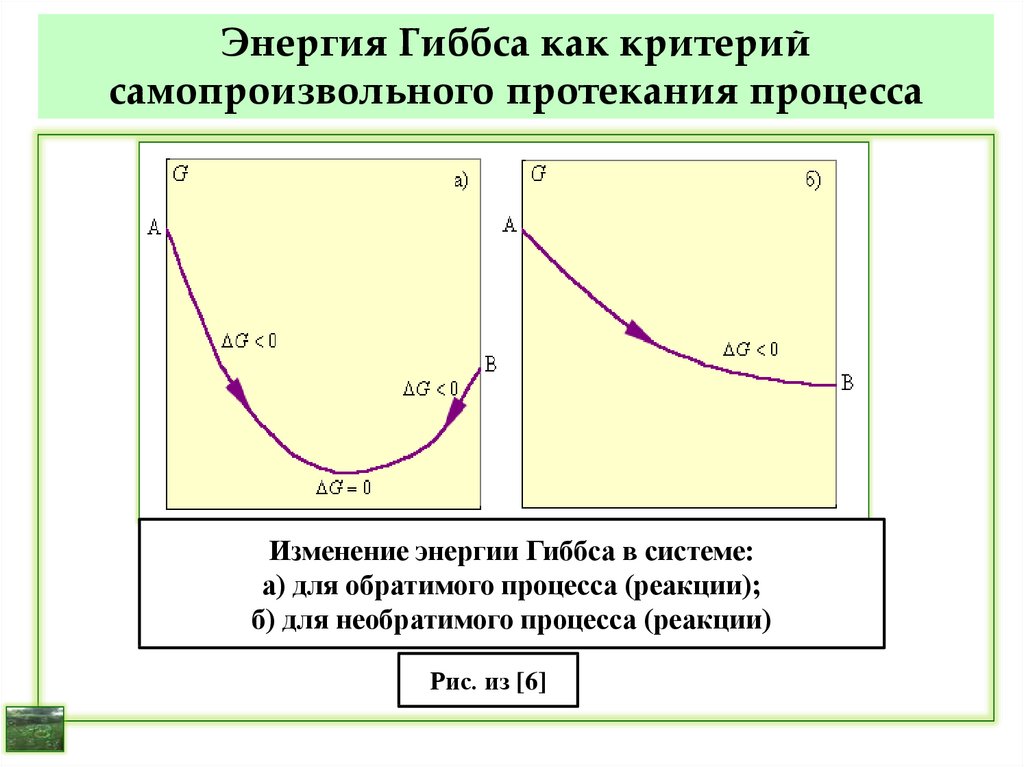
37. Энтропия как критерий самопроизвольного протекания процесса
Для изолированных систем (U = const; V = const)теплообмен и массообмен отсутствует: Q = 0.
Для обратимых процессов: dS = 0; S = 0.
Для необратимых процессов: dS > 0; S > 0.
В изолированной системе всякий самопроизвольный
процесс протекает в направлении возрастания
энтропии:
dS > 0; S > 0; S → Smax;
при dS = 0; S = 0; S = Smax в системе – равновесие.
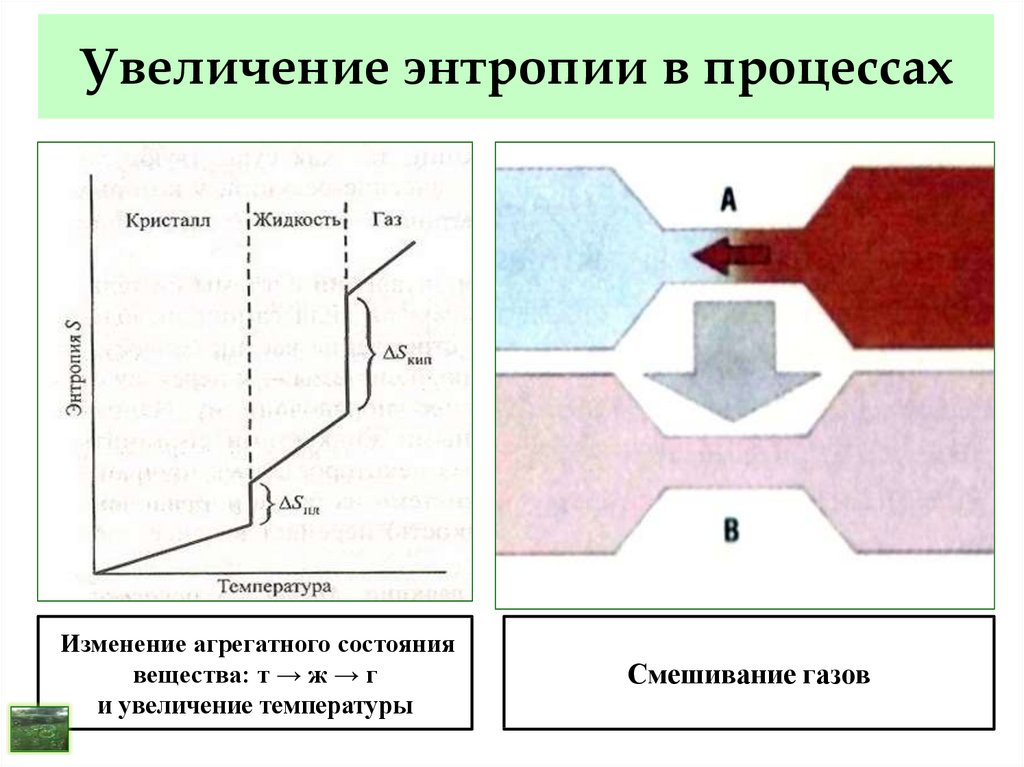
38. Изменение энтропии в процессах
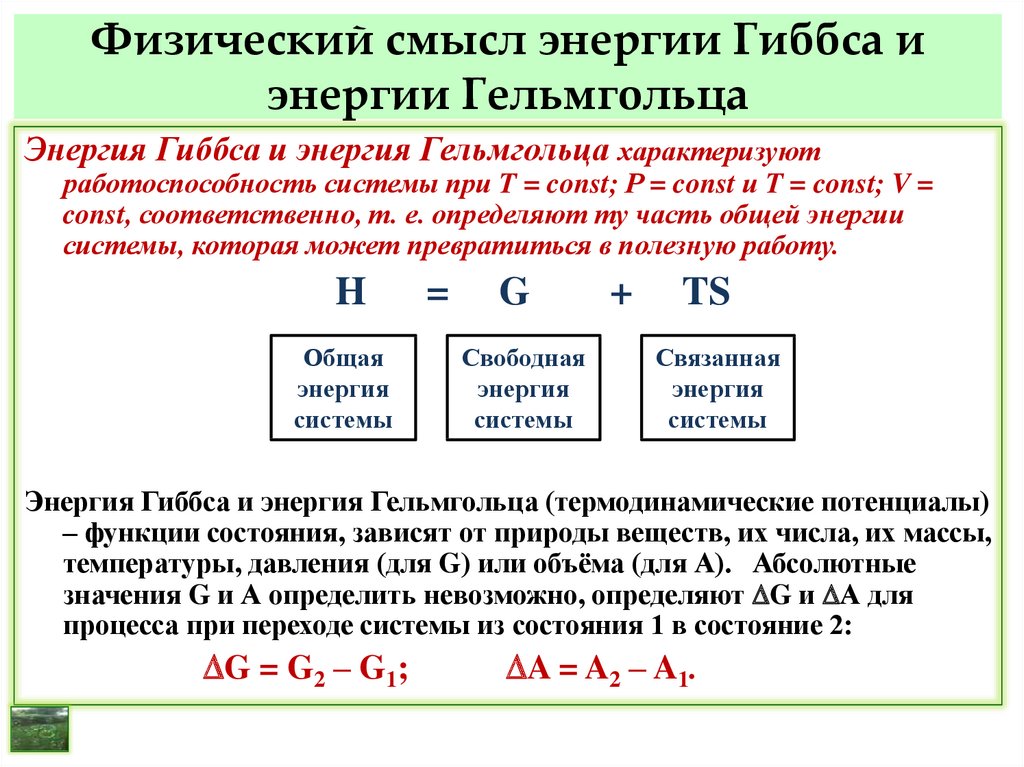
Энтропия S – мера беспорядка (хаоса) или степеньнеупорядоченности системы – функция состояния.
ТS – мера связанной энергии (не может превратиться в
полезную работу).
Всякий процесс, приводящий к увеличению
беспорядка приводит к увеличению энтропии:
- изменение агрегатного состояния т → ж → г;
- повышение температуры;
- усложнение состава вещества;
- растворение твёрдых и жидких веществ;
- в химических реакциях – увеличение числа газообразных
молекул и т. п.
39. Увеличение энтропии в процессах
Изменение агрегатного состояниявещества: т → ж → г
и увеличение температуры
Смешивание газов
40. Статистическое обоснование II закона термодинамики
Всякая изолированная системастремится перейти из состояния менее
вероятного в состояние более
вероятное: W → Wmax.
W – термодинамическая вероятность
(число микросостояний,
характеризующих данное
макросостояние).
Л. Больцман показал, что при
W → Wmax; S → Smax.
Уравнение Больцмана
S = k·lnW
k – постоянная Больцмана (1,38· 10−23 Дж/К)
Людвиг Больцман,
австрийский физик
(1844-1906)
41. Расчёт изменения энтропии в различных процессах
1. При фазовом превращении 1 моль вещества (Т = const;Р = const):
Н(ф.п.) – теплота (энтальпия) фазового превращения;
Т(ф.п.) – температура фазового превращения.
2. При изменении температуры 1 моль вещества (Р = const):
3. При взаимной диффузии двух идеальных газов:
S = – R(x1lnx1 + x2lnx2)
x1, x2 – молярная доля 1-го и 2-го газа.
42. Расчёт изменения энтропии в различных процессах
4. В химических реакциях:При Т = 298 К
rS 0298 = i S0(прод) – i S0(исх),
S2980, Дж/(моль·К) – абсолютная стандартная энтропия 1 моль
вещества (справочная величина).
При любой Т
СР = i СР(прод) – i СР(исх).
Первое приближение: СР = С0Р,298;
Второе приближение: СР = a + bT;
Третье приближение: СР = a + bT + c'/T2 + cT2 – точный расчёт.
С0Р,298 (а, b, с', c) – стандартная изобарная молярная теплоёмкость 1 моль
вещества (эмпирические коэффициенты в уравнении для расчёта
изобарной молярной теплоёмкости вещества) – справочные величины.
43. Расчёт изменения энтропии вещества при изменении температуры
Пример 4.Определить изменение энтропии при охлаждении 320 г моноклинной
серы от 360 0С до 25 0С.
Решение. Выпишем из справочных таблиц температуру плавления
моноклинной серы: Тпл = 119,3 0С.
При 25 0С сера находится в твёрдом (кристаллическом) состоянии,
следовательно, в интервал температур 360-25 0С попадает фазовый
переход: кристаллизация серы. При 360 0С сера находится в жидком
состоянии.
Запишем схему процессов, происходящих с серой S в интервале
температур Т1 − Т2:
Охлаждение
S(ж) →
360 0С
Кристаллизация Охлаждение
S(ж) → S(т)
→ S(т)
119,3 0С
25 0С
44. Расчёт изменения энтропии вещества при изменении температуры
Таким образом, общее изменение энтропии S при охлаждении серы винтервале температур Т1 − Т2 складывается из изменения энтропии
S1 − при охлаждение жидкой серы; S2 − при кристаллизации серы;
S3 − при охлаждение твёрдой серы.
Для расчёта S выпишем из справочных таблиц теплоту плавления
Нпл, изобарные молярные теплоёмкости в твёрдом СР(т) и жидком
СР(ж) состояниях для моноклинной серы: Нпл = 1,446 кДж/моль;
СР(т) = 23,64 Дж/(моль∙К), СР(ж) = 35,73 Дж/(моль∙К).
Переведём массу серы в количество:
m
320
n=
=
= 10 моль.
M(S)
32
Определим теплоту кристаллизации Нкр:
Нкр = − Нпл = −1446 Дж/моль,
т. к. кристаллизация − процесс, обратный плавлению.
Переведём величины температур из 0С в К:
Т1 = 573 К; Т2 = 298 К; Тпл = Ткр= 392,3 К.
45. Расчёт изменения энтропии вещества при изменении температуры
Рассчитаем изменение энтропии в процессе охлаждения жидкой серы:Т С
Т
392,3
S1 = Т кр Р(ж)




























































 chemistry
chemistry








