Similar presentations:
Современные лабораторные технологии в трансплантологии
1. Современные лабораторные технологии в трансплантологии
Зав. кафедройклинической лабораторной диагностики,
аллергологии и иммунологии ГомГМУ
профессор Новикова И.А.
2.
3. В основе отторжения - иммунные механизмы (P.Medavar, 1945)
Создание исовершенствование
иммунодепрессантов
Разработка технологий
иммунологического
тестирования
Радиация, азатиоприн,
преднизолон
Открытие генов
гистосовместимости (1950)
Циклоспорин А (1978)
Применение тканевого
типирования
Такролимус,
микофенолаты, МАТ
Определение реактивных АТ,
cross-matсh тестов
4. Классификация трансплантатов
• Аутологичныйтрансплантат
–
аутотрансплантация (в пределах организма)
• Синергичный
трансплантат
–
изотрансплантация (от генетически идентичного
организма)
• Аллогенный
трансплантат
–
аллотрансплантация
(от
генетически
различающегося индивидуума в пределах вида)
• Ксеногенный
трансплантат
–
ксенотрансплантация,
гетерологичная
трансплантация (от другого вида)
5.
6. Источники трансплантатов
• ДонорыПреимущества:
• Лучше краткосрочные и долгосрочные результаты
• Более раннее восстановление функций органа
• Возможность применения менее агрессивного супрессивного
режима
• Больше времени персоналу для подготовки к операции
Недостатки:
• Ограниченный выбор органов
• Психологический стресс донора
• Оперативная летальность донора (~1/2000)
• Послеоперационные осложнения (~ 2%)
• Отдаленные последствия (умеренная гипертензия и протеинурия)
• Риск травматического повреждения второй почки
• Риск скрытопротекающей почечной патологии
• Трупный материал
7. Проблемы в трансплантации
• Недостаточность органов• Отторжение
–
иммунная система хозяина
обнаруживает
чужеродные
АГ
трансплантата
–
запуск атаки, приводящей к
отторжению трансплантата
8. Клинические фазы отторжения
1. Сверхострое отторжение (минуты-часы)• Предсуществующие АТ к антигенам донора (стенки
сосудов, клетки крови) → фиксация на эндотелии
→ активация комплемента и системы свертывания
→ окклюзия сосудов и гибель трансплантата.
2. Острое отторжение (первые 4 недели)
• Различия по HLA (на фоне недостаточной
иммуносупрессии!)
→
активация
клеточных
механизмов (CD4, CD8, NK, макрофаги), индукция
синтеза
специфических
АТ
→
деструкция
трансплантата.
3. Хроническое отторжение (месяцы-годы)
• Хронический иммунный процесс? → смешанные
гуморальные и клеточные механизмы.
9. Предотвращение посттрансплантационных реакций
• Иммуносупрессия• Подбор оптимальных доноров
трансплантатов
10. Иммуносупрессивная терапия
• Аллогеннаятрансплантация
всегда
требует иммуносупрессивной терапии!
• Назначается
на
этапе
подготовки
пациента, в ранний период после
пересадки, а затем в зависимости от
состояния пациента (постоянный клиниколабораторный мониторинг!)
• Большинство
препаратов
обладают
неспецифическим действием.
• Основные побочные проявления
Инфекции
Злокачественные опухоли
Угнетение костного мозга
11. Иммуносупрессивные препараты
Стандартные препараты– Стероиды (преднизолон)
– Азатиоприн /Imuran/
– Циклофосфамид
– Meтотрексат
Новые препараты:
– Циклоспорин A
– FK506 - такролимус /PROGRAF/
– Сиролимус
– CELLCEPT (micophenolate mofetil)
Моноклональные антитела:
• Anti CD3
• Anti-TAC (anti-IL2 receptor) - даклизумаб
• Anti-CD4
• Anti-CD52 (Campath)
• Anti-LFA1 + anti-ICAM-1 (в эксперименте)
• Anti-cytokine (IL-2, TNFα, IFNγ)
–
12. Подбор оптимальных доноров
• Соответствие по антигенам АВ0• Максимальное соответствие реципиенту по
HLA (тканевое типирование)
• Минимальная сенсибилизация потенциального
реципиента (панель реактивных антител). У
всех реципиентов на «листе ожидания»
должны быть сведения о проценте и
специфичности PRA.
• Отсутствие реакции донор-реципиент в тестах
перекрестной антигенной совместимости
(cross-matсh)
13. Совместимость по АВО
14. Тестирование гистосовместимости
• Типированиереципиента
HLA
у
донора
и
• Выявление
у
реципиента
аллосенсибилизации к HLA-антигенам
(панель реактивных антител)
• Тест на совместимость донора и
реципиента (crossmatch)
15. Главный комплекс гистосовместимости
• Главный комплекс гистосовместимости (МНСmajor histocompatibility complex, у человека –
HLA human leucocyte antigens) – это комплекс
генов, которые сами по себе и через
кодируемые ими продукты обеспечивают
контроль
иммунного
ответа
и
реакции
отторжения при трансплантации.
• У всех клеток конкретного человека система
HLA тождественна и строго индивидуальна.
HLA «иммунный паспорт индивида»
16.
17. Распределение HLA - молекул
ТканьHLA-I
HLA-II
+++
+++
+++
+++
+
+/ –
+++
++
–
–
Паренхима почек
+
–
Эпителий тимуса
Мозг
Эритроциты
+
+
–
+++
–
–
Т-клетки
В-клетки
Макрофаги
Нейтрофилы
Гепатоциты
18. Тканевое типирование
Позволяет установить панель HLAгенов,присущих
определенному
организму (индивидуальный «паспорт»)
Методы:
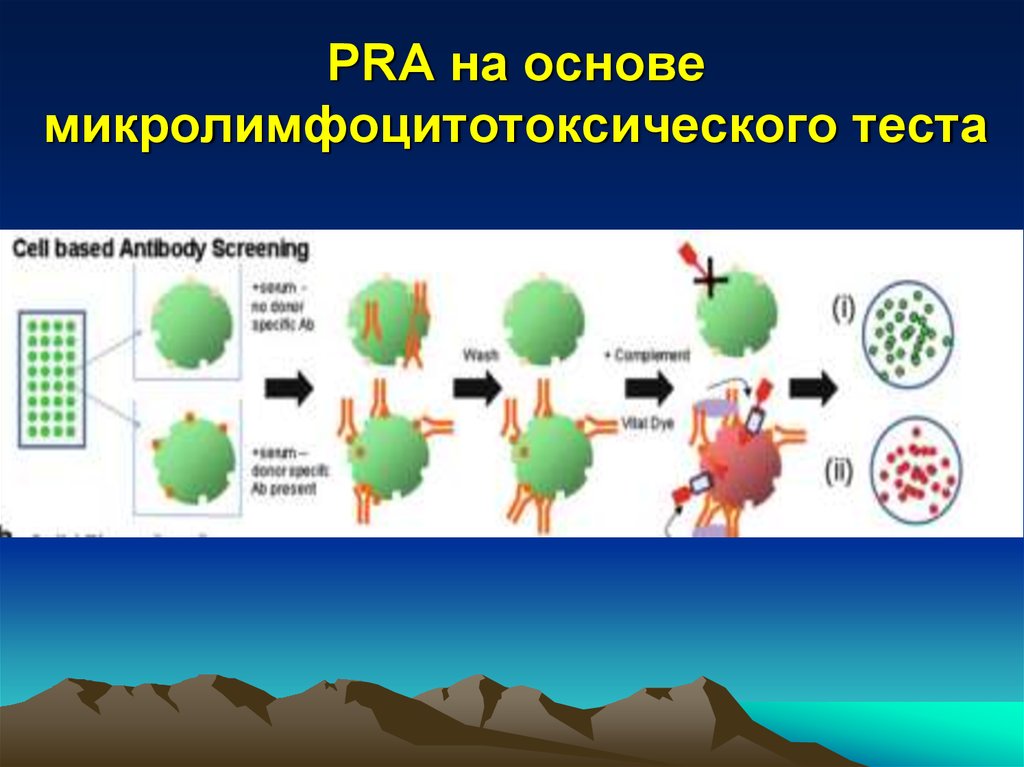
• Микролимфоцитотоксический тест
(CDC-тест)
• Анализ ДНК
19. CDC - Complement Dependent Cytotoxicity test
20. Характеристика CDC - теста
Преимущества:• Простота выполнения
• Скорость получения результата
Недостатки:
• Выявляют ограниченное количество HLA антигенов
• Должны
быть
использованы
живые
лимфоциты обязательно в день взятия
• Тест не применим у пациентов с малым
количеством лимфоцитов и подавленной
лимфоцитарной активностью
21. Какие HLA имеют решающее значение в исходе трансплантации
• При трансплантации почки —HLA-A > HLA-B > HLA-DR > HLA-С
• При трансплантации КМ —
HLA-DR > HLA-А > HLA-В > HLA-С
22. Тестирование гистосовместимости
• Типирование HLA• Скрининг на наличие у реципиента
анти- HLA антител
• Тест на совместимость донора и
реципиента (crossmatching)
23. Анти HLA - антитела
• Образуются при сенсибилизации:- переливание крови
- беременность
- предшествующие трансплантации
- инфекции
• Обусловливают сверхострое отторжение
• Определение анти HLA – антител у
потенциальных
реципиентов
абсолютно
необходимо!
24. Антитела на Т и В-лимфоцитах и их клиническая значимость
АнтителаНа Тклетках
+++
На Вклетках
++++
Ассоциация с
отторжением
Да
Анти-HLA DR
-
++++
Да
Анти-эндотел.
кл-ки
Аутоантитела
Иммунные
комплексы
Fc-R связыв.
-
-
Да
+
-
++
++
Нет
Нет
Анти-HLA А, В,
С
25. Скрининг антител (панель реактивных антител)
• Позволяет определить степень аллосенсибилизации(% из панели реактивных АТ) у потенциального
реципиента.
• Пациенты с высоким % PRA (80-100%) имеют высокую
вероятность позитивной crossmatch (высокий риск
ранней потери трансплантата).
• PRA = 0% не исключает реакций отторжения
• Рекомендуется проводить с периодичностью не менее
1 раз в 3 месяца у реципиентов на «листе ожидания».
• При трансплантации солидных органов результаты
PRA более важны, чем совместимость по HLA
26. Методы тестирования предсуществующих АТ (PRA)
• Микролимфоцитотоксический тест (CDC – тест )Недостатки:
выявляет
только
комплементфиксирующие АТ
Ложноотрицательные
результаты
(при
низкой
плотности АТ на клетках)
Ложно-положительные результаты в результате
наличия не-HLA-АТ
Высокая вариабельность (лейкоциты случайных
волонтеров)
• Иммунохимические твердофазные тесты (ELISA)
Недостатки:
Ограниченное количество HLA
Неспособность выявлять не HLA -АТ
• Проточная цитофлуориметрия (flow PRA)
27. PRA на основе микролимфоцитотоксического теста
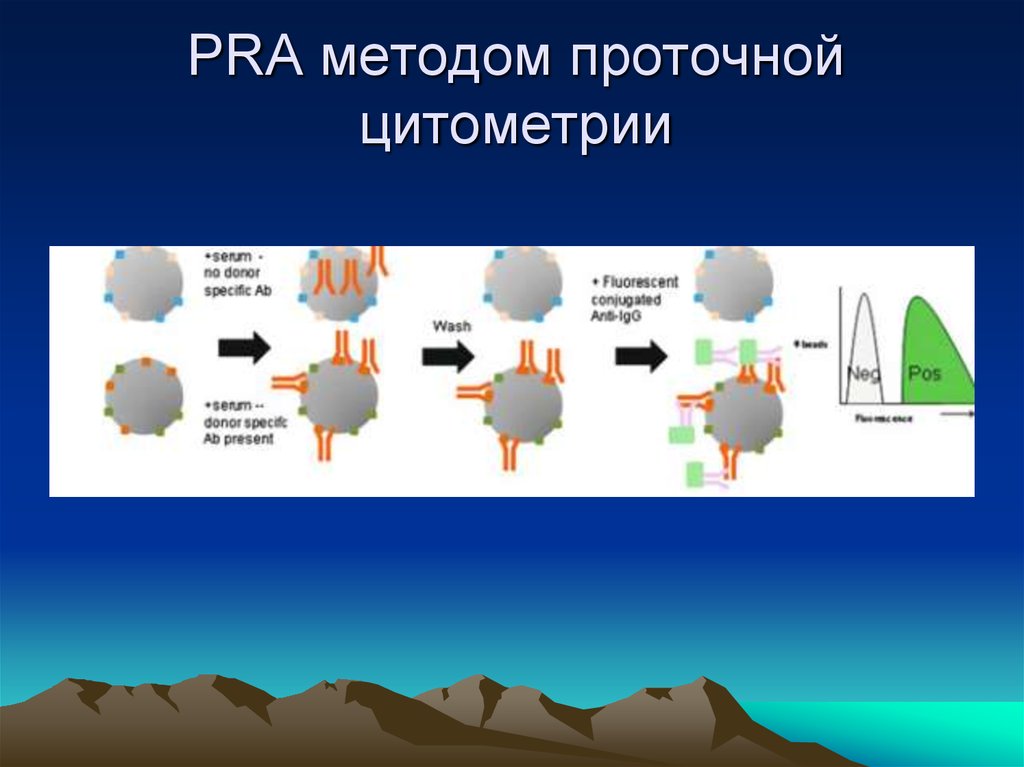
28. PRA методом проточной цитометрии
29. Метод проточной цитофлуориметрии
Преимущества
высокая чувствительность и специфичность
Возможность
проводить
одновременно
анализ Т- и В клеток.
В перспективе отрицательный результат flow
PRA отменяет необходимость crossmatch
Используют
для
мониторинга
сенсибилизации в посттрансплантациеонном
периоде
30. Тестирование гистосовместимости
• Типирование HLA• Скрининг на наличие у реципиента
анти- HLA антител
• Тест
на
индивидуальную
совместимость донора и реципиента
(crossmatch)
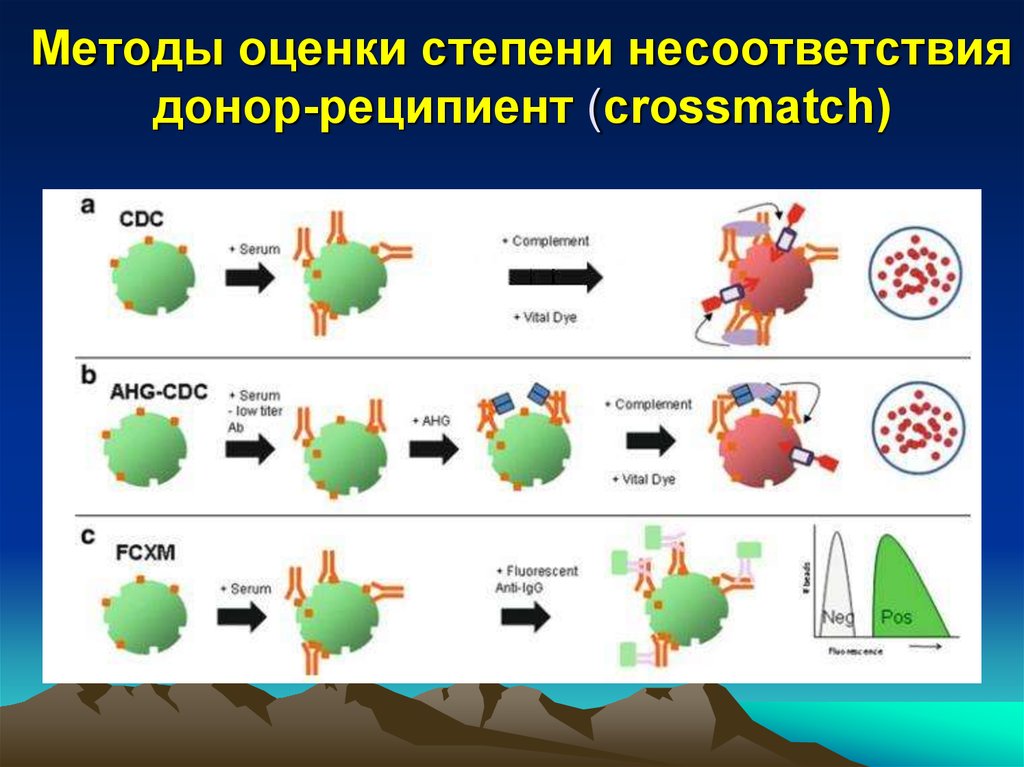
31. Методы оценки степени несоответствия донор-реципиент (crossmatch)
32. Виртуальный crossmatch
33. Клиническое применение результатов crossmatch
• Положительная реакция CDC - предикторсверхострого отторжения, трансплантация не
целесообразна
• При отрицательном результате CDC, но
положительном flow –
трансплантация не
целесообразна у пациентов высокого риска.
Может быть проведена на фоне усиленной
иммуносупрессии
(при
ограниченной
возможности выбора трансплантата)
• Виртуальная crossmatch рассматривается как
более чувствительная и специфичная для
оценки трансплантационного риска































 medicine
medicine








