Similar presentations:
Отдаленные последствия радиационного облучения
1. Отдаленные последствия радиационного облучения
Выполнила:Студентка 4 курса
Медико-биологического факультета
Отделения: мед.биохимия группы 3.4.11
Агеева Ф.А.
2. Радиобиологические эффекты
• — это функциональные и морфологические изменения, развивающиеся ворганизме в результате воздействия на него ионизирующего излучения.
Биологические эффекты различны, и зависят от вида и интенсивности
облучения.
К биологическим эффектам ионизирующего излучения относятся:
1. Эффект естественного радиационного фона.
2. Эффект малых доз.
3. Эффект больших доз
3. Отдаленные последствия облучения
• — детерминированные и стохастические эффекты, проявляющиеся через длительноевремя (несколько месяцев или лет) после одноразового или в результате хронического
облучения.
В основе отдаленных последствий облучения лежат 3 типа нарушений, возникающих
в клетках под непосредственным воздействием ионизирующих излучений:
1) Гибель части стволовых клеток в системах клеточного самообновления –
невосполнимая утрата части их приводит к развитию гипопластических прцессов.
(Анемия, анацидный гастрит, атрофические изменения в гонадах)
2) Длительное хранение (консервация) ненаследственных изменений в клетках таких
как нервная, мышечная.
3) Нелетальные наследственные нарушения, затрагивающие один из гомологичных
локусов.
4.
Отдалённые эффекты можно разделить на:
1. Генетические последствия
* По тому, у кого проявляются признаки:
1. Соматические (проявляющиеся в облученном организме)
2. Генетические (наблюдаемые у потомства)
* Пороговые или беспороговые.
Стохастические эффекты — последствия, носящие вероятностный, случайный характер. Вероятность их проявления существует
при облучении в малых дозах ИИ. С их увеличением она возрастает, но при этом тяжесть течения процесса от них не зависит. К
ним относятся:
2. Опухолевые эффекты
2.1 Гормонозависимые опухоли(матки, молочных желёз, щитовидной железы, яичника, гипофиза)
2.2 Гормононезависимые опухоли( печени, лёгких, костей и лейкозы)
Нестохастические (детерминированные) эффекты — последствия, проявляющиеся после накопления в организме дозы
облучения, превышающей пороговую. В этом случае тяжесть поражения зависит от дозы. К ним относятся:
• 1. Гипопластические и апластические процессы
• 2. Склеротические процессы (цирроз печени, нефросклероз, пневмосклероз (>40-50 Гр, сначала через 4-6 мес развивается
пневмония, затем склероз (что имеет место после радиотерапии)),очаговая или диффузная глиальная реакция в головном мозге,
артериосклероз, кожные фиброзы – хронический лучевой дерматит, лучевая катаракта)
• 3. Дисгормональные состояния (ожирение, эстрогенизм, альдостерониз )
• 4. Преждевременное старение и сокращение продолжительности жизни
5. Генетические (наследственные) эффекты облучения
• вызванные ионизирующим излучением биологические эффекты,обусловленные повреждением генома (появление доминантных и
рецессивных генных мутаций) половых клеток облученного организма
и проявляющиеся у его потомства.
• Ионизирующее излучение вызывает мутации любого рода — от
точечных замен до хромосомных аберраций и разрывов.
6. Опухолевые эффекты.
• Основной причиной злокачественной трансформации облученнойклетки являются нелетальные повреждения генетического материала.
Наиболее распространена гипотеза, в соответствии с которой под
влиянием облучения повышается нестабильность ядерной ДНК. В
процессе репарации ее нелетальных повреждений возникают условия,
способствующие включению онковируса в геном соматической клетки
или активации онковируса, уже находившегося в репрессированном
состоянии в составе генома, с последующей раковой трансформацией.
7. Лейкозы.
• Проявляются раньше других, они становятся виновниками летальныхисходов уже через 10 лет после обучения. Среди людей, подвергшихся
действию проникающей радиации после бомбардировок Хиросимы и
Нагасаки, смертность от лейкозов пошла на убыль только после 1970
года. Согласно данным НКДАР ООН (Научного комитета по действию
атомной радиации), вероятность заболевания лейкозом составляет 1
шанс из 500 при получении дозы облучения 1 Гр.
8.
• Среди наиболее впечатляющих цифр могут быть приведены данные о заболеваемости лейкозомяпонцев всех возрастных групп на 1945 г. — 12,8 на млн. жителей в год, и данные о
заболеваемости лейкозом пострадавших, находившихся на расстоянии до 1500 м от эпицентра —
458 на 1 млн. Заболеваемость среди находившихся на расстоянии до 1000 м оказалась еще в 3 раза
выше. Имеется указание, что для детей 0—9 лет при расстоянии от 1000 до 1 1500 м показатель
заболеваемости оказался в 1,5 раза выше, чем средний, и составлял 673 на 1 млн.
• Вторым важным выводом, сделанным на основании изучения атомных бомбардировок, были
данные о длительности латентного периода для радиационных лейкозов. Оказалось, что он имеет
значительную протяженность во времени. Минимальные сроки латентного периода
приближались к трем годам, средние составляли от 4 до 8 лет, а точные границы максимальных
сроков еще не могут быть установлены с точностью, так как до настоящего времени среди лиц,
переживших атомную бомбардировку, наблюдаются лейкозы.
• Третьим важным выводом, сделанным при изучении лейкозов в Хиросиме и Нагасаки, явилось
приблизительное определение дозы облучения, удваивающей частоту лейкозов в группе
облученных людей. Эта доза составляет около 50 р. В то же время не удалось установить
минимальной дозы облучения, приводящей к лейкозогенному эффекту.
• Выявлена закономерность: чем в более молодом возрасте облучается человек, тем короче
латентный период до возможного развития лейкоза или другой опухоли. С повышением дозы
облучения частота лейкозов нарастает.
9. Формализованное распределение во времени регистрации острых лейкозов в когорте пострадавших при атомных взрывах в Японии в
зависимости от возрастаоблученных
в
момент
бомбардировки [Isimaru M.
et al.]. Возраст в момент
облучения: 1 —менее 15
лет; 2 — от 15 до 29 лет; 3
— от 30 до 34 лет; 4 —
более 45 лет.
10.
• Среди ликвидаторов рассматривались два периода наблюдения: 1986-1996 годы и1997-2003 годы. Если сравнить по частоте заболеваемости лейкозами только две
группы ликвидаторов, получивших дозы внешнего облучения до 150 мГр и более
150 мГр, то можно обнаружить, что в течение первых десяти лет наблюдения
заболеваемость лейкозами во второй группе, (при дозах более 150 мГр) была в 2,2
раза выше, чем в первой. Вместе с тем во второй период наблюдения (1997-2003
годы) отличия между указанными выше группами по частоте заболеваемости
лейкозами не выявлено. Среди детей и взрослых людей, проживающих в
зараженных районах, такое возрастание не было четко продемонстрировано. На
основе данных о людях, выживших после взрывов бомб в Японии, можно
предположить, что сейчас, спустя более 30 лет после катастрофы, большинство
случаев лейкемии, которые могут быть связаны с Чернобыльской аварией, уже
произошло. Тем не менее, необходимы дальнейшие исследования для получения
более точных данных.
11. Рак щитовидной железы.
• Еще чаще развивается рак щитовидной железы – по информации тогоже НКДАР он поражает 10 человек из каждой тысячи облученных (в
расчете на индивидуальную поглощенную дозу 1 Гр). С такой же
частотой развивается и рак груди у женщин. Правда, оба этих
заболевания, несмотря на злокачественность, приводят к смерти далеко
не всегда: выжить удается 9 из 10 человек, перенесших рак щитовидной
железы, и каждой второй заболевшей раком молочной железы
женщине.
12.
• Значительное увеличение заболеваемости раком щитовидной железы произошлоу людей, которые были детьми и подростками во время аварии на ЧАЭС и
проживали в наиболее зараженных районах Беларуси, Российской Федерации и
Украины. Это было вызвано высокими уровнями радиоактивного йода, который
вырвался из реактора Чернобыльской атомной электростанции в первые дни после
аварии. Радиоактивный йод осел на пастбищах, где паслись коровы, и затем
сконцентрировался в их молоке, впоследствии употребляемом детьми. К тому же,
положение усугублялось общим дефицитом йода в местном рационе питания, что
привело к еще большему аккумулированию радиоактивного йода в щитовидной
железе. Поскольку срок жизни радиоактивного йода является коротким, если бы
люди прекратили давать местное зараженное молоко детям в течение нескольких
месяцев после аварии, вероятно, в большинстве случае не произошло бы
увеличения рака щитовидной железы, индуцированного радиацией. В Российской
Федерации в наибольшей степени подверглись радиационному загрязнению 4
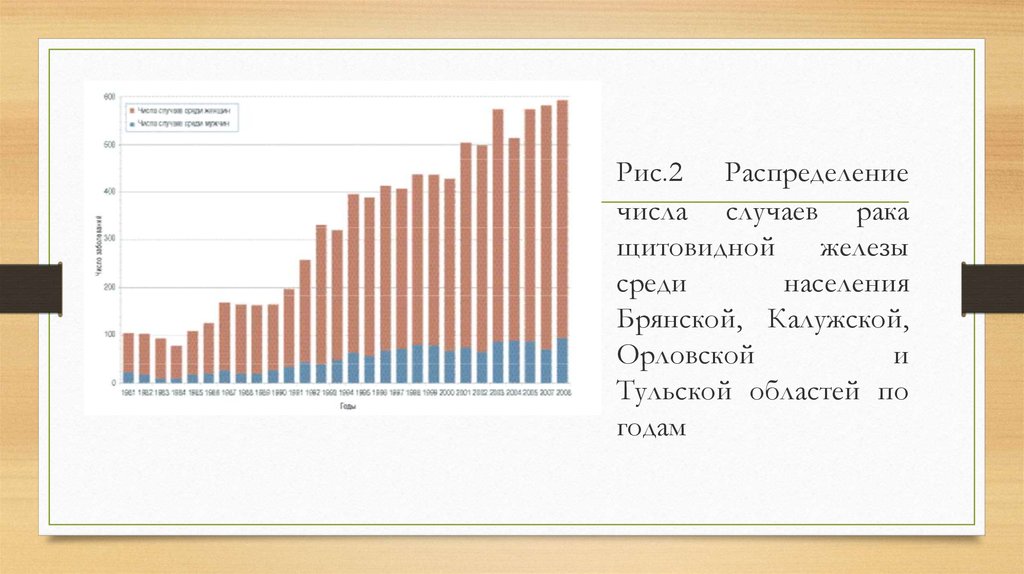
области: Брянская, Калужская, Орловская и Тульская.
13. Рис.1 карта распределения средней полученной дозы облучения щитовидной железы
14. Рис.2 Распределение числа случаев рака щитовидной железы среди населения Брянской, Калужской, Орловской и Тульской областей по
годам15. Рак легких.
• Одно из самых грозных отдаленных последствий, которое проникающаярадиация может вызвать у людей, – это рак легких. Рак легкого развивается
под влиянием длительного вдыхания радиоактивной пыли, а также
газообразных радиоактивных веществ - радона и его продуктов.
• Согласно исследованиям, наиболее высока вероятность заболеть им у
шахтеров урановых родников – в 4-7 раз выше, чем у тех, кто пережил
атомную бомбардировку. По мнению специалистов НКДАР, одна из причин
этого – возраст шахтеров, которые в подавляющем большинстве старше
облученного населения японских городов.
16. Гипопластическая (апластическая) анемия
• - резкое угнетении костномозгового кроветворения, что сопровождается снижениемколичества эритроцитов, лейкоцитов и тромбоцитов.
Предполагают несколько механизмов развития АА:
1.
поражение полипотентной стволовой клетки костного мозга (стволовые клеткиактивно делящиеся клетки). Эта причина является основной;
2.
подавление кроветворения, связанное с воздействием иммунных механизмов
(клеточных, гуморальных); (лимфоциты наиболее радиочувствительные клетки в
периферической крови)
3.
нарушения функционирования элементов микроокружения;
4.
дефицит факторов, стимулирующих кроветворение.
17. Радиационный энтерит и колит
• Воздействие массивного облучения может вызывать энтерит и колитспустя длительное время (иногда - годы) после завершения лучевой
терапии. Пороговая доза для отсроченного повреждения слизистой
оболочки находится в диапазоне 40 Гр. Она не связана с острым
повреждением слизистой оболочки, а является следствием лучевого
поражения мелких сосудов: эндартериит, микротромбы и ишемия
кишки. Все это приводит к возникновению фиброза, отека стенки
кишки с формированием сужения, непроходимости сосудов слизистой
оболочки с ее вторичным повреждением.
18. Поражение половых клеток.
• Облучение малыми дозами не приводит к структурным изменениямсеменников. При местном облучении большими дозами (5 Гр и более)
отмечаются постепенное уменьшение их размеров и гибель спермиогенного
эпителия. Дегенеративные изменения в паренхиме железы при тяжелой
форме острой лучевой болезни наступают на 2...3-й день после облучения.
Первоначально поражаются спермиогонии, затем спермиоциты I и II
порядков. Спермиды и зрелые спермии повреждаются в последнюю очередь.
• У выживших - спермиогенез восстанавливается за счет сохранившихся
спермиогонии, однако при этом отмечается большой процент дефектных
спермиев, а в паренхиме семенников — развитие склеротических процессов.
19.
• Лучевые поражения яичников.• У организмов раннего возраста и в период полового созревания яичники более
радиочувствительны, чем у половозрелых. У последних, в свою очередь,
радиочувствительность железы зависит от ее функциональной активности.
Например, облучение в период созревания фолликулов вызывает изменения
яичников в большей степени, чем во время роста и развития желтого тела. В
яичнике различают корковое и мозговое вещество. В корковом слое содержится
большое количество половых клеток. При общем облучении у самок возникают
изменения половых циклов, степень и направленность которых зависят от дозы
воздействия. Картина радиационного поражения яичников при однократном
облучении самок полулетальными и более высокими дозами излучений: вначале
наблюдаются повреждения и гибель наиболее радиочувствительных тканевых
элементов железы — зрелых фолликулов, затем дегенерация и гибель первичных
фолликулов и других клеточных элементов. Многократные лучевые воздействия на
яичники приводят к деструкции фолликулярного эпителия и фиброзному
разрастанию соединительной ткани железы.
20.
• Изменения в яичниках при поступлении в организм радионуклидов сравномерным типом распределения в принципе равнозначны поражениям,
которые наблюдаются в железе при общем внешнем облучении. При воздействии
радиации вначале нарушается гормональная функция гонад и других
функционально связанных с ними эндокринных желез. Вслед за этим или
одновременно возникают морфологические изменения половых желез.
Инкреторные сдвиги у облученных самок характеризуются изменением динамики
половых циклов. Известно, что полноту и регулярную смену стадий половых
циклов обеспечивают гонадотропный гормон гипофиза, фолликулярный гормон,
гормон желтого тела и плацента.
• В гуморальной регуляции функции гонад при облучении возникают
дисгормональные состояния. Гормональные сдвиги эндокринных желез часто
сопровождаются пролиферативными процессами в них и в том числе в гонадах,
результатом чего в отдаленный период может быть рост злокачественной опухоли.
Восстановление функции гонад как при остром, так и при хроническом лучевом
поражении идет медленно и параллельно с общим выздоровлением.
21. Лучевая катаракта
• Лучевой катарактой называют помутнение хрусталика, котороевозникает вследствие его повреждения ионизирующим излучением.
• В клинике развития лучевой катаракты принято различать два периода:
• • Латентный или скрытый, который охватывает период времени от
момента непосредственного
признаков заболевания.
облучения
до
проявления
первых
• • Период прогрессирования, продолжающийся вплоть до стабилизации
катаракты либо полного помутнения хрусталика.
22.
• Скорость помутнения хрусталика, продолжительность латентного периода и интенсивность прогрессирования катарактынапрямую зависят от величины дозы полученного облучения, вида излучения, фактора времени, возраста пострадавшего.
Самая маленькая доза однократного бета/гамма воздействия, способного привести к развитию лучевой катаракты,
составляет примерно 200 рад, с поглощением непосредственно в хрусталике; при воздействии дробно, эта доза может
увеличиваться до 400-550 и более рад.
• Особенно большой катарактогенной способностью, в сравнении с другими видами ионизирующего излучения, обладают
нейтроны. При комбинированном однократном гамма-нейтронном воздействии на глаз дозой в 150-700 рад лучевую
катаракту можно клинически обнаружить спустя 2-7 лет. В течение следующих 3-6 лет после выявления первых
проявлений лучевой катаракты образуется различной степени помутнение, что зависит от дозы излучения. Далее развитие
лучевой катаракты приостанавливается, и помутнение медленно распространяется в глубокие слои хрусталиковой коры.
• При дозах свыше 700 рад возникновение лучевой катаракты выявляется спустя 1,5 или 2 года после облучения; в случае
поражения сосудистой оболочки, спустя 2,5 - 3 года после облучения констатируется полное помутнение хрусталика.
• Первичное лучевое поражение хрусталика происходит в герминативной (ростковой) зоне эпителия хрусталика, которая
находится под передней капсулой рядом с экватором.
• Помутнение под передней капсулой хрусталика, состоящее из скопления точечных, штриховидных помутнений и
вакуолей, обычно появляется позже и никогда не достигает такой интенсивности, как у заднего полюса.
• Когда основная масса поврежденных клеток переместится с экватора к полюсам хрусталика, помутнение стабилизируется и
постепенно отодвигается нормально растущими прозрачными хрусталиковыми волокнами от задней капсулы внутрь
хрусталика. В таком состоянии помутнение может оставаться (не прогрессируя) в течение всей последующей жизни
организма. Полное помутнение хрусталика может развиваться в результате лучевого поражения сосудистой оболочки глаза.
Степень понижения остроты зрения зависит от размера помутнения хрусталика.
23. Лучевые повреждения легких
• Лучевые повреждения легких могут развиваться при лучевой терапии рака легких,пищевода, молочной железы и т.д. Предрасполагающими факторами являются
хронические воспалительные заболевания легких. Лучевые повреждения могут развиваться
остро во время лучевой терапии, в ближайшие недели и месяцы после ее окончания и в
более поздние сроки после применения доз более 2000—5000 рад.
• Лучевые повреждения легких возникают в связи с тем, что толерантность легочной ткани к
лучевым воздействиям находится в пределах 35 - 40 Гр, а при лечении злокачественных
опухолей используют суммарные очаговые дозы около 60 - 80 Гр. В ходе лучевого
воздействия на первом этапе поражаются клетки альвеолярного эпителия и эндотелия
капилляров: в результате повреждения альвеолоцитов II типа уменьшается синтез
сурфактанта, повышается поверхностное натяжение альвеол, происходит спадение
альвеолярных стенок; повреждение эндотелиальных клеток капилляров, ведет к
тромбообразованию, изменению тонуса сосудов и обструкции просвета сосуда.
24. Лучевой дерматит (рентгеновский дерматит)
• это воспалительные изменения, происходящие в коже в результатевоздействия ионизирующего излучения.
• При лучевом дерматите под воздействием излучения происходит разрыв или
спазм капилляров, ведущие к нарушению структуры капиллярного русла, что
нарушает микроциркуляцию крови и повышает давление в сосудах. При
нарастании излучения начинаются склеротические процессы, это грозит
возникновением локальной гипоксии.
• Изменения, которые зачастую невозможно обратить, приводят к лучевым
дерматитам, имеющим две формы: острую и хроническую.
25.
• На эпидермисе лучевой дерматит может проявляться в таких формах:• • эритематозная форма. Если доза облучения составляет 8-12 Гр, сопровождается
покраснением, которые проходит через 3-4 дня, выпадают волосы, но начинают расти
через несколько дней ,
• • буллезная. Эта форма болезни появляется при действии облучения в дозе 12-20 Гр,
начинается с эритемы, область поражения болит, на этом месте выпадают волосы,
ощущается жжение, остаются пигментные пятна. Проходит через 6-7 недель
• некротическая. Она проявляется при влиянии на эпителий облучения свыше 25 Гр;
кожа отслаивается, образуются язвы. Самостоятельно, без лечения лучевой дерматит
такого вида не проходит.
26.
27. Дисгормональные состояния.
• Эндокринная система находится в самой тесной связи с нервной системой.Обе регулирующие системы объединяются гипоталамусом, нейросекреторные
клетки которого занимают промежуточное положение между нейронами и
инкреторными клетками желез внутренней секреции.
• В ряду радиочувствительности органов (по функциональному принципу)
эндокринные железы следуют за нервной системой.
• Чувствительность эндокринных желез на лучевой раздражитель является в
основном опосредованной реакцией и осуществляется рефлекторным путем
через нервную систему.
28. Изменения в гипофизе после облучения.
• Вначале после облучения повышается адренокортикотропная функция гипофиза, а вотдаленные сроки наступает ее снижение. При облучении в сублетальных дозах
усиливается тирео- и гонадотропная функции. Летальные дозы резко снижают и
соответственно угнетают гормональную активность щитовидной и половых желез. В
результате нарушения секреции и выделения тропных гормонов гипофиза
регулируемые ими железы могут оказаться в состоянии физиологической изоляции
(разобщенности).
• Морфологические изменения в гипофизе после лучевого воздействия не имеют
четкой специфичности. Обычно отмечают набухание и уменьшение числа
ацидофильных клеток, появление пикнотических ядер в хромофильных клетках,
дегрануляцию и преобразование протоплазмы в гомогенный коллоид. Сдвиги в
гипофизе происходят в результате нарушения в гипоталамо-гипофизарной системе.
29. Изменения в надпочечниках после облучения.
• В первый период (часы, иногда сутки) после облучения в широком диапазоне доз (от0,25 до 50 Гр) наблюдается усиление секреции надпочечниковых желез.
Гиперсекреция коры надпочечников — один из механизмов опосредованных
изменений крови и кроветворных органов. Изменяются масса надпочечников,
величина корковой и мозговой зон, уменьшается содержание липоидных субстанций.
В облученных надпочечниках отмечается возрастание активности кислой фосфатазы,
протеолитических ферментов и развитие деструктивных изменений.
• В коре надпочечников при облучении преобладающую роль, по-видимому, играет
опосредованное влияние радиации, в частности со стороны нервной системы,
гипофиза и других органов. Таким образом, в острый период лучевого поражения
повышается функциональная активность надпочечников, а в последующие сроки
наступает истощение коркового и мозгового вещества и развитие атрофических
процессов.
30. Изменения в щитовидной железе после облучения.
• Первичная реакция ЩЖ на облучение характеризуется гиперфункцией, за которой взависимости от дозы облучения и других условий следует нормализация или
снижение функции. В отдаленные сроки наблюдается дисфункция железы,
выражающаяся периодичностью гипер- или гипофункции. Уменьшается
относительная масса щитовидной железы, преобладают фолликулы крупного
диаметра с низким эпителием и густым коллоидом, появляются деструктивные
изменения в отдельных фолликулах. В мышечной ткани обычно накапливается
большое количество тироксина, и одновременно с этим ускоряется его выведение из
печени. В отдаленные сроки на фоне деструктивных пострадиационных изменений
возможно развитие злокачественных новообразований в щитовидной железе.
• Изменения функциональной активности щитовидной железы при общем внешнем
облучении животных в основном определяются тиреотропной функцией гипофиза.
31. Преждевременное старение и сокращение продолжительности жизни.
• Единого мнения о безусловном влиянии радиации на среднююпродолжительность жизни человека (СПЖ) у современных ученых нет.
Но опыты на грызунах показали, что связь между облучением и более
ранней смертностью есть. После получения дозы 1 Гр
продолжительность жизни грызунов сокращалась на 1-5 %. Длительное
воздействие гамма-излучения приводило к сокращению СПЖ при
накоплении суммарной дозы 2 Гр. Причем смерть в каждом случае
наступала от разных болезней, вызываемых радиацией: склеротических
изменений, злокачественных новообразований, лейкозов и других
патологий.
32.
По оценкам разных ученых сокращение СПЖ человека составляет:
• при кратковременном облучении – 100-1000 суток на 1 Гр;
• при хроническом облучении – около 8 суток на 1 Гр.
При анализе феномена сокращения СПЖ не удается выделить какой-нибудь типичный
патологический процесс, непосредственно приводящий облученных животных к
преждевременной гибели. В тех случаях, когда причину смертельного исхода у отдельных
особей удавалось связать с каким-то конкретным патологическим процессом, это мог быть
и сосудистый криз, и новообразование, и склеротические изменения, и лейкоз и т.д.
• Основной причиной сокращения СПЖ после облучения в сублетальных дозах в
настоящее время называют повреждение капилляров и мелких артериол, нарушения
микроциркуляции, приводящие к гипоксии и гибели паренхиматозных клеток,
преимущественно, в органах иммунитета и железах внутренней секреции. Отчасти
сокращение СПЖ может быть связано с более частым развитием у облученных
злокачественных новообразований.
































 biology
biology








