Similar presentations:
Электронное строение элементов главной подгруппы III группы
1. 3А
Дженикян А.СГруппа Т-10415
2. Электронное строение элементов главной подгруппы III группы
Электронное строение элементовглавной подгруппы III группы
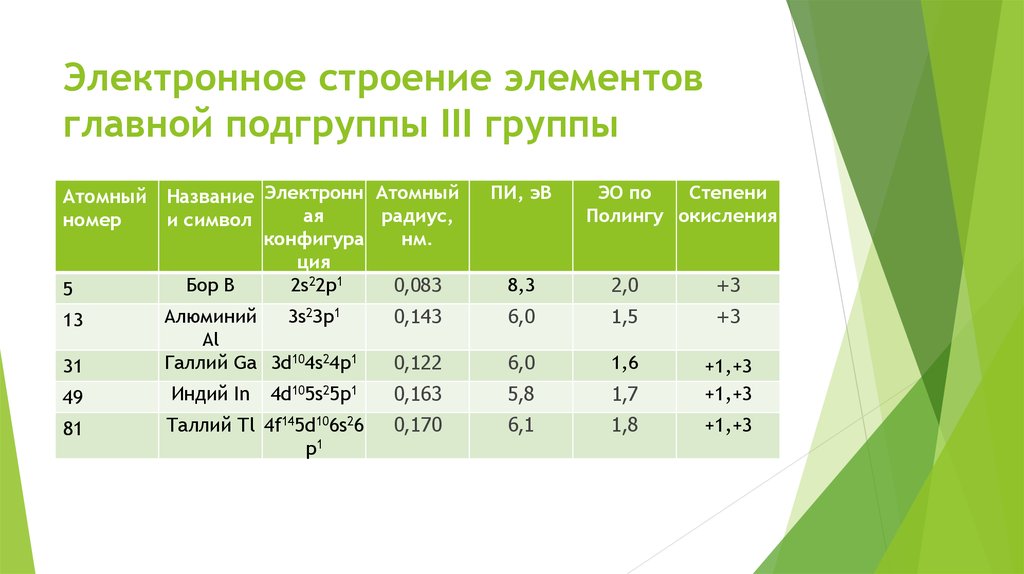
Атомный
номер
5
13
31
Название Электронн Атомный
ая
радиус,
и символ
конфигура
нм.
ция
Бор В
2s22р1
0,083
Алюминий
3s2Зр1
Аl
Галлий Gа 3d104s24р1
49
Индий In
4d105s25р1
81
Таллий Тl 4f145d106s26
р1
ПИ, эВ
ЭО по
Степени
Полингу окисления
8,3
2,0
+3
0,143
6,0
1,5
+3
0,122
6,0
1,6
0,163
5,8
1,7
+1,+3
+1,+3
0,170
6,1
1,8
+1,+3
3. Al — Алюминий
Алюминий — основной представительметаллов главной подгруппы III группы
Периодической системы. Свойства его
аналогов — галлия, индия и таллия —
напоминают свойства алюминия,
поскольку все эти элементы имеют
одинаковую электронную конфигурацию
внешнего уровня ns2nр1 и могут
проявлять степень окисления +3.
Свойства: алюминий — типичный
металл, кристаллическая решетка
кубическая гранецентрированная,
параметр а = 0,40403 нм. Температура
плавления чистого металла 660°C,
температура кипения около 2450°C,
плотность 2,6989 г/см3. Температурный
коэффициент линейного расширения
алюминия около 2,5·10–5 К–1.
Стандартный электродный потенциал
Al3+/Al — 1,663В.
4. Al — Алюминий
Алюминий – химически активный металл, но прочная оксидная пленкаопределяет его стойкость при обычных условиях. Практически во всех
химических реакциях алюминий проявляет восстановительные свойства.
5. Химические свойства Al
Взаимодействие с водой2Al + 6H2O = 2Al(OH)3 + 3H2
Взаимодействие с кислотами
2Al + 6HCl = 2AlCl3 + 3H2
Взаимодействие с галогенами
2Al + 3Cl = 2AlCl
Взаимодействие с O2
4Al + 3O2 = 2Al2O3
Взаимодействие с S
2Al + 3S = Al2S3
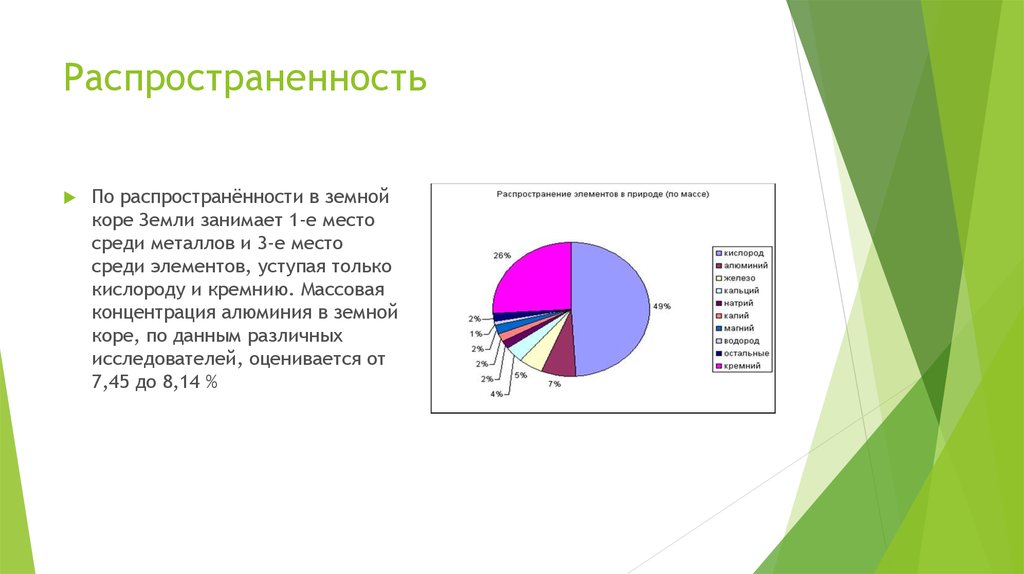
6. Распространенность
По распространённости в земнойкоре Земли занимает 1-е место
среди металлов и 3-е место
среди элементов, уступая только
кислороду и кремнию. Массовая
концентрация алюминия в земной
коре, по данным различных
исследователей, оценивается от
7,45 до 8,14 %
7. Природные соединения алюминия
В природе алюминий, в связи с высокой химической активностью, встречаетсяпочти исключительно в виде соединений. Некоторые из природных минералов
алюминия:
Бокситы — Al2O3 · H2O (с примесями SiO2, Fe2O3, CaCO3)
Нефелины — KNa3[AlSiO4]4
Алуниты — (Na,K)2SO4·Al2(SO4)3·4Al(OH)3
Глинозёмы
Корунд — Al2O3
Полевые шпаты — (K,Na)2O·Al2O3·6SiO2, Ca[Al2Si2O8]
Каолинит — Al2O3·2SiO2 · 2H2O
Берилл — 3ВеО · Al2О3 · 6SiO2
Хризоберилл — BeAl2O4.





 chemistry
chemistry








