Similar presentations:
Лабораторная диагностика воздушно-капельных инфекций
1. Лабораторная диагностика воздушно-капельных инфекций
2. Воздушно-капельные инфекции
Воздушно-капельные инфекции – инфек-ционные заболевания с аэрозольным механизмом передачи , протекающие с преимущественным поражением различных
отделов дыхательного тракта и характеризующиеся воспалением в месте входных
ворот , лихорадкой и интоксикацией .
3. Воздушно-капельные инфекции
Механизм передачи-аэрозольный.Пути передачи:
- Воздушно-капельный путь
- Воздушно-пылевой
Входные ворота: слизистая оболочка
верхних и нижних дыхательных путей.
4. Аэрозольный механизм передачи
5. Этиология воздушно-капельных инфекций
1.Вирусы:
Вирусы гриппа
Вирус парагриппа 1,2,3 и 4 типа.
Респираторно-синцитиальный
вирус
Риновирус
Коронавирус
6. Этиология воздушно-капельных инфекций
БокавирусМетапневмовирус
Аденовирус серогрупп А , В , С.
Вирус кори (Morbillivirus)
Вирус краснухи (Rubella)
Парвовирус В19
7. Этиология воздушно-капельных инфекций
Вирус ветряной оспы (ВГЧ 3 типа)Вирус герпеса человека 6 типа (ВГЧ 6 типа)
Вирус Эпштейн-Барр (ВГЧ 4 типа)
Вирус эпидемического паротита
Подавляющая часть ОРЗ вызывается вирусами.
8. Этиология воздушно-капельных инфекций
2. Бактерии:Дифтерийная палочка (Corynebacterium
diphtheriae)
Коклюшная палочка (Bordetella pertussis)
Паракоклюшная палочка (Bordetella
parapertussis)
Bordetella bronchiseptica
9. Этиология воздушно-капельных инфекций
Менингококк (Neisseria meningitidis)Гемофильная палочка (Haemophilus
influanzae гр. В )
β-гемолитический стрептококк серогруппы
А –Streptococcus pyogenes.
β- гемолитические стрептококки других
серогрупп : С , G и В.
10. Этиология воздушно-капельных инфекций
Пневмококк – Streptococcus pneumoniaeMycobacterium tuberculosis
Mycoplasma pneumoniae
Chlamydophila pneumoniae
Chlamydophila psittaci –возбудитель
орнитоза.
Legionella pneumophila-возбудитель
легионеллеза
11. Лабораторная диагностика ВКИ вирусной этиологии
Вирусологический методМолекулярно-генетический метод:
- ПЦР в классическом варианте.
- ПЦР в реальном времени.
Инфекционная иммунодиагностика:
- Выявление антигенов вирусов методом
ИФА , люминесцентным методом.
- Выявление отдельных классов антител к вирусам методом ИФА.
Лабораторная диагностика должна быть комплексной!!!
12. Лабораторная диагностика ВКИ бактериальной этиологии
Показания к исследованию:Острые и хронические тонзиллиты.
Острые и хронические фарингиты и
назофарингиты.
Острый и хронический ринит.
Острый и хронический синусит.
Острый средний отит.
Острый и хронический трахеобронхит и бронхит.
Пневмонии
13. Методы исследования на бактериальные возбудители ОКИ
Бактериологический метод – «золотой»стандарт.
Молекулярно-генетический метод – ПЦР
в реальном времени.
Иммунологические методы:
- Выявление антигенов бактерий в материале.
- Выявление отдельных классов антител в
крови к данному возбудителю.
14. Исследуемый материал
Мазки из зева ( с миндалин)Мазки из носа
Мазки из носоглотки
Пунктат пазух
Мокрота
Промывные воды бронхов
Бронхоальвеолярный лаваж
15. Правила взятия материала для исследования на ВКИ.
Исследуемый материал забирается доначала антибактериальной терапии и
назначения местного лечения.
Материал из дыхательных путей берется
натощак или не ранее , чем через 2 часа
после еды.
Мазки забираются на границе здоровой
и пораженной ткани.
16. Дифтерия
Дифтерия -антропонозное заболевание , характери-зующееся фибринозным воспалением в месте
входных ворот и поражением внутренних органов за
счет продукции токсина.
Клинические формы : -Дифтерия зева.
-Дифтерия носа.
-Дифтерия гортани.
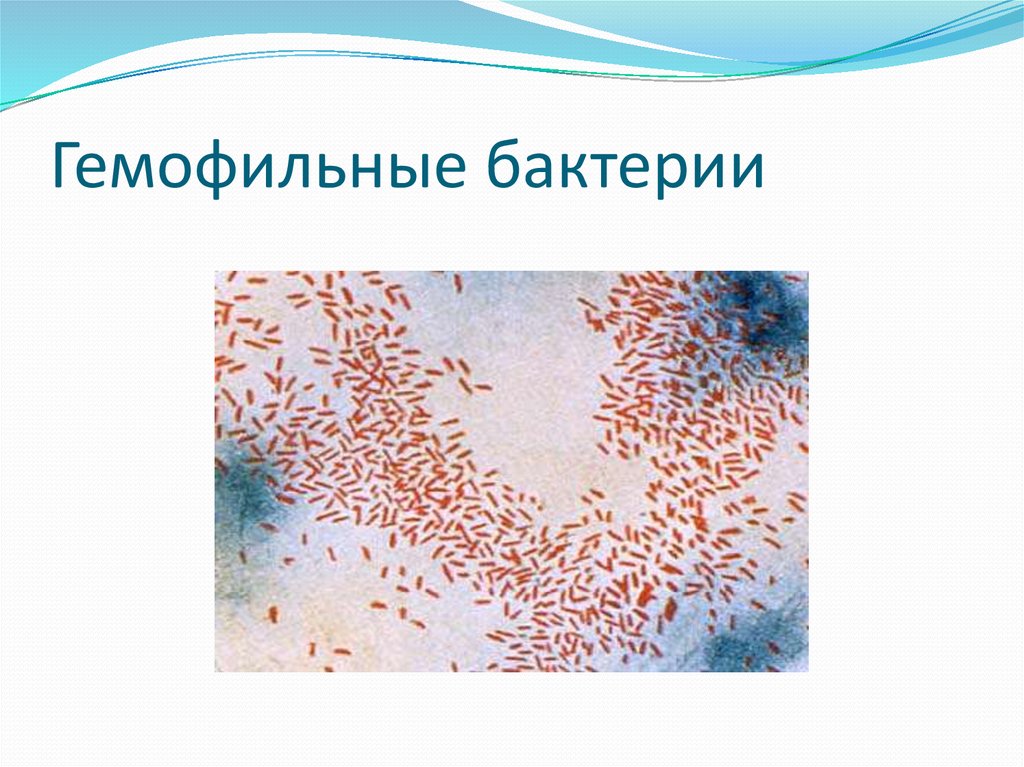
-Дифтерия глаза.
-Дифтерия гениталий.
-Дифтерия кожи (ран)
17. Дифтерия зева
18. Этиология дифтерии
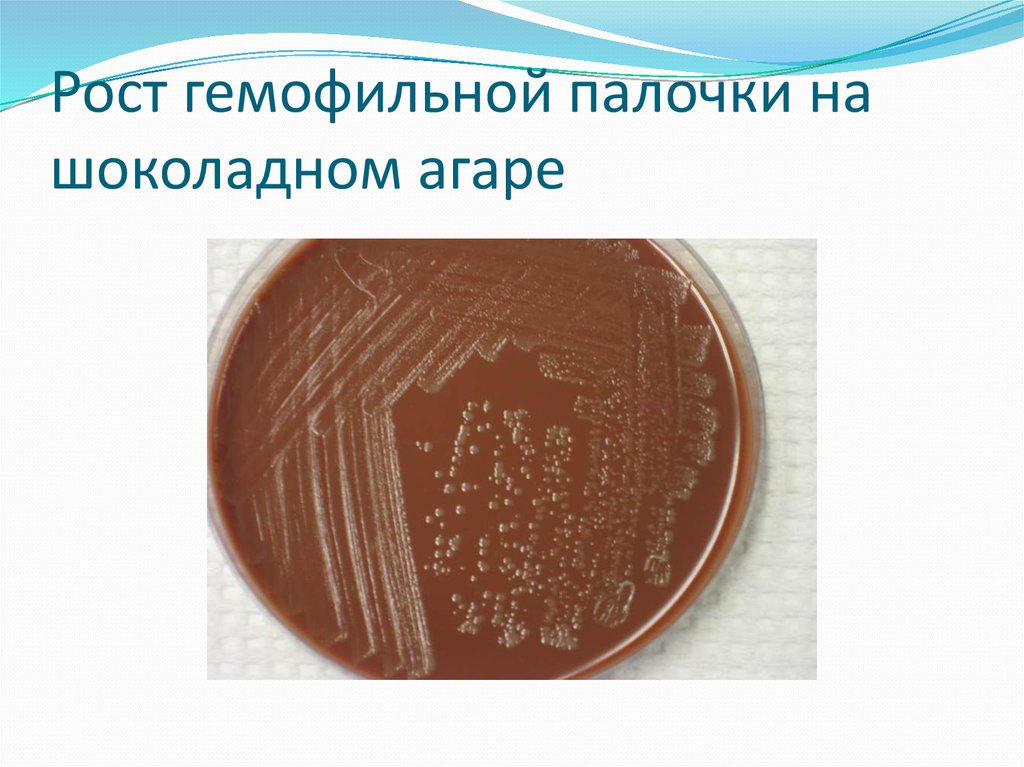
Возбудитель – токсигенные штаммы дифтерийнойпалочки (Corynebacterium diphtheriae).
Нетоксигенные штаммы заболевания не вызывают.
Тонкие,иногда слегка изогнутые Грам(+) палочки ,
распологающиеся под углом, часто содержащие
метахроматические зерна: при окраске щелочным
метиленовым синим окрашиваются в фиолетовый
цвет в отличие от светло-синего цвета всей клетки.
Характерен полиморфизм.
19. Сorynebacterium diphtheriae
20. Corynebacterium diphtheriae
C.diphthereiae растут на питательных средах, сбалансированных посвоему составу, и не растут на простых питательных средах.
Требуется кровь любого животного или человека (донора), как
источник аминокислот, ростовых факторов, железа и пр. Не всегда
коммерческие среды удовлетворяют этим требованиям, поэтому
контроль качества питательных сред и всех ингредиентов в
лабораториях обязателен.
Кровяные теллуритовые среды (КТА, Клауберг II) остаются
лучшими селективными дифференциально-диагностическими
средами, обеспечивающими рост колоний через 24 ч, что на одни
сутки сокращает сроки выдачи окончательного
бактериологического ответа.
КТА прост в приготовлении: основой этой среды является
коммерческий сухой питательный агар (СПА), в качестве
кровяных добавок используют кровь, однако не исключены любые
гемолизированные кровяные добавки
21. Питательные среды для выделения Corynebacterium diphtheriae
Питательные среды общего назначения:5% кровяной агар на основе бараньей крови
Специальные питательные среды:
Элективные(Селективные) среды:
1.Кровяной теллуритовый агар.
Основакоринебакагар+гемолизированнаякровь
(барана,лошади,кролика,донора)и 0,03-0,04%
теллурита калия, который подавляет сопутст вующую микрофлору.
2.Среда Клауберга 2
22. Рост Corynebacterium diphtheriae на 5% кровяном агаре.
23. Правила взятия и транспортировки материала на дифтерию
Эффективность проведения бактериологическогоисследования в значительной степени зависит от
своевременного правильного взятия материала и
соблюдения сроков доставки его в
бактериологическую лабораторию.
Для взятия материала используют коммерческие
стерильные сухие ватные (или дакроновые)
тампоны, также возможно их приготовление в
лабораторных условиях с учетом требований
нормативных документов. Тампоны должны иметь
форму "капли", а не "веретена
24. Правила взятия материала на дифтерию
Материал из ротоглотки и носа берут отдельнымитампонами, натощак или не ранее чем через 2 ч после
еды, а также до применения полоскания или других
видов лечения.
Взятие материала осуществляют при хорошем
освещении, с использованием шпателя, не касаясь
тампоном языка и внутренних поверхностей щек и
зубов.
Одним тампоном собирают материал с участков
ротоглотки - миндалин, дужек мягкого неба, небного
язычка, при необходимости - с задней стенки глотки.
При наличии налетов патологический материал
следует брать с границы пораженных и здоровых
тканей, слегка нажимая на них тампоном.
25. Правила взятия материала на дифтерию
Для взятия материала из носа используют другойтампон, который вводят глубоко сначала в один, а
потом в другой носовой ход, собирая материал со
стенок и перегородки носа, при этом не касаясь
крыльев носа снаружи.
При дифтерии других локализаций (глаза, уши,
кожа, раны, гениталии и пр.) помимо материала из
пораженных участков забирают материал из
ротоглотки и носа
26. Доставка материала для исследования на дифтерию
Тампоны должны быть доставлены в лабораторию непозднее чем через 3 ч после взятия материала. В холодное
время года для предотвращения замерзания исследуемый
материал доставляют в бактериологическую лабораторию
в сумках-термосах.
Не допускается использование коммерческих
транспортных сред, предназначенных для исследования
на микрофлору ротоглотки и носа, в связи с тем, что состав
этих сред не удовлетворяет условиям культивирования
возбудителя дифтерийной инфекции, что приводит к
потере патологического материала.
27. Доставка материала для исследования на дифтерию.
При невозможности доставки исследуемогоматериала в баклабораторию в установленные сроки
(не позднее 3 ч) или проведения обследования в ЛПО
во второй половине дня материал из ротоглотки
(зева) и носа засевают "площадкой" с последующим
рассевом на одну чашку Петри с питательной средой,
разделенной пополам ("чашечный метод"). Посевы
помещают в термостат при 37 °С до утра следующего
дня, после чего доставляют в сумках-термосах в
баклабораторию (с указанием времени посева
материала).
28. Схема посева на BL
Посев от одного лица производят на одну чашку,используя при этом половину поверхности чашки
среды для посева материала из ротоглотки (зева), а
вторую - для посева материала из носа.
При посеве материала с кожи или других
пораженных мест добавляют еще одну чашку (все
чашки маркируются). Не допускается посев
материала от нескольких лиц на одну чашку!
29. Cхема посева на BL
При посеве материал тщательно втирают в среду со всехсторон тампона на участке площадью 2 x1 см у края чашки,
стараясь оставить весь патологический материал на
поверхности формируемой "площадки". Формирование такой
"площадки" является обязательным, что позволяет сохранить
исследуемый материал, находящийся на тампоне.
Дальнейший рассев исследуемого патологического материала
осуществляют этим же тампоном, не отрывая тампон от
поверхности питательной среды, засевая оставшуюся
поверхность чашки, что позволяет получить изолированные
колонии (чистую культуру) для дальнейшей идентификации
непосредственно с чашки первичного посева
30. Cхема бактериологического исследования на дифтерию.
Засеянные чашки с плотной питательной средой помещают втермостат для инкубации при 37 °С.
Чашки с колониями, "подозрительными" на дифтерийные,
отбирают для дальнейшей идентификации культуры по всем
тестам. "Подозрительные" колонии на кровяно-теллуритовых
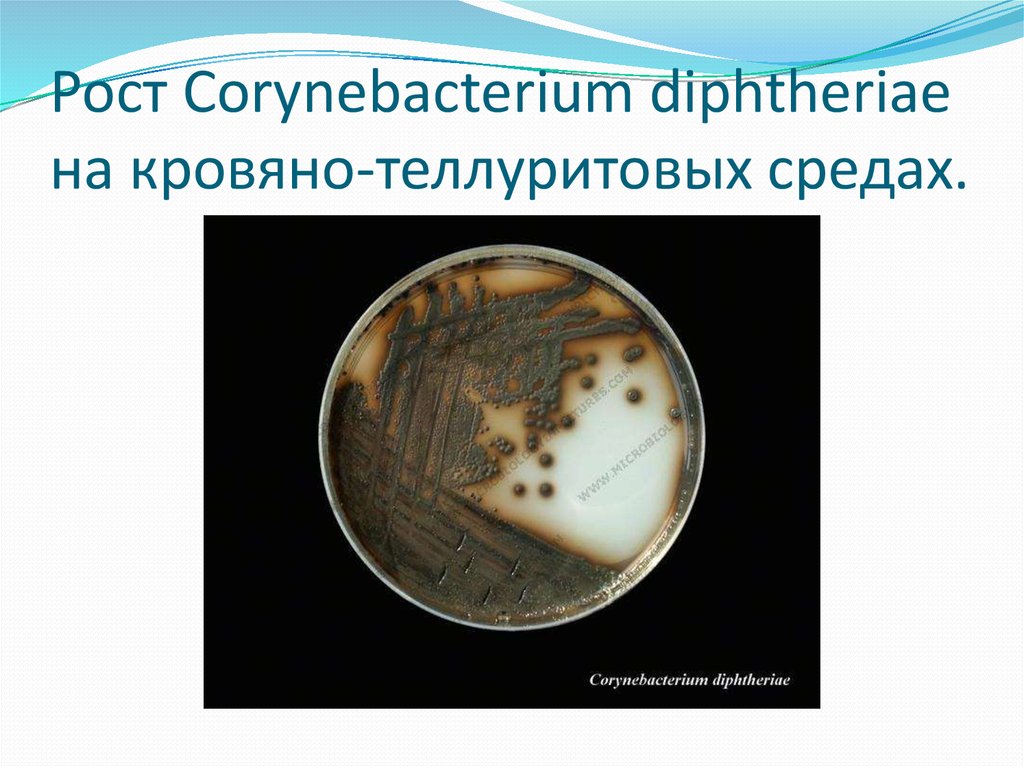
средах (КТА) через 24 ч роста - темно-серого или серо-черного
цвета, выпуклые, округлой формы, непрозрачные, с ровными
краями или с легкой изрезанностью края или радиальной
исчерченностью, мягкой, маслянистой консистенции; через
48 ч окончательно формируется типичная морфология
(архитектоника) колоний - серо-черного или черного цвета с
металлическим оттенком ("цвет мокрого асфальта"),
непрозрачные, матовые, приподнятые с выпуклым центром
или выпуклые, округлой формы.
31. Рост Corynebacterium diphtheriae на кровяно-теллуритовых средах.
32. Схема бактериологического исследования на дифтерию.
Проводится идентификация подозрительных надифтерию колоний по культуральным , морфологическим ,тинкториальным и биохимическим
свойствам.
Обязательно проводится определение токсигеннных свойств выделенной культуры на среде
ОТДМ и отношение к крахмалу.
33. Определение токсигенности дифтерийной палочки
34. Коклюш.
Коклюш – инфекционное заболевание ,продолжающеесяминимум 2 недеи ,без явлений интоксикации и повышения
температуры тела ,протекающее с приступообразным кашлем
,усиливающимся ночью и по утрам ,сопровождающееся
покраснением лица ,шумными вдохами (репризами)
,заканчивающмся отхождением вязкой слизи или рвотой в
конце приступа кашля.
Заболевание протекает циклично со сменой ряда периодов:
- Инкубационный период (7-8 дней)
-Предсудорожный период (Катаральный) -3-14 дней ,сухой
навязчивый кашель на фоне нормальной температуры тела.
-Период судорожного кашля (от 2-3 нед до 6-8 нед)
- Период реконвалесценции.
35.
36. Этиология.
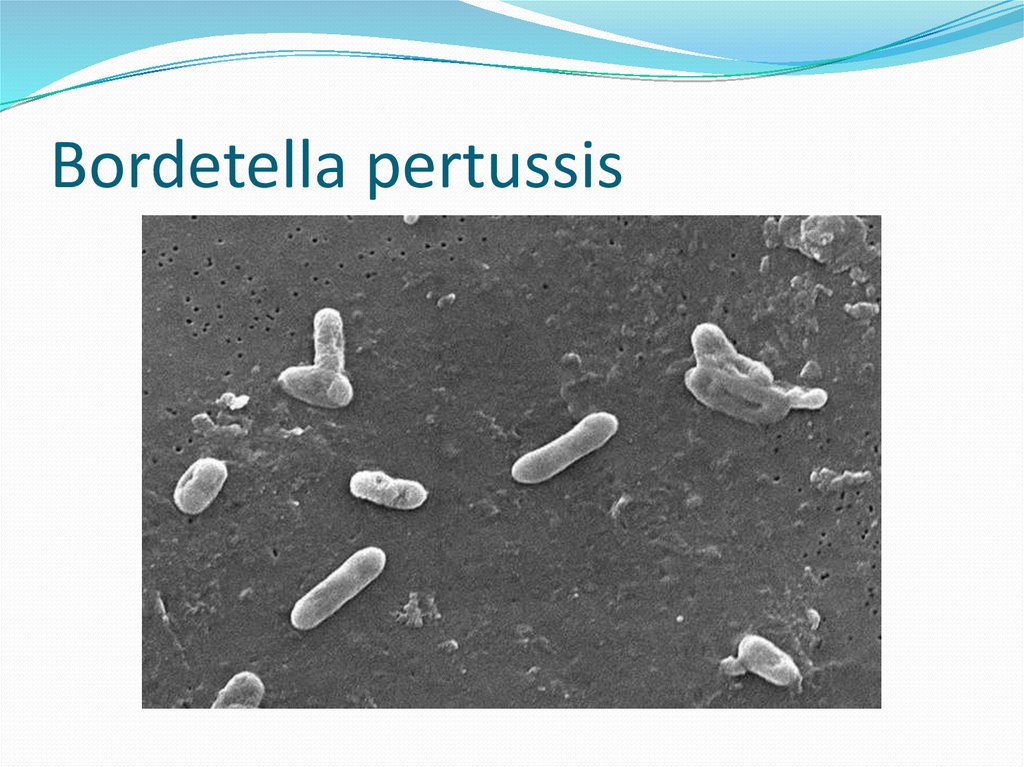
Возбудитель- Bordetella pertussisМелкие неподвижные капсулообразующие ,Грам(-)
кокко бактерии.Биохимически малоактивны. Не растут
на простых питательных средах.Облигатные паразиты.
Источник инфекции-человек.
Bordetella pertussis поражает эпителий ВДП от гортани
до бронхов,в кровь не проникают.
Основной фактор патогенности – коклюшный токсин.
37. Bordetella pertussis
38. Лабораторная диагностика коклюша
Основные документы по лабораторной диагностикекоклюша:
МР 3.1.2.0072-13 «Диагностика коклюша и
паракоклюша»
СП 3.1.2.3162-14 «Профилактика коклюша»
Методы диагностики:
1)Бактериологический
2)Серологический
3) Молекулярно-генетический метод (ПЦР в реальном
времени)
39. Бактериологический метод диагностики коклюша
Используют на ранних сроках заболевания впервые 2-3 недели.
Исследуемый материал:
Слизь из ВДП ,осаждающаяся при кашле на задней
стенке глотки .
Забор материала:
1. Активный.
2. Пассивный
40. Забора материала для исследования на коклюш.
1)Активный.Забор до начала антибиотикотерапии , не ранее чем через 2 часа после
еды, натощак.
Метод наиболее информативен в ранние сроки заболевания (до 2-й
недели спазматического кашля).
В РФ забирается заднеглоточным тампоном через рот согласно
«Инструкции по бактериологическому и серологическому
исследованиям при коклюше и паракоклюше» МЗ СССР, Москва ,1984
г.) ,не касаясь поверхности щек и языка.
Используют тампоны ,изготовленные в лаборатории ,либо стерильные
тампоны из хлопка и вискозы на алюминиевой основе (проволоке) в
индивидуальной пластиковой пробирке.
При извлечении из пробирки конец тампона изгибают под углом 110120⁰.
41. Забор материала на коклюш
Взятие материала производят 2 тампонами : сухим исмоченным забуференным физ.раствором.Взятие
сухим тампоном стимулирует кашель и повышает
возможность выделения при взятии материала
вторым тампоном. Материал сухим тампоном
засевают обязательно на месте взятия , а с влажного
тампона посев производят в лаборатории.
В ряде стран-через нижний носовой ход,т.к. его
считают технически более легким путем и с
меньшей контаминацией (назофарингеальный
метод).
42. Забор материала на коклюш.
2) Пассивный-метод кашлевых пластинок.Непосредственно после забора материала проводят прямой
посев на чашку,либо используют транспортные среды:
-при транспортировке в течение суток используют угольную
среду без крови
Доставка при температуре 35-37⁰С ,не позднее 2-4 ч после
взятия , для транспортировки рекомендуются сумкитермосы.
Чувствительность метода на практике 10-20%,что связано с
контаминацией исследуемого материала,низким качеством
питательных сред,поздним обследованием больных
,неправильным забором материала,недостаточной
кратностью обследования.
43. Основные питательные среды для первичного посева.
Казеиново-угольный агарКазеиново-угольный агар+антибиотик
Казеиново-угольный агар+среда №199
Казеиново-угольный агар+антибиотик+среда №199
Казеиново-угольный агар+антибиотик+среда
№199+сыворотка крупного рогатого скота
Добавляется 5% сыворотки крупного рогатого
скота,1% среды №199.
44. Основные питательные среды для выделения бордетелл.
В качестве антибиотика используют пенициллин,но т.к.чувствительность коклюшной палочки к пенициллину
возросла , то используют либо уменьшенную дозу
антибиотика (0,1 мл рабочего разведения вместо 0,3
мл),либо используют цефалексин (40 мг/л)
В отличие от пенициллина цефалексин не подавляет рост
бордетелл и более эффективен в отношении
сопутствующей микрофлоры.
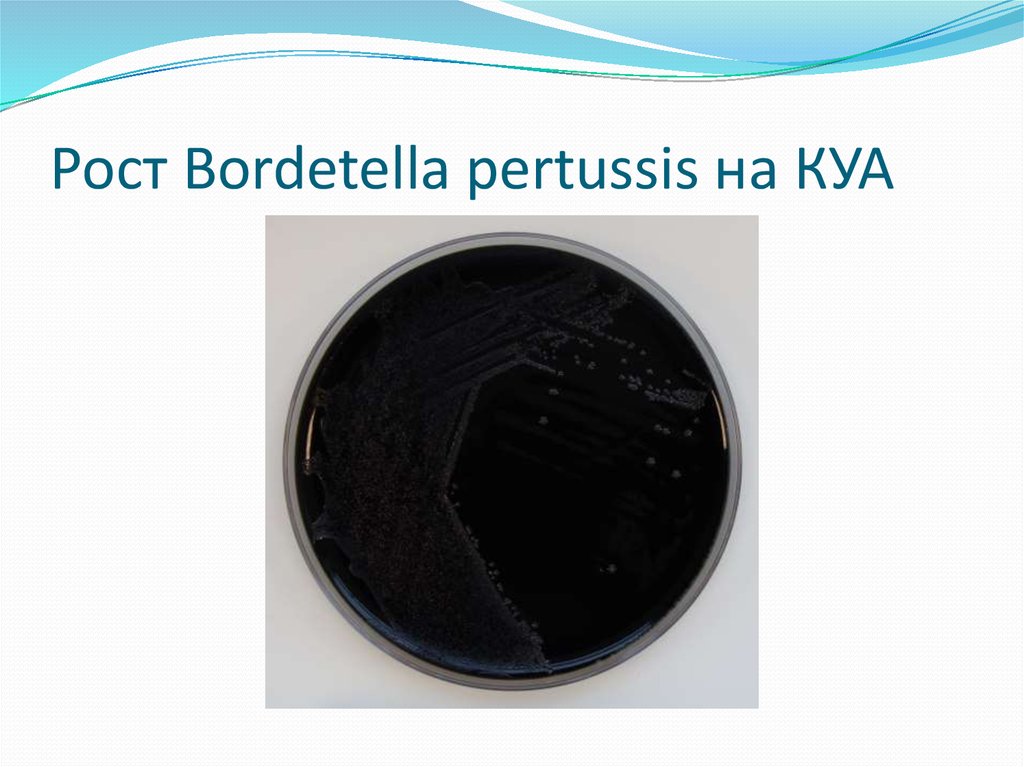
Среда Борде-Жангу
Угольно-кровяной агар (среда Regan-Lowe)
45. Схема бактериологического исследования на коклюш.
1-й день посев материалаИнкубация при 35°С в условиях повышенной влажности,без
добавления CO2
3-й день Просмотр посевов через 72 часа в стереомикроскопе.
Откол подозрительных колоний на сектор КУА без
антибиотика,тест на оксидазу,мочевину.
Идентификация выделенной чистой культуры в РА на стекле с
агглютинирующей коклюшной и паракоклюшной
сыворотками.
Внутривидовое серотипирование Bordetella pertussis с
факторными сыворотками в РА.
Выдача отрицательного ответа на 5-е сутки ,положитель ного на 6-7-е сутки.
46. Рост Bordetella pertussis на КУА
47. Колонии Bordetella pertussis при увеличении в микроскопе.
48. Схема исследования на коклюш
49. Молекулярно-генетический метод диагностики коклюша
Молекулярно-генетический методПЦР используют на любых сроках от начала заболевания , независимо
от проведения больному антибиотикотерапии.
Патологический материал забирают с задней стенки ротоглотки
последовательно двумясухими стерильными зондами из полистирола
с вискозными тампонами ,которые объединяют в одну пробу.
После взятия рабочую часть зонда помещают на глубину 1,5 см в
стерильную одноразовую пробирку с 0,5 мл транспортной
среды.Рукоятку зонда помещают в пробирку и отламывают.Пробирку
герметично закрывают и маркируют.
Допускается хранение материала в течение 3-х суток при 2-8⁰С.
Набор «Bordetella-multi-Fl» :выявление ДНК Bordetella pertussi
,Bordetella bronchiseptica и гена коклюшного токсина А.
Высокая специфичность и чувствительность.
50. Серологические методы диагностики коклюша.
1)Выявление антигенов возбудителя коклюша м-дами меченых антител (ИФА и РИФ.)
Материал:носоглоточная слизь.
Для РИФ-чувствительность 60%
2) Серодиагностика-выявление специфических
антител(агглютининов) к антигенам коклюшной
палочки и (или) ее токсину методом ИФА , РА.
Применяется с 3-й недели заболевания с
повторным исследованием через 10-14 дней.
51. Менингококковая инфекция
-инфекционные заболевания, вызываемые Neisseriameningitidis и протекающие с поражением дыхательной и
центральной нервной системы.
Менингококк колонизирует заднюю стенку носоглотки
человека , в зависимости от вирулентности и резистентнос ти макроорганизма вызывает инфекционный процесс с
широким диапазоном клинических проявлений:
1)Бессимптомное носительство
2)Острый назофарингит
3)Менингококковый менингит
4)Менингоккокцемия
52. Источники инфекции
Больные генерализованной формой менингококковой инфекции(менингококкемия ,менингит, менингоэнцефалит, смешанная форма составляют около 1 % - 2 % от общего числа инфицированных лиц).
Больные острым менингококковым назофарингитом (10 % - 20 % от
общего числа инфицированных лиц).
"Здоровые" носители - лица без клинических проявлений,
выявляющиеся только при бактериологическом обследовании.
Длительность носительства менингококка в среднем составляет 2 - 3
недели, у 2 % - 3 % лиц оно может продолжаться до 6 и более недель.
Широкая распространенность бактерионосительства в человеческой
популяции поддерживает непрерывность эпидемического процесса.
Наибольшая заболеваемость, как в период эпидемии, так и в
межэпидемический период регистрируется среди детей и подростков.
53. Этиология менингококковой инфекции.
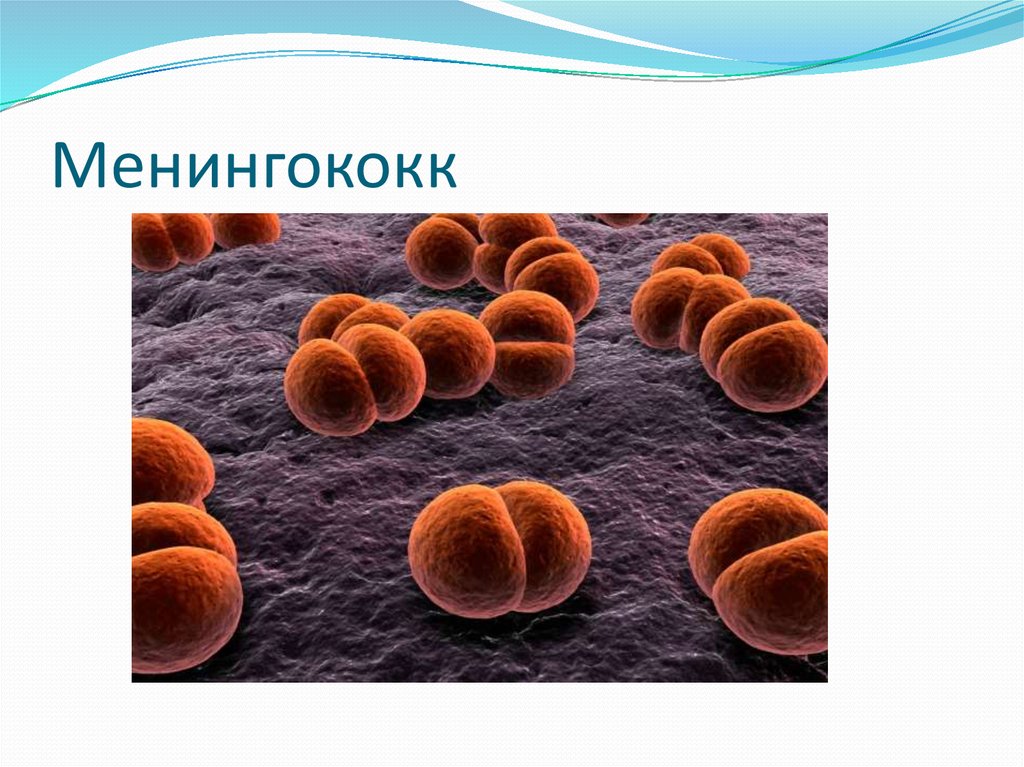
Семейство NeisseriaceaeРод Neisseria
N.meningitidis (менингококк)-Грамотрицательный диплококк
бобовидной формы, неподвижен , образует капсулы.
Аэроб. Растет только на питательных средах с добавлением крови
или сыворотки,лучше в микроаэрофильных условиях (5-10%
СО2).Среды должны быть влажными.
Узкий оптимум температуры:+35-37°С.
Нахождение посевов вне термостата должно быть минимальным ,
исследуемый материал транспортируют в утепленных
контейнерах (30-35 °С) с грелкой , сумках-термосах.
54. Этиология менингококковой инфекции.
Если материал не может быть исследованнемедленно ,то его сохраняют в термостате.
По антигенным свойствам подразделяется на 12
серогрупп , наиболее часто группы А,В и С.
Колонизирует заднюю стенку носоглотки человека
55. Менингококк
56. Лабораторная диагностика
Проводится согласно следующим нормативным документам:Приказ №858 «О мерах по совершенствованию лечебнодиагностических и профилактических мероприятий по
борьбе с менингококковой инфекцией и внедрению ЭН»
МУК 4.2.1887-04 «Лабораторная диагностика
менингококковой инфекции и гнойных бактериальных
менингитов».
СП 3.1.2.2512-09 «Профилактика менингококковой
инфекции»
Основной метод диагностики –бактериологический.
57. Исследуемый материал
КровьЛиквор
Носоглоточная слизь при назофа-
рингите и обследовании на носительство.
58. Взятие ликвора
1. Спинномозговая жидкость.Спинномозговую жидкость отбирают у больного при пункции в
объеме 2,0 - 5,0 мл на этапе поступлении в стационар до начала
антибиотикотерапии с соблюдением правил асептики. Ликвор после
пункции распределяют для исследования следующим образом:
- 1,0 мл направляют в клиническую лабораторию для проведения
общего ликворологического и цитологического исследования;
- 0,2 мл направляют для постановки полимеразной цепной реакции,
которую выполняют в лабораториях, специально оснащенных всем
необходимым для проведения такого рода исследований и имеющих
разрешение на данный вид деятельности в установленном порядке;
- 1,0 мл направляют для первичного бактериологического посева
(если не сделан в отделении при пункции), бактериоскопии и
серологических исследований
59. Взятие крови
Кровь отбирают из вены при поступлении больного в стационар ссоблюдением правил асептики и до начала антибиотикотерапии.
Образцы распределяют следующим образом:
- для бактериологического посева на гемокультуру отбирают 5,0 - 10,0
мл крови у взрослых; 2,0 - 5,0 мл - у детей и 1,0 - 2,0 мл - у
новорожденных и детей неонатального периода;
- 3,0 - 5,0 мл крови используют для серологических исследований с
целью выявления специфических антигенов (встречный
иммуноэлектрофорез - ВИЭФ) и специфических антител (реакция
непрямой гемагглютинации - РНГА). Для получения достоверных
результатов о нарастании титров антител в реакции РНГА важно
исследовать парные сыворотки, т.е. сыворотки крови, взятые в
первые дни болезни при поступлении больного в стационар и затем
на 10 - 12 день заболевания;
- несколько капель крови наносят на предметное стекло для
приготовления препарата "толстой капли" крови.
60. Взятие назофарингеальной слизи
Назофарингеальная слизь.Назофарингеальную слизь с задней стенки глотки берут натощак
или через 3 - 4 часа после еды стерильным ватным тампоном.
Материал берут с обязательным надавливанием шпателем на
корень языка для наиболее полного открытия глоточного
отверстия. Тампон вводят ватным концом кверху за мягкое небо в
носоглотку и проводят 2 - 3 раза по задней стенке. При извлечении
из носоглотки тампон не должен касаться окружающих тканей
(зубы, слизистая щек, язык, небный язычок). После извлечения из
носоглотки содержащуюся на тампоне слизь засевают на чашки
(сывороточный агар и сывороточный агар с линкомицином) или
помещают в транспортную среду для немедленной доставки в
лабораторию. Допускается применение готовых питательных
транспортных сред, разрешенных к применению в Российской
Федерации в установленном порядке.
61. Доставка материала
Материал для бактериологических и серологическихисследований доставляют в бактериологическую лабораторию
немедленно после отбора в специальных контейнерах, способных
поддерживать температуру 37 °С. При невозможности быстрой
доставки материала из отделения в лабораторию (ночное время,
выходные и праздничные дни и др.) материал хранят следующим
образом:
- посевы ликвора на первичной чашке с "шоколадным" агаром и в
0,1% полужидком питательном агаре, а также посев крови на
гемокультуру хранят в условиях термостата при 37 °С;
- нативный ликвор и кровь для серологических исследований
хранят в условиях холодильника при +4 °С. В лаборатории
нативный ликвор используют только для бактериоскопии и
постановки серологических реакций (латекс-агглютинация, ВИЭФ
и др.). Для бактериологического посева хранившийся в
холодильнике нативный ликвор не используют.
62. Методы исследования
1. Бактериоскопический методМазок нативного ликвора.
На предметное стекло наносят каплю ликвора из
осажденного после центрифугирования слоя и
высушивают при комнатной температуре или в условиях
термостата при 37 °С. Далее на препарат наносят
краситель (водно-спиртовой раствор метиленовой сини)
и после 2-х минутной экспозиции проводят тщательное,
но осторожное промывание водопроводной водой.
Препарат подсушивают и микроскопируют под
иммерсией при большом увеличении, просматривая не
менее 20 полей зрения или до обнаружения
морфологически четких микробных клеток.
63. Методы исследования
Мазок препарата "толстая капля" крови.На середину предметного стекла наносят каплю крови и
распределяют с помощью чистого стерильного аппликатора так,
чтобы диаметр мазка соответствовал величине пятикопеечной
монеты. Стекло оставляют в горизонтальном положении до
подсыхания крови. Данный фрагмент исследования выполняют
непосредственно у постели больного при его поступлении в
стационар. Далее препарат доставляют в бактериологическую
лабораторию. Окраску мазка производят водно-спиртовым
раствором метиленовой сини в течение 2 - 3 минут без
предварительной фиксации. После окрашивания препарат
осторожно промывают водой и подсушивают на воздухе. Препарат
смотрят под иммерсией при большом увеличении, просматривая не
менее 20 полей зрения или до обнаружения морфологически четких
микробных клеток.
64. Методы исследования
Бактериологическое исследование- золотойстандарт лабораторной диагностики менингококковой инфекции.
Основные питательные среды для посева:
Сывороточный агар
Шоколадный агар
Полужидкий сывороточный агар
65. Бактериологическое исследование на менингококк
Бактериологический посев спинномозговой жидкости.Первичный бактериологический посев СМЖ на чашку с
"шоколадным"агаром выполняют непосредственно "у постели
больного" в стационаре после проведения пункции. Чашки с
питательной средой, так же как и все необходимые для
забора патологического материала принадлежности
(пустые стерильные пробирки, пробирки с 0,1% полужидким сывороточным агаром , стерильные предметные стекла
для приготовления препарата "толстая капля" крови,
флаконы с питательными средами для посева крови ), в
достаточном количестве хранят в профильном отделении
стационара или их немедленно (при необходимости)
доставляют из бактериологической лаборатории
66. Бактериологическое исследование на менингококк
Допустимым условием хранения емкостей с питательными средамиявляется температура бытового холодильника (+4 °С). Срок хранения- не
более 7 дней.
Перед пункцией емкости с питательными средами достают из холодильника и
выдерживают при комнатной температуре не менее 10 минут.
После проведения пункции непосредственно из пункционной иглы
выполняют посев СМЖ на чашку с "шоколадным" агаром. Чашку
осторожно открывают и на поверхность средызакапывают несколько
капель ликвора (3 - 4 капли).
Далее чашку закрывают, ставят на ровную поверхность и с помощью
нескольких круговых движений чашки по поверхности стола капли
ликвора распределяют по поверхности агара. После того как СМЖ впитается
(обычно 2 - 3 минуты), необходимо зафиксировать дно и крышку
чашки(например, пластырем) для того, чтобы не возникло ее случайного
открытия.
67. Бактериологическое исследование на менингококк
Посев ликвора в пробирку с 0,1% полужидкимсывороточным агаром проводят сразу после пункции. Для
этого непосредственно из пункционной иглы 5 - 6 капель
СМЖ вносят в пробирку с 0,1% полужидким сывороточным
агаром. Следует указать на то, что если непосредственно у
постели больного сделан посев СМЖ по выше изложен
ному способу, то этап посева нативной СМЖ в лаборатории
следует исключить, при этом доставленную в лабораторию
стерильную СМЖ исследуют только бактериоскопическими
и серологическими методами.
Емкости с посевами до доставки в лабораторию хранят в
условиях термостата при 37 °С или немедленно доставляют
в бактериологическую лабораторию
68. Бактериологическое исследование на менингококк
В бактериологической лаборатории посевы инкубируютпри 37 °С в течение 24 - 48 часов в атмосфере, содержащей
5 - 10% СО (эксикатор со свечой, СО -инкубатор).
При наличии роста на плотных питательных средах
проводят визуальную оценку выросших колоний,
готовят мазок по Граму, определяют оксидазу, каталазу
и, в зависимости от полученного результата, проводят
дальнейшую идентификацию возбудителя и
определение чувствительности к антибиотикам.
При наличии признаков роста в 0,1% полужидком
сывороточном агаре проводят высев на чашки с
сывороточ ным агаром.
69. Рост менингококка на шоколадном агаре
70. Бактериологическое исследование крови на менингококк.
Посев крови выполняют во флаконы с "двухфазной"питательной средой в соотношении крови к жидкой
фазе 1:10 для уменьшения бактерицидного эффекта
человеческой сыворотки.
"Двухфазная" питательная среда содержит X , V
факторы роста и витамины. На ней хорошо растут
менингококки, пневмококки, гемофильные палочки
и другие менее требовательные к составу питатель ной среды микроорганизмы.
71. Бактериологическое исследование крови на менингококк.
Засеянную в отделении кровь доставляют влабораторию и инкубируют в течение 5 суток при
температуре 37 °С.
Посевы ежедневно просматривают на наличие
микробного роста. Признаками микробного роста на
"двухфазной" среде служит помутнение жидкой
среды, наличие хлопьевидного осадка, газообразование, образование пленки. Часто изменения "жидкой"
фазы среды сопровождаются ростом колоний на
"плотной" фазе среды
72. Бактериологическое исследование крови на менингококк
В случае обнаружения роста микроорганизмов в "двухфазной"питательной среде флакон вскрывают и из бульона или
выросших на твердой фазе колоний готовят мазок,
окрашенный по Граму. По результатам микроскопии
выполняют высев на чашки с "шоколадным" агаром для
выделения менингококков, пневмококков и гемофильных
палочек типа «В".
В других случаях, в соответствии с данными
бактериоскопического исследования, к указанному набору
сред добавляют любые адекватные питательные среды
(желточно-солевой агар, среда Эндо, среда Сабуро и др.) для
выделения и идентификации "прочих" возбудителей гнойных
бактериальных менингитов
73. Бактериологическое исследование носоглоточной слизи на менингококк.
Посев выполняют немедленно после забора материала или последоставки материала в лабораторию на чашки с сывороточным агаром
и на чашки с селективным сывороточным агаром (в качестве
селективной добавки используют линкомицин).
Материал засевают путем втирания тампона на четверть чашки.
Оставшуюся часть агара на чашке засевают штриховым методом с
помощью стерильной бактериологической петли.
Инкубация посевов при 37 °С в течение 24-х часов. При обнаружении
колоний, визуально сходных с ростом менингококков, выполняют
отсев на чашки с сывороточным агаром.
После культивирования посевов в условиях термостата при 37 °С из
выросших колоний готовят мазок по Граму и проводят дальнейшую
идентификацию
74. Иммунологические методы диагностики менингококкового менингита.
Реакция латекс-агглютинации (экспресс-метод).Наиболее простым методом, не требующим сложного оборудования и
дорогостоящих реактивов, является метод латекс-агглютинации,
позволяющий в течение 15 минут дать заключение об отсутствии или
наличии в СМЖ больного специфических антигенов.
Реакцию проводят при наличии признаков гнойного воспаления в ликворе
и/или при бактериоскопическом обнаружении в нем возбудителей.
Предварительно СМЖ необходимо прогреть в течение 5 минут при 100 °С и
отцентрифугировать при 1500 - 2000 об./мин. Для проведения реакции
используют прозрачную
Агглютинация в течение 2-х минут с одним из латекс-диагностических
препаратов свидетельствует о присутствии в испытуемом образце
специфического антигена. Для выполнения реакции используют наборы
латекс-диагностических препаратов, разрешенные к применению в
Российской Федерации в установленном порядке.
75. Молекулярно-генетические методы диагностики менингококкового менингита
Исследование ликвора методом ПЦР в реальномвремени.
Набор Амплисенс «Neisseria meningitidis
/Streptococcus pneumoniaе /Haemophilus influanzaeFL»
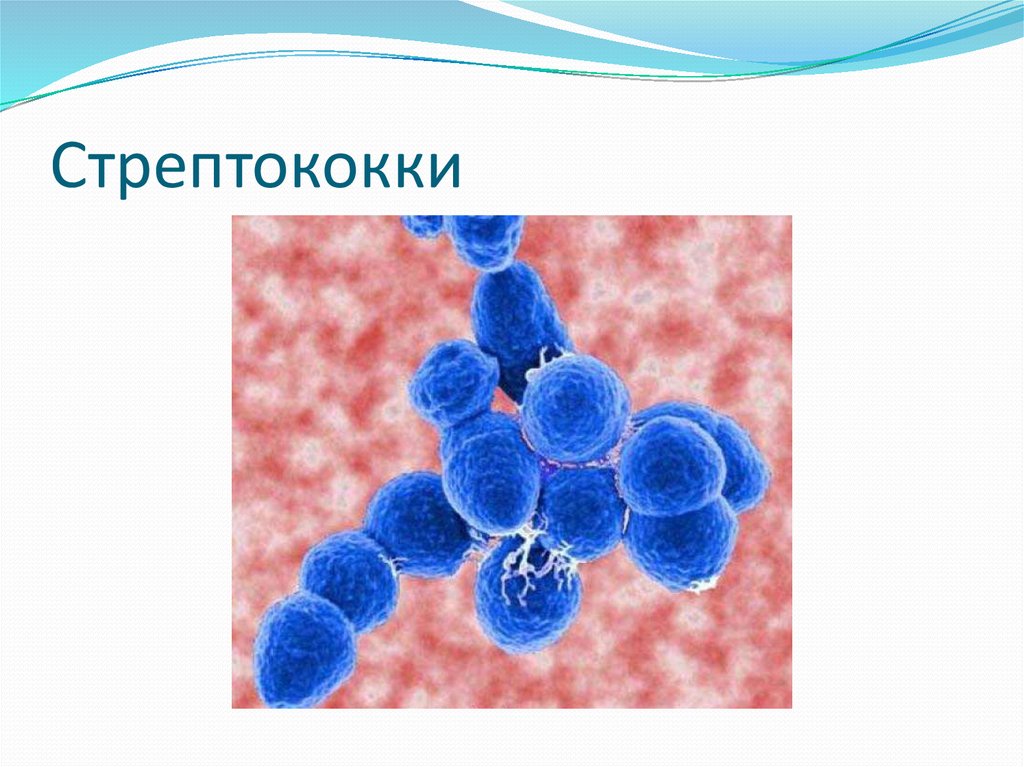
76. Cтрептококковые инфекции. Этиология.
CемействоStreptococcaceaeРод Streptococcus
Род Enterococcus
Характеристика семейства:
Грамположительные бактерии шаровидной формы
(кокки),которые располагаются преимущественно
цепочками или парами,спор не образуют.
Являются факультативными анаэробами, оптимальной
считается инкубация в атмосфере с повышенным
содержанием СО2.(3-7%)
Первичнаяидентификация основана на их гемолитической активности на 5 % кровяном агаре.
77. Классификация стрептококков.
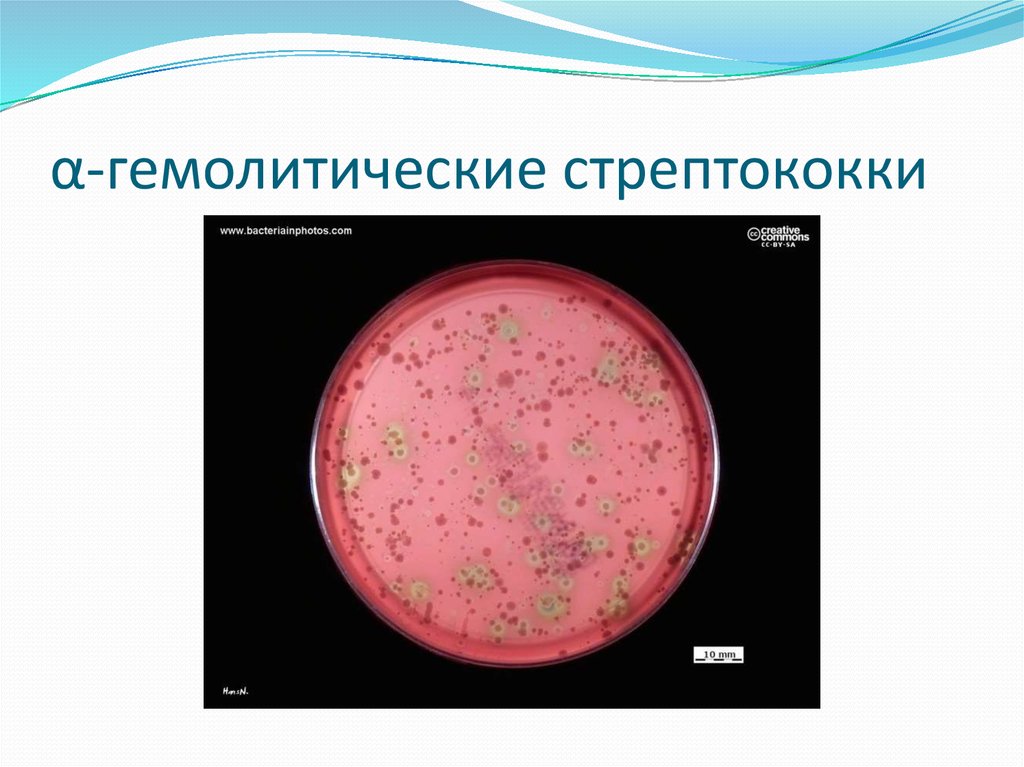
По типу гемолиза различают:α-гемолитические стрептококки (стрептококки
группы «viridans»,пневмококк)
β-гемолитические стрептококки,подразделяются на
серогруппы по антигенным свойствам (гр. А, В, С ,D
,F,G,R)
γ-гемолитические стрептококки (негемолитические
стрептококки)
78. Стрептококки
79. α-гемолитические стрептококки
80. β-гемолитические стрептококки
81. Медицинское значение
Стрептококки являются широко распространеннымив природе микроорганизмами,входят в состав
резидентной микрофлоры организма человека и
животных ,колонизируют кожу и слизистые
оболочки ЖКТ, ВДП и половых путей.
В тоже время отдельные представители этого рода
могут вызывать различные инфекции: гнойно-септические и воздушно-капельные.
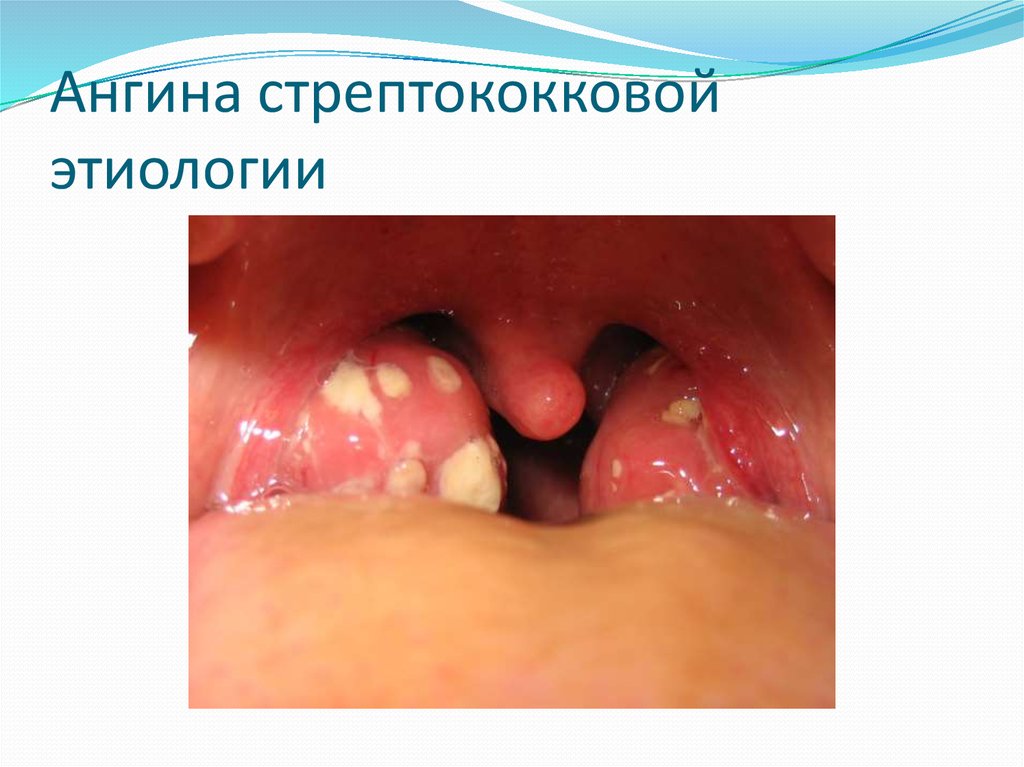
82. Ангина стрептококковой этиологии
83. β-гемолитические стрептококки
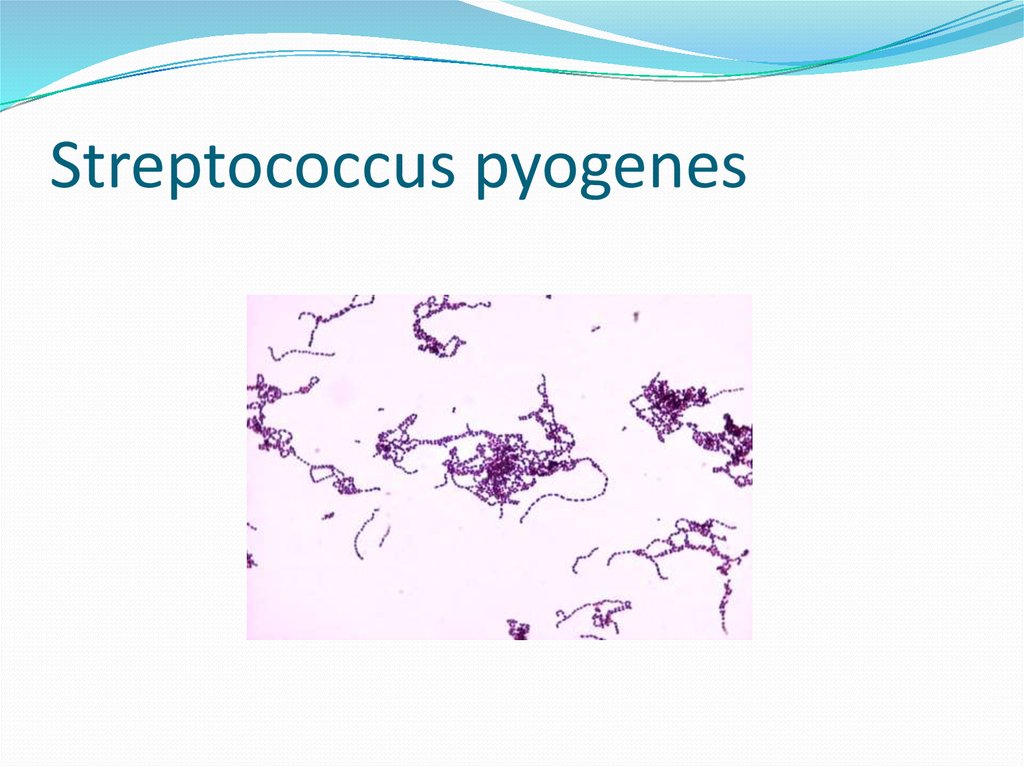
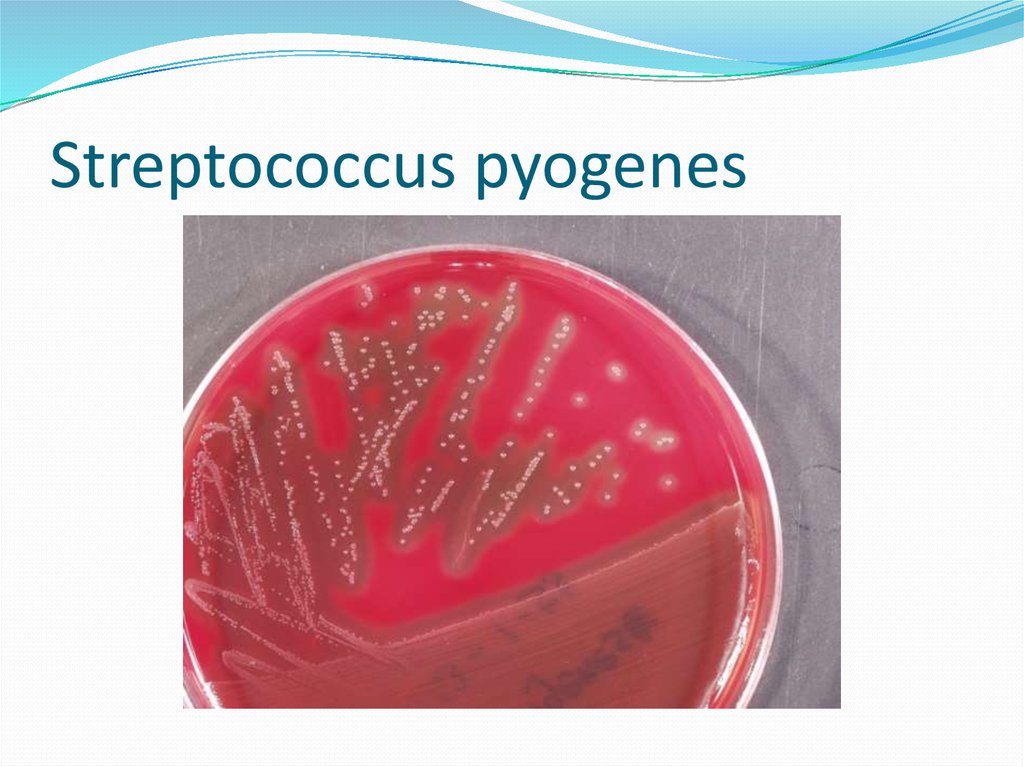
Подразделяются по антигенным свойствам на серогруппы.1.Стрептококк серогруппы А (Streptococcus pyogenes)
- патогенный , один из основных возбудителей инфекционных
заболеваний человека:
тонзиллиты, фарингиты,
инфекции кожи и мягких тканей (рожистое воспаление)
острые средние отиты и синуситы,
инвазивные инфекции(некротические фасциты и миозиты,синдром
токсического шока),
скарлатину (штаммы продуцирующие эритрогенный токсин)
иммунологические осложнения: острый гломерулонефрит
,ревматизм)
84. Streptococcus pyogenes
85. Streptococcus pyogenes
86. β-гемолитические стрептококки
2.Стрептококки серогруппы ВStreptococcus agalactiae
Возбудитель интранатальных и постнатальных
инфекций новорожденных(бактериемии,
пневмонии,менингиты).
Также может вызывать инвазивные инфекции
(эндокардит,инфекции кожи и мягких тканей,
остеомиелит) у взрослых с тяжелыми фоновыми
заболеваниями.
87. Streptococcus agalactiae
88. β-гемолитические стрептококки
3. Стрептококки серогрупп С, F и G Streptococcusdysgalactiae,
Streptococcus equi
Streptococcus canis
Вызывают преимущественно фарингиты и тонзиллиты,реже-эндокардиты,менингиты,септическийартрит
,инфекции дыхательных путей и кожи.
89. Streptococcus equi
90. α-гемолитические стрептококки
α-гемолитические стрептококки:В антигенном отношении сходны,исключение
пневмококк.
α-гемолитические стрептококки группы
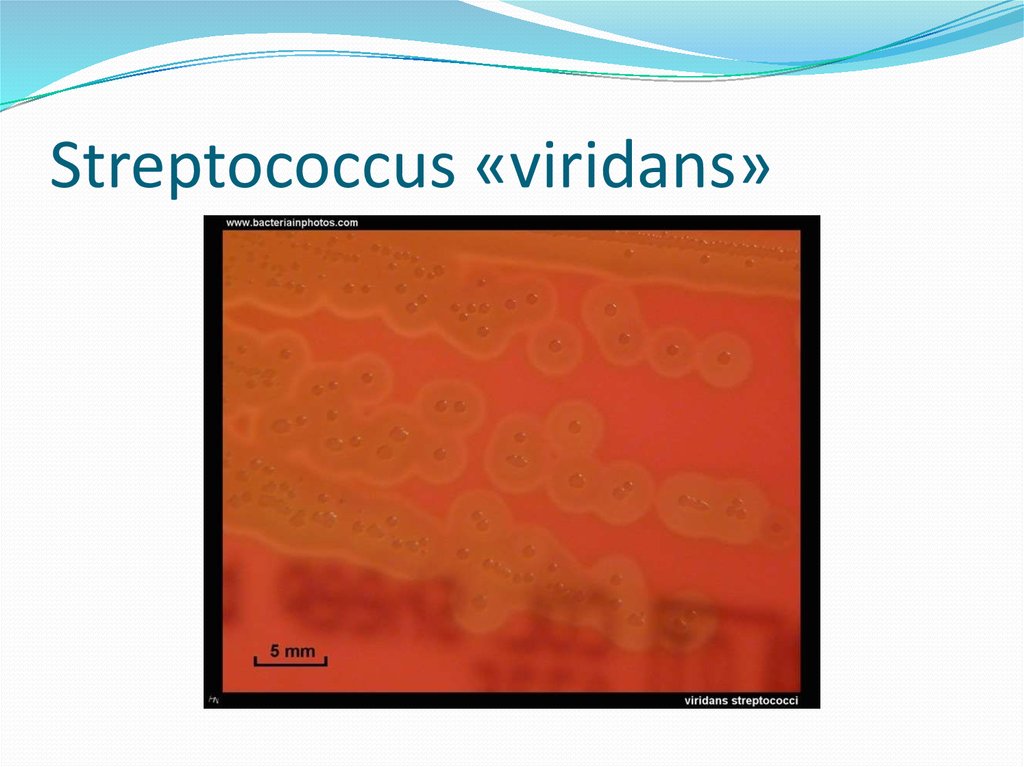
«viridans»
В норме обитают в ротовой полости,ЖКТ и женских
половых путях.Могут вызывать подострые
эндокардиты,особенно у пациентов с поврежден ными или искусственными клапанами,является
возбудителем инфекций у пациентов с нейтропенией
91. Streptococcus «viridans»
92. α-гемолитические стрептококки
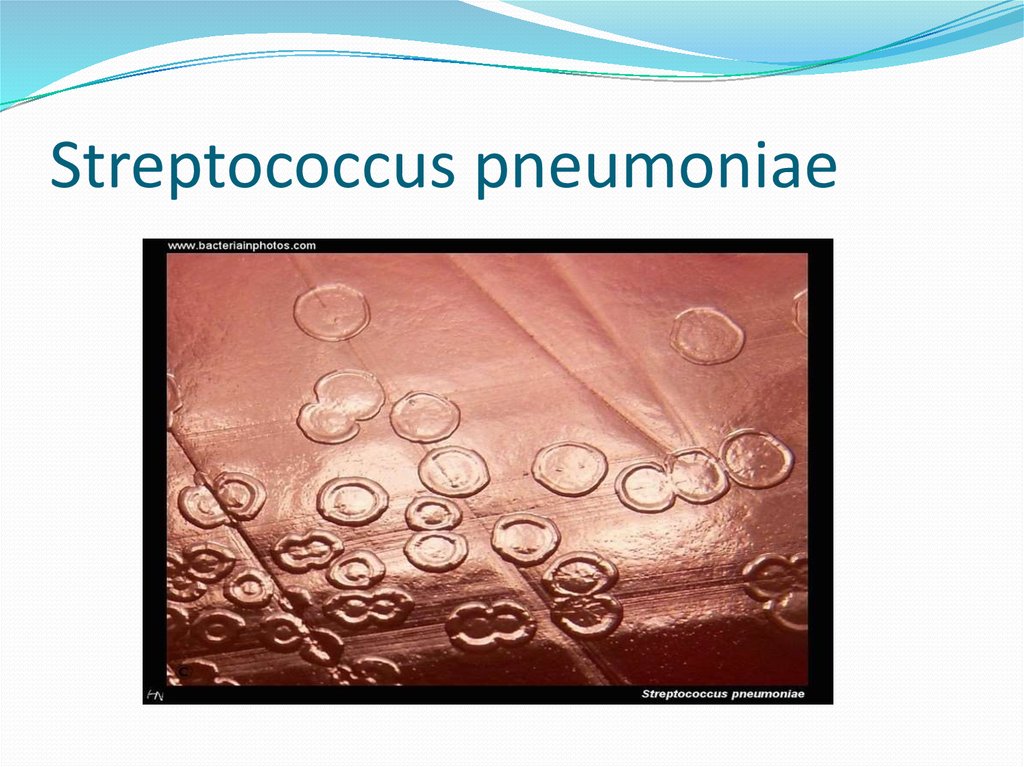
Streptococcus pneumoniaе (пневмококк)Характерно наличие мощной капсулы,выделяют 23 серотипа,которые входят в
полисахариднуювакцину.КолонизируетВДП.
Является основным возбудителем менингита,среднего , отита , риносинусита ,в
небольничной(крупозной) пневмонии у детей и взрослых.
В более редких случаях пневмококк может вызывать инфекции другой
локализации: эндокардит,септическийартрит,перитонит,флегмоны.
Колонии стрептококков обычно влажные,серого или беловатого
цветов,блестящие,номогут быть сухими. β-гемолитические стрептококки групп А,С
и G образуют колонии диаметром > 0.5 мм.Колонии стрептококков группы В
больше по размеру и имеют более выраженную зону гемолиза.
Стрептококки группы viridans могут образовывать колонии,морфологически
сходные с пневмококками , некоторые из них образуют сероватые колонии без
гемолиза.(S.bovis)
93. Streptococcus pneumoniae
94. Лабораторная диагностика
Исследуемый материал:Отделяемое зева и носа , ран , половых путей , кровь ,мокрота
,ликвор.
Методы лабораторной диагностики:
Экспресс-диагностика
Выявление антигенов стрептококков в исследуемом материале.
Исследуемый материал помещают в экстрагирующий
раствор,затемполсе короткой инкубации антиген определяют мдом РЛА,коааглютинации,ИФА,иммунохроматографии)
Чувствительность и специфичность уступает культуральному
методу.
Бактериоскопический метод с окраской мазков по Граму
Чувствительность ≥105 клеток.
Бактериологический метод-«золотой стандарт» лабораторной
диагностики
95. Бактериологический метод лабораторной диагностики стрептококковой инфекции.
Среды для перевичного посева:-Триптиказо-соевый агар с добавлением 3-% %
дефибринированнойлошадиной/ бараньей крови.
-Эритрит-агар , ГРМ-агар с добавлением 5-10%
инактивированной лошадиной сыворотки и 3-5 %
дефибринированной нецитратной крови(или эритромассы)
Инкубация при 37°Cв присутствии 5% CO2
Просмотр посевов , откол подозрительных колоний и
идентификация
96. Лабораторная диагностика пневмококковых инфекций.
Исследуемый материал:Отделяемое зева и носа.
Мокрота
Аспираты из пазух и среднего уха.
Ликвор
Кровь
При поступлении мокроты следует обратить внимание на
оценку качества забора материала. Д.б. > 25
лейкоцитов/поле зрения и не более 10 эпителиальных
клеток,какминиммум в 20 полях зрения.
97. Лабораторная диагностика пневмококковых инфекций.
Необходимо использование приемлемых питательных сред ,являетяс прихотливым м/о.
5% КА с добавлением 10-15 % лошадиной сыворотки или
крупного рогатого скота.
Из коммерческих сред-триптиказо-соевый агар и
колумбийский агар.
Инкубация в атмосфере с повышенным содержанием СО2.
Пневмококки формируют 1-2 мм в диаметре
округлые,блестящие,бесцветные,с ровным краем,мягкой
консистенции колонии с α-гемолизом,которые через 24 часа
имеют полую сферическую форму с уплощенным центром в
результате аутолиза .
98. Диагностика энтерококковой инфекции.
CемействоStreptococcaceaeРод Enterococcus
Виды:Enterococcus faecalis
Enterococcus faecium
Enterococcus durans
Enterococcus avium
30 видов
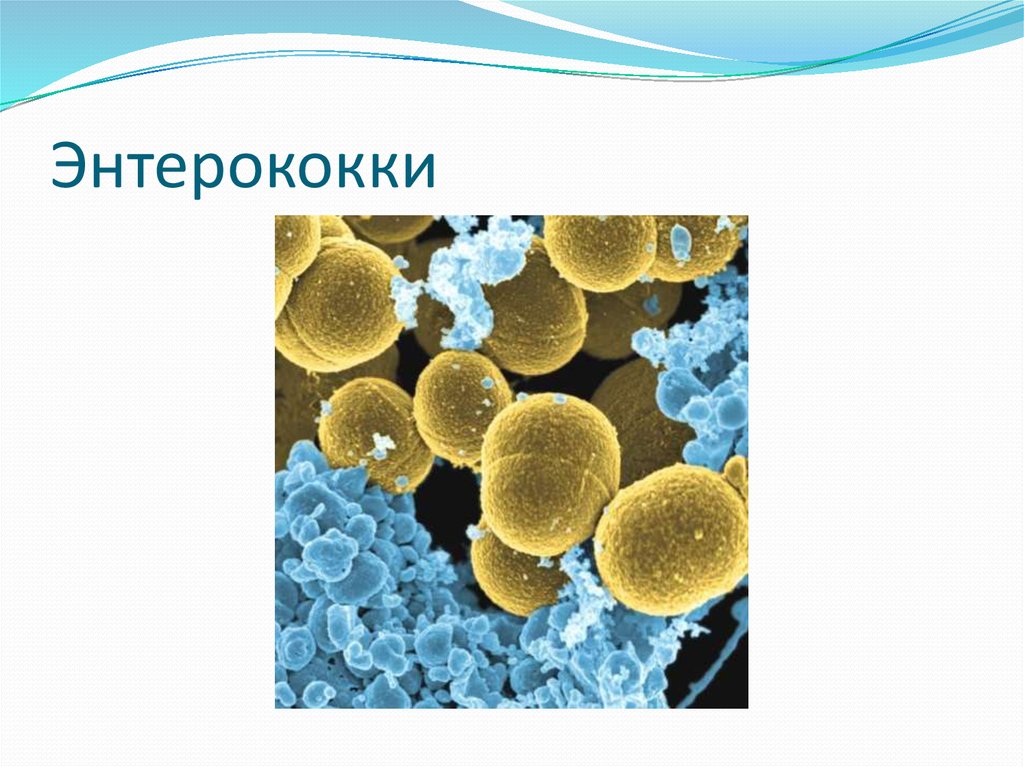
Грамположительные кокки (часто овоидной формы) ,при микроскопии
располагаются попарно ,в виде коротких цепочек или одиночных клеток.
На кровяном агаре образуют колонии диаметром 1-2 мм. Часть штаммов дает
β-гемолиз , остальные α-гемолиз.
Все энтерококки устойчивы к желчи ,сохраняют жизнеспособность в
присутствии 6,5% хлорида натрия ,растут в широком диапазоне температур
(от 10 до 45оС) , неподвижны.
99. Энтерококки
100. Энтерококки
101. Клиническое значение
Клиническое значение.- УПМ-представители нормальной микрофлоры ЖКТ
-возбудители ГСИ (ИМВП , эндокардит , менингит
,неонатальный сепсис,перитонит, раневые инфекции)
особенно ИСМП – инфекции ,связанные с оказанием
медицинской помощи.
-Enterococcus faecalis -80-90% изолятов энтерококков
-Enterococcus faecium -5-10% изолятов.
-циркуляция ванкомицинрезистентных штаммов (VRE)
102. Лабораторная диагностика пневмококковых инфекций.
Необходимо использование приемлемых питательных сред.,являетяс прихотливым м/о.5% КА с добавлением 10-15 % лошадиной сыворотки или крупного рогатого скота.
Из коммерческих сред-триптиказо-соевый агар и колумбийский агар.
Инкубация в атмосфере с повышенным содержанием СО2.
Пневмококки формируют 1-2 мм в диаметре округлые,блестящие,бесцветные,с ровным
краем,мягкой консистенции колонии с α-гемолизом,которые через 24 часа имеют полую
сферическую форму с уплощенным центром в результате аутолиза .
Могут образовывать слизистые колонии.
Идентификация:
Тест с оптохином.Диски 5 мкг оптохина. >14(16) мм-пневмококк.
4-5% пневмококков резистентны к оптохину,также могут подавляться другие зеленящие
Стрептококки.
Тест с желчью.Лизис в присутствии желчных кислот.(дезоксихолаты)
10% р-р дезоксихолатанатрия.Постановка в пробирке.Просветеление-«+»
Тест Нейсфельда (с помощью антисыворотки)
Иммунохроматографическийтест , РЛА.
Идентификация на бактериологическом анализаторе
103. Гемофильная инфекция
Род HaemophilusВиды: - Haemophilus inflaenzae
- Haemophilus parainfluanzae
- Haemophilua parainfluanzae
Грамотрицательные мелкие полиморфные коккобактерии , имеют капсулу.
Нуждаются в факторах роста : X и V.
Лучше растут в атмосфере 5-10% СО2
104. Клиническое значение
Комменсалы слизистых оболочек человека иживотных.
Haemophilus influanzae имеет наибольшее клиническое значение:
- менингит у детей.
-пневмонии
-острый синусит
- острый отит
- конъюнктивит
- обострение хронического бронхита
105. Гемофильные бактерии
106. Лабораторная диагностика
Исследуемый материал :Отделяемое зева и носа
Мокрота
Ликвор
Отделяемое глаза
Гной
Аспират из пазух.
107. Лабораторная диагностика
Бактериоскопический метод- для ликвора
- для мокроты
Бактериологический метод – основной.
Молекулярно-генетический – ПЦР в реальном времени.
Иммунологические методы- реакция латекс-агглютинации.
108. Бактериологический метод диагностики.
Питательные среды для первичного посева:5 % кровяной агар с наложением диска с сапонином.
Шоколадный агар
Инкубация 24 ч при 37°С в атмосфере СО2 –
эксикатор со свечой.
Идентификация выделенной культуры
109. Рост гемофильной палочки на шоколадном агаре
110. Стафилококковые инфекции
Грам(+) неподвижные бактерии сферической(шаровидной) формы в мазках располагаются в виде
«виноградной грозди».
Не требовательны к питательным средам, температурный оптимум роста 30-37⁰С.
Способны расти на плотных питательных средах с
высоким содеранием хлорида натрия(до 10%).
На средах могут быть окрашены в белый ,жёлтый ,
кремовый цвета , колонии выпуклые с ровными краями,
непрозрачные , с зоной β-гемолиза.
111. Стафилококки
112. Классификация стафилококков
Семейство Micrococcaceaeрод Staphylococcus
более 30 видов
В медицинской микробиологии условно делятся на:
1.Коагулазоположительные -имеют фермент
плазмокоагулазу-фактор патогенности.
Виды Staphylococcus aureus
2.Коагулазоотрицательные-не имеют плазмокоагулазы.
Staphylococcus epidermidis,Staphylococcus saprophyticus и
др
113. Медицинское значение
Наибольшее медицинское значение имеют 3 вида:1)Staphylococcus aureus(Золотистый стафилококк)
2) Staphylococcus epidermidis(Эпидермальный
стафилококк)
3) Staphylococcus saprophyticus(Сапрофитный
стафилококк)
114. Медицинское значение стафилококков
- Возбудители гнойно-септических инфекций.1)Гнойные заболевания кожи и подкожной клетчатки
(Пиодермия,фурункул,карбункул,панариций,гидраденит)
2)Раневые инфекции и абсцессы
3)Стафилококковый сепсис
4)Воспалительные заболевания дыхательных
путей(бронхиты,пневмонии,плевриты)
5)Воспалительные заболевания уха,носоглотки и
придаточных пазух носа(отиты,ангины, синуситы)
6)Маститы
115. Медицинское значение стафилококков
7)Остеомиелиты8)Перитониты
9)Инфекции мочевыводящих путей(циститы,пиелиты)
10)Синдром токсического шока(TSST-1)/ токсигенные штаммы
S.aureus/
11)Синдром «ошпаренной кожи»( «ошпаренных младенцев»
),при инфицировании токсигенными штаммами
S.aureus,продуцирующими эксфолиативные токсины А и В.
12)Пищевой стафилококковый токсикоз(Термостабильный
токсин)
13)Стафилококковый энтероколит
116. Лабораторная диагностика
Основной метод диагностики-бактериологический.Исследуемый материал:
кровь
ликвор,
мокрота,
мазки из зева и носа,
отделяемое ран.
Посев согласно приказа №535
117. Бактериологический метод диагностики
Основные питательные среды:I.Универсальные(Общего назначения)
5% кровяной агар
МПА
II.Элективные(Селективные)
Элективный фактор-высокая концентрация
хлорида натрия.
Солевой агар
118. Бактериологический метод диагностики
III.Элективно-дифференциальныеЖелточно-солевой агар(среда Чистовича)
Основа-10% солевой агар
Диференцирующий фактор-20% желточная взвесь
Учёт роста через 48 часов.
Солевой агар с маннитом(Маннитол Солт Агар/Маннитол солт агар с
плазмокоагулазой/
Среда Бэйрд-Паркера
-Элективный фактор-хлорид лития
-Дифференцирующий фактор-эмульсия желтка.
Учёт роста через 24 часа.
IV.Хромогенные среды
Хромогенные среды для выделения MRSA-cтафилококков











































































































 medicine
medicine








