Similar presentations:
Досье формата CTD
1. Досье формата CTD
Выполнила: Нураханкызы Б.Факультет: Фармация
Курс: 5
Группа: 506-02
Проверил: Жакипбеков К. С.
2.
• Обеспечение высоких показателейкачества и эффективности
лекарственных средств во многом
определяется процедурой регистрации,
которую обязаны проходить препараты
до того, как поступят на рынок.
3.
• CTD – Common Technical Document – общийтехнический формат документа
представляющего международное
европейское регистрационное досье.
4. Главная цель разработки CTD
• Гармонизация требований кпредставлению регистрационных
документов, что позволяет направлять их в
органы регистрации и лицензирования
разных стран в качестве единого досье (для
регистрации препаратов).
5. Гармонизация – это…
• Согласование различий и несоответствиймежду разными инструментами, методами,
процедурами, перечнями, спецификациями
или системами с целью сделать их
единообразными или совместимыми.
6.
• Основой регистрационной документацииявляется CTD (Common Technical Document) –
(ОТД) Общий технический документ , перечень
регистрационных документов, созданный в
рамках ICH.
• CTD на протяжении последних лет органично
вписался в пакет важнейших руководств в этой
области и по сути является международным
стандартом представления данных
регистрационного досье препарата.
7.
• ICH – международная конференция погармонизации технических требований к
регистрации лекарственных препаратов для
медицинского применения
8. Область применения CTD
• CTD, первоначально применимый исключительно кновым химическим соединениям и
биотехнологическим препаратам, в дальнейшем стали
использовать также для групп препаратов и всех видов
торговых лицензии (для оригинальных препаратов,
генериков). В будущем, возможно CTD будет
применяться при проведении клинических испытании.
• Перспективным является применение CTD для
планирования развития фармацевтической индустрии,
также он может быть использован экспертами при
подготовке соответствующих рецензии на все типы
заявок на регистрацию препаратов.
9.
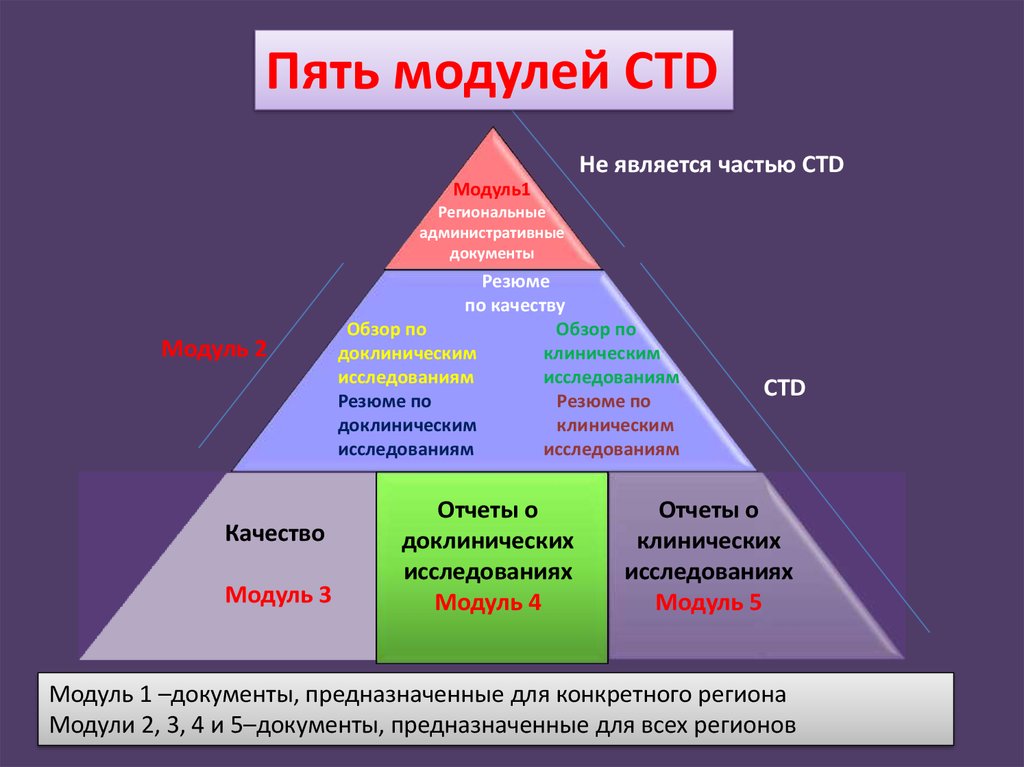
Оно содержит пять модулей описанияпродукта:
• Модуль 1 - административная информация
• Модуль 2 – резюме
• Модуль 3 – качество
• Модуль 4 – доклинические исследования
• Модуль 5 - клинические исследования
• Неклинические исследования, в том числе
резюме и рефераты, описания качества и
характера, состава, производства, упаковки.
10.
Пять модулей CTDНе является частью CTD
Модуль1
Региональные
административные
документы
Модуль 2
Качество
Модуль 3
Резюме
по качеству
Обзор по
Обзор по
доклиническим
клиническим
исследованиям
исследованиям
Резюме по
Резюме по
доклиническим
клиническим
исследованиям
исследованиям
Отчеты о
доклинических
исследованиях
Модуль 4
CTD
Отчеты о
клинических
исследованиях
Модуль 5
Модуль 1 –документы, предназначенные для конкретного региона
Модули 2, 3, 4 и 5–документы, предназначенные для всех регионов










 medicine
medicine law
law








