Similar presentations:
Строение атома и периодическая система элементов Д. И. Менделеева
1.
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮФедеральное государственное образовательное учреждение
высшего профессионального образования
Сибирский федеральный университет
Институт фундаментальной подготовки
Красноярск, 2008
2.
Кафедра химииХимия
Для студентов нехимических специальностей технических вузов
Красноярск, 2008
3.
УДКББК
54
24
Х46
Электронный учебно-методический комплекс по дисциплине «Химия» подготовлен в рамках инновационной образовательной
программы «Институт фундаментальной подготовки», реализованной в ФГОУ ВПО СФУ в 2007 г.
Рецензенты:
Красноярский краевой фонд науки;
Экспертная комиссия СФУ по подготовке учебно-методических комплексов дисциплин
Х46
Химия. Презентационные материалы. Версия 1.0 [Электронный ресурс] : наглядное пособие / А. Г. Аншиц,
Е. В. Грачева, О. К. Клусс, Е. А. Салькова. – Электрон. дан. (3 Мб). – Красноярск : ИПК СФУ, 2008. – (Химия : УМКД
№ 225-2007 / рук. творч. коллектива А. Г. Аншиц). – 1 электрон. опт. диск (DVD). – Систем. требования : Intel Pentium
(или аналогичный процессор других производителей) 1 ГГц ; 512 Мб оперативной памяти ; 3 Мб свободного дискового
пространства ; привод DVD ; операционная система Microsoft Windows 2000 SP 4 / XP SP 2 / Vista (32 бит) ; Microsoft
PowerPoint 2003 или выше.
ISBN 978-5-7638-1078-3 (комплекса)
ISBN 978-5-7638-0934-3 (пособия)
Номер гос. регистрации в ФГУП НТЦ «Информрегистр» 0320802386 от 21.11.2008 г. (комплекса)
Номер гос. регистрации в ФГУП НТЦ «Информрегистр» 0320802384 от 22.11.2008 г. (пособия)
Настоящее издание является частью электронного учебно-методического комплекса по дисциплине «Химия», включающего учебную
программу,
учебное пособие, лабораторный практикум, методические указания по самостоятельной работе, а также контрольноизмерительные материалы «Химия. Банк тестовых заданий».
Представлена презентация (в виде слайдов) теоретического курса «Химия».
Предназначено для студентов нехимических специальностей технических вузов.
© Сибирский федеральный университет, 2008
Рекомендовано к изданию Инновационно-методическим управлением СФУ
Разработка и оформление электронного образовательного ресурса: Центр технологий электронного обучения информационно-аналитического
департамента СФУ; лаборатория по разработке мультимедийных электронных образовательных ресурсов при КрЦНИТ
Содержимое ресурса охраняется законом об авторском праве. Несанкционированное копирование и использование данного продукта запрещается. Встречающиеся
названия программного обеспечения, изделий, устройств или систем могут являться зарегистрированными товарными знаками тех или иных фирм.
Подп. к использованию 01.10.2008
Объем 3 Мб
Красноярск: СФУ, 660041, Красноярск, пр. Свободный, 79
4. Оглавление
• Строение атома и периодическая системаэлементов Д. И. Менделеева
• Теория химической связи и строение молекул
• Комплексные соединения
• Энергетика химических процессов
• Химическая кинетика и равновесие
• Растворы
• Дисперсные системы
• Электрохимические процессы
• Коррозия металлов
• Общая характеристика металлов
• Полимеры и олигомеры
• Химическая идентификация
4
5.
Строение атомаи периодическая система
элементов Д. И. Менделеева
6.
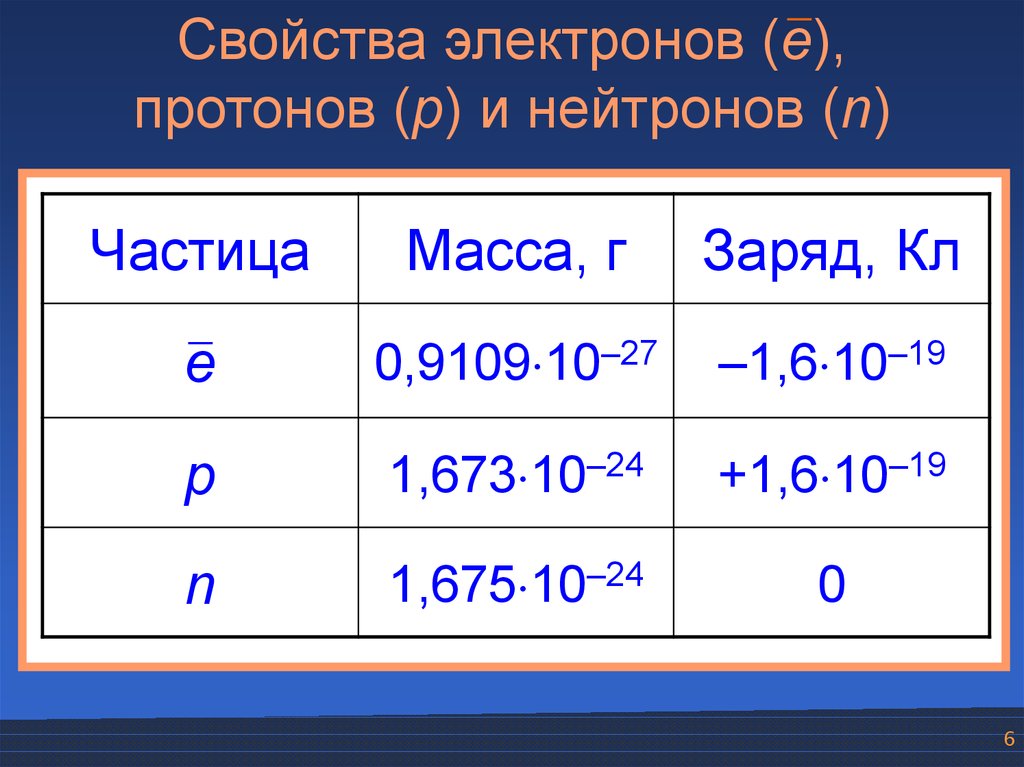
Свойства электронов (e),протонов (p) и нейтронов (n)
Частица
Масса, г
Заряд, Кл
e
0,9109 10–27
–1,6 10–19
p
1,673 10–24
+1,6 10–19
n
1,675 10–24
0
6
7.
Соотношение масс электронаи атома водорода
27
me 0,9109 10 г
1
24
mH
1,673 10 г 1837
–8
см.
–13
см.
Радиус атома 10
Радиус ядра 10
7
8.
Изотопы и изобарыИзотопы имеют одинаковые заряды
ядер,но различные атомные массы:
24Mg и 25Mg; 35Cl и 37Cl; 1H, 2H, 3H.
Изобары имеют одинаковые
массовые числа,но различные заряды
ядер и разные химические свойства:
40Ag, 40K, 40Ca;
54Fe, 54Cr.
8
9.
Двойственные свойстваэлектрона
Как частицы:
Как волны:
1. Дифракция.
1. Масса:
2. Заряд:
3. Спин:
me 9,1 10
e 1,6 10
mS 1
h
λ
mv
2
28
19
г.
Кл.
2. Интерференция.
3. Неопределенность
положения в пространстве
(принцип Гейзенберга).
уравнение
Бройля
(1924г).
уравнениедеде
Бройля
(1924 г.).
9
10.
Волновое уравнениеШредингера (1926 г.)
2
2
2
h2 2
e
H 2 2 2 2 E
8 m x y z r
или H E .
Волновые функции , являющиеся решениями
уравнения Шредингера, называют орбиталями
(s-, p-, d-, f-орбитали).
10
11.
Квантовые числаглавное (n) и орбитальное (l)
n – характеризует энергию электрона на
энергетическом уровне и удаленность его от ядра:
n = 1, 2, 3, …, .
l – характеризует энергию электрона на
энергетическом подуровне и форму электронного
облака (орбитали):
l = 0, 1, 2, …, (n – 1)
при l = 0 s-орбиталь,
l = 2 d-орбиталь,
l = 1 p-орбиталь,
l = 3 f-орбиталь.
11
12.
Формы электронных облаков12
13.
Квантовые числа:магнитное (ml) и спиновое (ms)
ml – определяет количество ориентаций электронных
облаков в пространстве и энергию электрона
в каждой ориентации:
ml = +l, …, 0, …, –l.
ms – характеризует вращение электрона вокруг
собственной оси по и против часовой стрелки:
ms = 1/2.
Спин – собственный угловой момент электрона.
13
14.
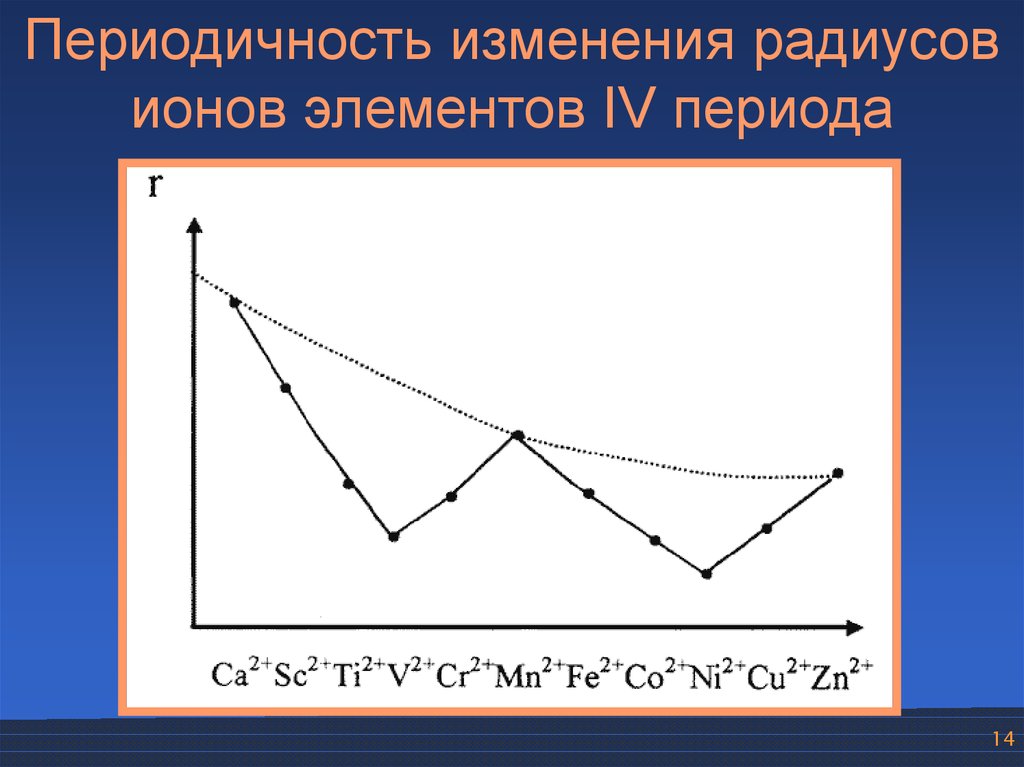
Периодичность изменения радиусовионов элементов IV периода
14
15.
Теория химической связии строение молекул
16.
Ковалентная связьНеполярная
Полярная
Очень полярная
ковалентная связь
ковалентная связь
ковалентная
или ионная связь
ЭОА=ЭОВ А=В
ЭОА ЭОВ
ЭОА << ЭОВ
NaCl, KBr …
H2, Cl2, O2, N2 … HCl, H2O, NH3 …
H:H
=0
H : Cl
+
–
> 0 до 3,5
Na
:Cl
+
–
> 3,5 до 10
+
– дипольный момент = l e, Д
–
–
l
16
17.
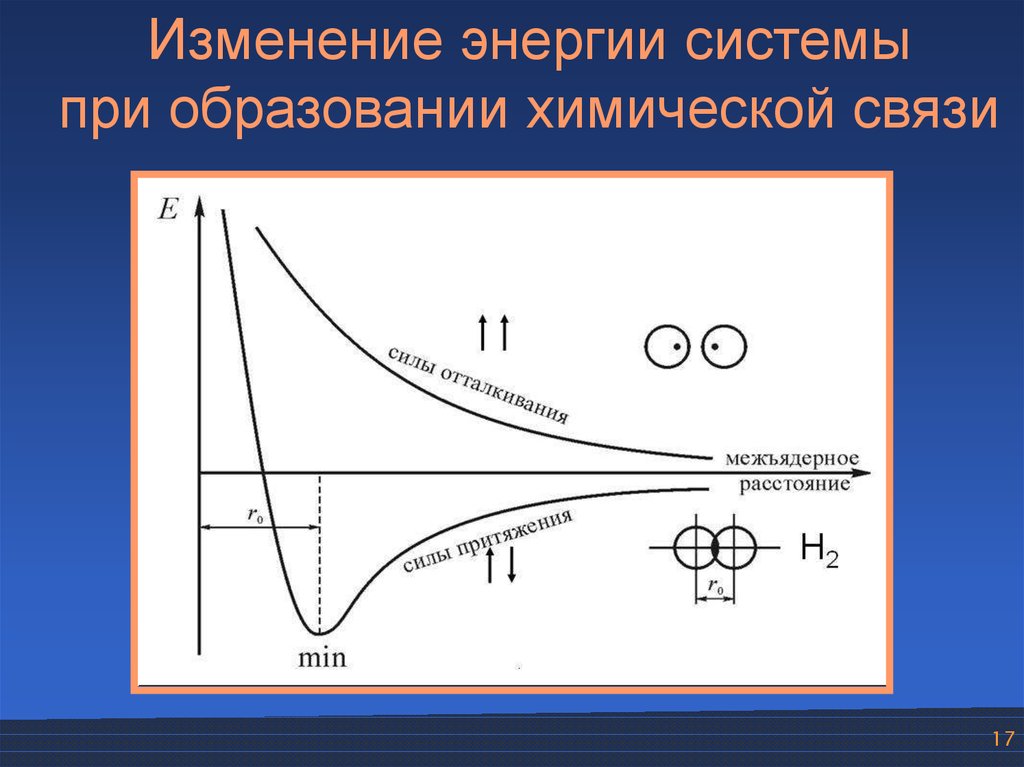
Изменение энергии системыпри образовании химической связи
17
18.
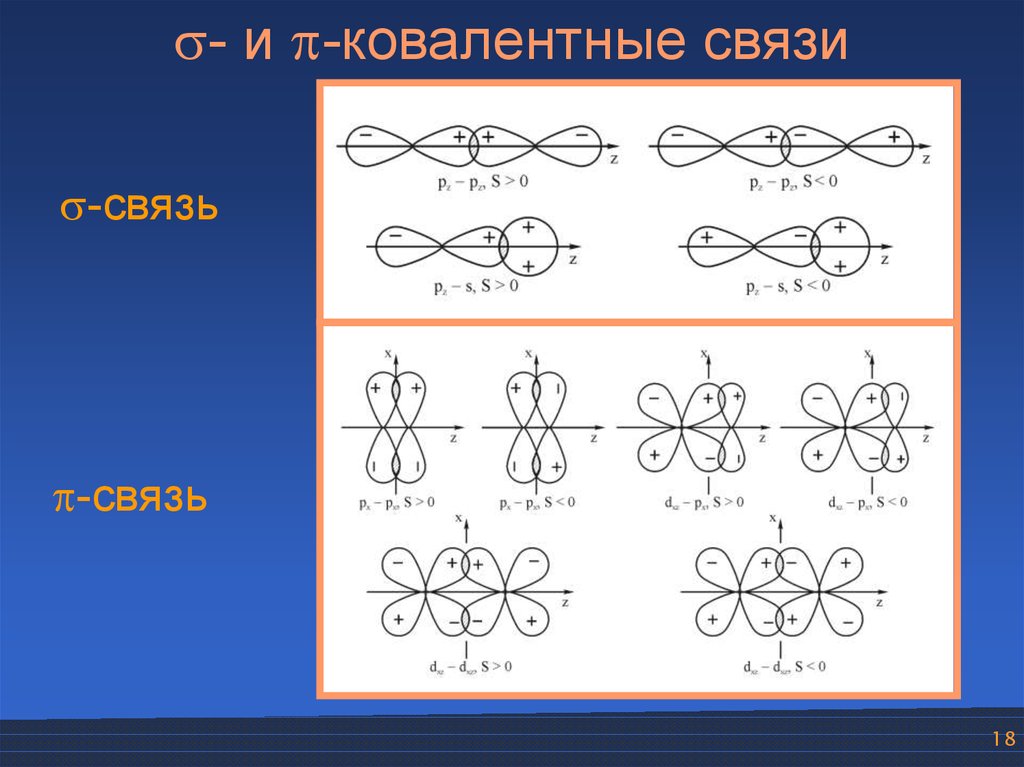
- и -ковалентные связи-связь
-связь
18
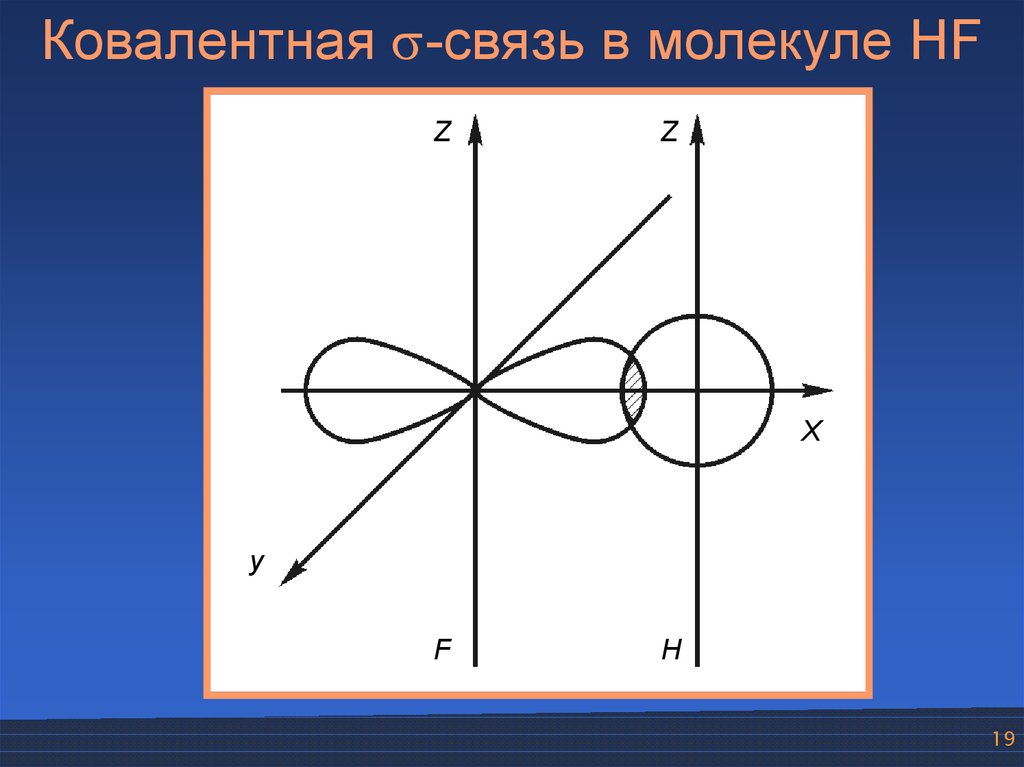
19.
Ковалентная -связь в молекуле HFZ
Z
X
y
F
H
19
20.
Образование - и -связив молекуле O2
Z
Z
2p
2S
2p
X
2S
y
y
20
21.
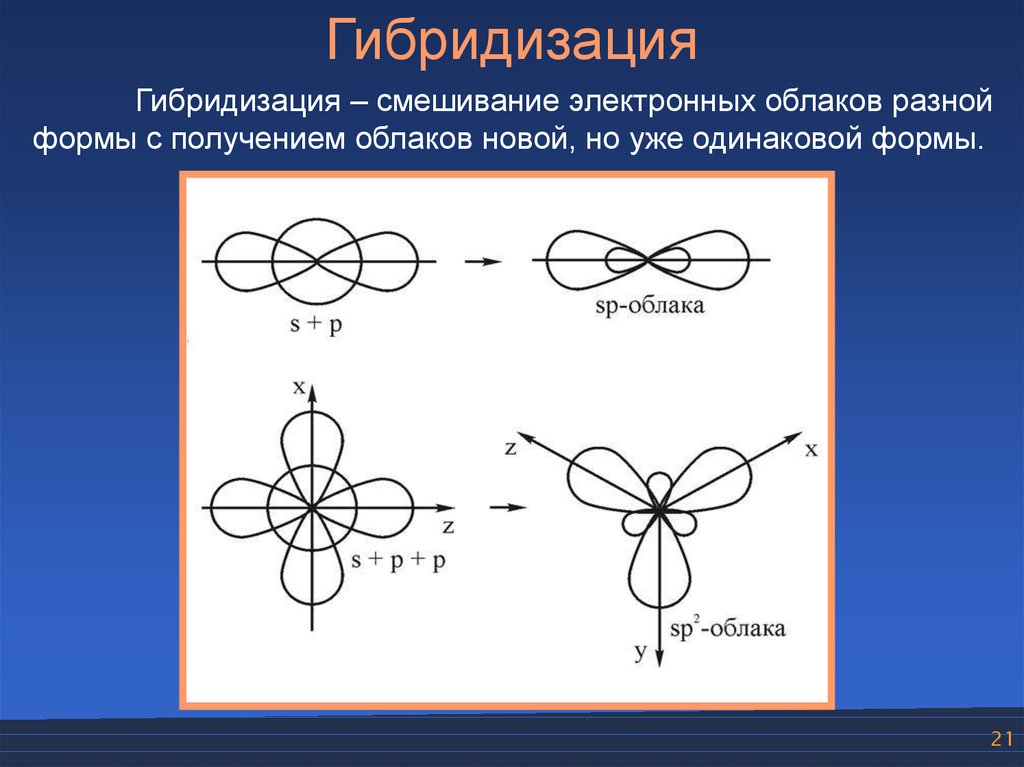
ГибридизацияГибридизация – смешивание электронных облаков разной
формы с получением облаков новой, но уже одинаковой формы.
21
22.
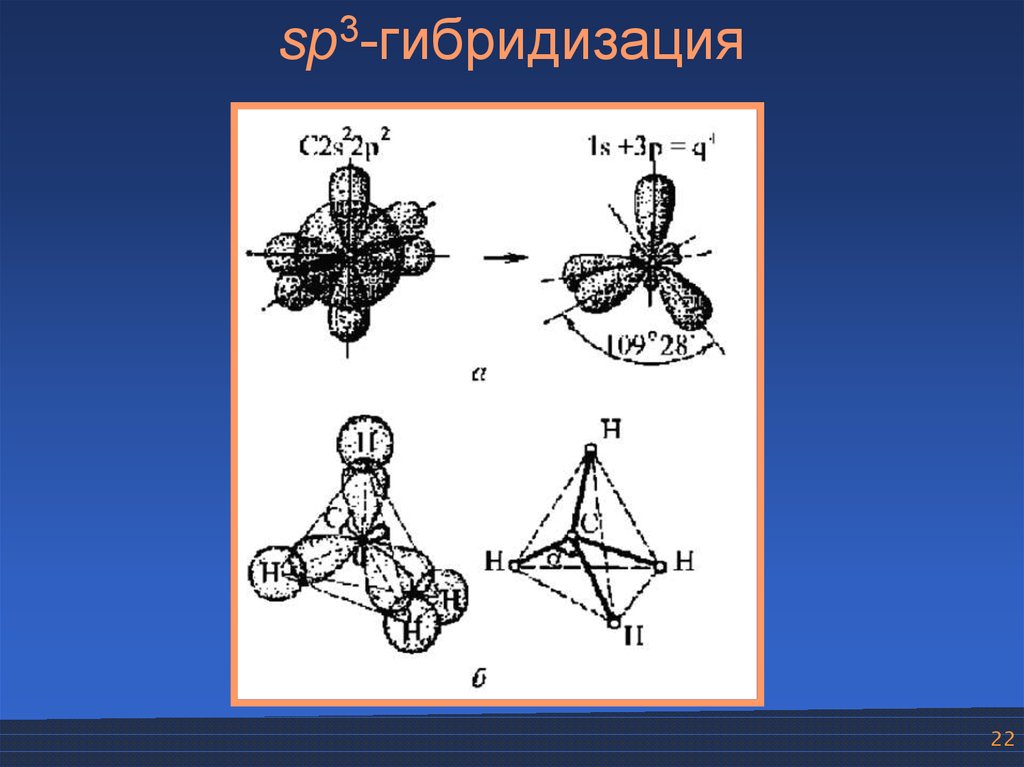
sp3-гибридизация22
23.
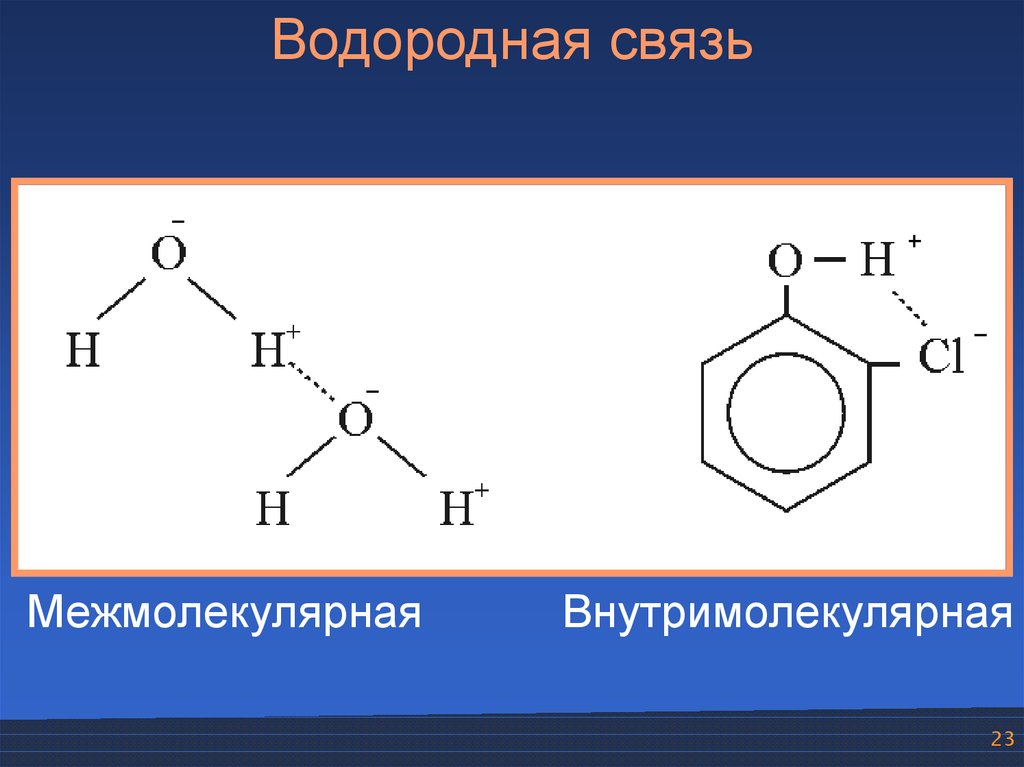
Водородная связьМежмолекулярная
Внутримолекулярная
23
24.
Межмолекулярное взаимодействие(силы Ван-дер-Ваальса, E)
E = Eориент. + Eинд. + Eдисп.
E – энергия ориентационного, индукционного
и дисперсионного взаимодействия молекул.
24
25.
Комплексные соединения26.
Комплексные соединения(строение)
Центральный атом (ц.а.)
или комплексообразователь
Лиганды
Na 2 Ni H 2O 2 NO3 4
Внешняя
сфера
Внутренняя сфера
или комплексный ион
Координационное
число (к.ч.)
Ц. а. – металлы: Fe2+, Co2+, Pt2+, Cu2+, Hg2+ …
неметаллы: N3+, B3+, P5+, Si4+, S6+ …
Лиганды – нейтральные молекулы: H2O, NH3, CO …
ионы: Cl–, Br–, SO42–, CN–, F–, I– …
К.ч. – 1, 2, 3, 4, 5, 6, 7, 8, 9, 12, чаще всего: 4 и 6.
26
27.
Комплексные соединенияКонстанта нестойкости
Na 2 Ni H 2O 2 NO3 4 Ђ 2Na + Ni H 2O 2 NO3 4
+
2–
Ni H 2O 2 NO3 4 Ђ Ni 2+ +2H 2O+4NO3–
2-
Ni H 2O NO
2
Ni H O NO
2
3 4
2
2
K нест
2
3
4
27
28.
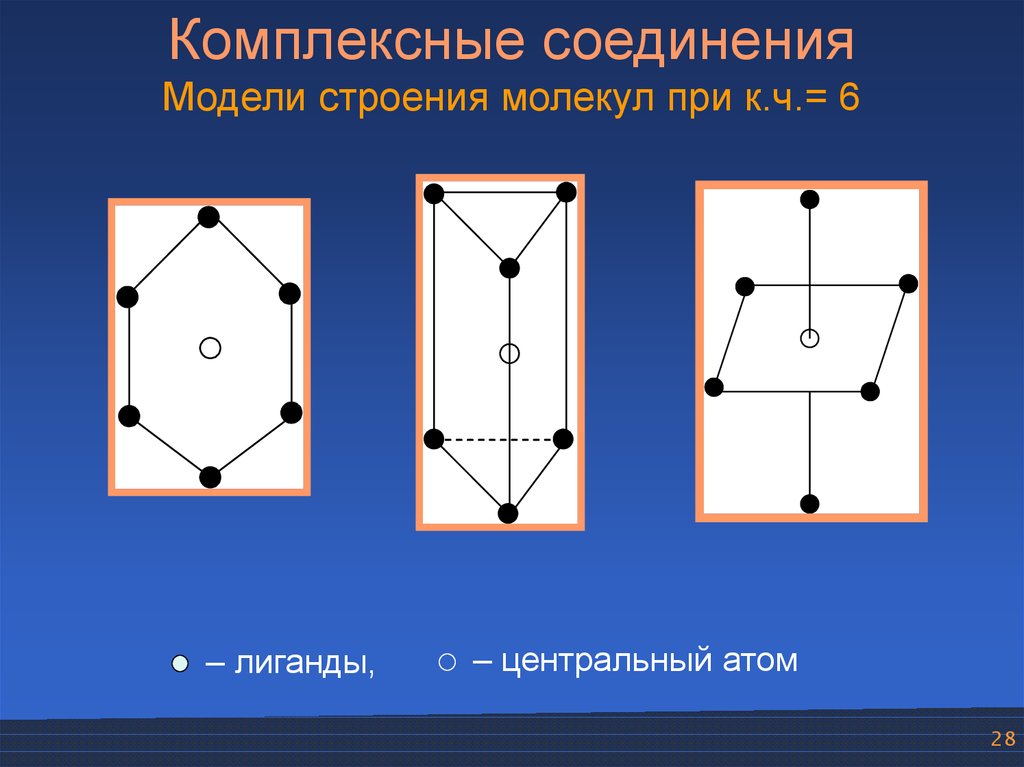
Комплексные соединенияМодели строения молекул при к.ч.= 6
– лиганды,
– центральный атом
28
29.
Комплексные соединенияо-, м-, п-изомеры, к.ч. = 6
X
X
NH3
X
NH3
NH3 NH3
NH3
NH3
NH3 NH3
NH3
NH3
NH3
X
NH3
ортоNH3, X –
X
металиганды,
X
пара-
– центральный атом
29
30.
Комплексные соединенияцис- и трансизомеры октаэдрической модели строения, к. ч. = 6
X
X
X
NH3
NH3
NH3
NH3
цис-
NH3, X – лиганды
NH3
NH3
NH3
NH3
X
транс-
– центральный атом
30
31.
Цис- и трансизомерыкомплексных соединений с к.ч. = 4
A
X
A
Pt
A
X
Pt
X
цисPt – центральный атом
X
A
трансA, X – лиганды
31
32.
Энергетика химических процессов33.
Внутренняя энергия (U)U=U1+U2+U3+U4+U5,
где U1 – энергия поступательного движения
молекул;
U2 – энергия вращательного движения молекул;
U3 – энергия движения электронов;
U4 – внутриядерная энергия;
U5 – энергия внутримолекулярных колебаний
электронов.
33
34.
Работа расширения газаCaCO3 +2HCl=CaCl2 +CO2- +H2O
ΔH=PV+ΔU
34
35.
Энтальпия ( Н), кДж/мольH хим.р-ции H конечн. H исходных
в-в
0
H обр
,298 стандартная энтальпия
в-в
образования вещества .
H
0
обр,298
простых веществ
O2 , H2 , Cl2 , N2 ...
0
H 0 в экзотермических реакциях,
H 0 в эндотермических реакциях.
35
36.
Изменение энтальпиив экзо- и эндотермических реакциях
36
37.
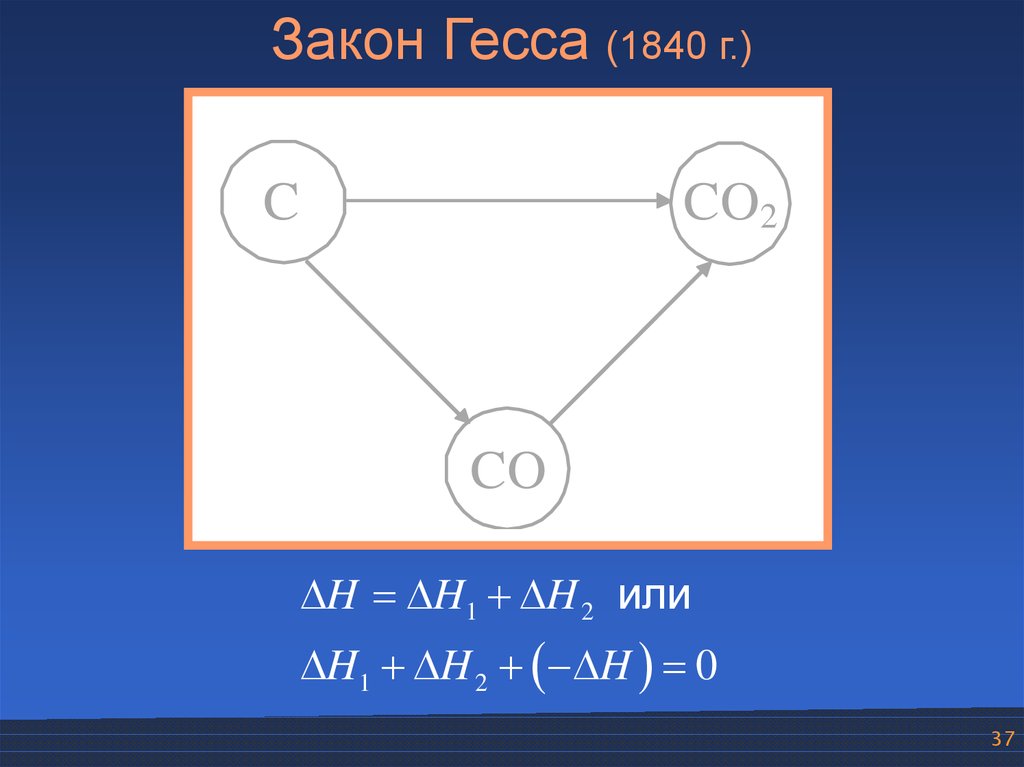
Закон Гесса (1840 г.)H
C
H1
CO2
H2
CO
H H1 H 2 или
H1 H 2 H 0
37
38.
Следствие из закона ГессаH х.р. H конечн. в-в H исх. в-в .
S х.р. Sконечн. в-в Sисх. в-в .
Gх.р. Gконечн. в-в Gисх. в-в .
38
39.
Энтропия (S), Дж/моль КS х.р. Sконечн. в-в Sисх. в-в ,
S
0
298
стандартная энтропия.
Стандартные условия:
T = 298 К,
P = 101,3 кПа = 1 атм.
39
40.
Энергия Гиббса ( G)(изобарно-изотермический потенциал)
кДж
G H T S ,
моль
,
Gх.р. Gконечн. в-в Gисх. в-в ,
G
0
обр ,298
G
0
обр ,298
простых веществ 0
O2 , H2 , Cl2 , N2 ...
– стандартная энергия Гиббса
образования вещества.
40
41.
Направленность химических реакций1. При G < 0 возможна прямая реакция.
2. При G > 0 невозможно протекание
прямой реакции,
но возможна обратная.
3. При G = 0 состояние химического
равновесия,
т. е. H = T S.
41
42.
Химическая кинетикаи равновесие
43.
Закон действия массПри постоянной температуре скорость реакции
прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их
стехиометрическим коэффициентам.
Vпр
N 2 3H 2
2NH3
Vобр
Vпр K1 N 2 H 2 ,
3
Vобр K 2 NH3 ,
2
где K1 и K2 – константы скорости реакции.
43
44.
Влияние температурына скорость химической реакции
Правило Вант-Гоффа
При повышении температуры на каждые 10
градусов скорость реакции возрастает в 2–4 раза:
2 4, Vt2 Vt1
t2 t1
10
,
где – температурный коэффициент;
V – скорость реакции.
44
45.
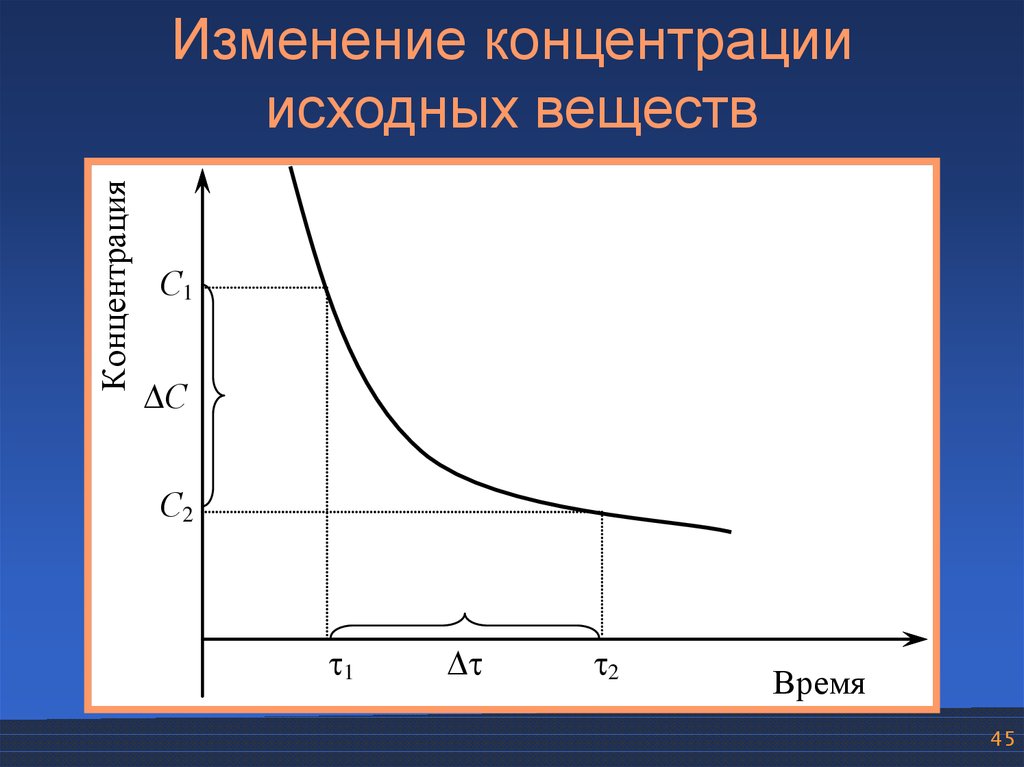
КонцентрацияИзменение концентрации
исходных веществ
С1
С
С2
1
2
Время
45
46.
Зависимость скорости реакцииот концентрации веществ
46
47.
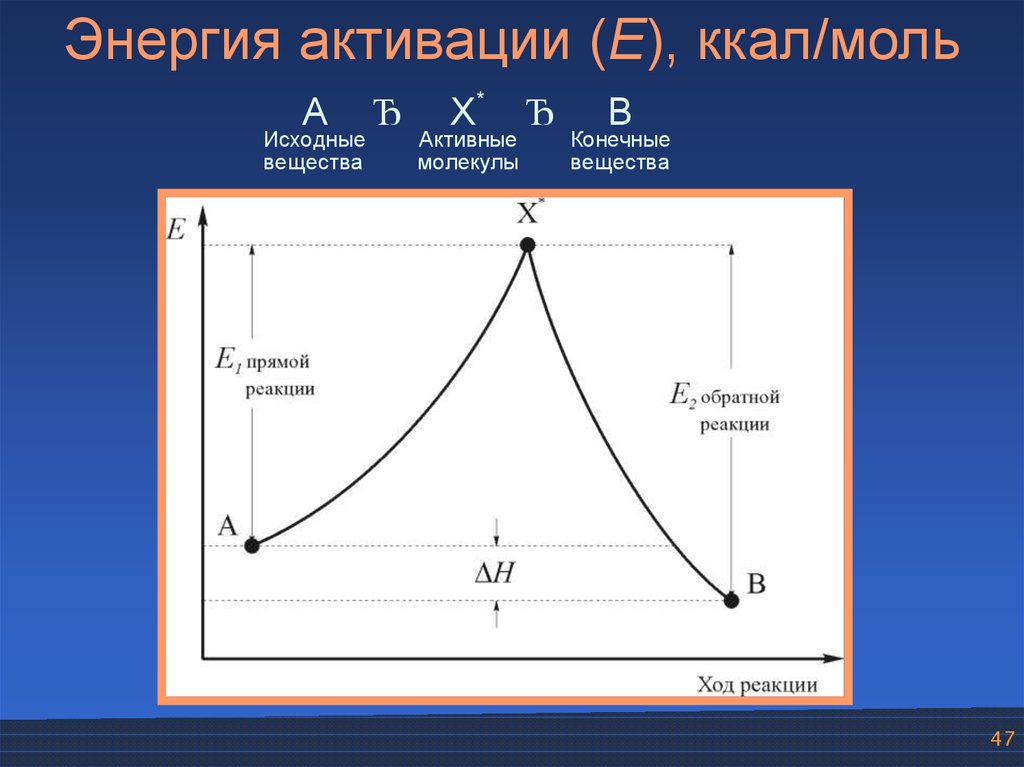
Энергия активации (E), ккал/мольA
Исходные
вещества
Ђ
X*
Активные
молекулы
Ђ
B
Конечные
вещества
47
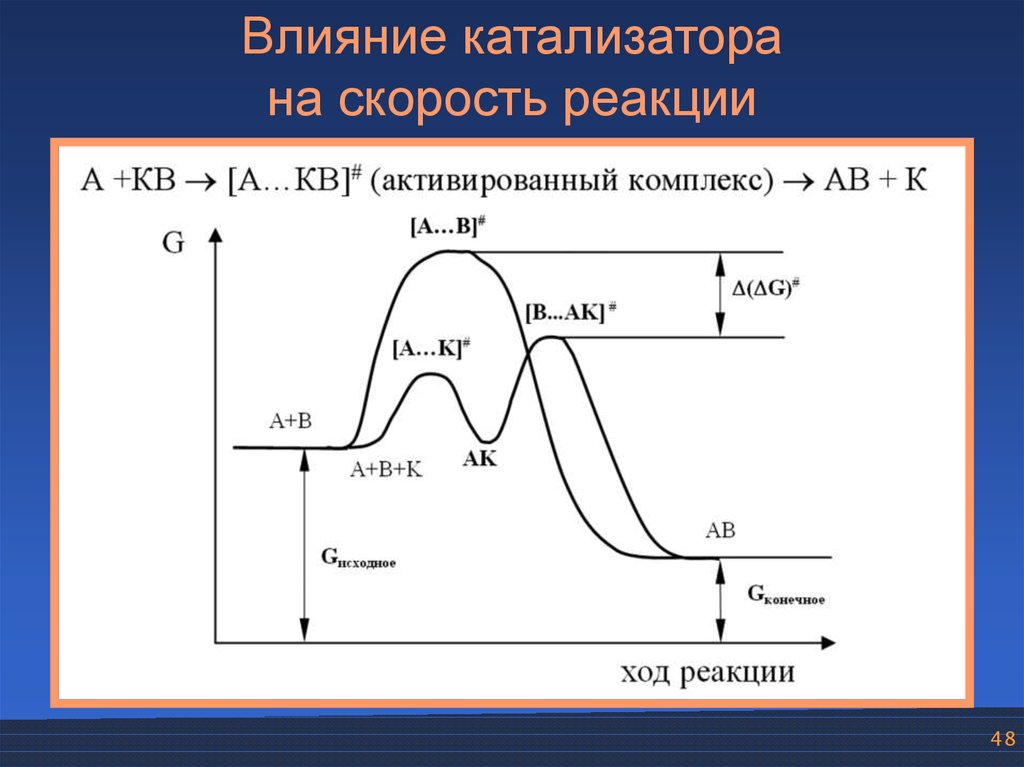
48.
Влияние катализаторана скорость реакции
48
49.
Химическое равновесиеКонстанта равновесия
Гомогенная реакция: 2H2(г) + O2(г) 2H2O(пар)
H 2O
K равн
.
2
H 2 O2
2
Гетерогенная реакция:
CaCO3(т) = CaO(т)+CO2(г).
Концентрации [CaCO3] и [CaO] при состоянии равновесия
постоянны.
K равн CO2 .
49
50.
Фазовые равновесияТвердое
вещество
Плавление
Испарение
Кристаллизация
Конденсация
Жидкость
Газ (пар)
Правило фаз Гиббса:
С = k – f + n,
где k – число независимых компонентов;
f – число фаз;
n – число внешних параметров, влияющих
на состояние фазового равновесия;
С – число степеней свободы, т. е. число параметров,
которые можно менять, не изменяя число фаз
в системе.
50
51.
Растворы52.
РастворыРазбавленные Концентрированные Насыщенные
Виды концентрации растворов
1. –
2. СM –
3. Сm –
4. СH –
моль/л.
5. T –
и др.
массовая доля вещества, % или доли единицы.
молярная концентрация, моль/л.
моляльная концентрация, моль/кг.
нормальная или эквивалентная концентрация,
титр раствора, г/мл
52
53.
РастворыСпособы выражения их концентрации
1. Массовая доля вещества ( ) показывает, какая
масса растворенного вещества содержится
в 100 г раствора:
mв-ва
100 %
mр-ра
или в долях единицы.
2. Молярная концентрация (СM) определяется количеством (n) моль растворенного вещества в 1 л
раствора:
n mв-ва 1000
СМ
, M молярная масса в-ва.
V
M V
53
54.
Растворы(продолжение)
3. Нормальная или эквивалентная концентрация (СH)
равна количеству (nЭ) эквивалентов
растворенного вещества в 1 л раствора:
nЭ mв-ва 1000
СН
.
V
M Э V
MЭ – молярная масса эквивалента растворенного вещества.
5. Титр раствора (T) соответствует числу грамм
растворенного вещества в 1 мл раствора:
mв-ва г
Т
,
.
мл
V
54
55.
Молярные массы эквивалентов (Мэ)M Э,кислоты
М кислоты
Основность
кислоты
M Э,основания
M Э,соли
M Э,оксида
, M Э,H2SO4
М основания
Кислотность
основания
98
49 г/моль,
2
, M Э,Al(OH)3
78
26 г/моль.
3
М соли
Число атомов Me × Валентность Me
, г/моль,,
М оксида
Число атомов элемента × Валентность элемента
, г/моль.
55
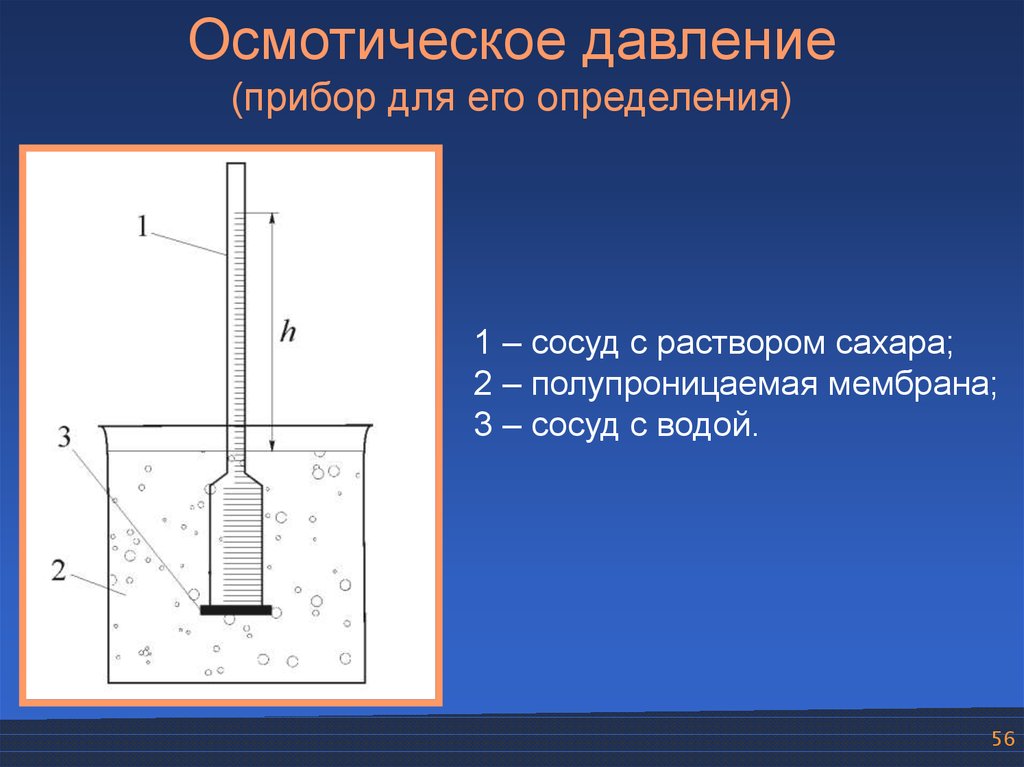
56.
Осмотическое давление(прибор для его определения)
1 – сосуд с раствором сахара;
2 – полупроницаемая мембрана;
3 – сосуд с водой.
56
57.
Гидролиз солейпо аниону
Na 2CO3 Ђ 2Na CO32
2
3
3
CO H OH HCO OH , pH 7
Na 2CO3 H 2O NaHCO3 OH , I ступень
ступень
HCO3 H OH H 2CO3 OH , pH 7
NaHCO3 H 2O H 2CO3 NaOH, IIII ступень
ступень
[
H2O
]
CO 2
57
58.
Гидролиз солейпо катиону
2
CuCl2 Ђ Cu 2Cl
2
Cu H OH CuOH H , pH 7
+
CuCl2 H 2O CuOHCl HCl, I ступень
I ступень
CuOH H OH Cu(OH) 2 H , pH 7
CuOHCl H 2O Cu(OH) 2 HCl, IIIIступень
ступень
58
59.
Жесткость водыЖ общ. =Ж врем. +Ж пост. ,
ммоль×экв
л
.
Соли временной жесткости воды:
Ca(HCO3)2, Mg(HCO3)2.
Соли постоянной жесткости воды:
CaCl2, CaSO4, Ca(NO3)2,
MgCl2, MgSO4, Mg(NO3)2.
59
60.
Способы устранения жесткости воды1. Термический:
T
Ca(HCO3 ) 2
CaCO3 CO 2 H 2O.
2. Реакция катионирования:
2HR Ca
Ca 2 (Mg 2+ ) Ђ Ca(Mg)R 2 2H .
3. Реагентный:
CaSO 4 Na 2CO3 CaCO3 Na 2SO 4 ,
3MgCl2 2 Na3PO 4 Mg 3 (PO 4 ) 2 6NaCl.
60
61.
Схема растворенияионного кристалла
61
62.
Дисперсные системы63.
Классификациядисперсных частиц
Название системы
Характер и размеры
частиц, м
Гетерогенность
и устойчивость
Грубодисперсные
системы
(суспензии,
эмульсии,
аэрозоли)
Крупные частицы,
10–5 – 10–7
Гетерогенны,
неустойчивы
Коллоиднодисперсные
системы (золи)
Коллоидные частицы,
10–7 – 10–9
Микрогетерогенны,
довольно
устойчивы
Истинные
растворы
Молекулы, ионы, 10–10
Гомогенны,
устойчивы
63
64.
Строение мицеллы{m[AgJ] nJ– (n – x) K+}x K+
m[AgJ] – агрегат;
m[AgJ] nJ– – ядро;
{m[AgJ] nJ– (n–x)K+} – коллоидная частица.
64
65.
Электрохимические системы66.
Окислительно-восстановительные реакцииZn H 2SO 4 (разб.) ZnSO 4 H 2
Zn 2e Zn
0
2
–
процесс окисления,
Zn восстановитель.
0
2H 2e H 02 – процесс восстановления,
H окислитель.
Окисление – процесс отдачи электронов атомом или ионом.
Восстановление – процесс присоединения электронов
атомом или ионом.
66
67.
Окислительно-восстановительныесвойства металлов
+2
+3
Cr
CrO
+6
Cr
оксид Cr(II)
Cr(OH)2
гидроксид Cr(II)
Cr2O3
Cr
оксид Cr(III)
Cr(OH)3
CrO3
оксид Сr(YI)
H2CrO4
гидроксид Cr(III)
хромовая кислота
или H3CrO3
Сr(OH)2 Cr2+ + 2OH–
Основные свойства
H2CrO4 2H+ + CrO42–
Кислотные свойства
Cr3+ + 3OH– Cr(OH)3 H3CrO3 3H+ + CrO33–
Амфотерные свойства
67
68.
Водородный электрод2H
H 2 , Pt
моль
При H 1
л
P 1 атм, t 298 К
ЭДС
= 00
68
69.
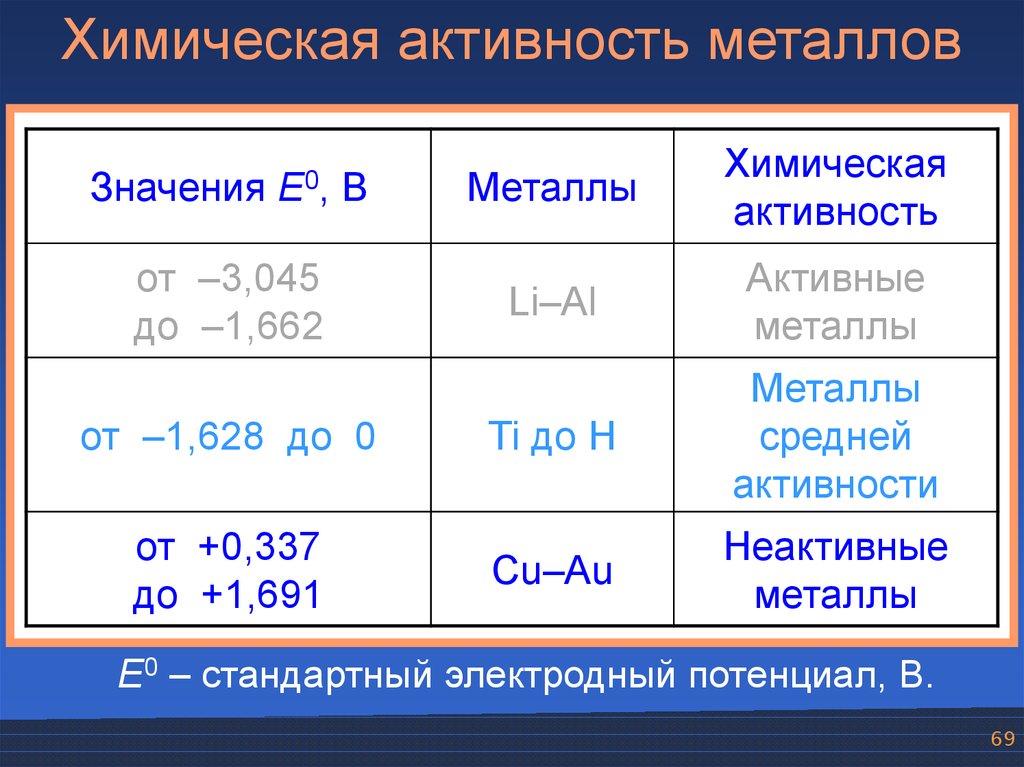
Химическая активность металловЗначения
E0,
В
от –3,045
до –1,662
от –1,628 до 0
от +0,337
до +1,691
Металлы
Химическая
активность
Li–Al
Активные
металлы
Ti до H
Металлы
средней
активности
Cu–Au
Неактивные
металлы
E0 – стандартный электродный потенциал, В.
69
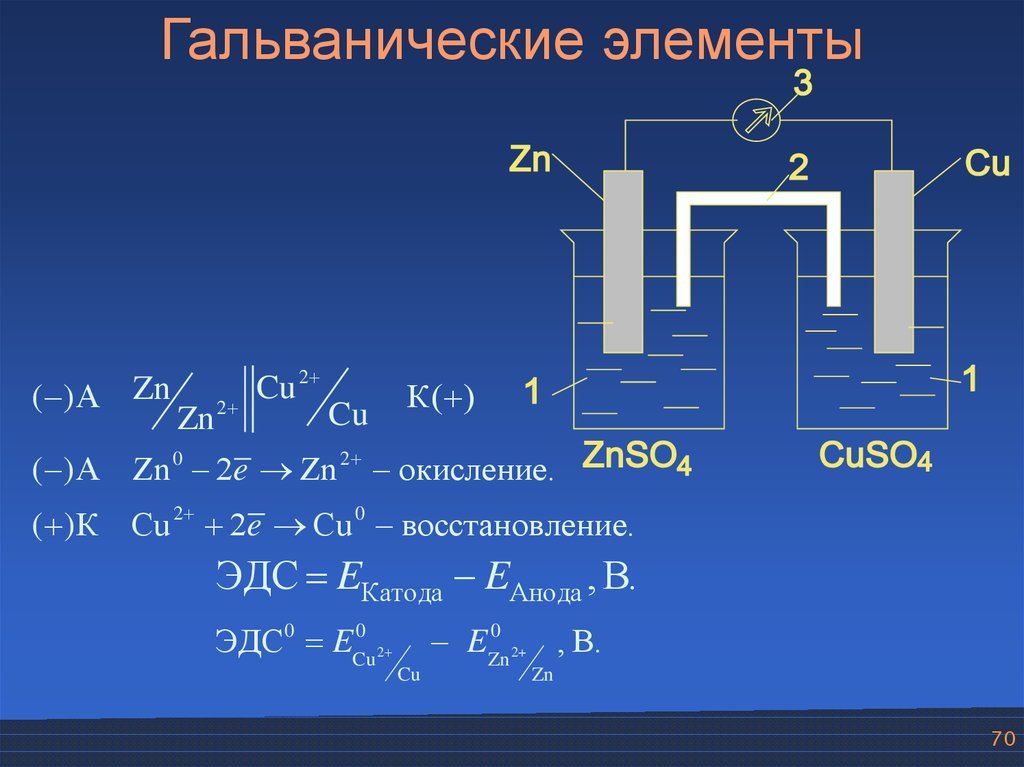
70.
Гальванические элементы( )А Zn
2
Cu 2
Cu
К( )
Zn
( )А Zn 0 2e Zn 2 окисление.
( )К Cu 2 2e Cu 0 восстановление.
ЭДС EКатода EАнода , В.
0
ЭДС0 ECu
2
Cu
0
EZn
, В.
2+
Zn
70
71.
Уравнение НернстаE
Men
0,059
E n
lg C n
Me
Me
n
Me
0
Me
Концентрационный гальванический элемент
( ) A Zn / 0,001M ZnSO 4 0,1М ZnSO 4 / Zn
K ( )
( ) A Zn 0 2e Zn 2 окисление.
( ) K
Zn 2 2e Zn 0 восстановление.
0,059 CMen (катода) 0,059
0,1
ЭДСк.г.э.
lg
lg
0,59 В.
n
CMen (анода)
n
0,001
71
72.
ЭлектролизЗакон Фарадея
MЭ I MЭ I
m
.
F
96494
Перенапряжение (En)
En Eразл.(практ.) Eразл.(теор.) , В.
Eразл. потенциал разложения вещества, В.
72
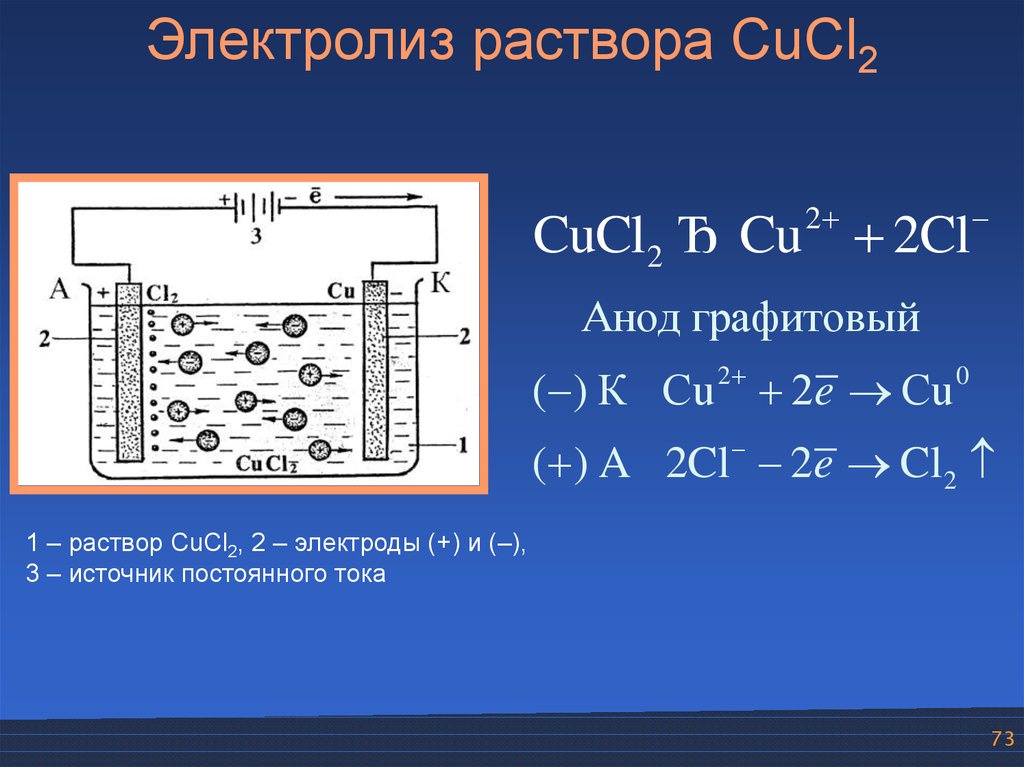
73.
Электролиз раствора CuCl22
CuCl2 Ђ Cu 2Cl
Анод графитовый
2
( ) К Cu 2e Cu
0
( ) A 2Cl 2e Cl2
1 – раствор CuCl2, 2 – электроды (+) и (–),
3 – источник постоянного тока
73
74.
Электролиз. Процессы на катоде1. Катионы активных металлов на катоде не
восстанавливаются, вместо них выделяется водород
из воды по уравнению
(–) К 2Н2О + 2ē = Н2 + 2ОН– или 2Н+ + 2ē = Н2 .
2. Катионы металлов средней активности –
восстанавливаются одновременно с молекулами воды:
(–) К Men+ + nē = Me0.
и
2Н2О + 2ē = Н2 + 2ОН–.
3. Катионы малоактивных металлов сами
восстанавливаются на катоде:
(–) К Men+ + nē = Me0.
74
75.
Электролиз. Процессы на анодеНерастворимый анод
1. Бескислородные кислотные остатки окисляются на аноде:
(+) А
2Cl – 2ē = Cl2 .
2. Кислородсодержащие кислотные остатки
НЕ ОКИСЛЯЮТСЯ на аноде, выделяется кислород из воды:
(+) А
(+) А
2H2O – 4ē = O2 + 4H+,
или
4OH– – 4ē = 2H2O + O2 .
Растворимый анод
(+) А
Me0 – nē = Men+.
75
76.
Электролиз расплава NaClNaCl Ђ Na +Cl .
+
Катод ( )
Na +e Na .
+
0
-
Анод (+)
2Cl -2e Cl2 .
-
76
77.
Электролиз водного раствора NaClNaCl Ђ Na +Cl .
+
Катод ( )
-
Анод (+)
2H2O 2e H 2 2OH , 2Cl -2e Cl2 .
-
В растворе : Na OH Ђ NaOH.
77
78.
Коррозия металлов79.
Виды коррозииКоррозия
Электрохимическая
Химическая
Газовая
Жидкостная
коррозия
коррозия
Электрокоррозия
(под действием внешнего
электрического тока)
Гальванокоррозия
(самопроизвольное
возникновение
микрогальванических элементов)
79
80.
Контактнаяэлектрохимическая коррозия
( ) А Zn | H | Cu K ( )
( ) А Zn 0 2e Zn 2
( ) К 2H 2e H 2
80
81.
Анодное покрытиеАнодное покрытие – металл покрытия более активен (–А),
чем защищаемый металл (+К).
Оцинкованное железо
Zn (–) А
Fe (+) К
K
Fe
в кислой среде
Е0Zn2+/Zn = –0,76В E0Fe2+/Fe = –0,44 В
(–) A Zn H2SO4 Fe (+) К
(–) А Zn0 – 2e Zn2+
в раствор
(+) К 2Н+ + 2е Н2 .
2+
В растворе: Zn
+ SO42– = ZnSO4.
81
82.
Катодное покрытиеКатодное покрытие – металл покрытия МЕНЕЕ АКТИВЕН(+К),
чем защищаемый металл (–А).
Никелированное железо
Е0Zn2+/Zn = –0,76В
E0Ni2+/Ni = –0,25В
Ni (+) К
(–) A Fe O2, Н2О Ni К (+)
Fe (–)
Fe
(–)АA
(–) А Fe0 – 2e Fe2+
в щелочной
или нейтральной среде
в раствор
(+) К О2 + 2Н2О + 4е 4ОН –.
+ 2OH– = Fe(OH)2
4Fe(OH)2 + O2 + 2H2O = 4 Fe(OH)3.
2+
В растворе: Fe
82
83.
Протекторная защитаПротектор-металл более активный,
чем защищаемый металл
Внешний проводник
Защищаемый
металл
Fe
Протектор
В кислой среде
E0Fe2+/Fe = –0,44 В
Zn
Е0Zn2+/Zn = –0,76 В
(–) А Zn H+ Fe (+) K
(–) A Zn0 – 2ē → Zn2+ – окисление;
(+) К
2Н+ + 2ē → Н2↑ – восстановление.
83
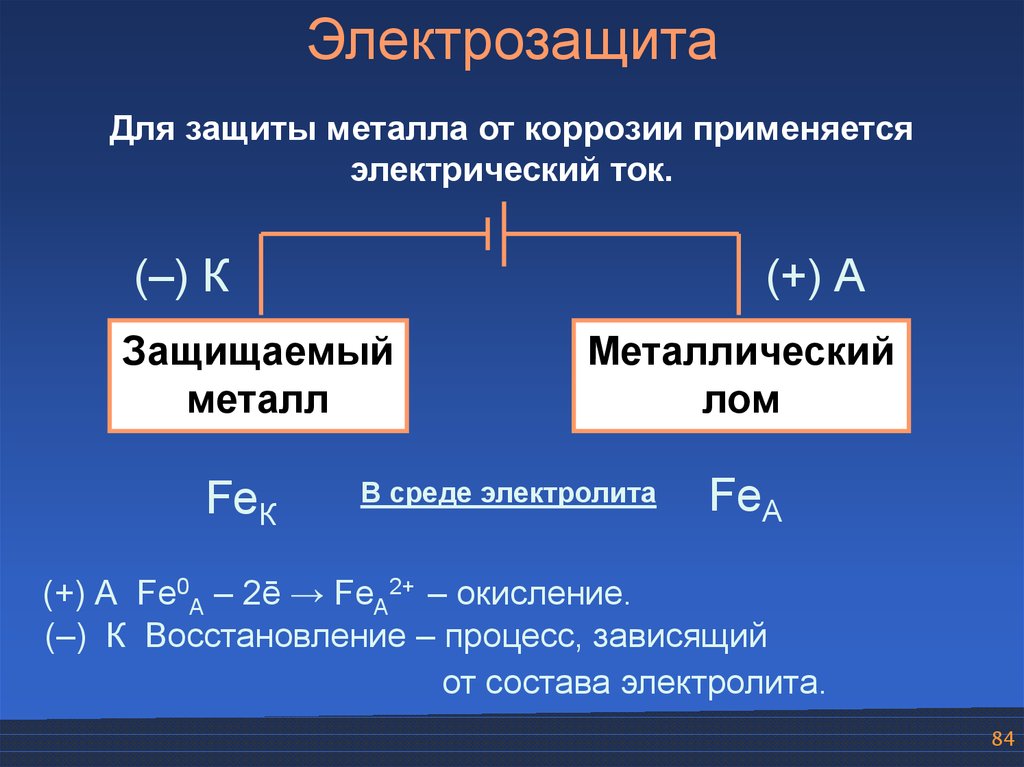
84.
ЭлектрозащитаДля защиты металла от коррозии применяется
электрический ток.
(–) К
(+) А
Защищаемый
металл
FeК
Металлический
лом
В среде электролита
FeА
(+) А Fe0А – 2ē → FeА2+ – окисление.
(–) К Восстановление – процесс, зависящий
от состава электролита.
84
85.
Общая характеристикаметаллов
86.
Минералы металлов в природеОксиды
Fe2O3 – гематит, Al2O3 nH2O – боксит, Cu2O – куприт
Сульфиды
FeS2 – пирит, ZnS – сфалерит, PbS –галенит
Сульфаты
CaSO4 2H2O – гипс, BaSO4 – барит
Карбонаты
CaCO3 – кальцит, CaCO3 MgCO3 – доломит
Хлориды
KCl – сильвин, NaCl KCl – сильвинит
и другие
86
87.
Взаимодействие металловс водой, щелочами
t
Mg(OH)2 + H2
Mg + 2H2O
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
Be + 2NaOH = Na2BeO2 + H2
2Nb +5KNO3 + 2NaOH = 2NaNbO3 + 5KNO2 + H2O
87
88.
Взаимодействие металловс разбавленными HCl и H2SO4
Zn 2HCl ZnCl2 H 2
Zn 2 e Zn
0
2
восстановитель Zn ;
2H 2 e H 2 окислитель H .
Mg H 2SO4 MgSO4 H 2 .
Mg 2 e Mg
0
2
восстановитель Mg ;
2H 2 e H 2 окислитель H .
88
89.
Взаимодействие металловс концентрированной серной кислотой
а
)
H
S
2
Z
Me+H 2SO 4 Me 2n+ SO4 n +H 2O+ б) S
]
в) SO2-
Сера изменяет степень окисления
от +6 до: а) – 2; б) 0; в) +4.
89
90.
Взаимодействие металловс разбавленной азотной кислотой
Z
а) NH3 ,
Me+HNO3 Men+ NO3 n +H 2O+ б) N 2 ,
]
NH4 NO3
N2O
в) NO
Азот изменяет степень окисления
от +5 до: а) –3; б) 0, +1; в) +2.
90
91.
Взаимодействие металловс концентрированной азотной кислотой
Me HNO3 ( конц.) Me
n
NO3 n H2O NO2
Cu 4HNO3 ( конц ) Cu NO3 2 2H 2O 2NO 2
Cu 2e Cu
0
5
N e N
4
2
восстановитель Cu ;
окислитель N
0
5
.
91
92.
Взаимодействие металловс неметаллами
Оксиды – Na2O, BaO.
Нитриды – Na3N, AlN.
Пероксиды – Na2O2, BaO2. Карбиды – Be2C, Ca2C.
Галиды – KCl, CaF2.
Фосфиды – Ca3P2, Na3P.
Сульфиды – MnS, Al2 S3.
Бориды – AlB, Mg3B2.
Гидриды – LiH, CaH2.
Силициды – Mg2Si, Al4Si3.
92
93.
Способы получения металлов из руд• пирометаллургия;
• гидрометаллургия;
• электрометаллургия;
• химические методы.
93
94.
Пирометаллургические способыполучения металлов из руд
1. Карботермический (восстановители C и CO):
t
Fe2O3 3CO
2Fe 3CO 2 ;
t
Cu O C
2Cu CO .
2
2. Металлотермический (восстановители Mg, Al,
Ca…):
t Ti 2MgCl ;
TiCl4 2Mg
2
t 2Cr 2Al O .
Cr2O3 2Al
2 3
3. Силикатометрический (восстановитель Si):
t
MnO2 Si
Mn SiO2 .
94
95.
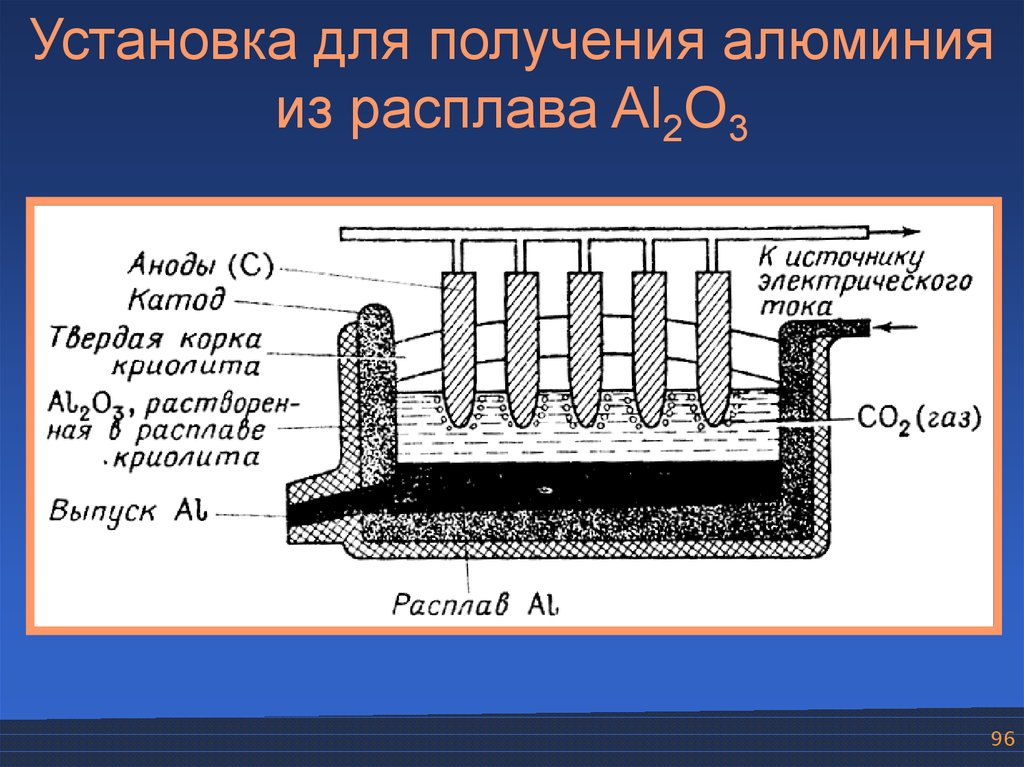
Электрометаллургический способt Al3+ + AlO 3–
Al2O3
3
(–) К Al3+ + 3ē → Al
(+) А AlO33– + 3С – 6ē → Al3+ 3СО
95
96.
Установка для получения алюминияиз расплава Al2O3
96
97.
Химический метод очистки металлов100 200 C
Ti 2 J 2 TiJ 4
черновой
1300 1500 C
TiJ 4 Ti 2J 2
чистый
97
98.
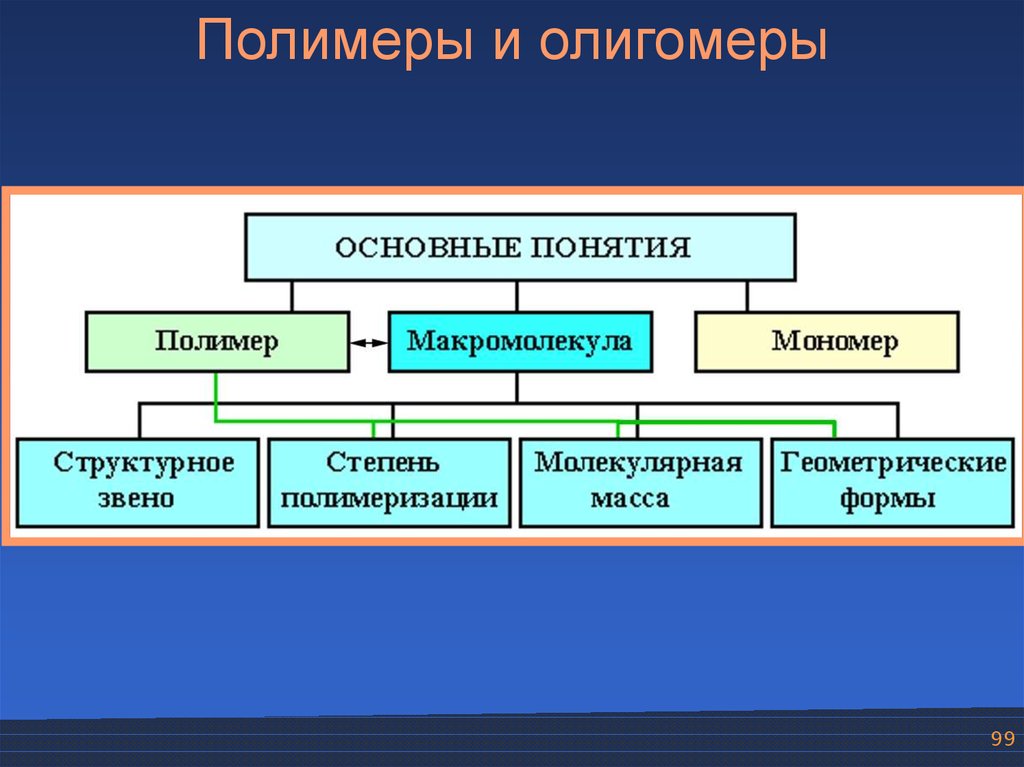
Полимеры и олигомеры99.
Полимеры и олигомеры99
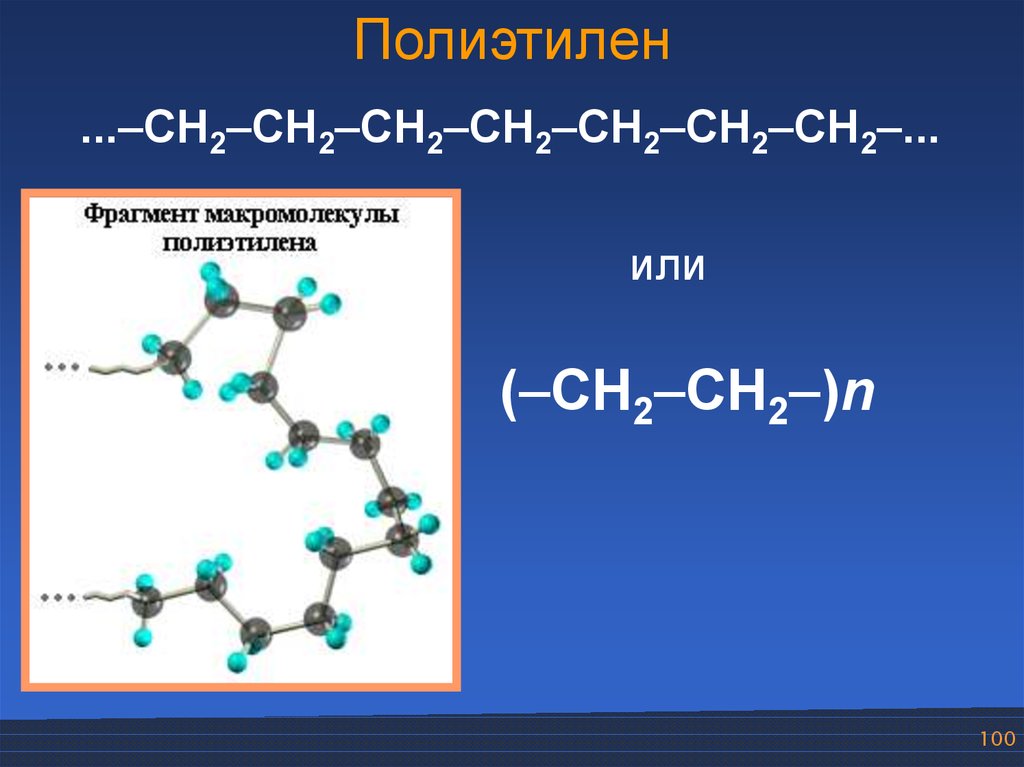
100.
Полиэтилен...–CH2–CH2–CH2–CH2–CH2–CH2–CH2–...
или
(–CH2–CH2–)n
100
101.
Мономеры и полимерыПропилен СН2=СH–CH3 – мономер полипропилена
-аминокислоты – мономеры природных полимеров
– белков (полипептидов):
101
102.
Степень полимеризацииСтепень полимеризации (n) показывает, сколько
молекул мономера соединилось в макромолекулу.
n >> 1
102
103.
Классификация полимеровПо происхождению
природные
синтетические
искусственные
По геометрической
форме
линейные
разветвленные
сетчатые (трехмерные)
По свойствам при нагревании
термопластичные
термореактивные
По однородности звеньев
гомополимеры
сополимеры
По методу синтеза
полимеризационные
поликонденсационные
По составу и химическому строению
гомоцепные
гетероцепные
103
104.
Гомоцепные полимерыПолиэтилен
Политетрафторэтилен
Полиизобутилен
Поливинилацетат
Поливинилхлорид
(полихлорвинил)
Полиакриловая
кислота
104
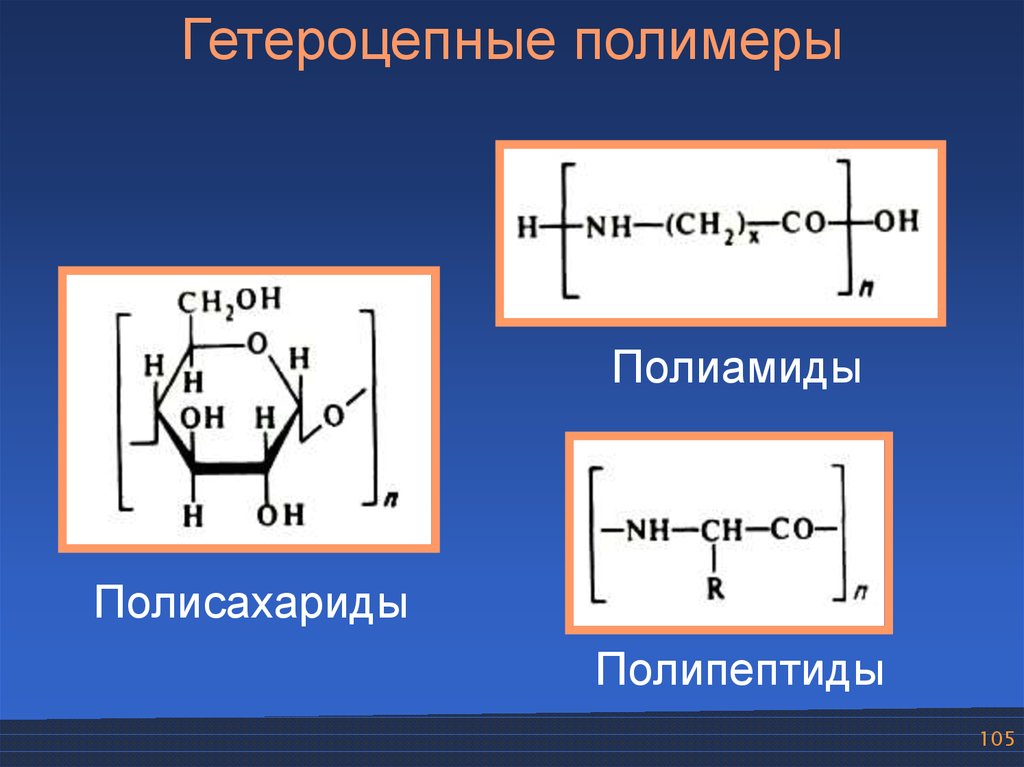
105.
Гетероцепные полимерыПолиамиды
Полисахариды
Полипептиды
105
106.
Физико-химическиеметоды анализа
107.
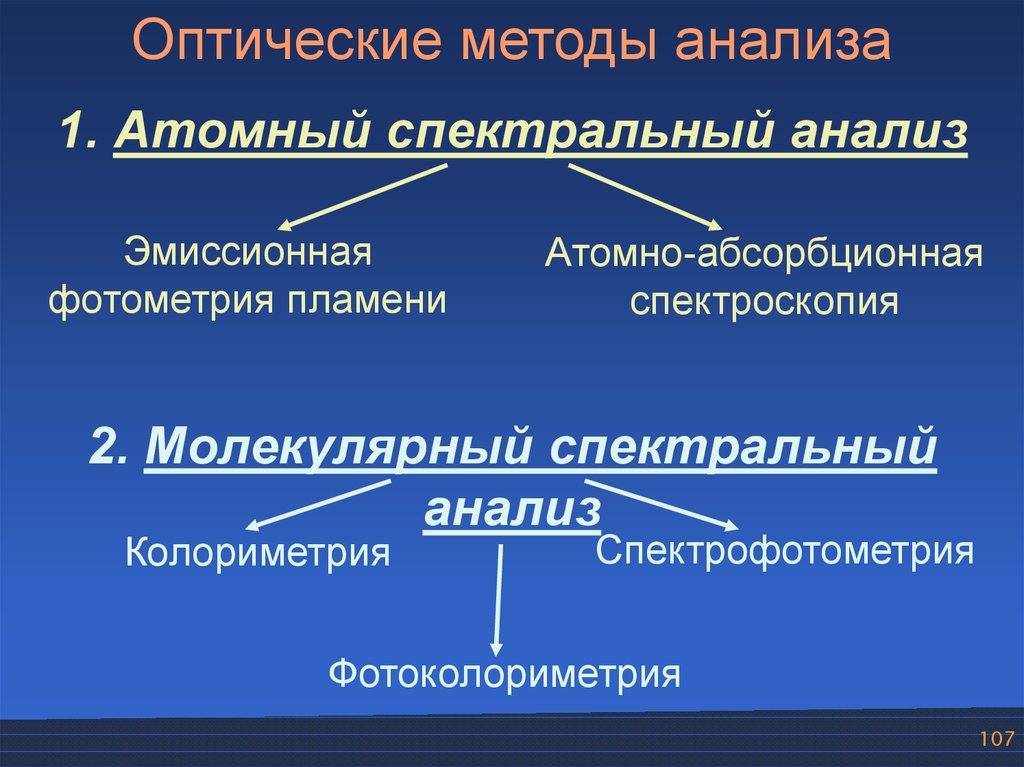
Оптические методы анализа1. Атомный спектральный анализ
Эмиссионная
фотометрия пламени
Атомно-абсорбционная
спектроскопия
2. Молекулярный спектральный
анализ
Колориметрия
Спектрофотометрия
Фотоколориметрия
107
108.
Оптические методы анализа(продолжение)
3. Люминисцентный метод анализа
Нефелометрия
Турбидиметрия
4. Рефрактометрический анализ
5. Поляриметрический метод
анализа
108
109.
Классификацияэлектрохимических методов анализа
Метод
Измеряемый параметр
Потенциометрия
Электродный потенциал Е, В
Кондуктометрия.
Высокочастотная
кондуктометрия
Электрогравиметрия
Удельная электропроводность ,
См см–1
Масса m, г
Кулонометрия
Количество электричества Q,
Кл
Вольтамперометрия
Сила тока I, мкА
109
110.
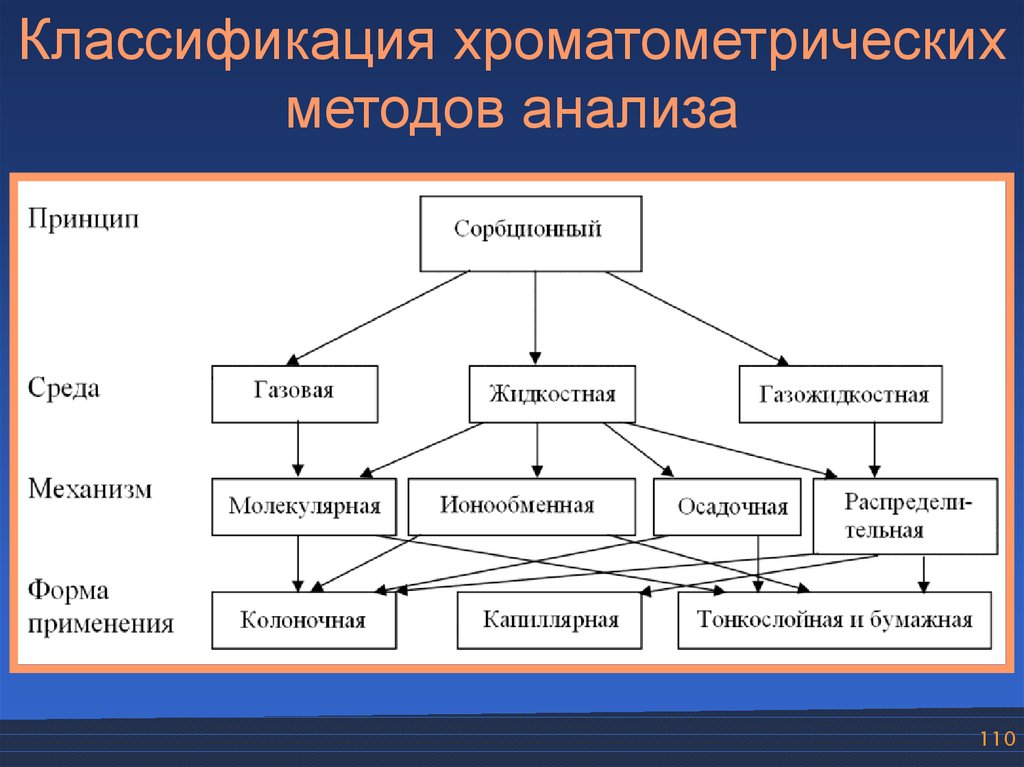
Классификация хроматометрическихметодов анализа
110




















































































 chemistry
chemistry








