Similar presentations:
Структура белка
1. Структура Белка
2. Структурная организация пептидов и белков
1. Первичная, вторичная структура белка2. Третичная и четвертичная структура
белка
3. Классификация белков: протеины и
протеиды
4. Химия простых и сложных белков
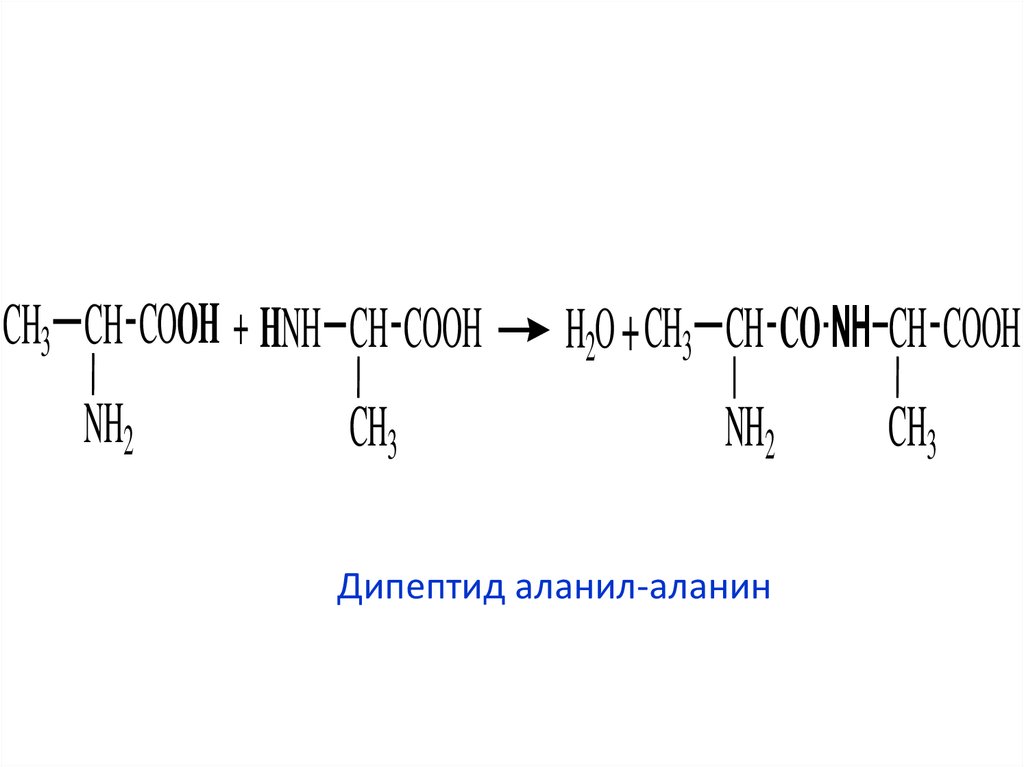
3. Дипептид аланил-аланин
CH3 CH COOH + HNH CH COOHNH2
CH3
H2O + CH3 CH CO NH CH COOH
NH2
Дипептид аланил-аланин
CH3
4. Пептиды
Пептиды - имеют Мм до 5000 дальтон (50аминокислотных остатка)
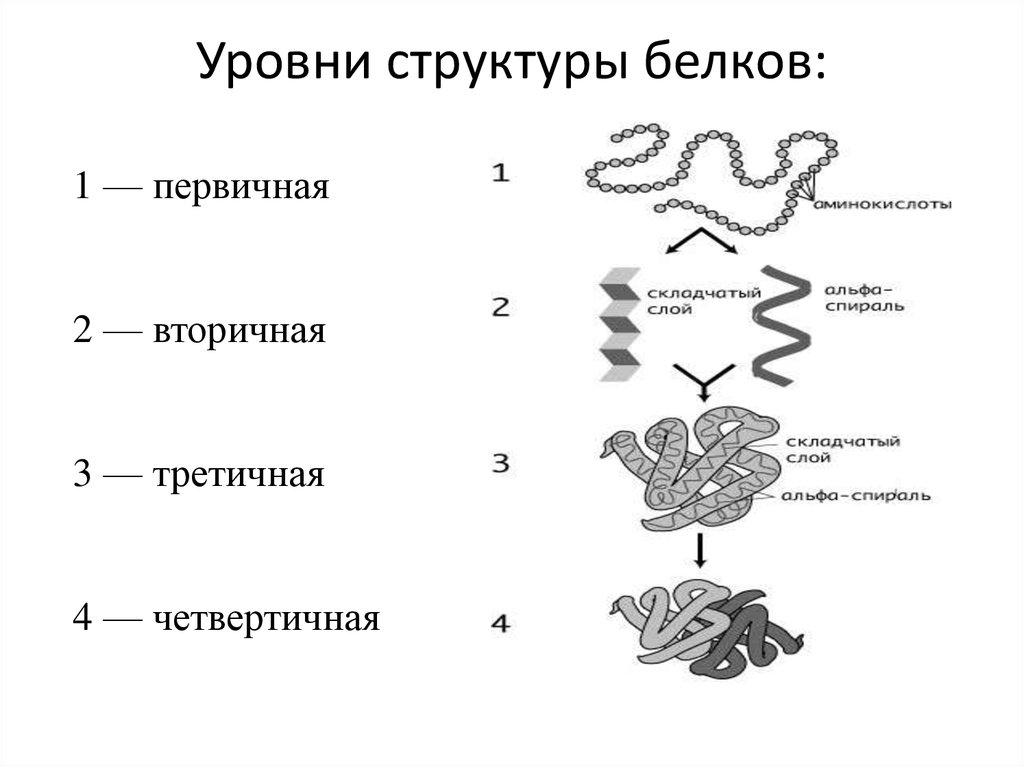
5. Уровни структуры белков:
1 — первичная2 — вторичная
3 — третичная
4 — четвертичная
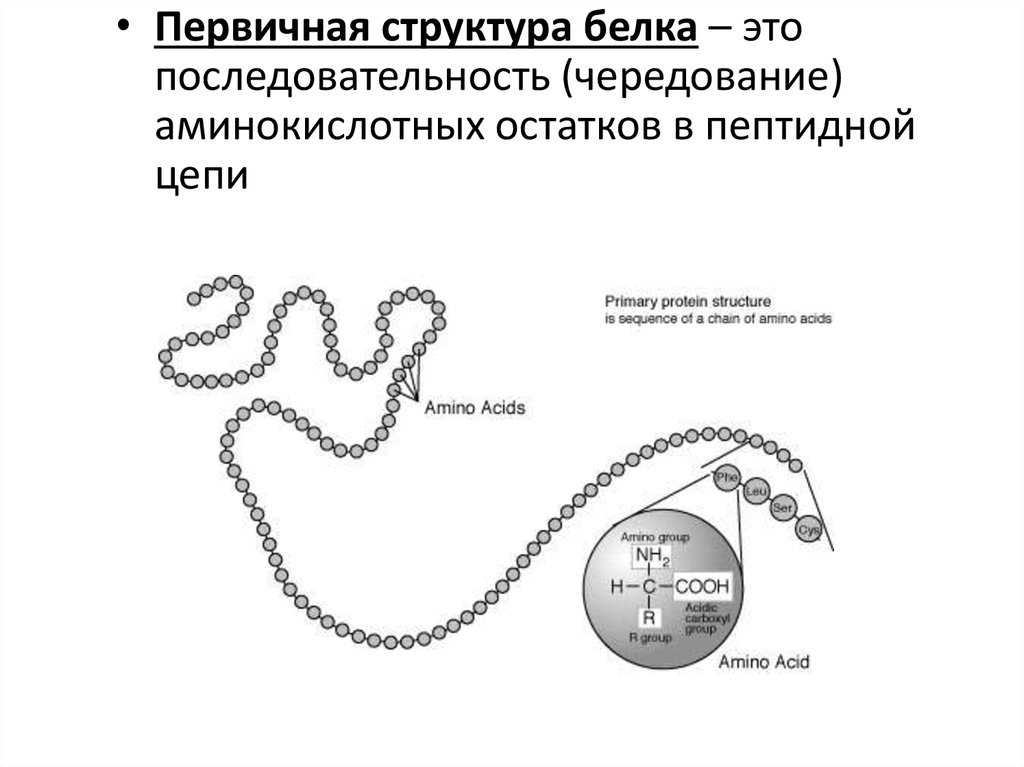
6. Первичная структура белка
Первичная структура белка – этопоследовательность аминокислот в
пептидной цепи.
Аминокислоты соединяются пептидной связью
CH3
CH COOH + HNH
CH COOH
NH2
CH3
H2O + CH3
CH CO NH CH COOH
NH2
CH3
7.
8. Пептиды
• Соединение из двух аминокислотназывают дипептидом, из трех –
трипептидом и т.д.
• Цепочка из менее чем 50
аминокислот называется пептидом
• Белки состоят из 50 и более
аминокислот
9. Пептиды
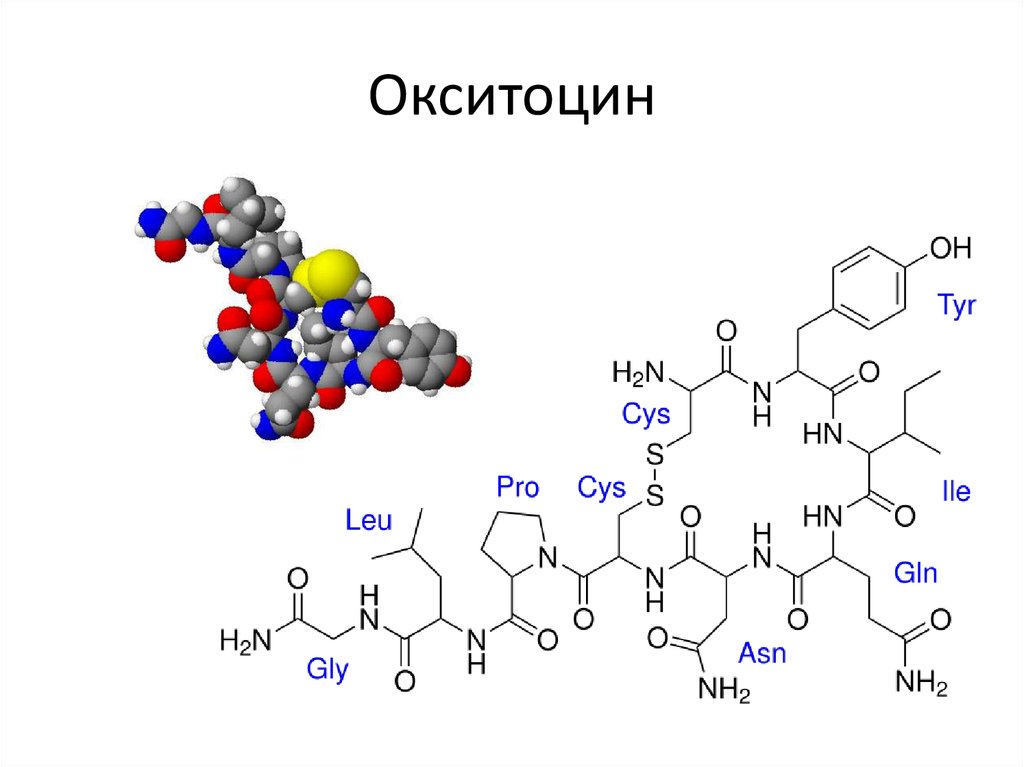
• Пептиды-гормоны: вазопрессин, окситоцин, кортикотропин,глюкагон, кальцитонин, меланостимулирующий гормон.
• Пептиды, принимающие участие в пищеварении, – гастрин,
секретин – всего 12 пептидов.
• Ангиотензин (сосудосуживающий), брадикинин.
• Нейропептиды.
• Пролинсодержащие ди- и трипептиды, образующиеся из
коллагена и эластина путем гидролиза, обладающие
антикоагулянтным действием, защищающие слизистую оболочку
желудка.
• Низкомолекулярные (Мм 4 кДа) пептиды, обуславливающие
устойчивость животных к разным инфекциям, обладающие
широким спектром антимикробной активности.
10. Окситоцин
11.
• Первичная структура белка – этопоследовательность (чередование)
аминокислотных остатков в пептидной
цепи
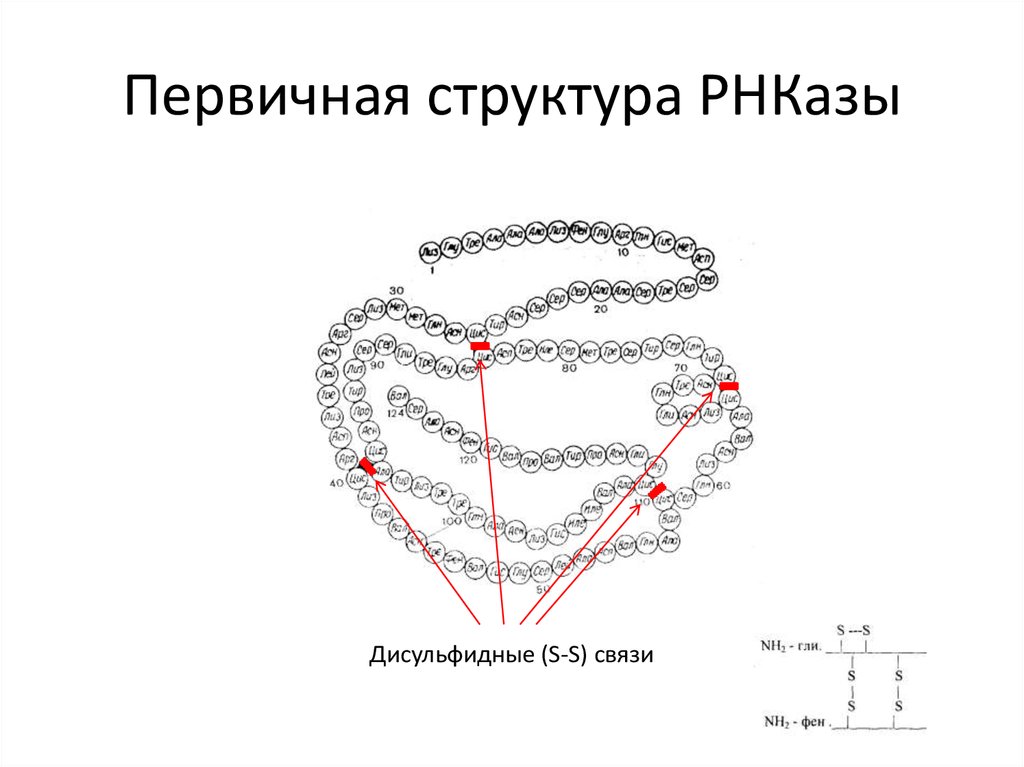
12. Первичная структура РНКазы
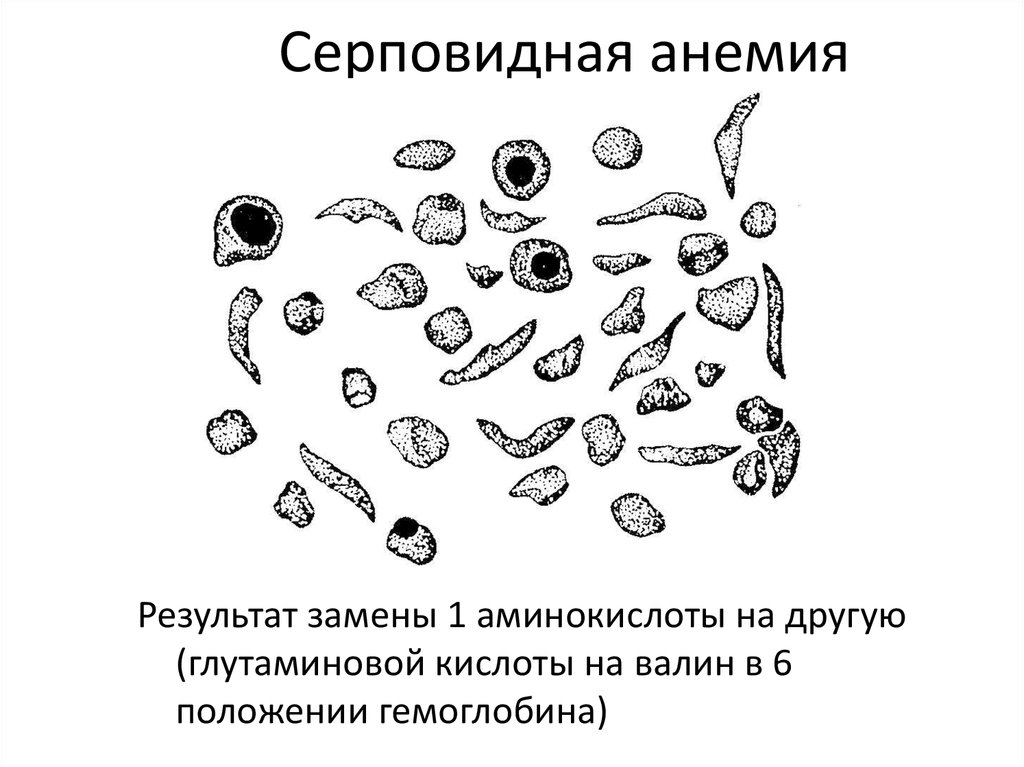
Дисульфидные (S-S) связи13. Серповидная анемия
Результат замены 1 аминокислоты на другую(глутаминовой кислоты на валин в 6
положении гемоглобина)
14. Вторичная структура белка
Вторичная структура белка – это способукладки полипептидной цепи в
спиральную конфигурацию,
стабилизированный водородными
связями и гидрофобными
взаимодействиями
15. α-спираль
16.
17. α-спираль
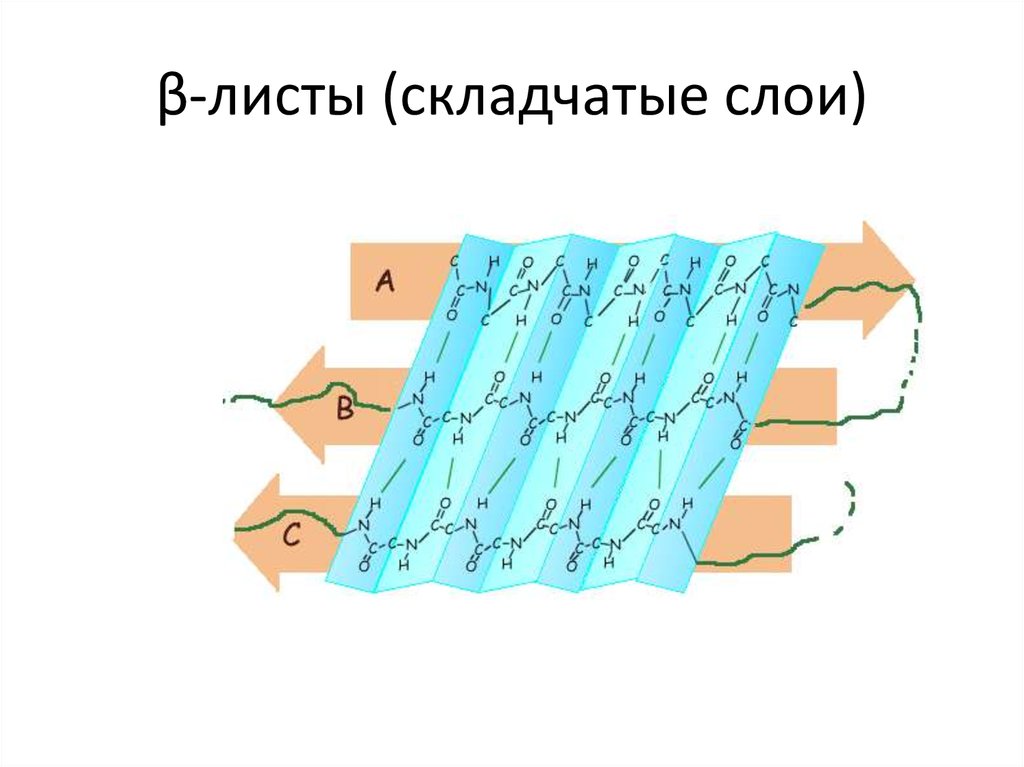
18. β-листы (складчатые слои)
19. Домены
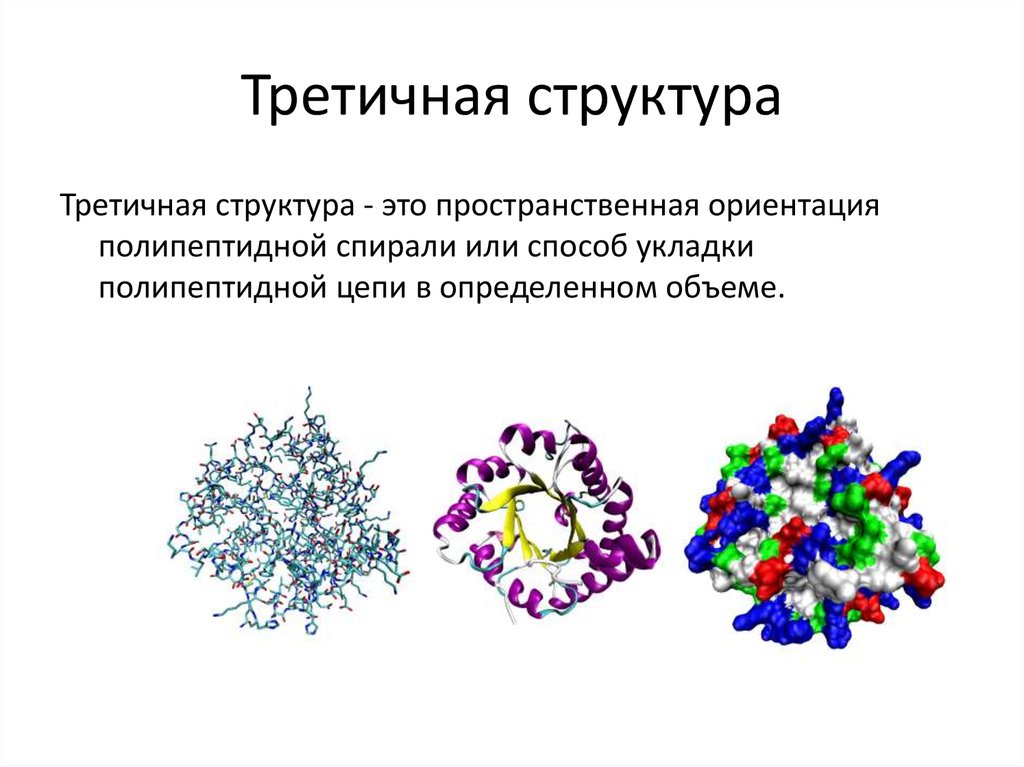
20. Третичная структура
Третичная структура - это пространственная ориентацияполипептидной спирали или способ укладки
полипептидной цепи в определенном объеме.
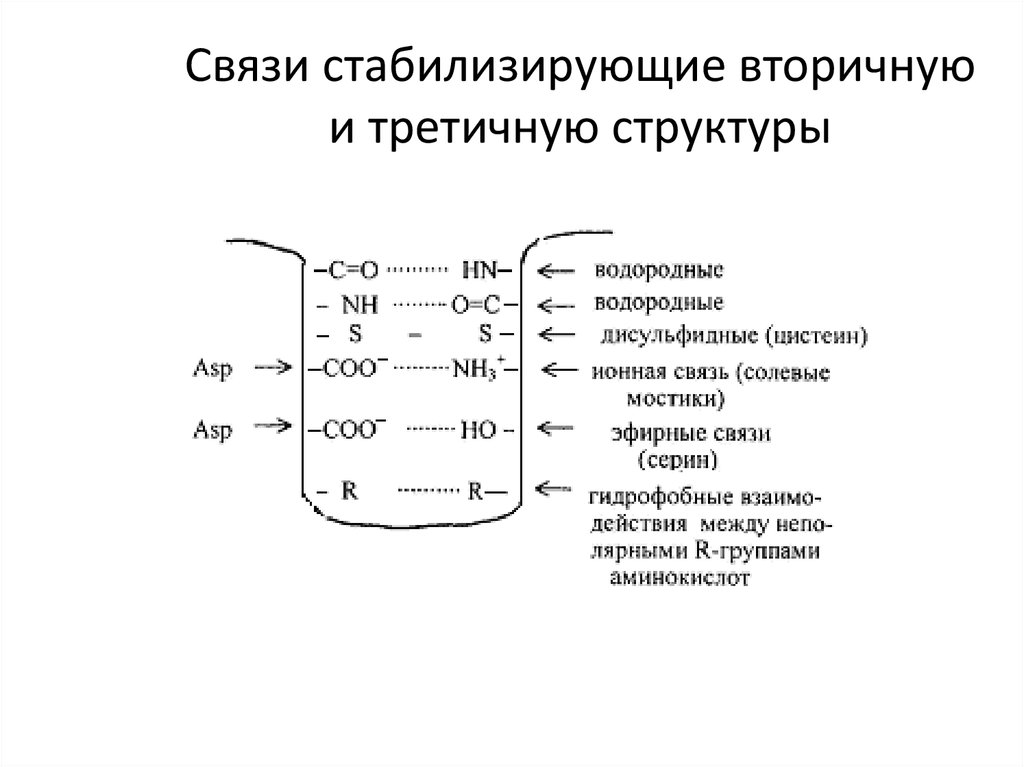
21. Связи стабилизирующие вторичную и третичную структуры
22.
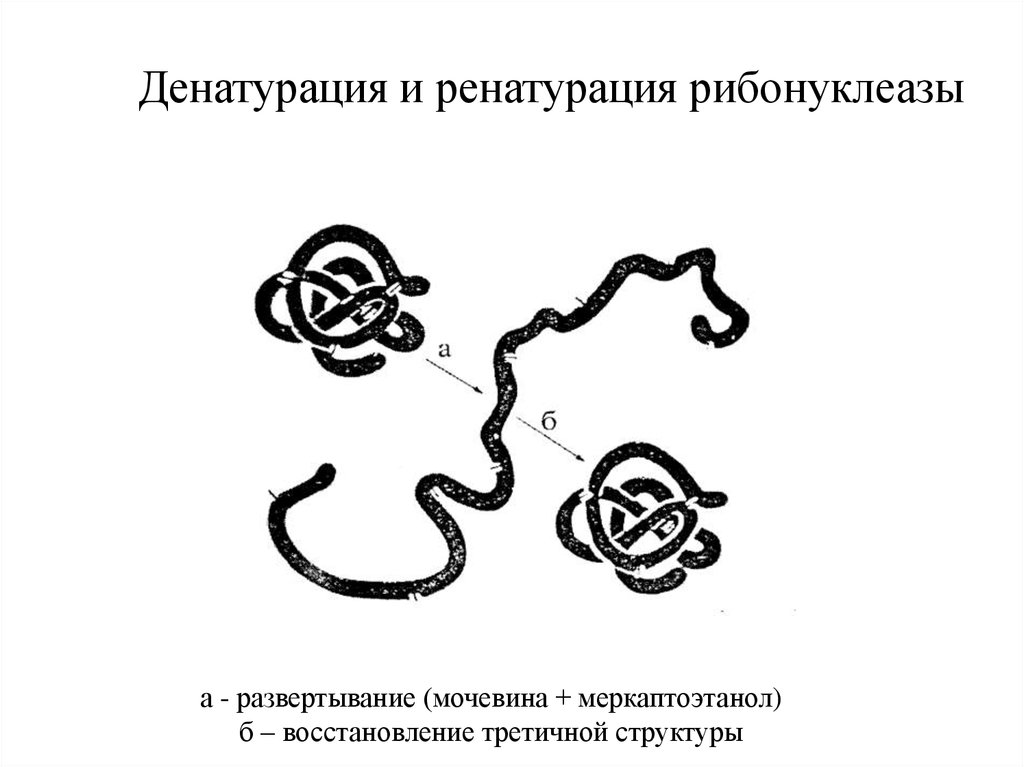
Денатурация и ренатурация рибонуклеазыа - развертывание (мочевина + меркаптоэтанол)
б – восстановление третичной структуры
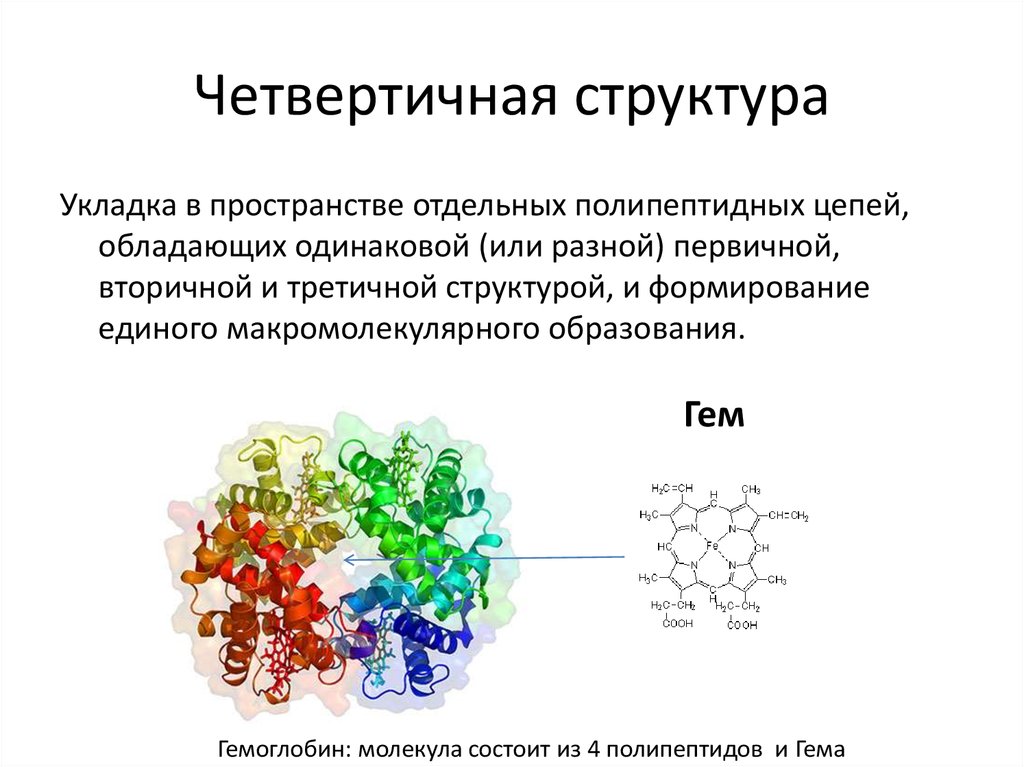
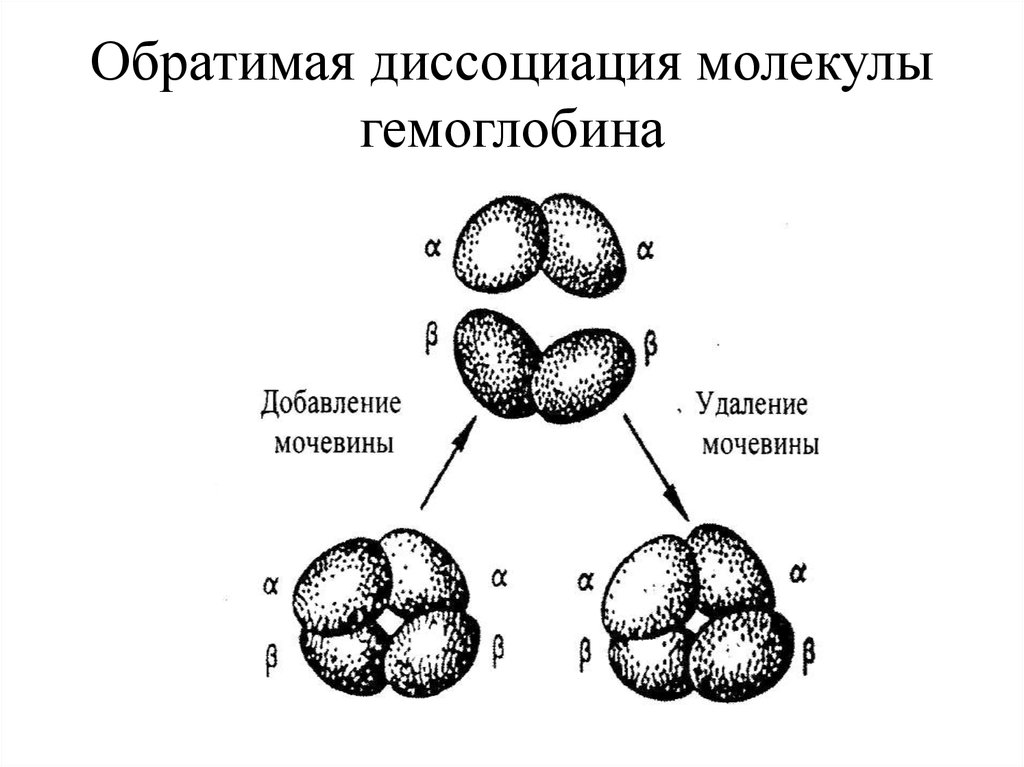
23. Четвертичная структура
Укладка в пространстве отдельных полипептидных цепей,обладающих одинаковой (или разной) первичной,
вторичной и третичной структурой, и формирование
единого макромолекулярного образования.
Гем
Гемоглобин: молекула состоит из 4 полипептидов и Гема
24. Обратимая диссоциация молекулы гемоглобина
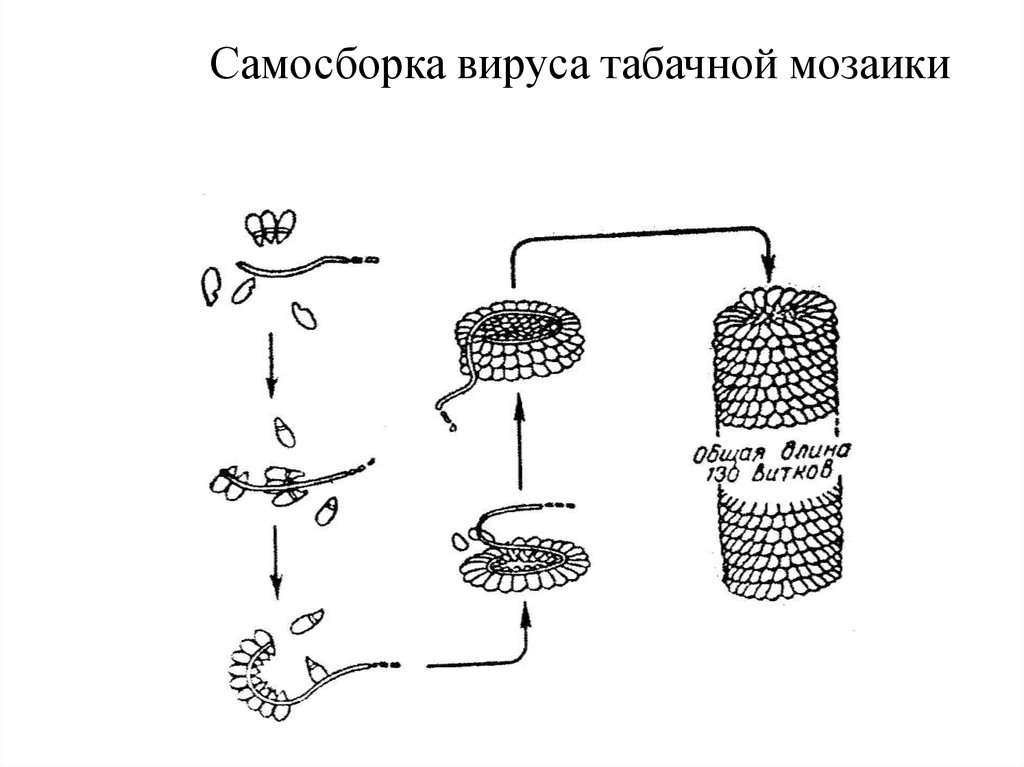
25. Самосборка вируса табачной мозаики
26. Классификация белков
• Протеины - простые белки, построенытолько из аминокислот
• Протеиды - сложные белки состоят из
белка и небелкового компонента,
который называется простетической
группой
27. Класс протеины (простые белки)
Гистоны
Протамины
Проламины
Глутелины
Протеиноиды
Коллаген, кератин
• Альбумины и глобулины
28. Кератины
29. Коллаген
• Электронная микрофотография коллагеновых фибриллсоединительной ткани.
30. Класс протеиды (сложные белки)
• Хромопротеидыбелок + окрашенный небелковый компонент.
гемопротеиды, магний-порфирины,
флавопротеиды.
Фотосинтез, дыхание, транспорт кислорода и
углекислоты, окислительновостановительные реакции
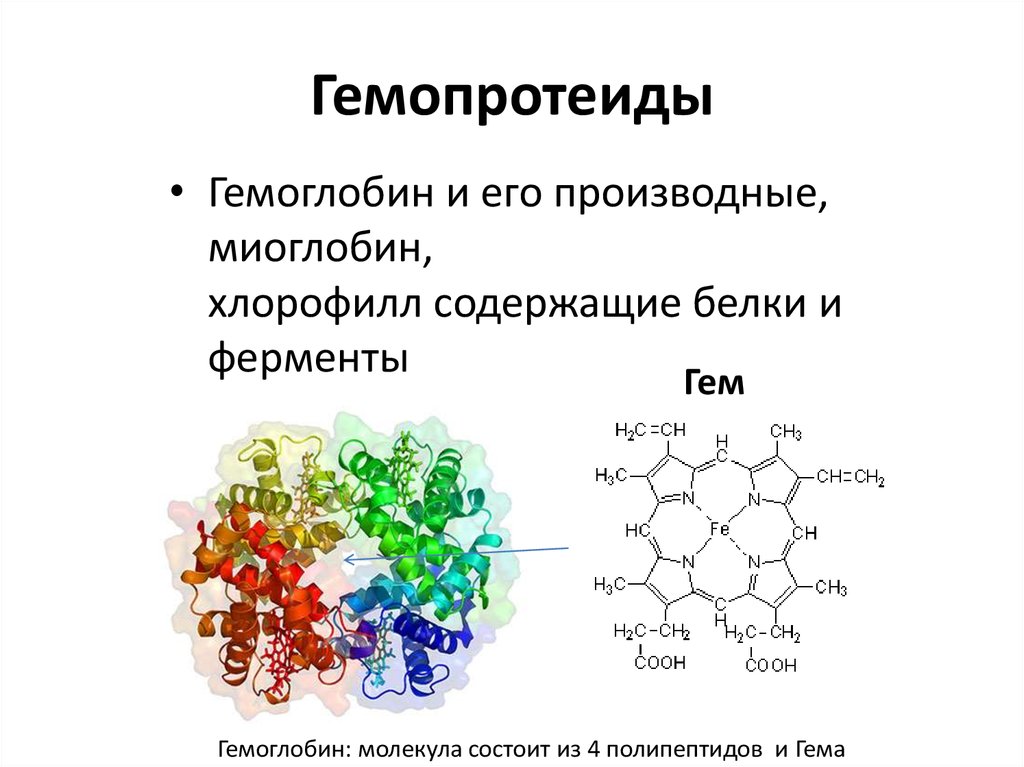
31. Гемопротеиды
• Гемоглобин и его производные,миоглобин,
хлорофилл содержащие белки и
ферменты
Гем
Гемоглобин: молекула состоит из 4 полипептидов и Гема
32. Нуклеопротеиды
• состоят из белков и нуклеиновых кислот.ДНП (дезоксинуклеопротеид): ДНК+белок
РНП (рибонуклеопротеид): РНК+белок
33. Липопротеиды
• Белок + Липидывходят в состав клеточной мембраны,
внутриклеточных мембран ядра,
митохондрий, микросом, миелиновых
оболочек нервных волокон
Ионные каналы, рецепторы гормонов
34. Фосфопротеиды
Казеиноген молока, вителлин,
фосфовитин,
выделенные из желтка куриного я
овальбумин
, фосфопротеиды в тканях нервной
35. Гликопротеиды
• Белок + углеводы и их производныегексозамины (глюкозамин, галактозамин),
глюкозу, маннозу, галактозу, ксилозу,
арабинозу, глюкуроновую, уксусную и серные
кислоты, нейраминовую и сиаловую кислоты,
Гиалуроновая и Хондроитинсерная кислоты–
входят в состав внеклеточного вещества
соединительной ткани, содержится в
клеточной оболочке, в стекловидном теле,
синовиальной жидкости.
36. Металлопротеиды
• Белок + металл (ион)1) Железо-содержащие:
- Ферритин (депо железа в клетке)
- Трансферрин (перенос железа)
- Гемосидерин
2) Ферменты, у которых ионы
металлов выполняют
каталитическую роль
Zn2+, Mg2+, Fe2+, Fe3+, Mn2+, Cu2+, K+, Na+, Ca2+
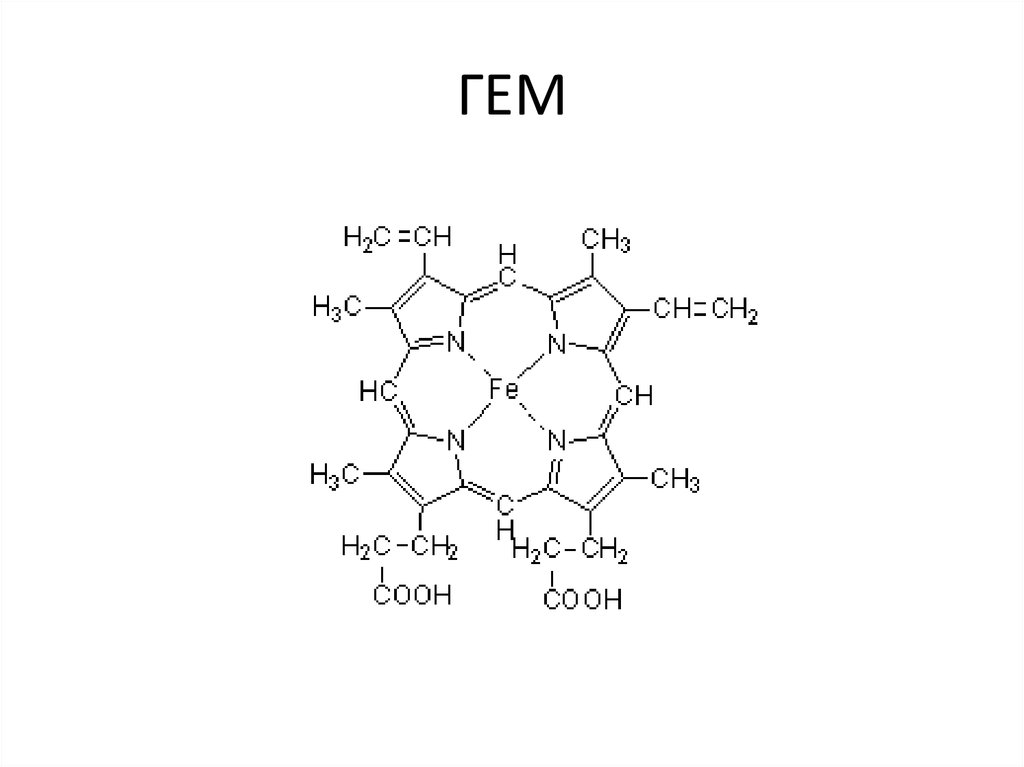
37. ГЕМ
38. Производные гемоглобина
• Оксигемоглобин HbO2, где кислород соединенкоординационной связью с атомом железа, что
обеспечивает оксигенизацию - насыщение кислородом,
это не химическая связь.
• Карбоксигемоглобин HbCO – гемоглобин связан с
оксидом углерода (угарным газом). При этом Hb теряет
способность связывать кислород.
• Метгемоглобин HbOH – окисленный гемоглобин.
Образуется при отравлении оксидом азота, парами
нитробензола и другими соединениями, железо
трехвалентное; не способен к оксигенизации.
• Карбгемоглобин HbCO2 – гемоглобин, насыщенный
углекислым газом CO2.
39.
• Миоглобин имеет Мм 17000 Да, имеет геми одну полипептидную цепь, содержится в
мышечной ткани.
• Каталаза – гемсодержащий фермент, имеет
Мм 225000 Да, катализирует разрушение
перекиси водорода:
2H2O2 → 2H2O +O2
40.
Липопротеиды – состоят из белка и липида. Онивходят в состав клеточной мембраны, мембран ядра,
митохондрий, микросом, миелиновых оболочек
нервных волокон.
В плазме крови:
α-ЛПВП – липопротеиды высокой плотности,
содержание белка - 50%,.
β-ЛПНП – липопротеиды низкой плотности,
содержание белка 21%, богаты холестерином.
Пре-β-ЛПОНП – липопротеиды особо низкой
плотности, содержание белка 9%;.
Хиломикроны, содержание белка 1% (жиры).
.
41.
• Фосфопротеиды. К ним относятся казеиноген молока,вителлин, фосфовитин, выделенные из желтка куриного
яйца, овальбумин,.
• .
• Гликопротеиды. В гидролизате обнаруживают
гексозамины (глюкозамин, галактозамин), глюкозу,
маннозу, галактозу, ксилозу, арабинозу, глюкуроновую,
уксусную и серные кислоты, нейраминовую и сиаловую
кислоты
• Гиалуроновая кислота – входит в состав внеклеточного
вещества соединительной ткани, содержится в
клеточной оболочке, в стекловидном теле,
синовиальной жидкости.
42.
• .• ,
• Металлопротеиды. содержат кроме белка, ионы какого-либо
металла.
• Ферритин – белок с Мм 400000, содержание железа 17-23%
является депо железа в организме.
• Трансферрин – с Мм 90000 содержание железа 0,13%.
физиологический переносчик железа.
• Гемосидерин – содержится в клетках РЭС, печени, селезенки.
• Ко второй группе относятся ферменты, у которых металл
выполняет каталитическую функцию.( Zn2+, Mg2+, Fe2+, Fe3+, Mn2+,
Cu2+, K+, Na+, Ca2)
43.
44. Гистоны – белки основного характера, содержат от 10 до 30% лизина, аргинина, гистидина. . Молекулярная масса 5000-37000. Входят
в состав ядерных белков –ДНК-протеидов, играют важную
роль в регуляции метаболической
активности генома.
45.
• Протамины – белки основного характера.Молекулярная масса около 5000
Содержание аргинина составляет 60-65%.
Входит в состав ДНП-нуклеопротеидов
46.
• Проламины – белки, нерастворимые вводе, не свертываются при кипячении.
Входят в состав белков злаков:
• глиадин – содержится в зерне пшеницы,
ржи,
• гордеин – содержится в семенах ячменя,
зеин - содержится в семенах кукурузы,
содержат до 30% глутаминовой кислоты,
10-15% пролина
47.
• Глютелины – растительные белки,нерастворимые в воде, содержатся в
семенах злаков (фр.gluten -клейковина).
Определяют хлебопекарные качества муки
(зерна
48.
• Протеиноиды (коллагены, кератины) –опорные белки
49.
• Коллаген и эластин – главныефибриллярные белки соединительной
ткани сухожилий, связок.
• На долю коллагена приходится почти 1/3
всей массы белков позвоночных. проволоку
равного поперечного
50.
• Альбумины и глобулины относятся кбелкам широко распространенным в
органах и тканях животных
• сыворотка крови, молоко, яичный белок,
мышцы и т.д.
• В плазме крови содержится 7% белков, из
которых на долю альбуминов приходится
больше половины, остальные на долю
глобулинов
51.
• Альбумины принимают участие в созданииосмотического давления крови
транспортируют жирные кислоты,
гормоны, Ca2+
52.
• Глобулины – по форме молекул относятся кглобулярным белкам.
• Различают
• сывороточные,
• молочные,
• яичные глобулины.
Глобулины имеют несколько фракций: α, β,
γ. Гамма-глобулины являются носителями
иммунитета



































 chemistry
chemistry








