Similar presentations:
Ионная, металлическая, водородная связь
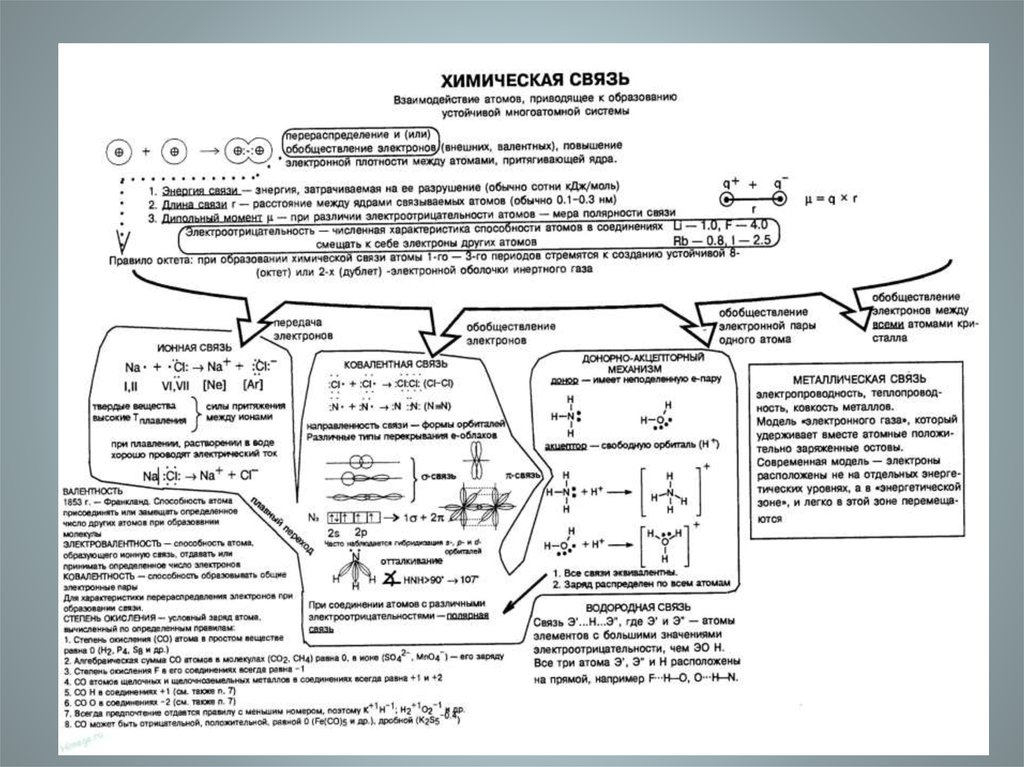
1. Ионная связь
Молчанова Елена РобертовнаМБОУ СОШ 144
Красноярск, 2010
2.
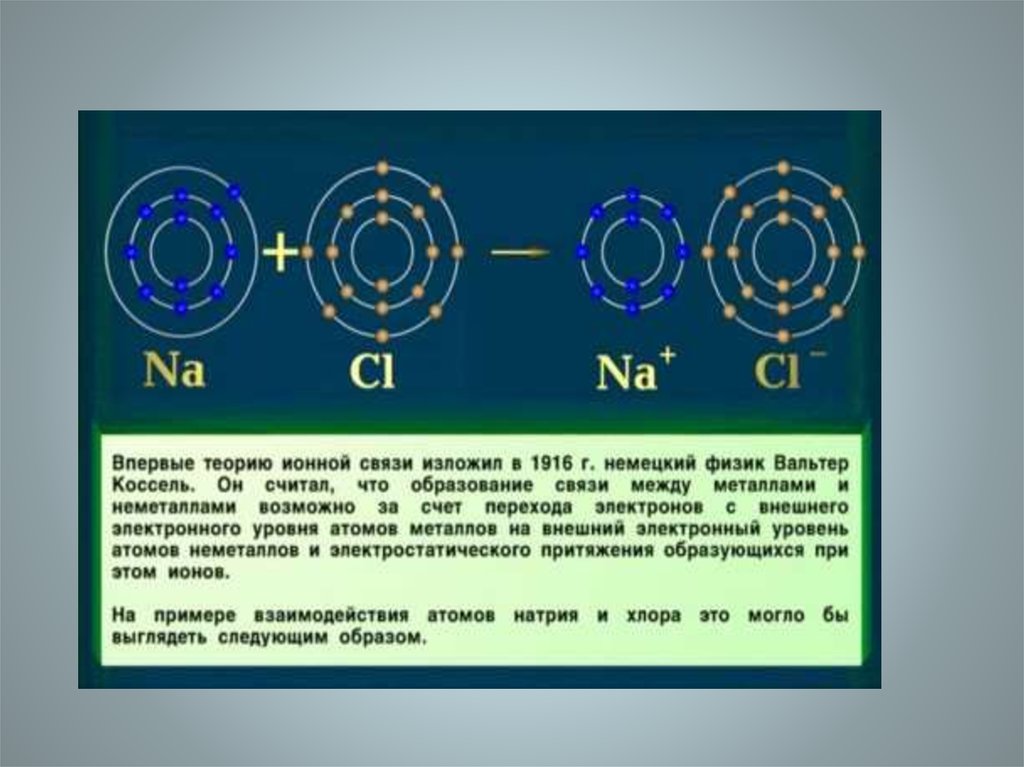
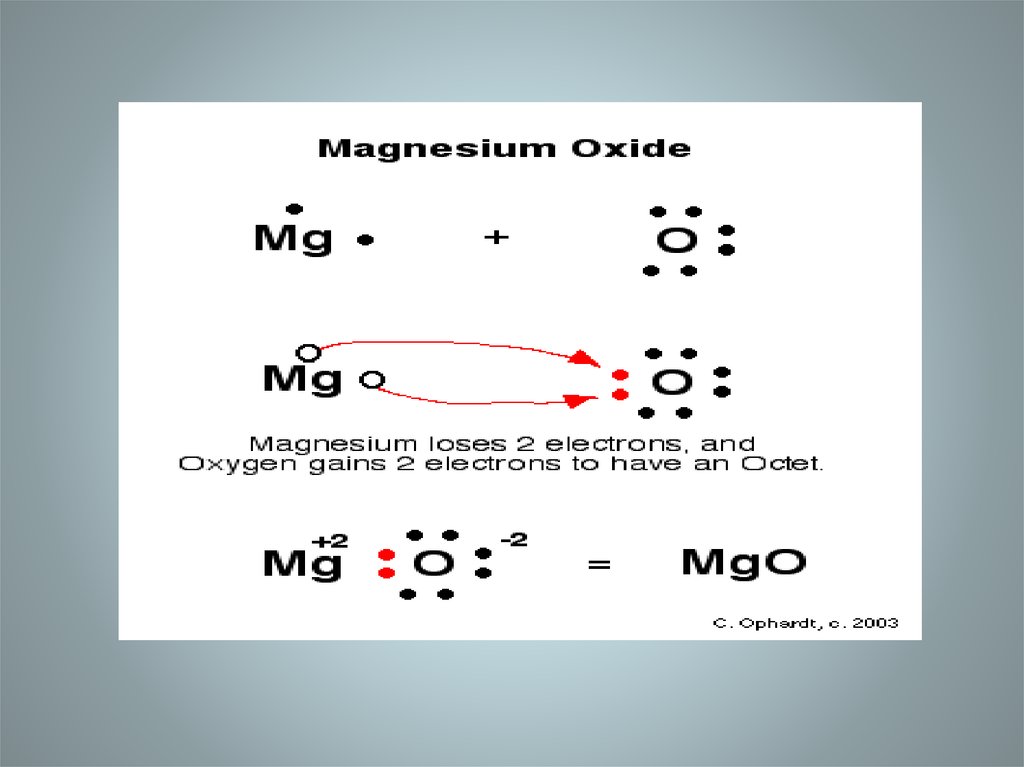
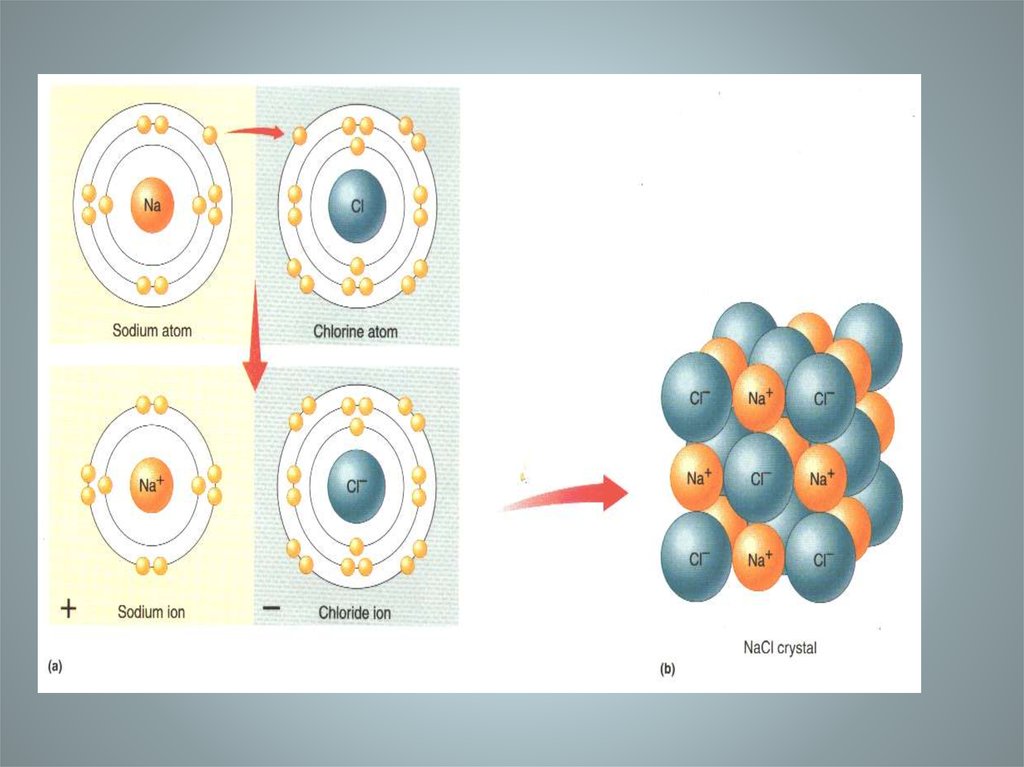
3. Ионная связь-
Ионная связь• прочная химическая связь,образующаяся между
атомами с большой
разностью (>1,7 по шкале
Полинга)
электроотрицательностей,
при которой общая
электронная пара
полностью переходит к
атому с большей
электроотрицательностью.
Это притяжение ионов как
разноименно заряженных
тел.
• Примером может служить
соединение CsF, в котором
«степень ионности»
составляет 97 %.
4.
Электроотрицательность- способность атомов одних химических элементов
притягивать электроны в соединениях от атомов других
химических элементов
IA
Δ – אразница
электроотрицательнос
тей:
Δ > א1,7 – ионная
химическая связь;
0 < Δ < א1,7 –
ковалентная
химическая связь
IIA
IIIA
IVA
VA
VIA
VIIA
Li
0,97
Be
1,47
B
2,01
C
2,50
N
3,07
O
3,50
F
4,10
Na
1,01
Mg
1,23
Al
1,47
Si
2,25
P
2,32
S
2,60
Cl
2,83
K
0,91
Ca
1,04
Ga
1,82
Ge
2,02
As
2,10
Se
2,48
Br
2,74
Rb
0,89
Sr
0,99
In
1,49
Sn
1,72
Sb
1,82
Te
2,01
I
2,21
Cs
0,86
Ba
0,97
Tl
1,44
Pb
1,55
Bi
1,67
Po
1,76
At
1,90
H
2,10
4
5.
Запомни!!!полного перехода электронов при образовании
ионной химической связи не происходит. Об
этом свидетельствуют величины эффективных
зарядов в соединениях
5
6.
7.
8.
9.
10.
11.
12.
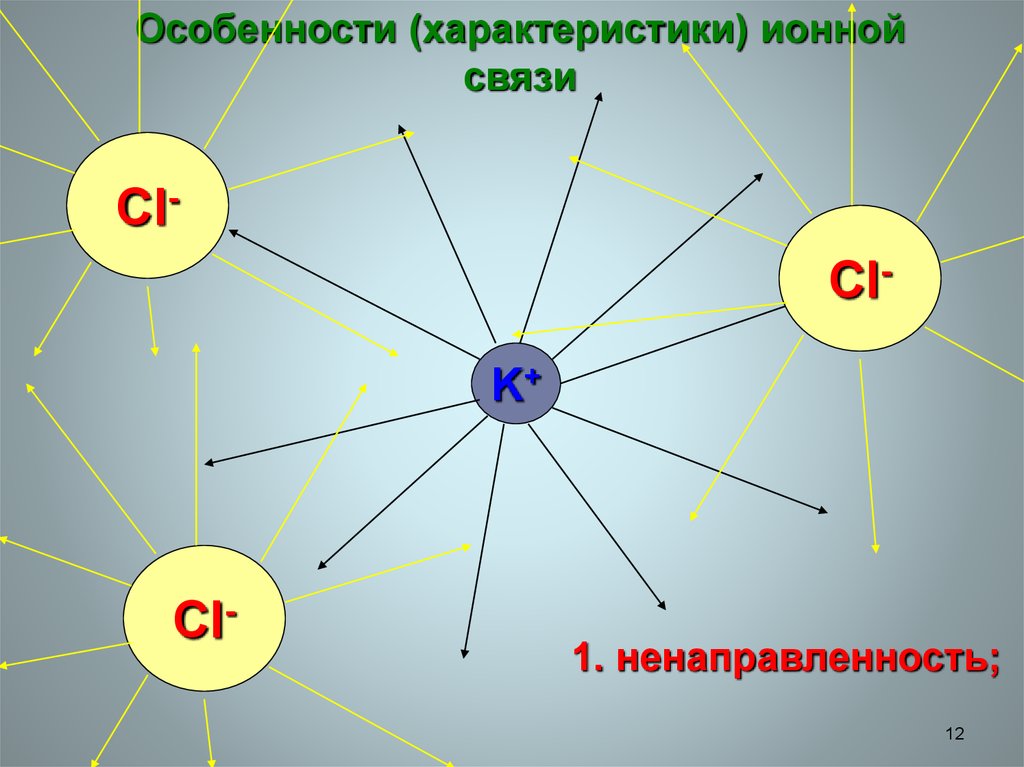
Особенности (характеристики) ионнойсвязи
ClClK+
Cl-
1. ненаправленность;
12
13.
Особенности (характеристики) ионнойсвязи
2. ненасыщаемость.
Кристаллическая
решетка ионных
соединений
представляет собой
трехмерную
бесконечную
решетку, в узлах
которой находятся
анионы и катионы
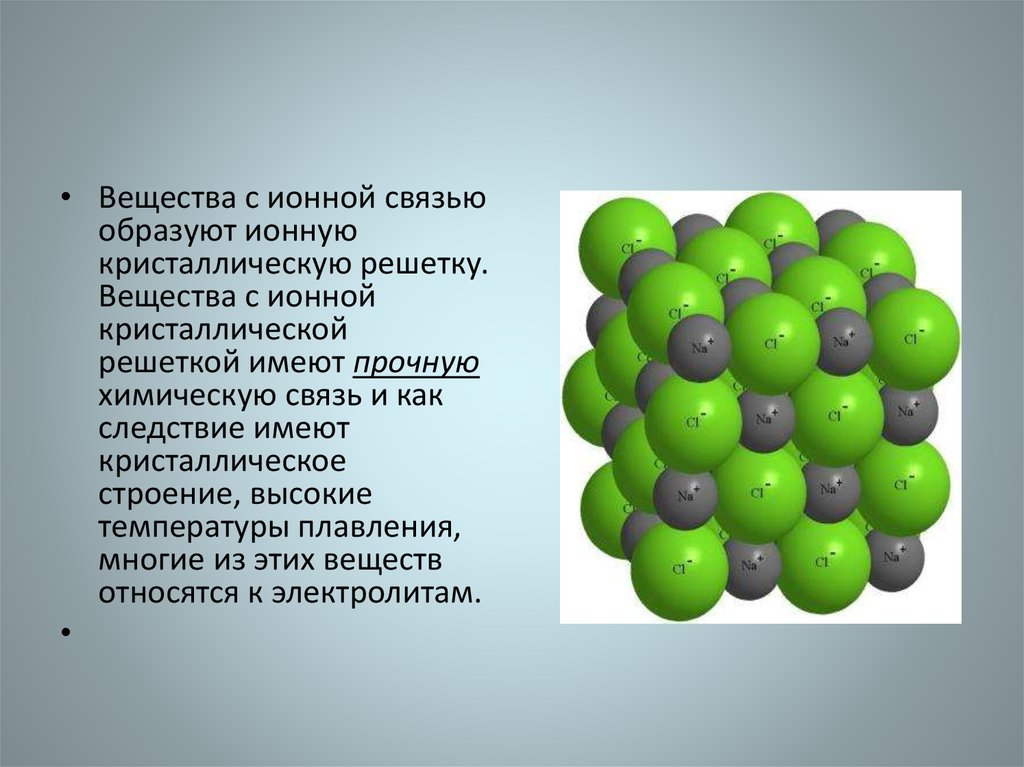
Кристаллическая решетка NaCl
13
14.
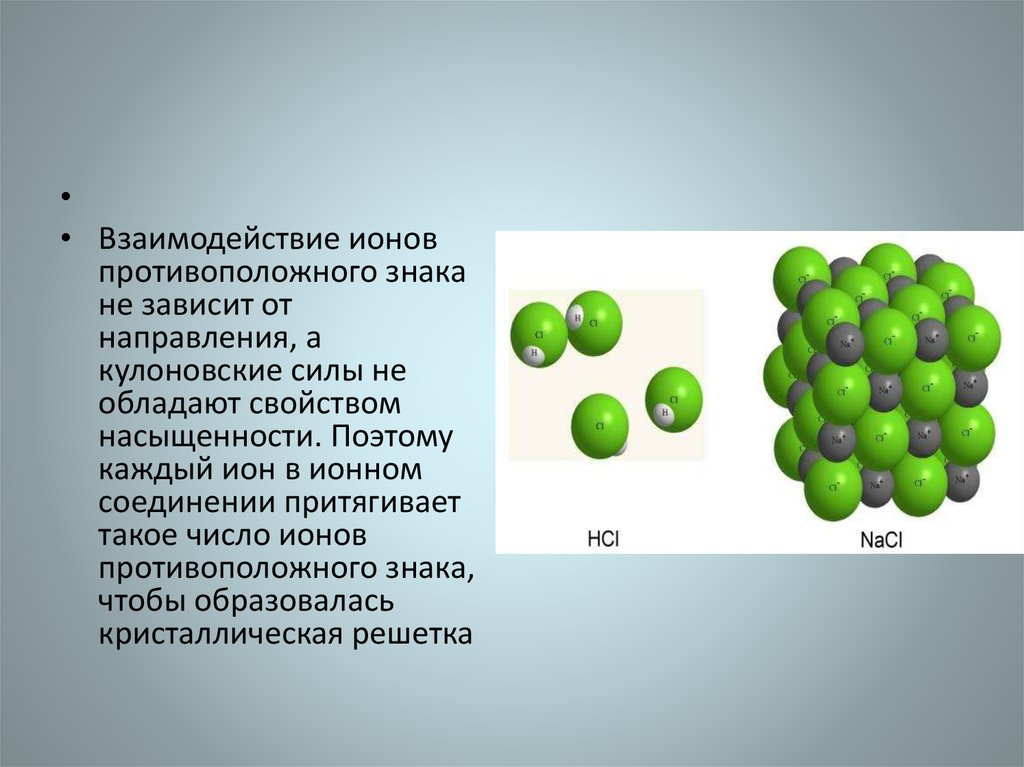
• Взаимодействие ионов
противоположного знака
не зависит от
направления, а
кулоновские силы не
обладают свойством
насыщенности. Поэтому
каждый ион в ионном
соединении притягивает
такое число ионов
противоположного знака,
чтобы образовалась
кристаллическая решетка
15.
• Вещества с ионной связьюобразуют ионную
кристаллическую решетку.
Вещества с ионной
кристаллической
решеткой имеют прочную
химическую связь и как
следствие имеют
кристаллическое
строение, высокие
температуры плавления,
многие из этих веществ
относятся к электролитам.
16.
17.
18. Металлическая связь.
19.
20.
21.
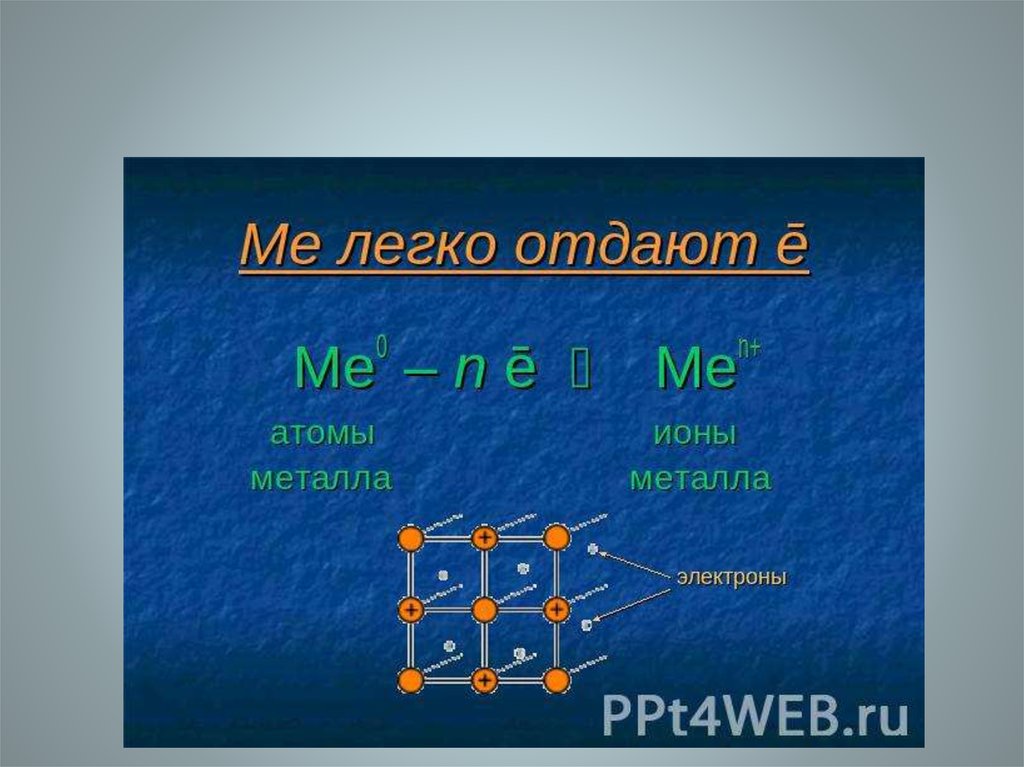
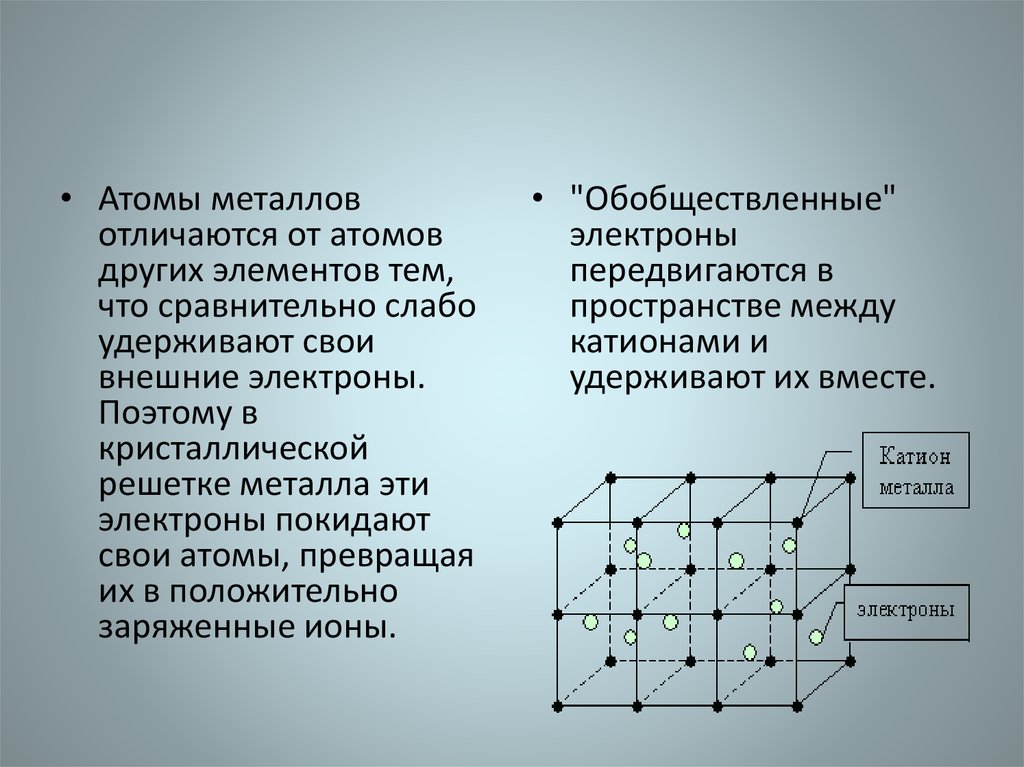
• Атомы металловотличаются от атомов
других элементов тем,
что сравнительно слабо
удерживают свои
внешние электроны.
Поэтому в
кристаллической
решетке металла эти
электроны покидают
свои атомы, превращая
их в положительно
заряженные ионы.
• "Обобществленные"
электроны
передвигаются в
пространстве между
катионами и
удерживают их вместе.
22. Металлическая связь имеет признаки, характерные как для ковалентной, так и для ионной связи
23.
24.
25.
• Самый пластичныйметалл- золото.
• Из 1 г золота можно
вытянуть проволоку
длиной 2,4 км.
Самая большая
электропроводность у
серебра. Она принята
за 100%.
26.
27.
Электропроводность,теплопроводность,
пластичность
объясняются
свободно
двигающимися
электронами.
28. Водородная связь
• -форма ассоциациимежду
электроотрицательным
атомом и атомом
водорода H, связанным
ковалентно с другим
электроотрицательным
атомом. В качестве
электроотрицательных
атомов могут выступать
N, O или F.
• Обычно водородную
связь обозначают
точками и этим
указывают, что она
намного слабее
ковалентной связи
(примерно в 15-20 раз).
Тем не менее она
ответственна за
ассоциацию молекул.
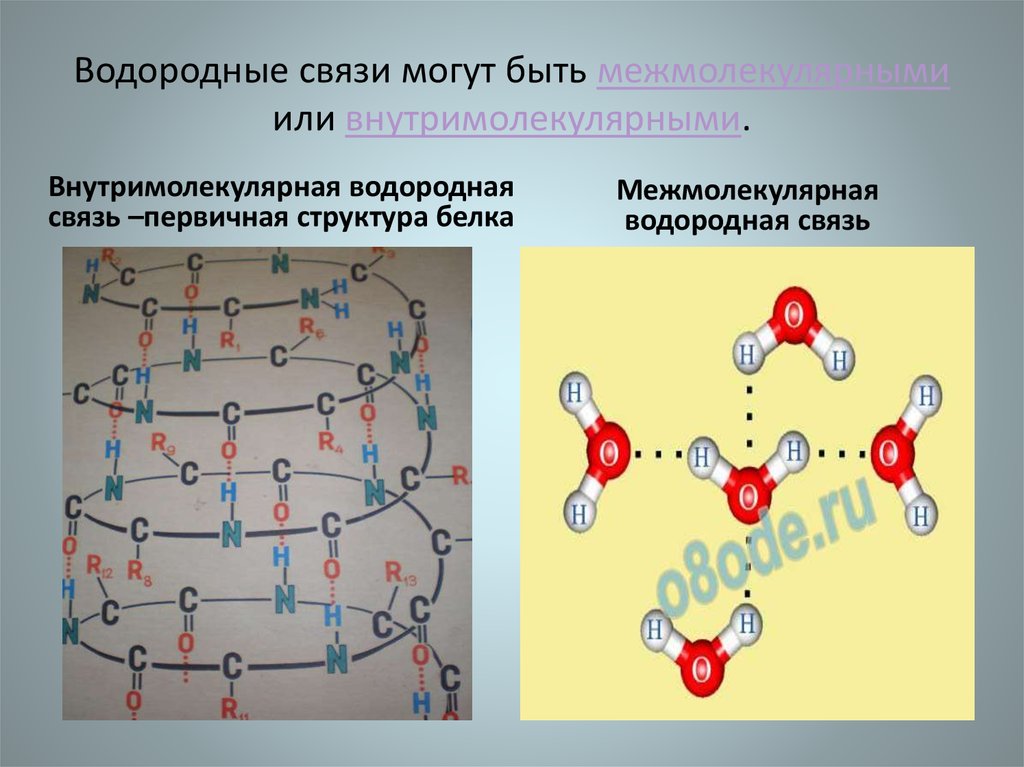
29. Водородные связи могут быть межмолекулярными или внутримолекулярными.
Внутримолекулярная водороднаясвязь –первичная структура белка
Межмолекулярная
водородная связь
30.
31.
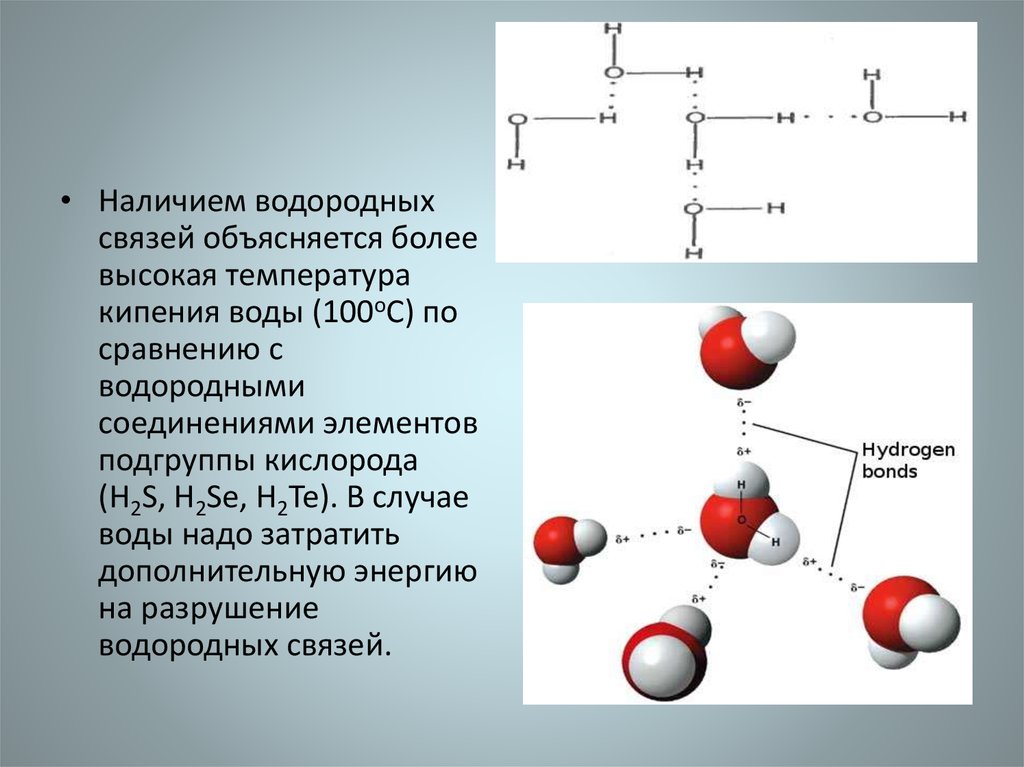
• Наличием водородныхсвязей объясняется более
высокая температура
кипения воды (100оС) по
сравнению с
водородными
соединениями элементов
подгруппы кислорода
(Н2S, Н2Sе, Н2Те). В случае
воды надо затратить
дополнительную энергию
на разрушение
водородных связей.
32.
33.
34.
• Водородная связьоказывает влияние на
свойства многих
веществ. Так,
благодаря водородной
связи фтороводород в
обычных условиях
существует в жидком
состоянии (ниже
19,5оС) .
35.
36.
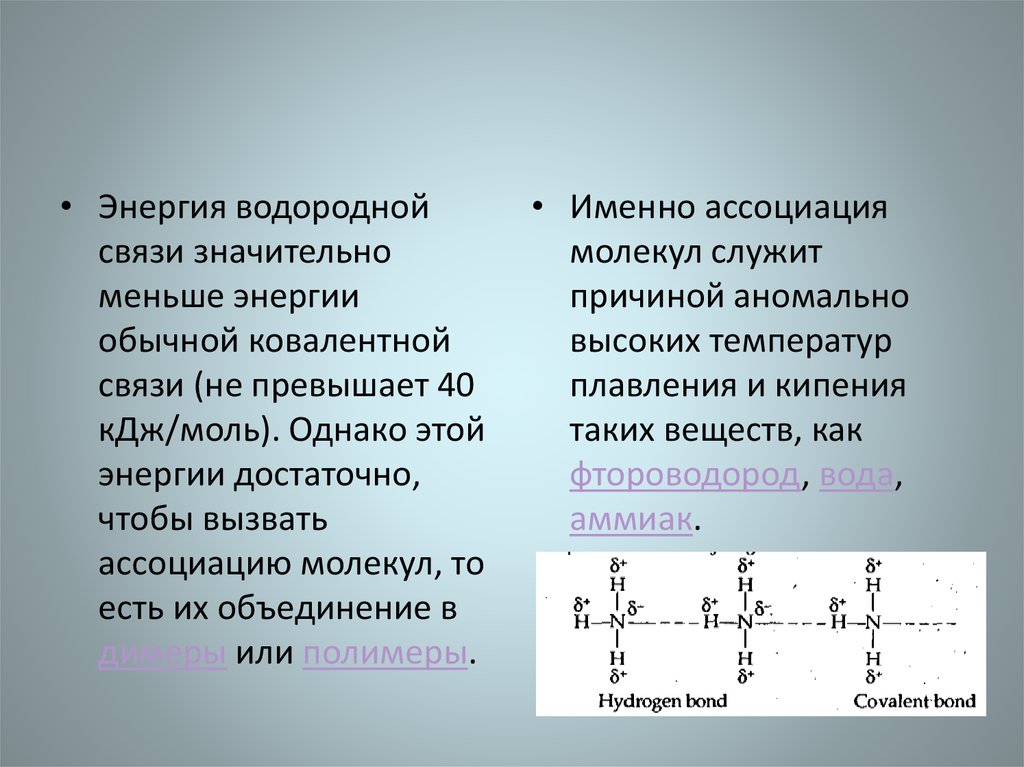
• Энергия водороднойсвязи значительно
меньше энергии
обычной ковалентной
связи (не превышает 40
кДж/моль). Однако этой
энергии достаточно,
чтобы вызвать
ассоциацию молекул, то
есть их объединение в
димеры или полимеры.
• Именно ассоциация
молекул служит
причиной аномально
высоких температур
плавления и кипения
таких веществ, как
фтороводород, вода,
аммиак.
37.
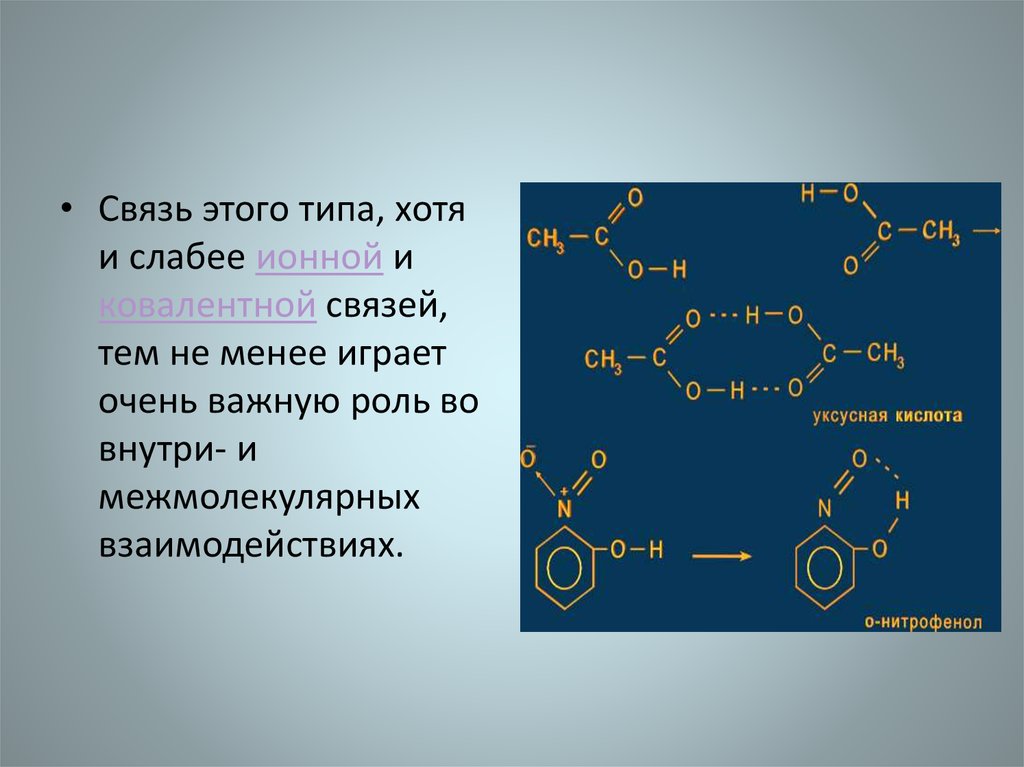
• Связь этого типа, хотяи слабее ионной и
ковалентной связей,
тем не менее играет
очень важную роль во
внутри- и
межмолекулярных
взаимодействиях.
• Водородные связи во
многом
обусловливают
физические свойства
воды и многих
органических
жидкостей (спирты,
карбоновые кислоты,
амиды карбоновых
кислот, сложные
эфиры).
38.
39.
• Связь этого типа, хотяи слабее ионной и
ковалентной связей,
тем не менее играет
очень важную роль во
внутри- и
межмолекулярных
взаимодействиях.
40. Вопрос:
• Сравните температуры кипениясоответствующих (по числу атомов С)
алканов, спиртов, альдегидов и
карбоновых кислот. Какие особенности
этой характеристики у веществ разных
гомологических рядов?
41.
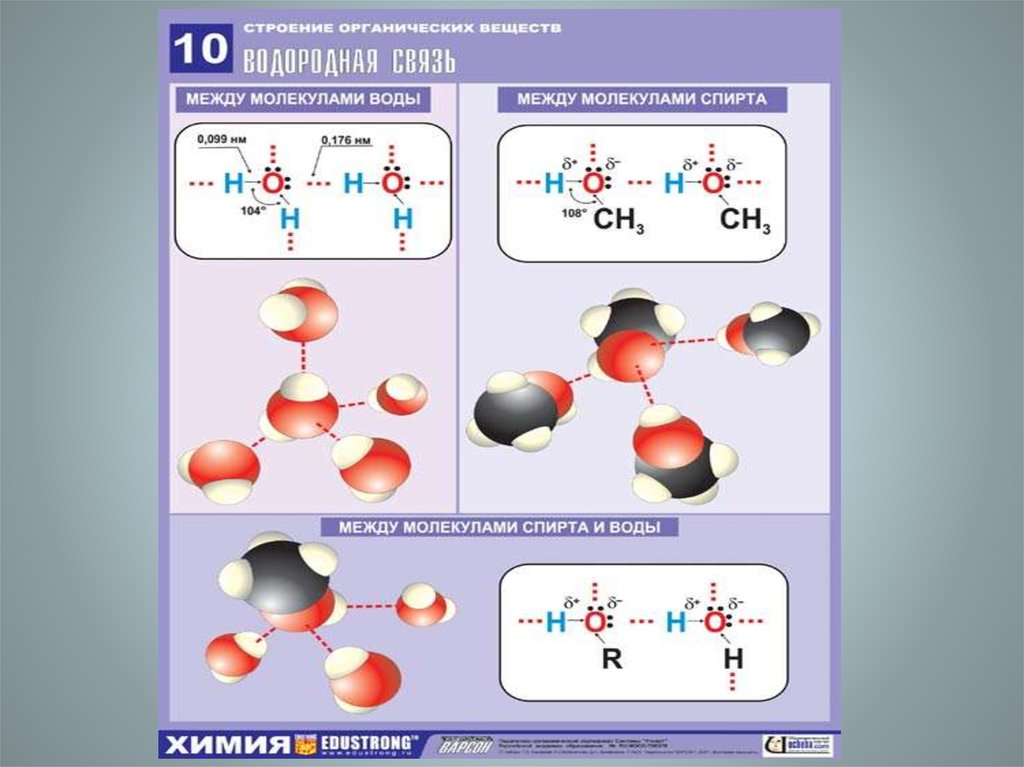
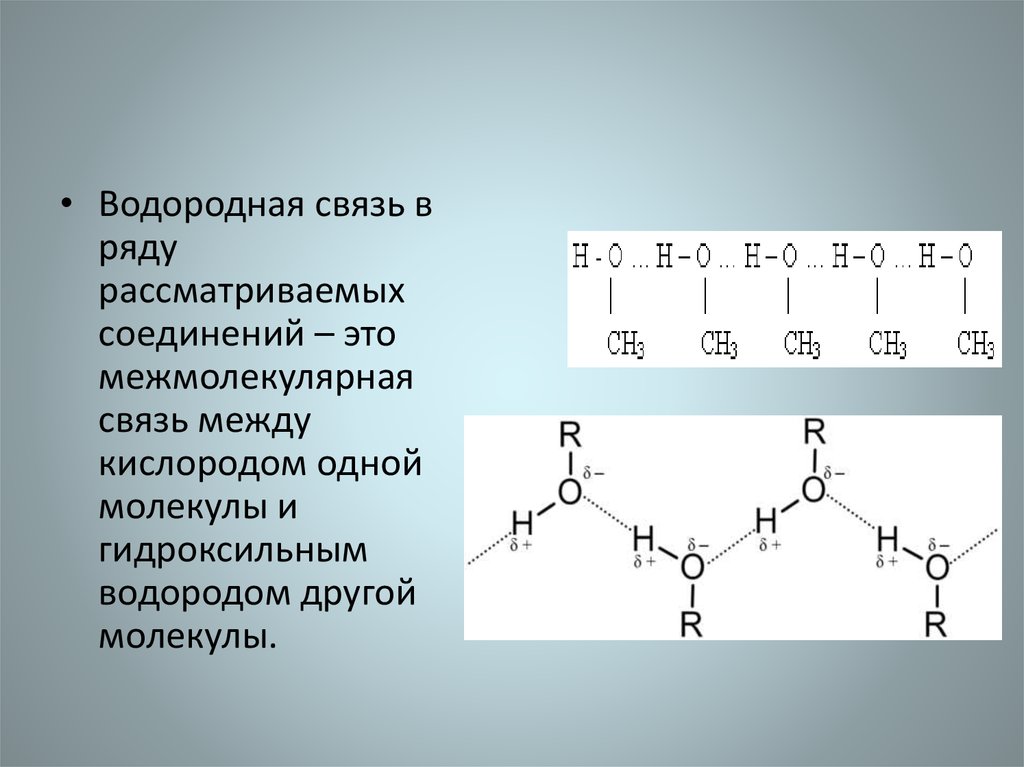
• Водородная связь вряду
рассматриваемых
соединений – это
межмолекулярная
связь между
кислородом одной
молекулы и
гидроксильным
водородом другой
молекулы.
42.
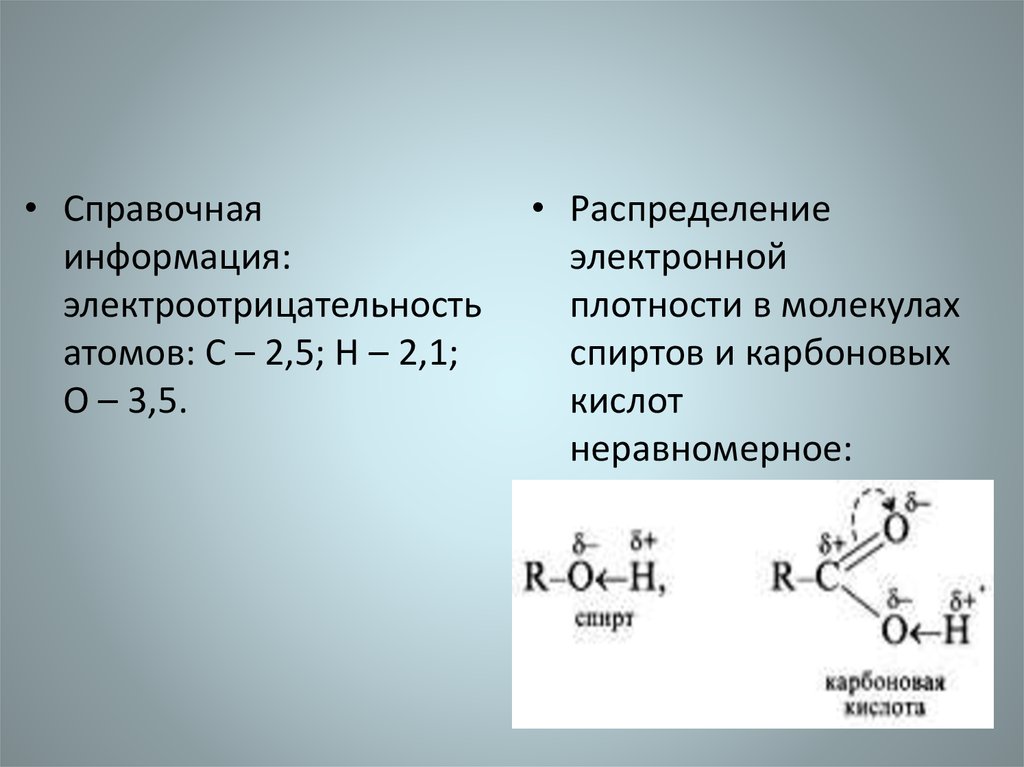
• Справочнаяинформация:
электроотрицательность
атомов: С – 2,5; Н – 2,1;
О – 3,5.
• Распределение
электронной
плотности в молекулах
спиртов и карбоновых
кислот
неравномерное:
43. В ы в о д.
• В гомологических рядахспиртов и карбоновых
кислот отсутствуют
газообразные вещества и
температуры кипения
веществ высокие.
• Это связано с наличием
водородных связей между
молекулами. За счет
водородных связей
молекулы оказываются
ассоциированными (как
бы сшитыми), поэтому,
чтобы молекулы стали
свободными и приобрели
летучесть, необходимо
затратить
дополнительную энергию
на разрыв этих связей.
44. Что можно сказать о растворимости спиртов, альдегидов и карбоновых кислот в воде? Чем объясняется растворимость этих веществ?
• Необходимо отметить, чтос увеличением
молекулярной массы
растворимость в воде
спиртов и кислот
уменьшается. Чем больше
углеводородный радикал
в молекуле спирта или
кислоты, тем труднее
группе ОН держать
молекулу в растворе за
счет образования слабых
водородных связей.
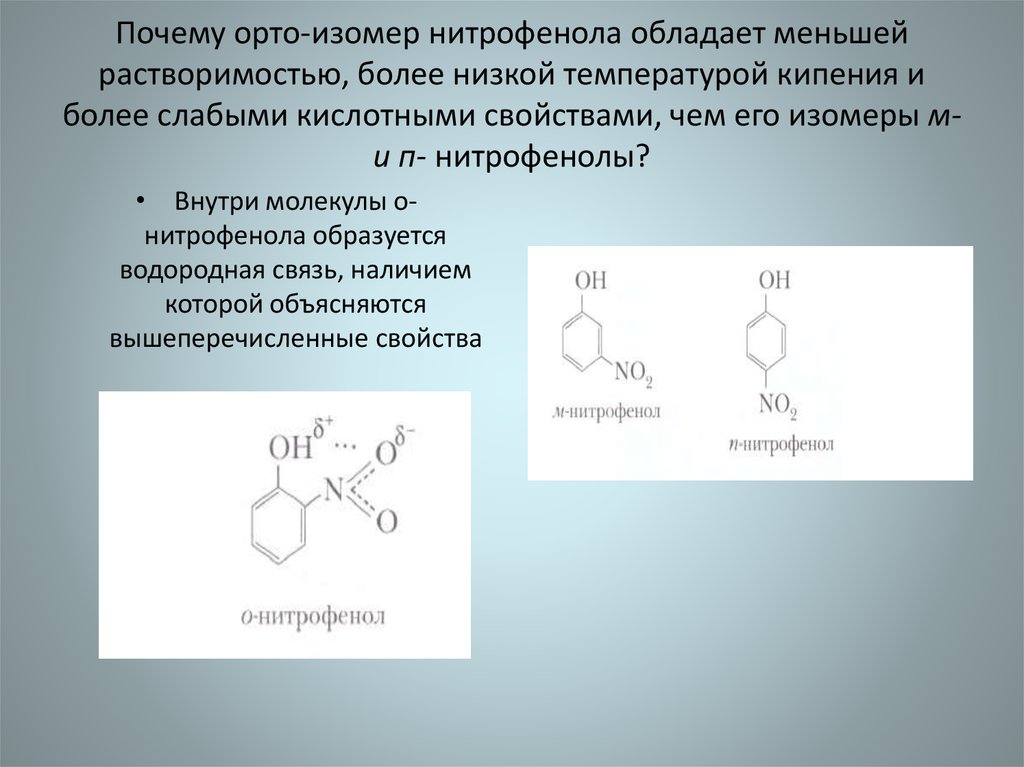
45. Почему орто-изомер нитрофенола обладает меньшей растворимостью, более низкой температурой кипения и более слабыми кислотными
свойствами, чем его изомеры ми п- нитрофенолы?• Внутри молекулы онитрофенола образуется
водородная связь, наличием
которой объясняются
вышеперечисленные свойства






























 chemistry
chemistry








