Similar presentations:
Строение вещества. Металлическая, водородная связь. Единая природа химической связи. Химия. 11 класс
1.
Химия. 11классТема «Строение вещества»
Металлическая, водородная связь.
Единая природа химической связи
2.
Содержание урока1. Металлическая химическая связь: механизм
образования, основные характеристики.
2. Кристаллическое строение веществ
с металлической связью.
3. Водородная химическая связь: механизм
образования, основные характеристики,
роль биологическая водородной связи.
4. Единая природа химической связи.
3.
Самостоятельная работа (15 мин)Определите тип связи и приведите
механизм её образования в веществах,
формулы которых приведены ниже. В
веществе с ковалентной полярной
связью стрелкой укажите смещение
электронной плотности и расставьте
частичные заряды
Вариант 1: CaCl2, O2, PF3
Вариант 2: K2S, N2, NCl3
4.
?Ответьте на вопросы
Назовите особенности
строения атомов металлов
5.
Особенности строения атомовметаллов
Na +11
281
Mg +12
28
Al +13
2
2 83
Особенности строения
атомов металлов:
1.
2.
На внешнем
энергетическом уровне
1 – 3 электрона.
Относительно большой
радиус атомов.
У атомов металлов
имеется избыток АО по
отношению к числу
электронов
6.
Металлическая связьВ узлах решетки
находятся:
атомы металлов
катионы металлов
свободные электроны (электронный газ)
7.
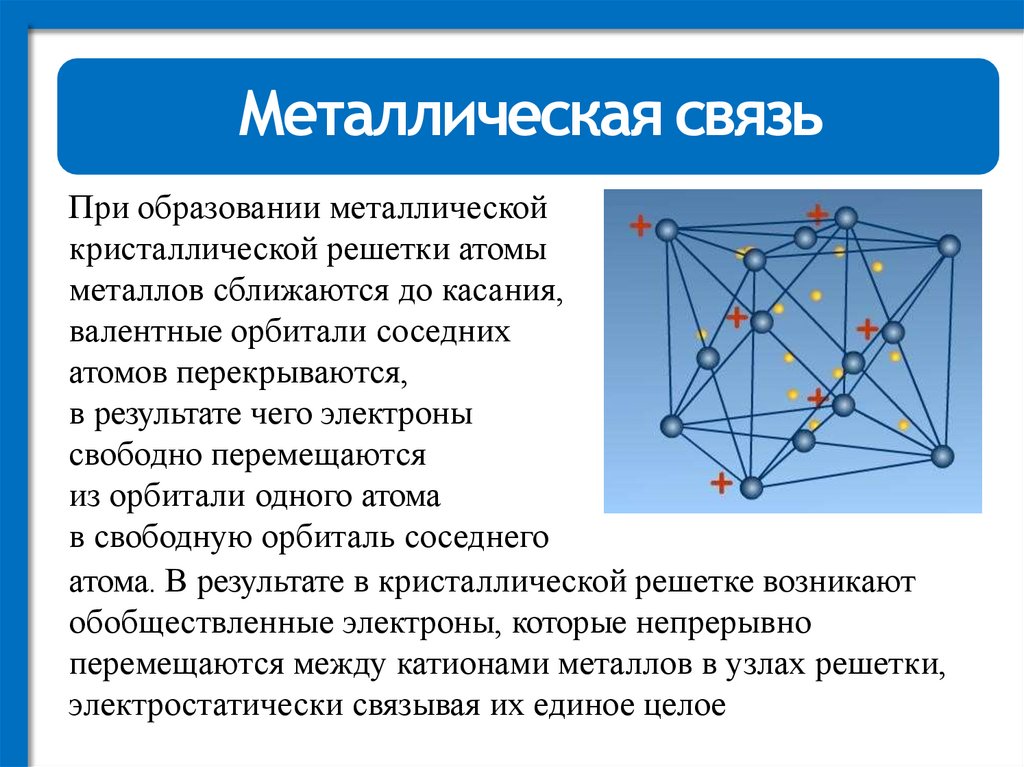
Металлическая связьПри образовании металлической
кристаллической решетки атомы
металлов сближаются до касания,
валентные орбитали соседних
атомов перекрываются,
в результате чего электроны
свободно перемещаются
из орбитали одного атома
в свободную орбиталь соседнего
атома. В результате в кристаллической решетке возникают
обобществленные электроны, которые непрерывно
перемещаются между катионами металлов в узлах решетки,
электростатически связывая их единое целое
8.
Запишите определениеМеталлическая химическая связь – связь
в металлах и сплавах за счет относительно
свободных электронов (электронного газа)
M ne
M
n
9.
Свойства металлическойсвязи
1. Ненаправленность
2. Ненасыщаемость
3. Небольшое число валентных электронов и
большое число свободных АО
4. Слабее ковалентной и ионной
5. Определяет все общие свойства металлов
10.
Общие физические свойстваметаллов
1. Твердое агрегатное
состояние
2. Серый цвет
искл. – Hg
искл. – Cu(красн.),
Au (желт.),
Cs(золотистый)
3. Металлический
блеск
4. Электропроводность Ag CuAu Al … Hg Pb Mn
понижение
5. Теплопроводность
6. Пластичность
Au AgCuSnPb Zn… Bi Mn
, ковкость
понижение
11.
Водородная связьВкаких веществах реализуется
водородная связь?
12.
Водородная связьМежмолекулярные
водородные связи
13.
Запишите определениеВодородная связь – химическая связь
между атомом водорода и атомом
сильно электроотрицательного
элемента (F, O, N)
14.
Водородная связьмежмолекулярная
внутримолекулярная
15.
Примеры водородной связиДаже в газообразном состоянии, фтороводород
состоит из смеси полимеров
H2F2, H3F3, H4F4, H5F5, H6F6
16.
Примеры водородной связиНаличием водородных
связей объясняются
аномальные свойства
воды: высокая температура
плавления и кипения (по
сравнению с H2S, H2Se),
высокая теплоемкость
17.
Структура кристаллов льдаФорма снежинок
обусловлена
направленностью
ковалентной связи
в молекулах воды
и межмолекулярными
водородными связями
18.
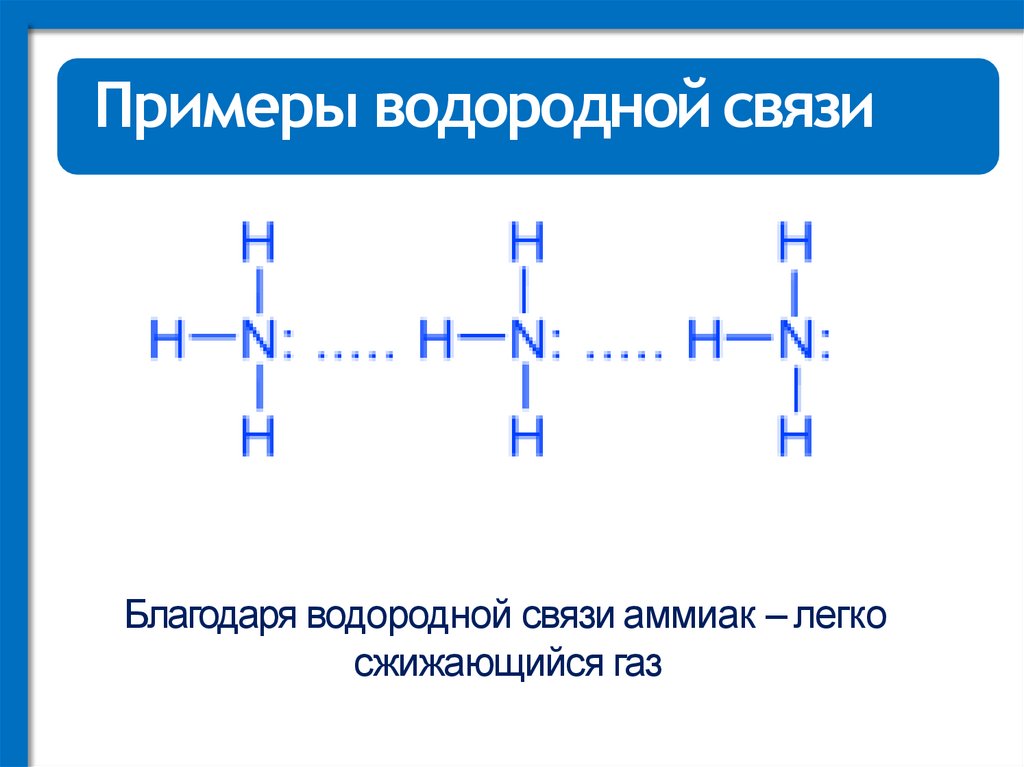
Примеры водородной связиБлагодаря водородной связи аммиак – легко
сжижающийся газ
19.
Примеры водородной связиОбразование межмолекулярной
водородной связи в спиртах
20.
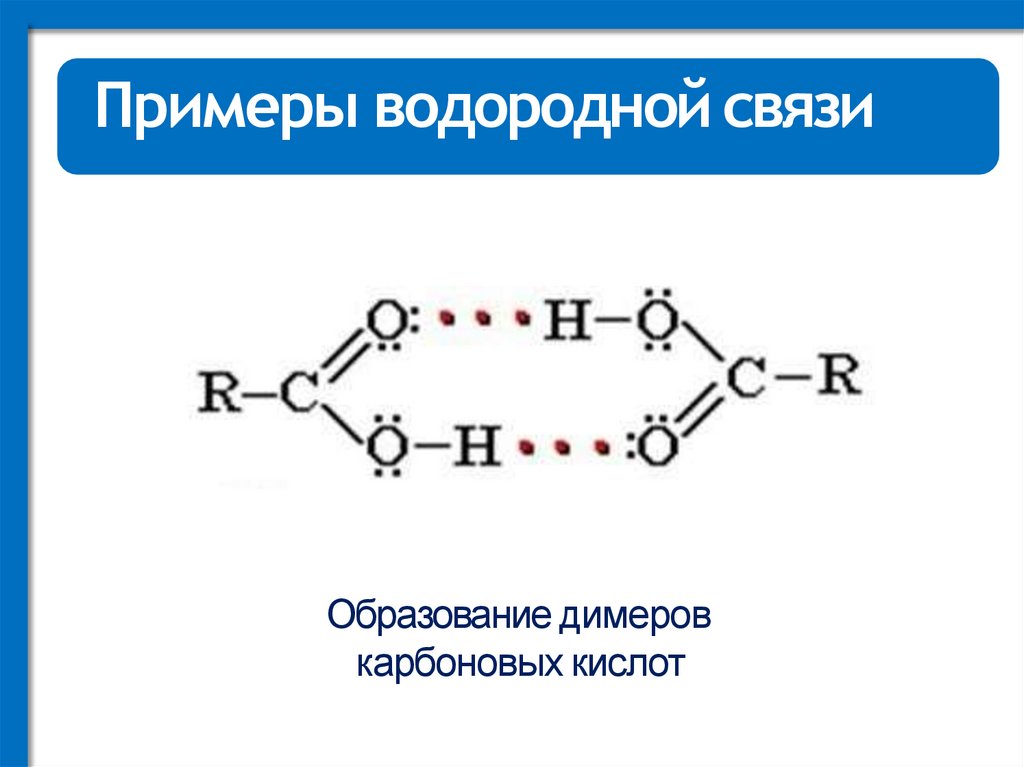
Примеры водородной связиОбразование димеров
карбоновых кислот
21.
Примеры водородной связивторичная структура
белковой молекулы
22.
Примеры водородной связиДНК
23.
Выполните заданиеВ аммиаке и хлориде бария химическаясвязь
соответственно
1) ионная и ковалентнаяполярная
2) ковалентная полярная и ионная
3) ковалентная неполярная металлическая
4) ковалентная неполярная и ионная
24.
Выполните заданиеЧисло – и –связей в молекуле этилена
соответственно равно
1) 4 и 1
2) 4 и 2
3) 5 и 1
4) 5 и 2
25.
Выполните заданиеУкажите формулу вещества, молекула которого
неполярна, но содержит ковалентные полярные
связи:
1) NH3
3) CH2Cl2
2) H2S
4) BF3
26.
Выполните заданиеКакие из приведенных утверждений верны?
А. Вещества с молекулярной решеткой имеют
низкие температуры плавления и низкую
электропроводность.
Б. Вещества с атомной решеткой пластичны и
обладают высокой электрической проводимостью.
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
27.
Выполните заданиеВещества, которые не могут образовать
межмолекулярные водородные связи
1) ацетон и вода
2) этаналь и хлорбензол
3) аланин и этанол
4) аммиак и пропанол
28.
Выполните заданиеКак меняется полярность связи вряду:
HCl – H2S – PH3
29.
Выполните заданиеОпределите число - и -связей
в каждой из молекул:
SF6
SO3
SO2F2
30.
Домашнее заданиеУчебник:
§ 5, 6;
Подготовиться к контрольной
работе по теме «Строение
вещества»



























 chemistry
chemistry








