Similar presentations:
Физиология и биохимия микроорганизмов. Биохимическая идентификация бактерий (часть 2)
1.
Основы микробиологии ииммунологии
1
2. Физиология и биохимия микроорганизмов 2 часть
3. Биохимическая идентификация бактерий
Биохимическая идентификация основывается на определении ферментов
микроорганизмов. Присутствие ферментов определяют по их способности
разлагать соответствующие субстраты, для такой идентификации необходимо
18 – 24 часа. В последнее время определяют непосредственно сами
ферменты, для такой идентификации требуется 4 – 6 часов.
Согласно международной биохимической классификации ферментов, в
зависимости от катализируемой реакции выделяют 6 основных классов:
оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы, лигазы.
Отдельные представители каждого класса ферментов имеют систематическое
название, традиционное (тривиальное) название, а также четырехуровневый
числовой код, который отражает класс, подкласс, под-подкласс и серийный
номер фермента в под-подклассе.
Кроме систематического названия ферменты микроорганизмов имеют
традиционные названия, получаемые в зависимости от субстратной
специфичности. Традиционно ферменты микроорганизмов
классифицируются на сахаролитические, протеолитические, липолитические,
окислительно-восстановительные ферменты, а также ферменты-токсины,
которые определяют с помощью специальных сред или тестов.
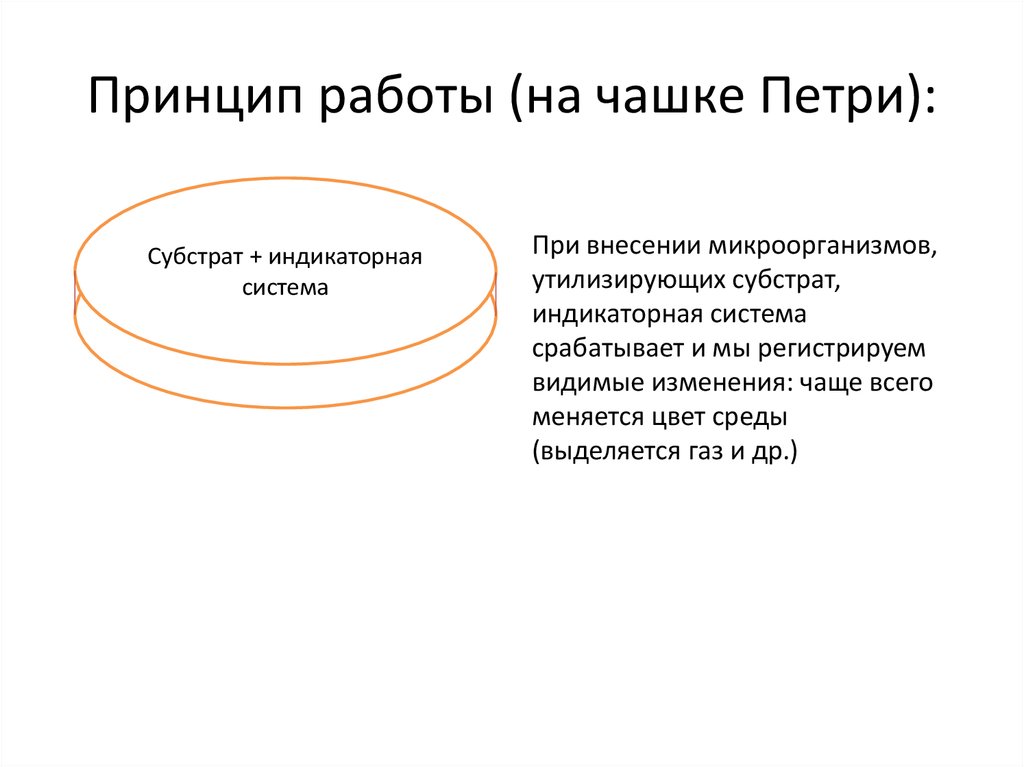
4. Принцип работы (на чашке Петри):
Субстрат + индикаторнаяСубстратсистема
+ индикаторная
система
При внесении микроорганизмов,
утилизирующих субстрат,
индикаторная система
срабатывает и мы регистрируем
видимые изменения: чаще всего
меняется цвет среды
(выделяется газ и др.)
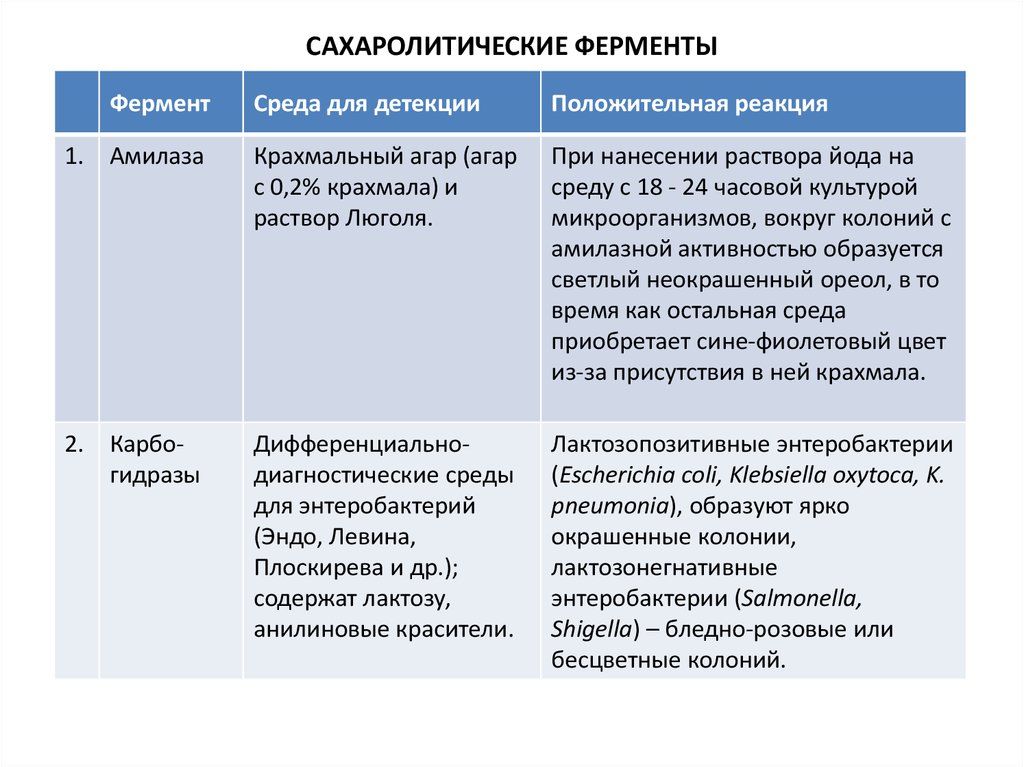
5. САХАРОЛИТИЧЕСКИЕ ФЕРМЕНТЫ
ФерментСреда для детекции
Положительная реакция
1. Амилаза
Крахмальный агар (агар
с 0,2% крахмала) и
раствор Люголя.
При нанесении раствора йода на
среду с 18 - 24 часовой культурой
микроорганизмов, вокруг колоний с
амилазной активностью образуется
светлый неокрашенный ореол, в то
время как остальная среда
приобретает сине-фиолетовый цвет
из-за присутствия в ней крахмала.
2. Карбогидразы
Дифференциальнодиагностические среды
для энтеробактерий
(Эндо, Левина,
Плоскирева и др.);
содержат лактозу,
анилиновые красители.
Лактозопозитивные энтеробактерии
(Escherichia coli, Klebsiella oxytoca, K.
pneumonia), образуют ярко
окрашенные колонии,
лактозонегнативные
энтеробактерии (Salmonella,
Shigella) – бледно-розовые или
бесцветные колоний.
6. Среда ЭНДО
Сульфат натрия и фуксин подавляют рост грамположительных бактерий.Е.coli и колиформные бактерии утилизируют* лактозу с образованием альдегида и
кислоты, а фуксин окрашивает колонии в красный цвет. У кишечной палочки этот
процесс протекает настолько сильно, что фуксин кристаллизуется и на поверхности
колонии, придавая им выраженный золотисто-зеленоватый металлический блеск.
Лактозоотрицательные и слабо лактозоположительные штаммы Е.coli такого
фуксинового блеска не образуют.
* - утилизировать – это означает перерабатывать, пользоваться, расходовать.
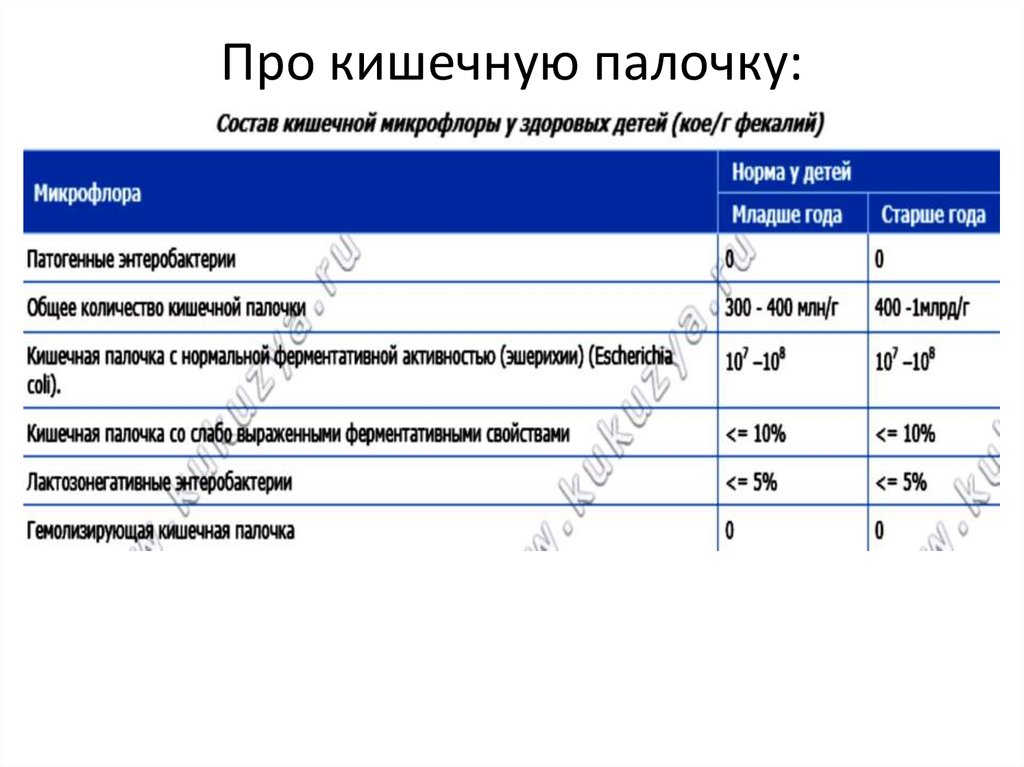
7. Про кишечную палочку:
8. Среда Левина
Среда
Левина
предназначена для выделения и дифференциации
энтеробактерий, для выделения
коагулазоположительного стафилококка при
обследовании декретированных групп.
Микроорганизмы, ферментирующие лактозу,
образуют на среде колонии фиолетового цвета с
металлическим блеском. Лактозоотрицательные
энтеробактерии образуют прозрачные, бесцветные
колонии. Стафилококки образуют на среде Левина ГРМ мелкие колонии с темным центром.
9. Среда Плоскирева (бактоагар Плоскирева)
Агар Плоскирева — селективная среда для выделения шигелл и сальмонелл из
инфицированного материала (испражнения, моча, желчь и др.). Готовая среда
прозрачна, имеет розовато-желтоватый цвет.
В состав среды Плоскирева входят ингибирующие вещества (желчные соли,
бриллиантовый зеленый, йод), вследствие чего она должна полностью подавлять
рост грамположительной флоры, значительно задерживать (первые 24 ч) рост
эшерихий и другой сопутствующей микрофлоры, подавлять роение протея.
Дифференцирующие свойства агара Плоскирева основаны на изменении рН в
кислую сторону при росте лактозоферментирующих бактерий, которые образуют
колонии брусничного цвета (индикатор нейтральный красный).
Лактозоотрицательные бактерии вырастают в виде бесцветных или
слабоокрашенных колоний. Вегетирующие свойства среды недостаточны для роста
Sh. dysenteriae и некоторых сальмонелл (S. cholerae-suis, S. pullorum).
10.
ФерментСреда для детекции
Положительная реакция
Карбогидразы
Полиуглеводные среды
(Клиглера, Олькеницкого
и др.). Среда Клиглера
имеет малиновокрасный цвет и
содержит: 0,1% глюкозы,
1% лактозы, соли Fe 2+,
феноловый красный
(индикатор рН).
При разложении глюкозы желтеет
столбик среды, при разложении
лактозы желтеет скошенная часть
среды, при разложении углеводов с
образованием CO2 в среде также
появляются газовые пузырьки или
разрыв столбика;
при образовании H2S наблюдается
почернение по ходу укола.
Карбогидразы
Жидкие или полужидкие
моноуглеводные среды
Гисса; содержат один из
углеводов, индикатор рН
(табл. 5); рН среды
устанавливают 7,2±0,2.
Для выявления
газообразования в
жидкие среды вносят
поплавок.
При разложении углеводов
образуются кислые продукты,
снижающие рН среды, в результате
чего индикатор рН изменяет цвет.
Газообразование на жидких средах
приводит к накоплению газа в
поплавке, в полужидких –
появлению разрывов или газовых
пузырьков в среде.
11. Ферменты бактерий на дифференциально-диагностических средах. Среда Клиглера
Дифференциация представителейсемейства Enterobacteriaceae на
среде Клиглера: 1 - среда до посева;
2 - Salmonella; 3 - Escherichia; 4 Shigella; 5 - Salmonella Typhi
12. Среда Олькеницкого
Среда предназначена для дифференциации энтеробактерий по способности
сбраживать углеводы в присутствии индикатора и железосульфатного
комплекса. Тифозная палочка разлагает глюкозу до кислоты (желтеет столбик
агара), не ферментирует лактозу и сахарозу (цвет скошенной части не
меняется), выделяет сероводород (почернение на границе столбика и
скошенной части). Паратифозные бактерии ферментируют глюкозу до
кислоты и газа (пожелтение и разрывы столбика агара).
13. Среды Гисса
• Эти среды рекомендованы для изученияферментации различных углеводов
чистыми культурами микроорганизмов с
целью их дифференциации.
После добавления углевода (глюкозы,
лактозы, сахарозы, маннита, мальтозы и
др.), в случае положительной реакции
В состав среды Гисса входит основной фон (пептон
продукты ферментации закисляют
и K2HPO4), индикатор (бромтимоловый синий,
среду. Перекрашивание среды в синий
бромкрезоловый пурпурный, Андреде) и один из
или голубой цвет (наличие индикатора изучаемых углеводов или спиртов. Различают
смесь водного голубого и розоловой
малый и
большой пестрый ряд Гисса. В малый ряд Гисса
кислоты) указывает на ферментацию
входят следующие углеводы и спирты: глюкоза,
сахара с образованием кислоты; такое
сахароза, лактоза, мальтоза и маннит. В большой
же перекрашивание среды и появление
пестрый ряд Гисса входят, кроме тех, что образуют
в ее толще пузырьков - на ферментацию
малый ряд, другие углеводы и спирты, например
сахара с выделением кислоты и газа.
арабиноза, рамноза, сорбит, дульцит и т. д.
При отсутствии ферментативной
Выделение продуктов обмена регистрируется по
активности у микроба среда мутнеет, но
изменению рН среды. Например, если среда Гисса
содержит индикатор бромтимоловый синий, то
цвета не меняет.
цвет ее будет изменяться в зависимости от рН
следующим образом: рН = 7,0 – зеленый; рН > 7,0
– синий; рН < 7,0 – желтый.
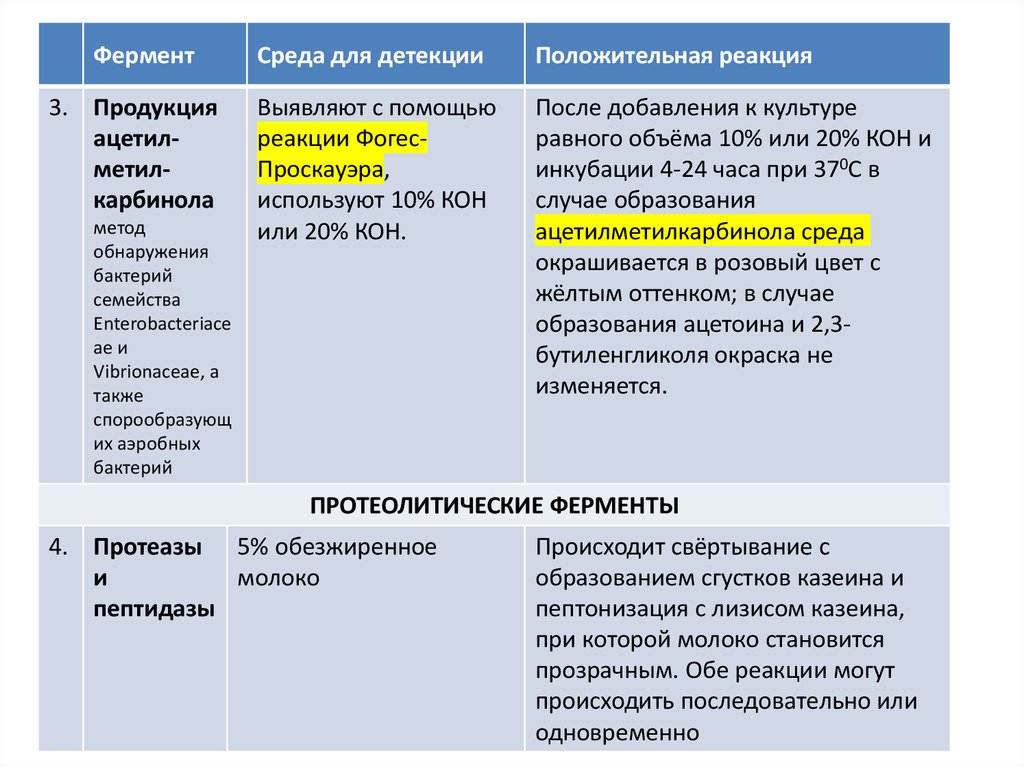
14.
Фермент3. Продукция
ацетилметилкарбинола
метод
обнаружения
бактерий
семейства
Enterobacteriace
ae и
Vibrionaceae, а
также
спорообразующ
их аэробных
бактерий
Среда для детекции
Положительная реакция
Выявляют с помощью
реакции ФогесПроскауэра,
используют 10% КОН
или 20% КОН.
После добавления к культуре
равного объёма 10% или 20% КОН и
инкубации 4-24 часа при 370С в
случае образования
ацетилметилкарбинола среда
окрашивается в розовый цвет с
жёлтым оттенком; в случае
образования ацетоина и 2,3бутиленгликоля окраска не
изменяется.
ПРОТЕОЛИТИЧЕСКИЕ ФЕРМЕНТЫ
4. Протеазы 5% обезжиренное
и
молоко
пептидазы
Происходит свёртывание с
образованием сгустков казеина и
пептонизация с лизисом казеина,
при которой молоко становится
прозрачным. Обе реакции могут
происходить последовательно или
одновременно
15. реакция Фогес-Проскауэра
Тест Фогеса-Проскауэра — один из тестов серии, известной как тесты IMViC. Буквы аббревиатурыобозначают Indole (индол), Methyl Red (метиловый красный), Voges-Proskauer (Фогес-Проскауэр) и
Citrate (цитрат). Эти тесты используются, главным образом, для различения кишечных палочек, но
могут использоваться и для других микроорганизмов семейства Enterobacteriaceae. Тест ФогесаПроскауэра основан на определении присутствия ацетилметилкарбинола. Это соединение
вырабатывается определенными микроорганизмами в ходе роста в буферном пептонноглюкозном бульоне. Ацетилметилкарбинол окисляется до диацетилметилкарбинола, меняя
окраску индикатора на розово-красную.
16.
5.Фермент
Среда для детекции
Положительная реакция
Протеазы и
пептидазы
Свёрнутая
сыворотка.
Происходит разжижение
Протеазы и
пептидазы
Столбик желатина.
Происходит разжижение
(желатину разжижают Proteus
vulgaris, Bacillus anthracis).
Протеазы и
пептидазы
Молочный агар, в
чашках Петри имеет
мутно-белый цвет.
Появляются зоны просветления
вокруг колоний на фоне мутнобелой среды.
Дезаминазы
аминокислот
Среда с одной из
аминокислот и
индикатором рН;
рН среды 7,2±0,2.
Образуется аммиак,
приводящий к защелачиванию
среды и изменению цвета
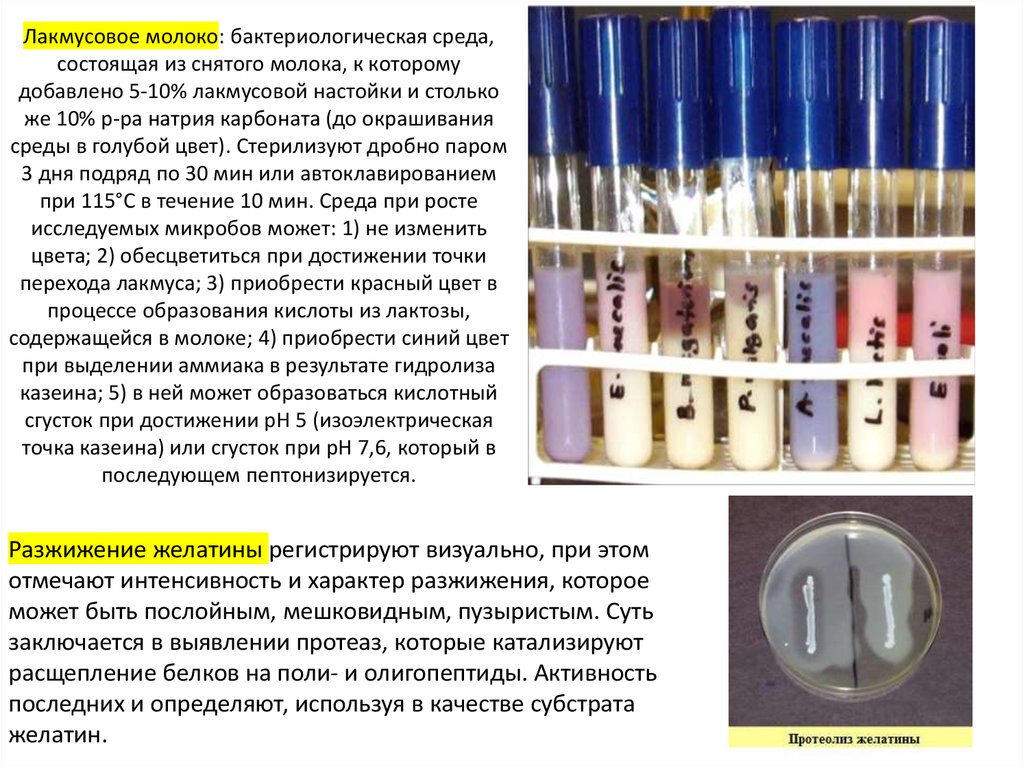
индикатора.
17. Лакмусовое молоко: бактериологическая среда, состоящая из снятого молока, к которому добавлено 5-10% лакмусовой настойки и
столькоже 10% р-ра натрия карбоната (до окрашивания
среды в голубой цвет). Стерилизуют дробно паром
3 дня подряд по 30 мин или автоклавированием
при 115°С в течение 10 мин. Среда при росте
исследуемых микробов может: 1) не изменить
цвета; 2) обесцветиться при достижении точки
перехода лакмуса; 3) приобрести красный цвет в
процессе образования кислоты из лактозы,
содержащейся в молоке; 4) приобрести синий цвет
при выделении аммиака в результате гидролиза
казеина; 5) в ней может образоваться кислотный
сгусток при достижении рН 5 (изоэлектрическая
точка казеина) или сгусток при рН 7,6, который в
последующем пептонизируется.
Разжижение желатины регистрируют визуально, при этом
отмечают интенсивность и характер разжижения, которое
может быть послойным, мешковидным, пузыристым. Суть
заключается в выявлении протеаз, которые катализируют
расщепление белков на поли- и олигопептиды. Активность
последних и определяют, используя в качестве субстрата
желатин.
18.
ФерментСреда для детекции
Положительная реакция
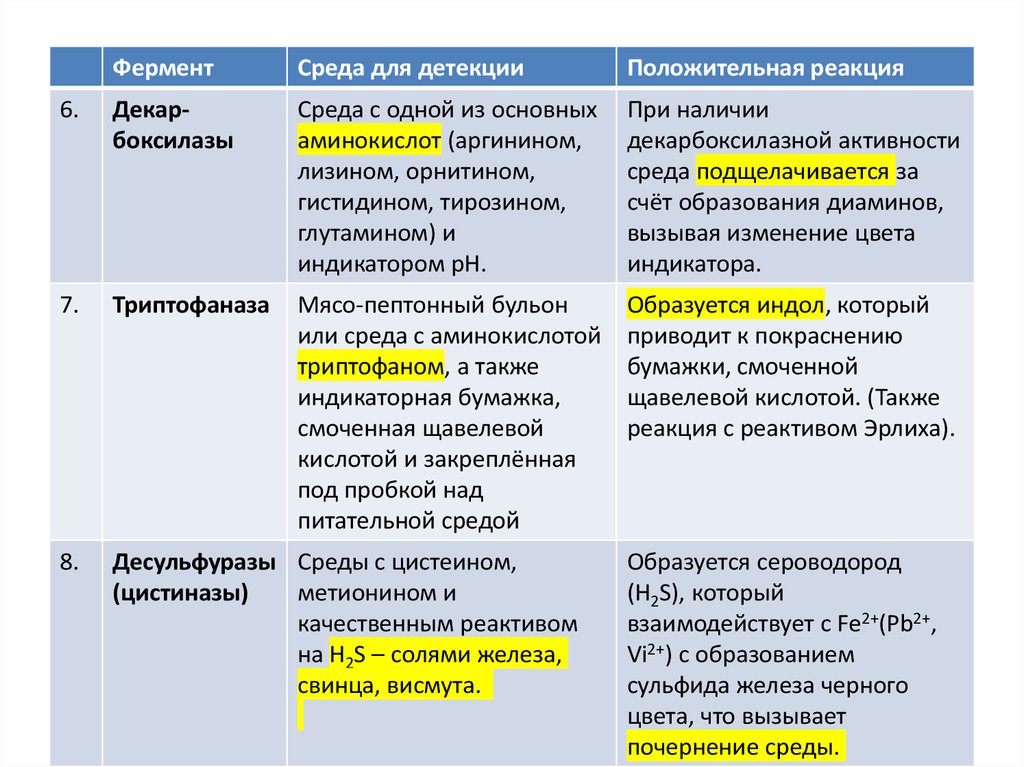
6.
Декарбоксилазы
Среда с одной из основных
аминокислот (аргинином,
лизином, орнитином,
гистидином, тирозином,
глутамином) и
индикатором рН.
При наличии
декарбоксилазной активности
среда подщелачивается за
счёт образования диаминов,
вызывая изменение цвета
индикатора.
7.
Триптофаназа
Мясо-пептонный бульон
или среда с аминокислотой
триптофаном, а также
индикаторная бумажка,
смоченная щавелевой
кислотой и закреплённая
под пробкой над
питательной средой
Образуется индол, который
приводит к покраснению
бумажки, смоченной
щавелевой кислотой. (Также
реакция с реактивом Эрлиха).
8.
Десульфуразы Среды с цистеином,
(цистиназы)
метионином и
качественным реактивом
на H2S – солями железа,
свинца, висмута.
Образуется сероводород
(H2S), который
взаимодействует с Fe2+(Pb2+,
Vi2+) с образованием
сульфида железа черного
цвета, что вызывает
почернение среды.
19.
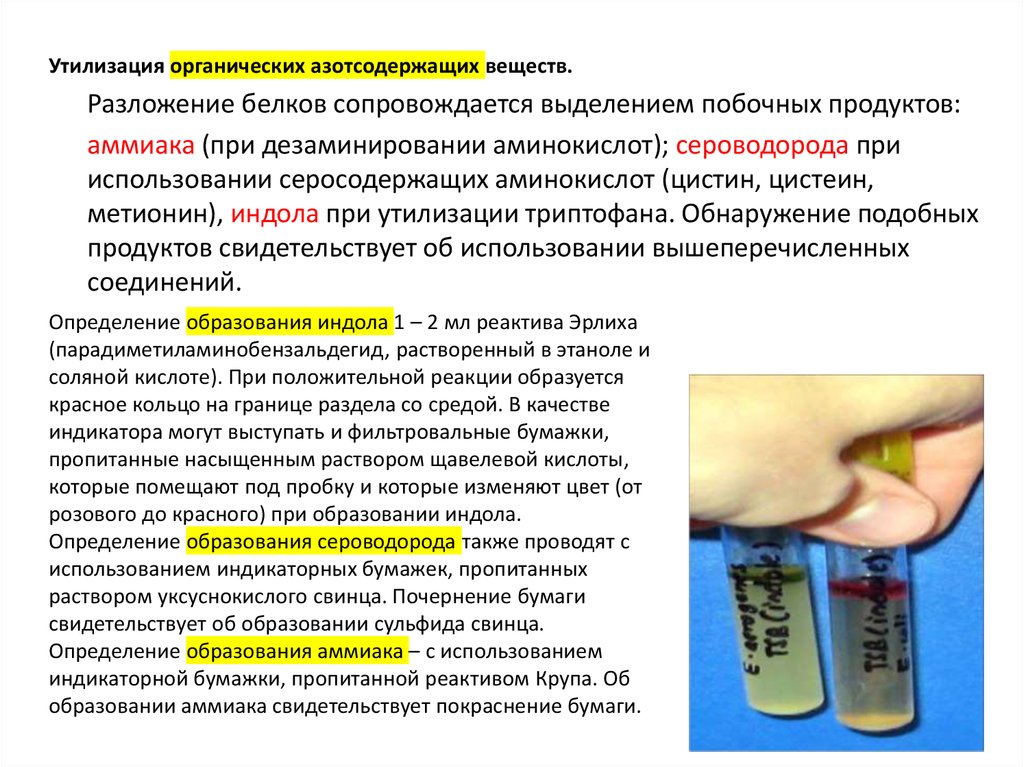
Утилизация органических азотсодержащих веществ.Разложение белков сопровождается выделением побочных продуктов:
аммиака (при дезаминировании аминокислот); сероводорода при
использовании серосодержащих аминокислот (цистин, цистеин,
метионин), индола при утилизации триптофана. Обнаружение подобных
продуктов свидетельствует об использовании вышеперечисленных
соединений.
Определение образования индола 1 – 2 мл реактива Эрлиха
(парадиметиламинобензальдегид, растворенный в этаноле и
соляной кислоте). При положительной реакции образуется
красное кольцо на границе раздела со средой. В качестве
индикатора могут выступать и фильтровальные бумажки,
пропитанные насыщенным раствором щавелевой кислоты,
которые помещают под пробку и которые изменяют цвет (от
розового до красного) при образовании индола.
Определение образования сероводорода также проводят с
использованием индикаторных бумажек, пропитанных
раствором уксуснокислого свинца. Почернение бумаги
свидетельствует об образовании сульфида свинца.
Определение образования аммиака – с использованием
индикаторной бумажки, пропитанной реактивом Крупа. Об
образовании аммиака свидетельствует покраснение бумаги.
20.
9.Фермент
Среда для детекции
Положительная реакция
Уреаза
Среда с мочевиной и
индикатором рН
феноловым красным, рН
среды устанавливают
6,8±0,2.
Образуется аммиак и окраска
среды из красно-оранжевой
переходит в малиново-лиловую
за счёт сдвига рН в щелочную
сторону.
ЛИПОЛИТИЧЕСКИЕ ФЕРМЕНТЫ
10. Липаза
Желточный агар или среда
с твином-80.
Липазы гидролизуют жиры на
глицерин и свободные жирные
кислоты. Вокруг колоний в
проходящем свете на
поверхности среды видна
радужная пленка (похожа на
бензиновую пленку на
поверхности воды).
11. Лецитиназа
есть у S.aureus,
клостридий,
фузобактерий
Желточный агар (к 300 мл
стерильного МПА
добавляют желток
куриного яйца).
Лецитиназа расщепляет лецитин
на фосфохолин и диглицерид, и
вокруг колоний появляются
опалесцирующие зоны, или
«венчики помутнения».
21.
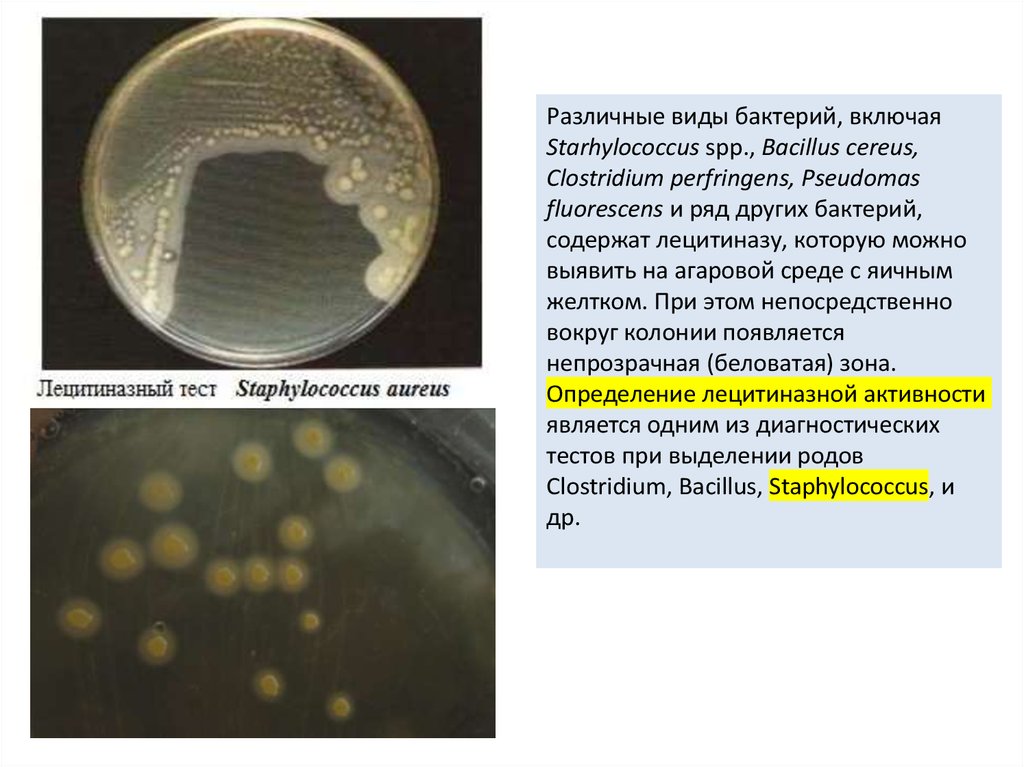
Различные виды бактерий, включаяStarhylococcus spp., Bacillus cereus,
Clostridium perfringens, Pseudomas
fluorescens и ряд других бактерий,
содержат лецитиназу, которую можно
выявить на агаровой среде с яичным
желтком. При этом непосредственно
вокруг колонии появляется
непрозрачная (беловатая) зона.
Определение лецитиназной активности
является одним из диагностических
тестов при выделении родов
Clostridium, Bacillus, Staphylococcus, и
др.
22.
ФерментСреда для детекции
Положительная реакция
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ФЕРМЕНТЫ (ОВФ)
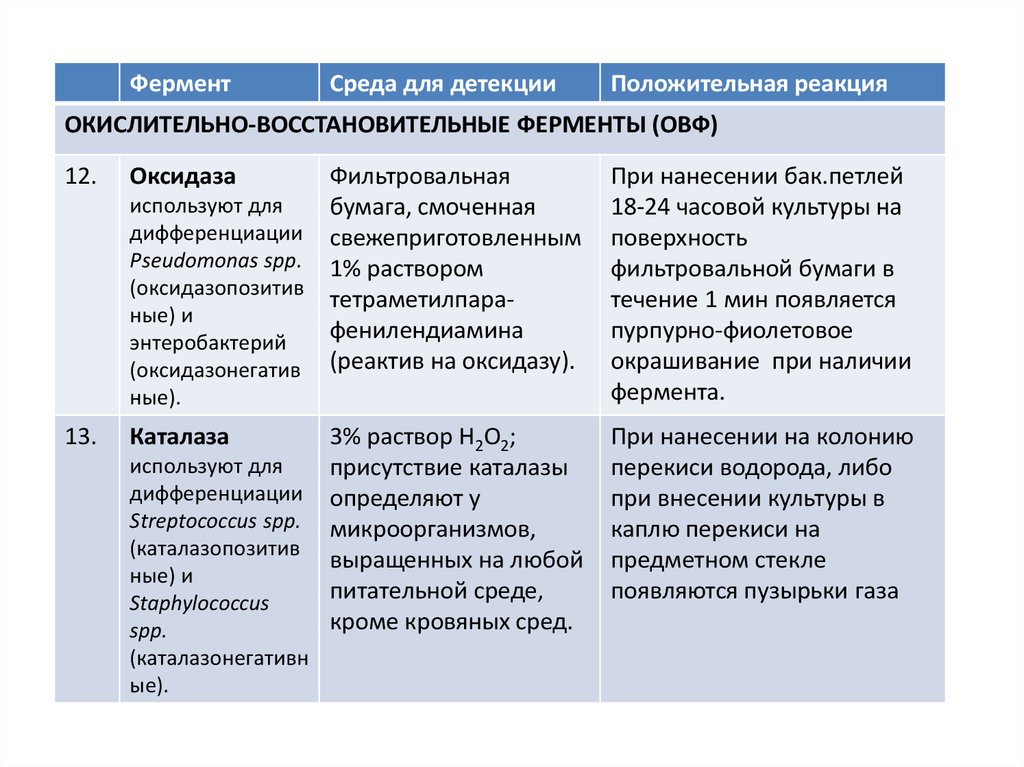
12.
Оксидаза
Фильтровальная
используют для
бумага, смоченная
дифференциации свежеприготовленным
Pseudomonas spр. 1% раствором
(оксидазопозитив
тетраметилпараные) и
фенилендиамина
энтеробактерий
(оксидазонегатив (реактив на оксидазу).
ные).
13.
Каталаза
используют для
дифференциации
Streptococcus spр.
(каталазопозитив
ные) и
Staphylococcus
spp.
(каталазонегативн
ые).
3% раствор Н2О2;
присутствие каталазы
определяют у
микроорганизмов,
выращенных на любой
питательной среде,
кроме кровяных сред.
При нанесении бак.петлей
18-24 часовой культуры на
поверхность
фильтровальной бумаги в
течение 1 мин появляется
пурпурно-фиолетовое
окрашивание при наличии
фермента.
При нанесении на колонию
перекиси водорода, либо
при внесении культуры в
каплю перекиси на
предметном стекле
появляются пузырьки газа
23.
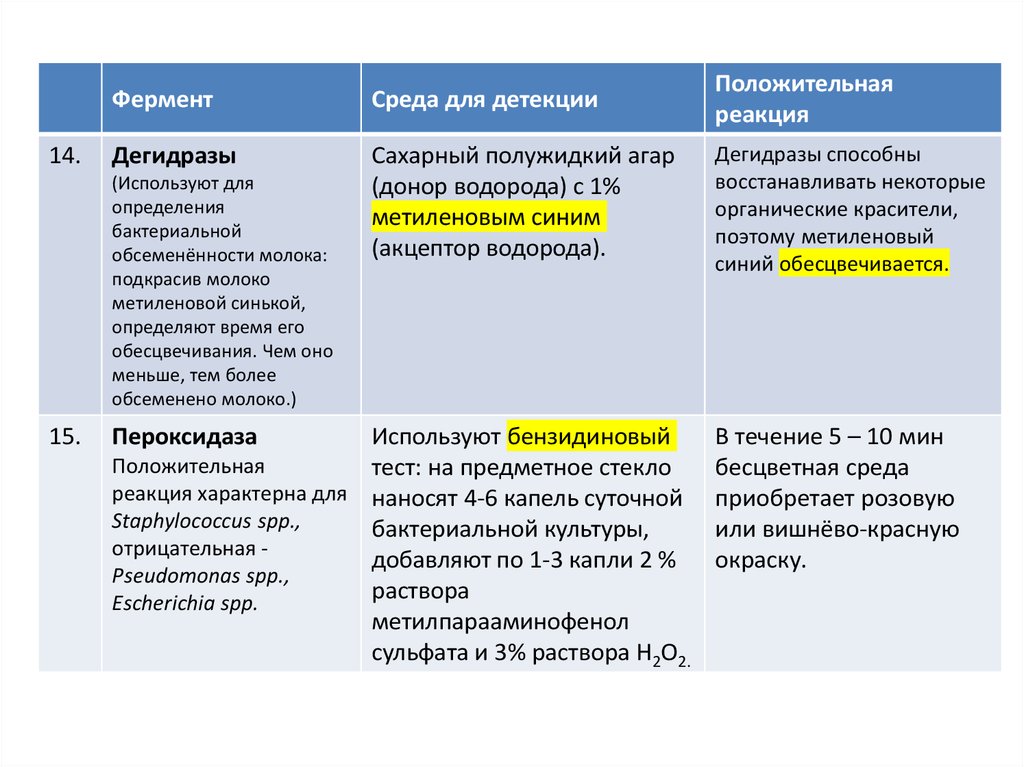
14.Фермент
Среда для детекции
Положительная
реакция
Дегидразы
Сахарный полужидкий агар
(донор водорода) с 1%
метиленовым синим
(акцептор водорода).
Дегидразы способны
восстанавливать некоторые
органические красители,
поэтому метиленовый
синий обесцвечивается.
(Используют для
определения
бактериальной
обсеменённости молока:
подкрасив молоко
метиленовой синькой,
определяют время его
обесцвечивания. Чем оно
меньше, тем более
обсеменено молоко.)
15.
Пероксидаза
Используют бензидиновый
Положительная
тест: на предметное стекло
реакция характерна для наносят 4-6 капель суточной
Staphylococcus spp.,
бактериальной культуры,
отрицательная добавляют по 1-3 капли 2 %
Pseudomonas spp.,
раствора
Escherichia spp.
метилпарааминофенол
сульфата и 3% раствора Н2О2.
В течение 5 – 10 мин
бесцветная среда
приобретает розовую
или вишнёво-красную
окраску.
24.
ФерментСреда для детекции
Положительная реакция
ФЕМЕНТЫ-ТОКСИНЫ
16.
Гемолизины
5-10% кровяной агар
β-гемолиз, когда зона лизиса
вокруг колонии бесцветная,
α-гемолиз, когда зона вокруг
колонии окрашена в
зеленый цвет,
γ-гемолиз - применяют для
обозначения отсутствия
видимой зоны гемолиза.
В пробирки с
двукратными
разведениями βгемолитических
стрептококков добавляют
равный объем 5%
эритроцитов кролика,
инкубируют при 370С 1
час; параллельно ставят
контроль из взвеси
эритроцитов в
питательном бульоне.
В положительных случаях
происходит гемолиз (лаковая
кровь), в отрицательных случаях
образуется осадок из
эритроцитов.
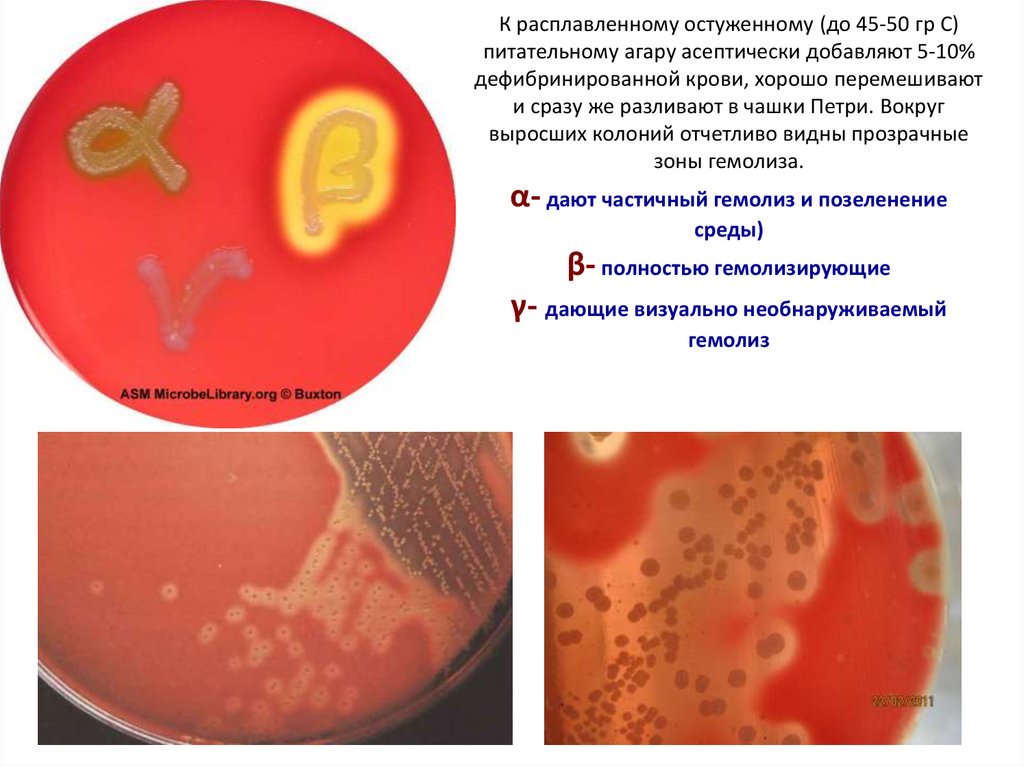
Streptococcus
pneumoniae: a-гемолиз,
зеленоватый ореол
вокруг колонии.
Streptococcus pyogenes:
b-гемолиз, зона лизиса
вокруг или под колонией.
17.
О-стрептолизин
Определяют титр Острептолизина - наибольшее
разведение микробной
культуры при котором
наблюдается гемолиз.
25. К расплавленному остуженному (до 45-50 гр С) питательному агару асептически добавляют 5-10% дефибринированной крови, хорошо
перемешиваюти сразу же разливают в чашки Петри. Вокруг
выросших колоний отчетливо видны прозрачные
зоны гемолиза.
α- дают частичный гемолиз и позеленение
среды)
β- полностью гемолизирующие
γ- дающие визуально необнаруживаемый
гемолиз
26.
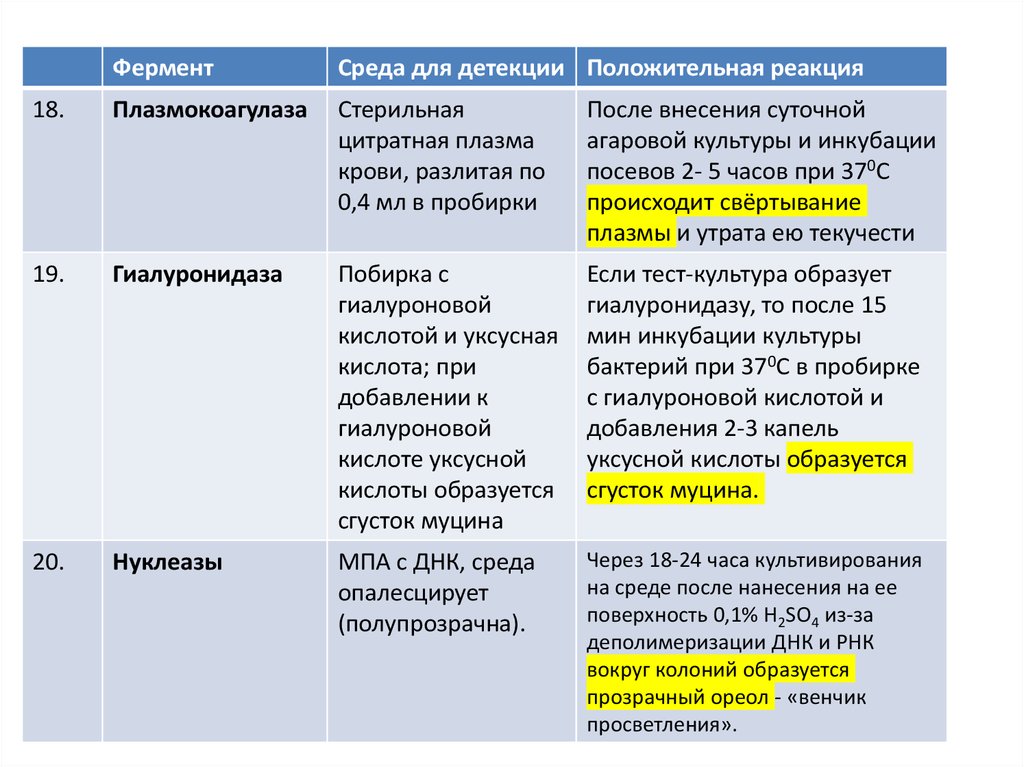
ФерментСреда для детекции Положительная реакция
18.
Плазмокоагулаза
Стерильная
цитратная плазма
крови, разлитая по
0,4 мл в пробирки
После внесения суточной
агаровой культуры и инкубации
посевов 2- 5 часов при 370С
происходит свёртывание
плазмы и утрата ею текучести
19.
Гиалуронидаза
Побирка с
гиалуроновой
кислотой и уксусная
кислота; при
добавлении к
гиалуроновой
кислоте уксусной
кислоты образуется
сгусток муцина
Если тест-культура образует
гиалуронидазу, то после 15
мин инкубации культуры
бактерий при 370С в пробирке
с гиалуроновой кислотой и
добавления 2-3 капель
уксусной кислоты образуется
сгусток муцина.
20.
Нуклеазы
МПА с ДНК, среда
опалесцирует
(полупрозрачна).
Через 18-24 часа культивирования
на среде после нанесения на ее
поверхность 0,1% H2SO4 из-за
деполимеризации ДНК и РНК
вокруг колоний образуется
прозрачный ореол - «венчик
просветления».
27. Коагулазный тест Staphylococcus aureus (положительный) и Staphylococcus epidermidis (отрицательный).
тест на плазмокоагулазу:культуру микроорганизмов вносят в
пробирку с 0,5 мл плазмы крови
кролика, помещают в термостат
при 37⁰С, через 3 часа пробирку
вынимают,
оставляют
при
комнатной температуре на 18 - 20
часов.
Реакция считается положительной
независимо
от
степени
свертывания
плазмы
от
небольшого сгустка, взвешенного в
плазме, до полного неподвижного
сгустка.
28.
21.22.
Фермент
Среда для детекции
Положительная реакция
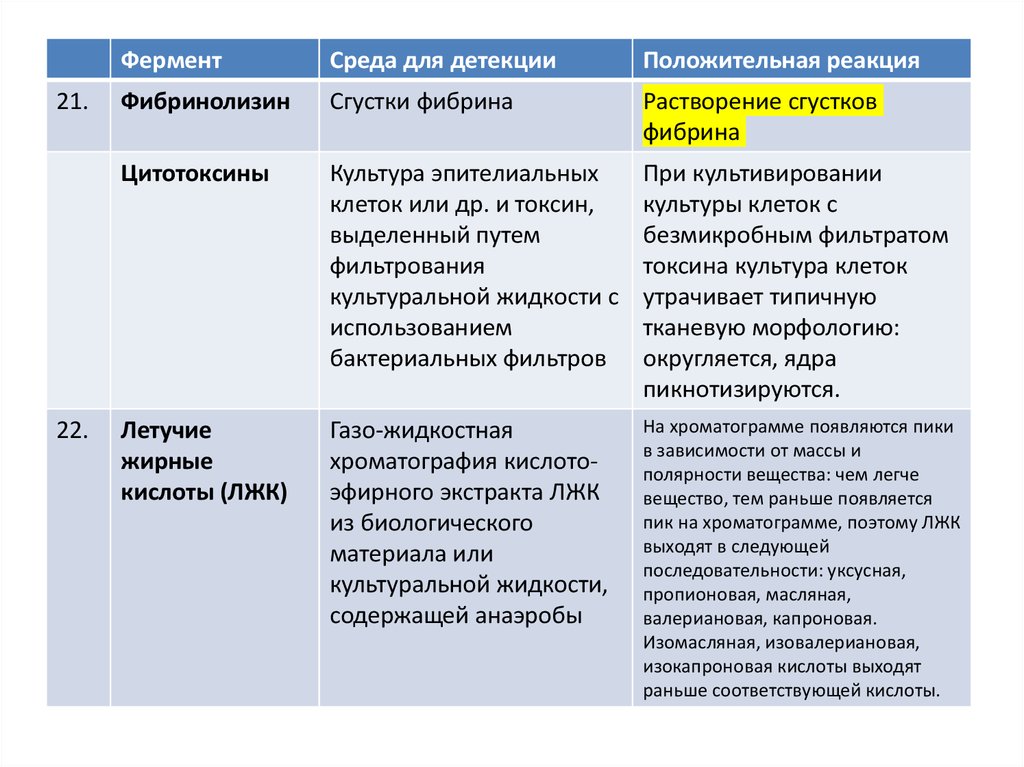
Фибринолизин
Сгустки фибрина
Растворение сгустков
фибрина
Цитотоксины
Культура эпителиальных
клеток или др. и токсин,
выделенный путем
фильтрования
культуральной жидкости с
использованием
бактериальных фильтров
При культивировании
культуры клеток с
безмикробным фильтратом
токсина культура клеток
утрачивает типичную
тканевую морфологию:
округляется, ядра
пикнотизируются.
Летучие
жирные
кислоты (ЛЖК)
Газо-жидкостная
хроматография кислотоэфирного экстракта ЛЖК
из биологического
материала или
культуральной жидкости,
содержащей анаэробы
На хроматограмме появляются пики
в зависимости от массы и
полярности вещества: чем легче
вещество, тем раньше появляется
пик на хроматограмме, поэтому ЛЖК
выходят в следующей
последовательности: уксусная,
пропионовая, масляная,
валериановая, капроновая.
Изомасляная, изовалериановая,
изокапроновая кислоты выходят
раньше соответствующей кислоты.
29. Среда TSN
• используется для выделенияанаэробных бактерий.
Готовится из питательного
агара, к которому добавляют
1% глюкозы, хлорид железа и
сульфит натрия. Анаэробные
клостридии (Clostridium
perfringens) образуют на
среде колонии черного цвета
за счет образования
соединений железа с серой.
30. Питательные среды для анаэробов:
Анаэробный кровяной агар (в т.ч. с селективными добавками – неомицин или
канамицин, гентамицин или др. – для подавления роста факультативноанаэробных МО).
Желточный агар.
Среда для контроля стерильности (СКС).
Среда для исследования крови на бактериемию.
Среда Китта-Тароцци – с добавлением кусочков печени и вазелиновым
маслом на поверхности.
Среда Вильсона-Блера – для ускоренной диагностики газовой гангрены
(среда с возбудителем через 4-6 часов чернеет и в ней появляются разрывы
за счет выделяемого газа)
Лакмусовое молоко. Для ускоренной диагностики газовой гангрены – через 24 часа при 42 С в среде появляется коричнево-красный творожистый осадок
казеина, пронизанный пузырьками газа.
Сахарный агар. Используют для выделения анаэробов методом Вейнберга,
Вейона-Виньяля, Перетца.
Среды для определения сахаролитических свойств анаэробов.
31. Методы выделения чистых культур облигатных анаэробов
Метод Цейсслера – исследуемый материал рассевают штрихами по поверхности
плотной пит.среды, помещают в анаэробные условия и выдерживают при 37 С в
течение 24-72 ч. Изолированные колонии пересевают в среду СКС или Китта-Тароцци.
Метод Вейнберга - готовят последовательные разведения материала в изотоническом
растворе и высевают их в пробирки с расплавленным и остуженным до 40-450С
сахарным агаром или средой Вильсон-Блера. Клостридии растут в виде черных
колоний в толще среды.
Метод Вейона-Виньяля - метод выделения анаэробных микроорганизмов путем
выращивания их изолированных колоний в глубине плотной питательной среды в
запаянном капилляре пастеровской пипетки, которые легко изолировали, надломав
капилляр выше уровня намеченной колонии.
Метод Перетца – готовят разведения исследуемого материала, содержимое пробирки
выливают на стерильную чашку Петри на дне которой на двух стеклянных палочках
лежит стеклянная пластинка размером 6Х6 см. Среду заливают сбоку таким образом,
чтобы она заполнила пространство между дном чашки и пластинкой, При появлении
микробного роста пластинку удаляют, а изолированную колонию пересевают на среду
Китта-Тароцци или СКС для получения чистой культуры. Разновидность этого метода –
метод «перевёрнутых чашек» – агар заливают в крышку, а закрывают стерильным
донышком так, чтобы не образовывались пузырьки воздуха. Щель между краями
крышки и донышка заливают парафином.
32. Методы выделения чистых культур облигатных анаэробов
• Химический способ культивирования анаэробов в эксикаторах (методАристовского). Посевы исследуемого материала в чашках Петри
помещали в эксикатор - стеклянные емкости с притертыми краями
крышки. На дно эксикатора вносили химический поглотитель
кислорода: гипосульфит натрия или пирогаллол, и углекислый натрий.
• Биологический способ культивирования анаэробов (метод Фортнера),
или метод совместного культивирования анаэробов и аэробов на
плотных питательных средах в запаянных чашках Петри. На
поверхность среды в чашках Петри (5% кровяной агар с 1-2%
глюкозы), разделенной на две половины желобком, высевали на
одной половине культуру активно поглощающих кислород аэробов (S.
marcescens или E. coli), на другой половине – исследуемый материал.
Чашки запаивали воском или заклеивали лейкопластырем. Аэробные
бактерии быстро использовали кислород в герметически закрытой
чашке, что создавало условия для роста анаэробов. Метод позволял
выделять некоторые Clostridium spp.




















 biology
biology








