Similar presentations:
Структура периодической системы элементов
1. Структура периодической системы элементов
2. Историческая справка
• Открыта 1 марта 1969г. Д. И. Менделеевым• Является графическим отображением
периодического закона
• Известны более 400 вариантов, но самые
используемые короткий и длинный вариант
3. Длинный вариант периодической системы
4. Короткий вариант периодической системы
5. Периодический закон
• Периодический закон (1869 г.):«Свойства химических элементов, а также
характер и свойства их соединений (оксидов
и гидроксидов) находятся в периодической
зависимости от их атомных масс»
• Современная трактовка: свойства
химических элементов и образуемых ими
соединений находятся в периодической
зависимости от величины заряда их
атомных ядер.
6.
Физический смысл порядковогономера химического элемента
Числу
протонов в ядре
Порядковый номер
элемента
Числу
электронов
Заряду
ядра атома
= численно равен
7.
Физический смысл положенияхимического элемента В ПСХЭ
Количество
энергетических
уровней
Номер
периода
Номер группы
(для Э главной
подгруппы)
Число электронов на
внешнем электронном
слое атома
Номер группы
(для Э побочной
подгруппы)
= численно равен
Число валентных
электронов
8. Структура периодической системы
Периодическая система9. Периоды
• Горизонтальные ряды, сходных по свойствамэлементов
• Всего 7
• Обозначаются римскими цифрами
• Делятся на малые (I,II,III) и большие
(IV,V,VI), VII-незаконченный
• Наблюдается закономерное изменение
свойств
10. Группы
• Горизонтальные ряды сходных по свойствамэлементов.
• Всего 8
• Делятся на главные (A) и побочные (B)
• Наблюдается изменение свойств элементов
11. Изменение свойств элементов в периодах
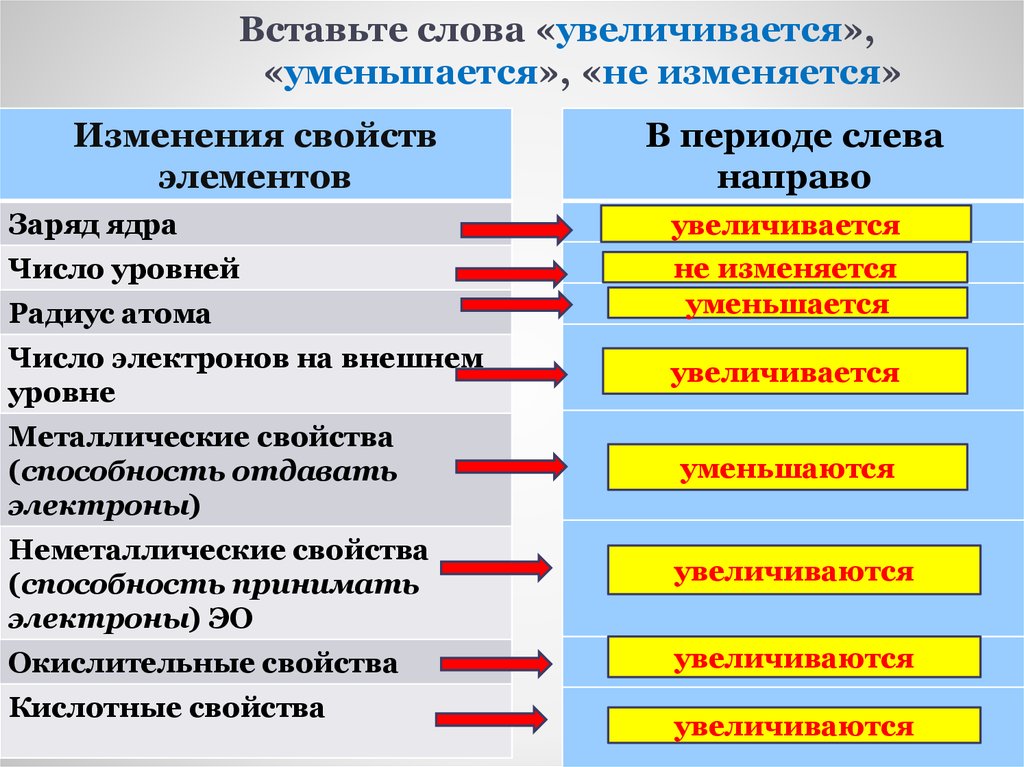
При увеличении заряда ядра атома (придвижении слева направо):
число электронных слоев атомов не изменяется
число электронов на внешнем слое атомов увеличивается от 1 до 8
радиус атома уменьшается
прочность связи электронов внешнего слоя с ядром увеличивается
Энергия ионизации увеличивается
Сродство к электрону увеличивается
Э.О увеличивается
Ме свойства , восстановительные свойства уменьшается
неМе свойства , окислительные свойства усиливается
основный характер оксидов и гидроксидов уменьшается
кислотный характер оксидов и гидроксидов усиливается
сила бескислородных кислот увеличивается
ст. ок. в высших оксидах возрастает от +1 до +7
12. Изменение свойств элементов в группах
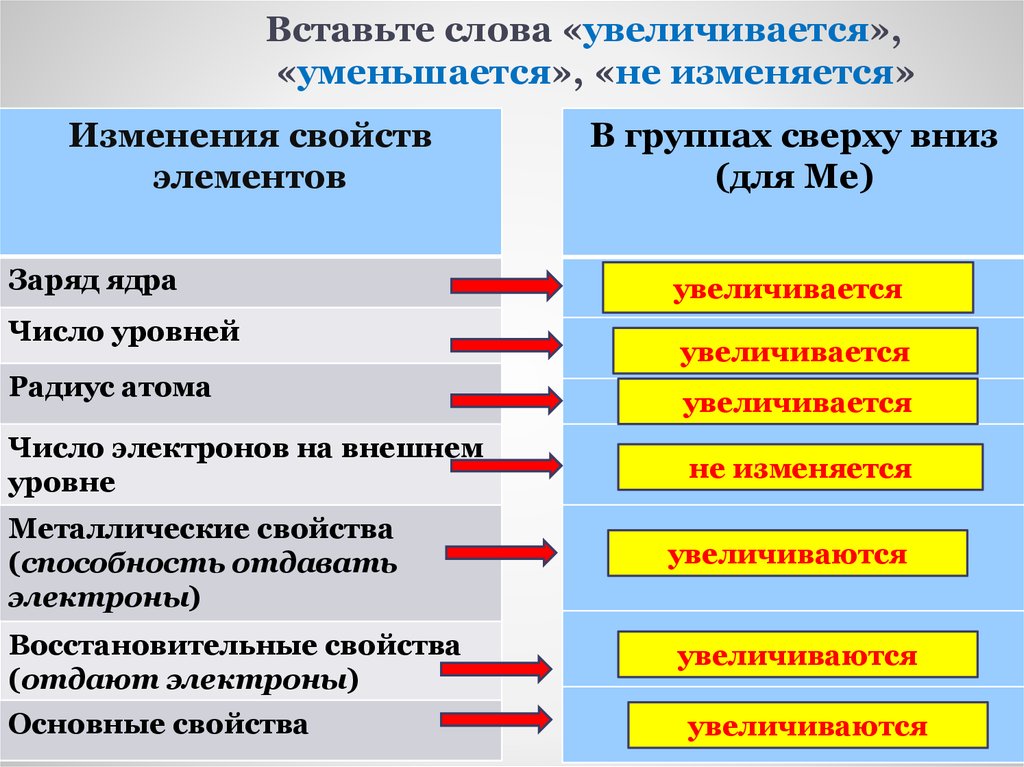
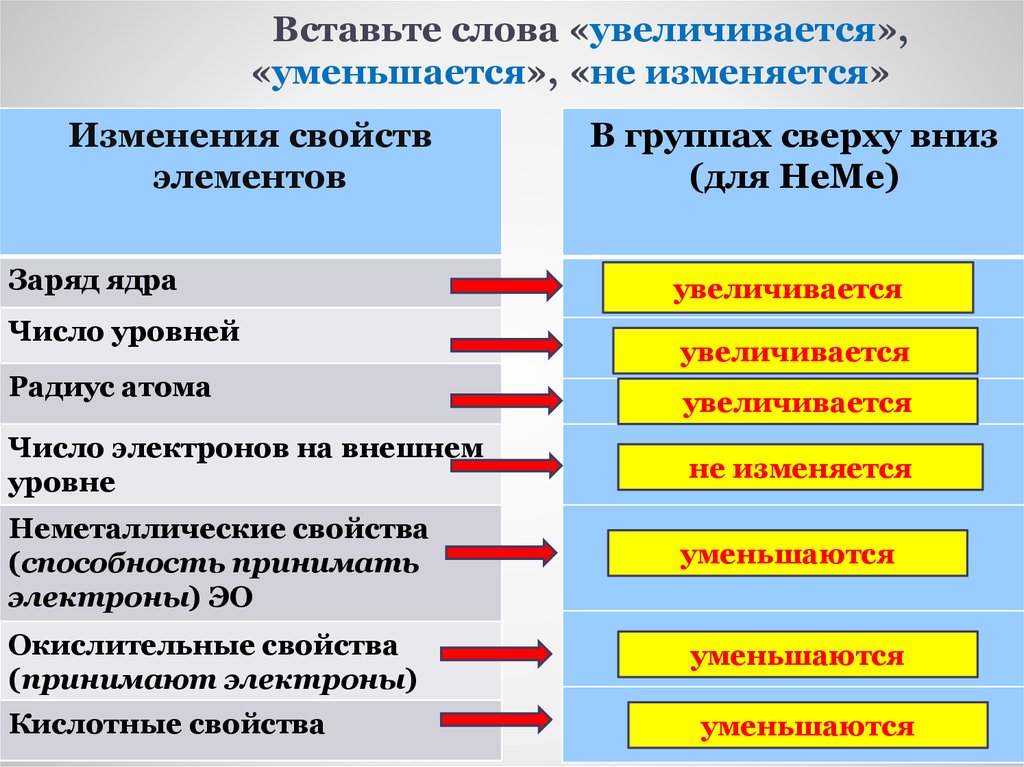
При увеличении заряда ядра атома (придвижении сверху вниз):
число электронных слоев атомов увеличивается
число электронов на внешнем слое атомов одинаково
радиус атомов увеличивается
прочность связи электронов внешнего слоя с ядром
увеличивается
Энергия ионизации уменьшается
Сродство к электрону уменьшается
Э.О уменьшается
Ме свойства , восстановительные свойства
увеличиваются
неМе свойства , окислительные свойства уменьшаются
13. Домашнее задание
1. § 5,6,7 проработать2. стр. 27, упр. 1-5 (устно)
3. стр. 32-33, упр. 1, 3 (1 вар.); упр. 2, 4 (2 вар.)
стр. 36-37, упр. 3, 5 (1 вар.); упр. 2, 4 (2 вар.)
14. Вставьте слова «увеличивается», «уменьшается», «не изменяется»
Изменения свойствэлементов
В периоде слева
направо
Заряд ядра
увеличивается
Число уровней
не изменяется
уменьшается
Радиус атома
Число электронов на внешнем
уровне
увеличивается
Металлические свойства
(способность отдавать
электроны)
уменьшаются
Неметаллические свойства
(способность принимать
электроны) ЭО
увеличиваются
Окислительные свойства
увеличиваются
Кислотные свойства
увеличиваются
15. Вставьте слова «увеличивается», «уменьшается», «не изменяется»
Изменения свойствэлементов
Заряд ядра
Число уровней
Радиус атома
Число электронов на внешнем
уровне
Металлические свойства
(способность отдавать
электроны)
Восстановительные свойства
(отдают электроны)
Основные свойства
В группах сверху вниз
(для Ме)
увеличивается
увеличивается
увеличивается
не изменяется
увеличиваются
увеличиваются
увеличиваются
16. Вставьте слова «увеличивается», «уменьшается», «не изменяется»
Изменения свойствэлементов
Заряд ядра
Число уровней
Радиус атома
В группах сверху вниз
(для НеМе)
увеличивается
увеличивается
увеличивается
Число электронов на внешнем
уровне
не изменяется
Неметаллические свойства
(способность принимать
электроны) ЭО
уменьшаются
Окислительные свойства
(принимают электроны)
Кислотные свойства
уменьшаются
уменьшаются
17.
1. В ряду химических элементовC → Si → Ge → Sn
1) увеличивается число электронных
слоёв
2) увеличивается
электроотрицательность
3) увеличиваются неметаллические
свойства
4) уменьшается число протонов в
ядре атома
18.
2. В ряду химических элементовбор - углерод - азот возрастает:
1) способность атома отдавать
электроны
2) высшая степень окисления
3) низшая степень окисления
4) радиус атома
19.
3. С увеличением порядковогономера элемента в периоде радиус
атома:
1) увеличивается
2) уменьшается
3) не изменяется
20.
4. В главных подгруппахпериодической системы с
увеличением заряда ядра атомов:
1) усиливаются металлические
свойства элементов
2) ослабевают металлические
свойства элементов
3) усиливаются неметаллические
свойства элементов
4) ослабевают неметаллические
свойства элементов
21.
5. В периоде:1) идет последовательное заполнение
электронами одного энергетического
уровня
2) идет последовательное
заполнение электронами одного
энергетического подуровня
3) идет последовательное
заполнение электронами одной
электронной орбитали
22.
6.В периодах с увеличением зарядаядра атомов:
1) усиливаются металлические
свойства элементов
2) усиливаются неметаллические
свойства элементов
3) ослабевают металлические
свойства элемента
4) ослабевают неметаллические
свойства элементов
23.
7.Металлические свойстваэлементов в периоде:
1) увеличиваются слева направо
2) уменьшаются слева направо
3) не изменяются
8.Радиус атома в группе:
1) уменьшается сверху вниз
2) увеличиваются сверху вниз
3) правильного ответа нет
24.
9.У какого элемента способностьпринимать электроны проявляется
сильнее:
1) В
2) C
4) F
3) O
10.У какого элемента способность
отдавать электроны проявляются
сильнее:
1) Na
2) Al
3) Mg
4) Cl





















 chemistry
chemistry








