Similar presentations:
Белки. Многообразие белков
1.
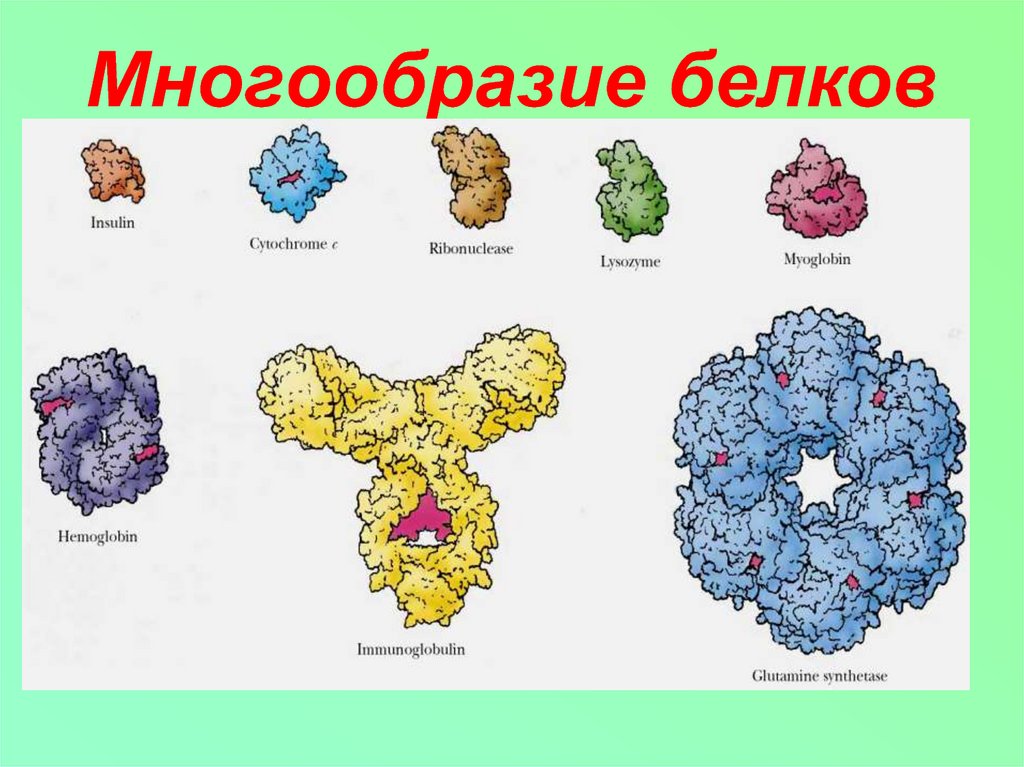
2. Многообразие белков
• 1868г. - немецкий химик Ф. Мишероткрыл нуклеиновые кислоты в
ядрах лейкоцитов в составе
гноя
• 1889г. – химик Альтман получил
дрожжевую Н.К.
• 1892г. – химик Лильенфельд
выделил тимонуклеиновую
кислоту из зобной железы
• 1953г. – амер. Джеймс Уотсон и
англ. Френсис Крик
расшифровали структуру ДНК
• 1970г. – Жак Гриффитс и Джеймс
Боннер обнаружили
двуспиральную структуру ДНК
3. История открытия
• "Во всех растениях и животных присутствует некоевещество, которое без сомнения является наиболее
важным из всех известных веществ живой природы и без
которого жизнь была бы на нашей планете невозможна.
Это вещество я наименовал-протеин" – голландский
биохимик Жерар Мюльдер (1838 г)
• греч. Рrotos –– первый, важнейший
4. Белок – высокомолекулярное соединение
• В состав входят сотни и даже тысячи аминокислот .• Молекулярная масса от 6 000 до 1 000 000 Да и более в
зависимости от количества отдельных
полипептидных цепей в составе единой молекулярной
структуры белка.
• Субъединицы имеют молекулярную массу от 6 000 до
100 000 Да.
• Дальтон (Да) – единица массы, практически равная
массе атома водорода (условной единице
относительной атомной массы)
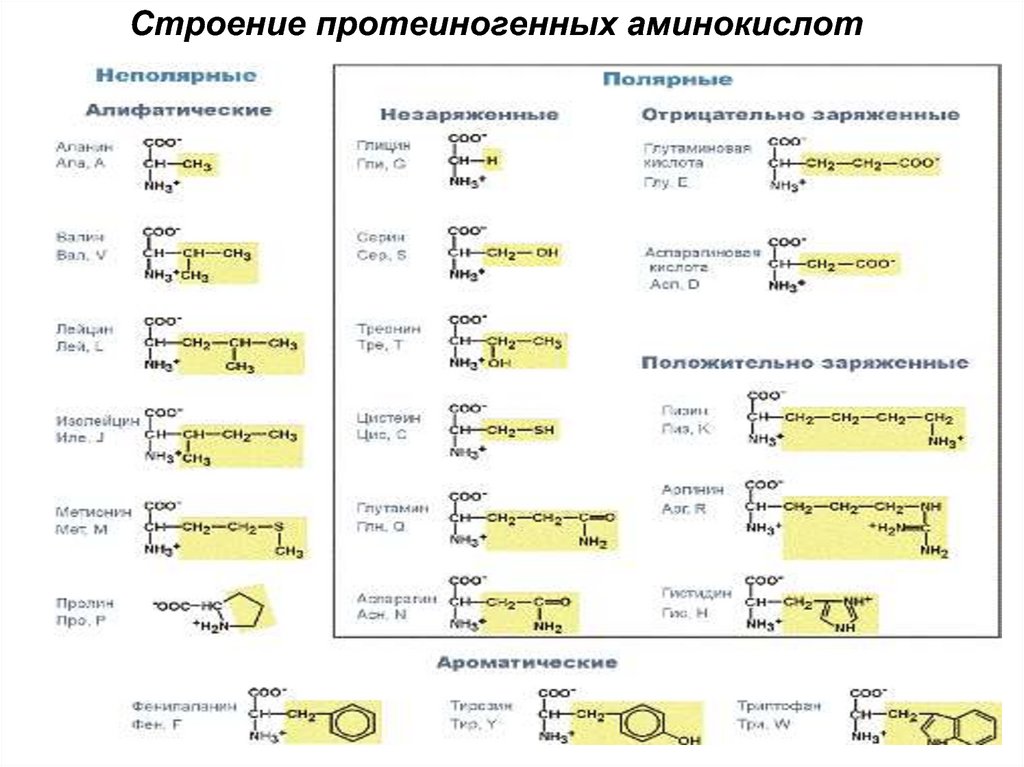
5. Мономер-аминокислота Двадцать аминокислот необходимы для синтеза белка По строению бокового радикала: - алифатические (аланин,
Мономер-аминокислотаДвадцать аминокислот необходимы для синтеза белка
По строению бокового радикала:
- алифатические (аланин, валин, лейцин, изолейцин,
пролин, глицин),
- ароматические (фенилаланин, тирозин, триптофан),
- серусодержащие (цистеин, метионин),
- содержащие ОН-группу (серин, треонин,
опять тирозин),
- содержащие дополнительную СООН-группу
(аспарагиновая и глутаминовая кислоты),
- дополнительную NH2-группу (лизин,
аргинин, гистидин, также глутамин, аспарагин).
6. Строение протеиногенных аминокислот
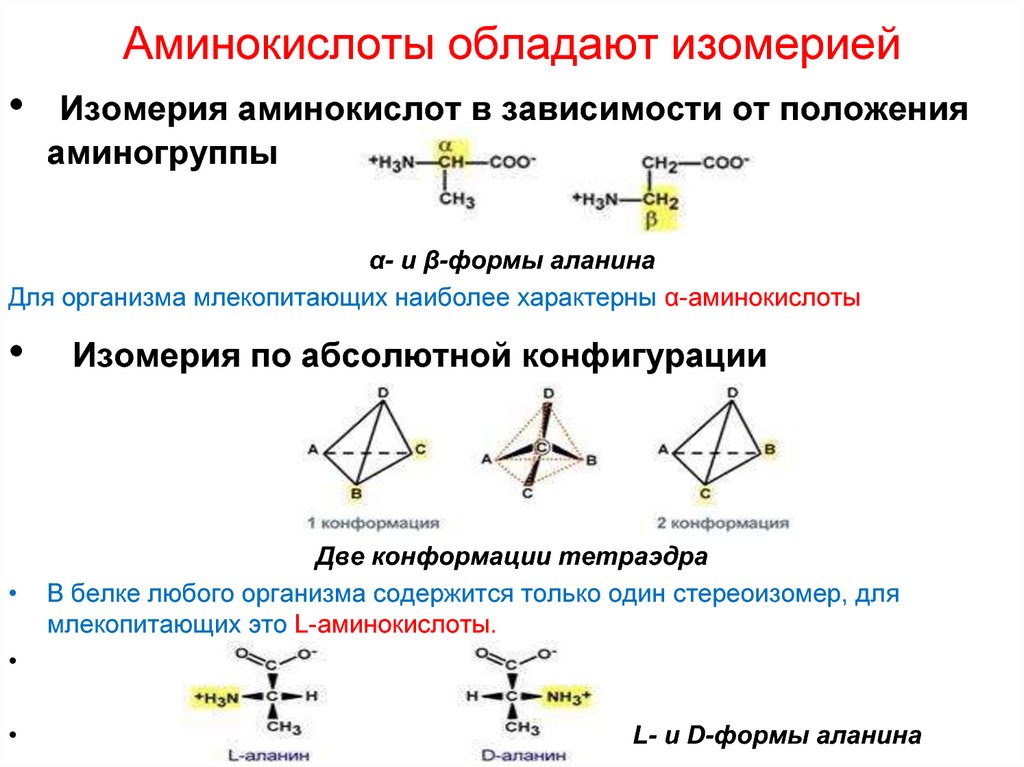
7. Аминокислоты обладают изомерией
Изомерия аминокислот в зависимости от положения
аминогруппы
α- и β-формы аланина
Для организма млекопитающих наиболее характерны α-аминокислоты
Изомерия по абсолютной конфигурации
Две конформации тетраэдра
В белке любого организма содержится только один стереоизомер, для
млекопитающих это L-аминокислоты.
L- и D-формы аланина
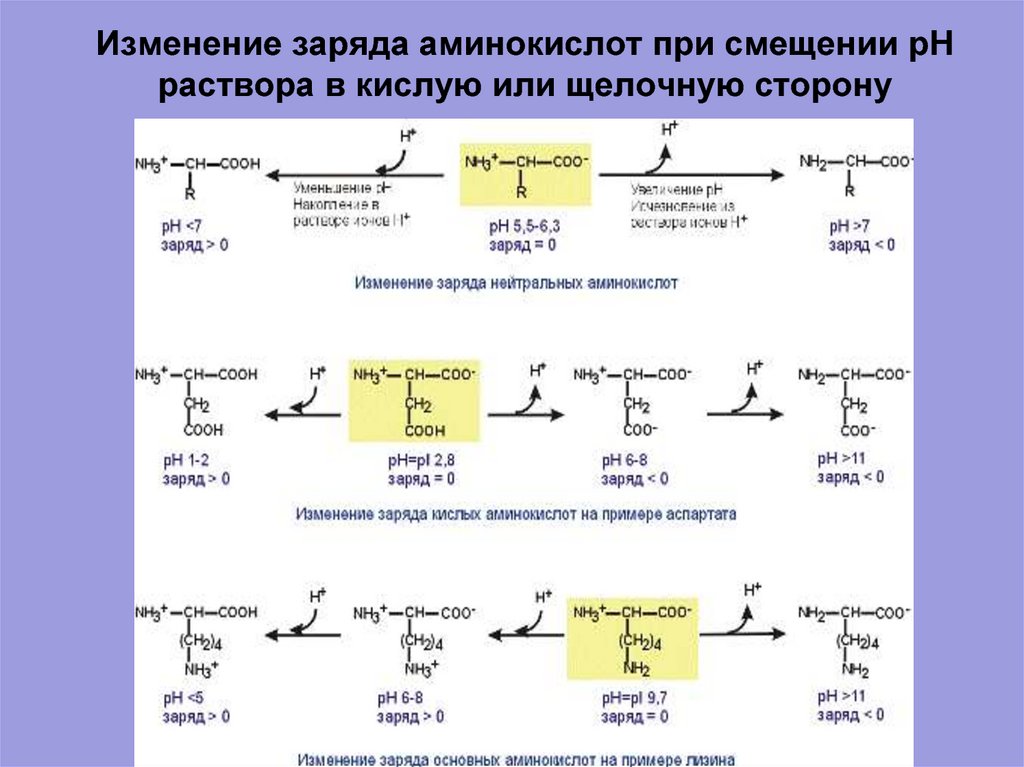
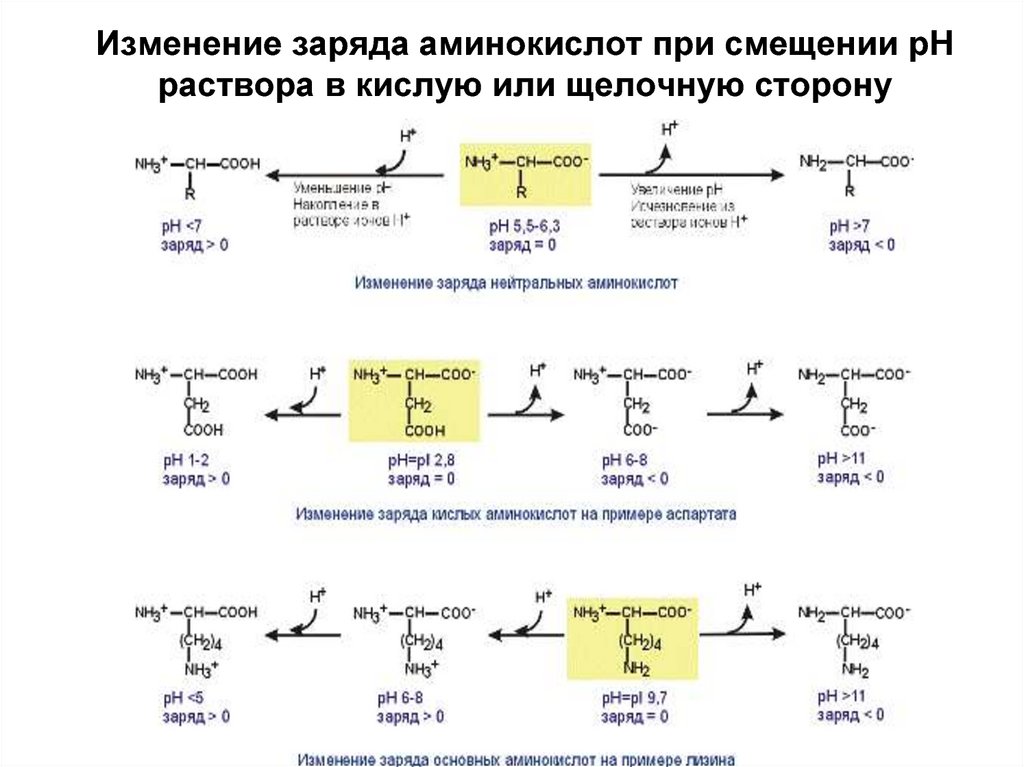
8. Изменение заряда аминокислот при смещении рН раствора в кислую или щелочную сторону
Изменение заряда аминокислот при смещении рНраствора в кислую или щелочную сторону
9. Изменение заряда аминокислот при смещении рН раствора в кислую или щелочную сторону
Изменение заряда аминокислот при смещении рНраствора в кислую или щелочную сторону
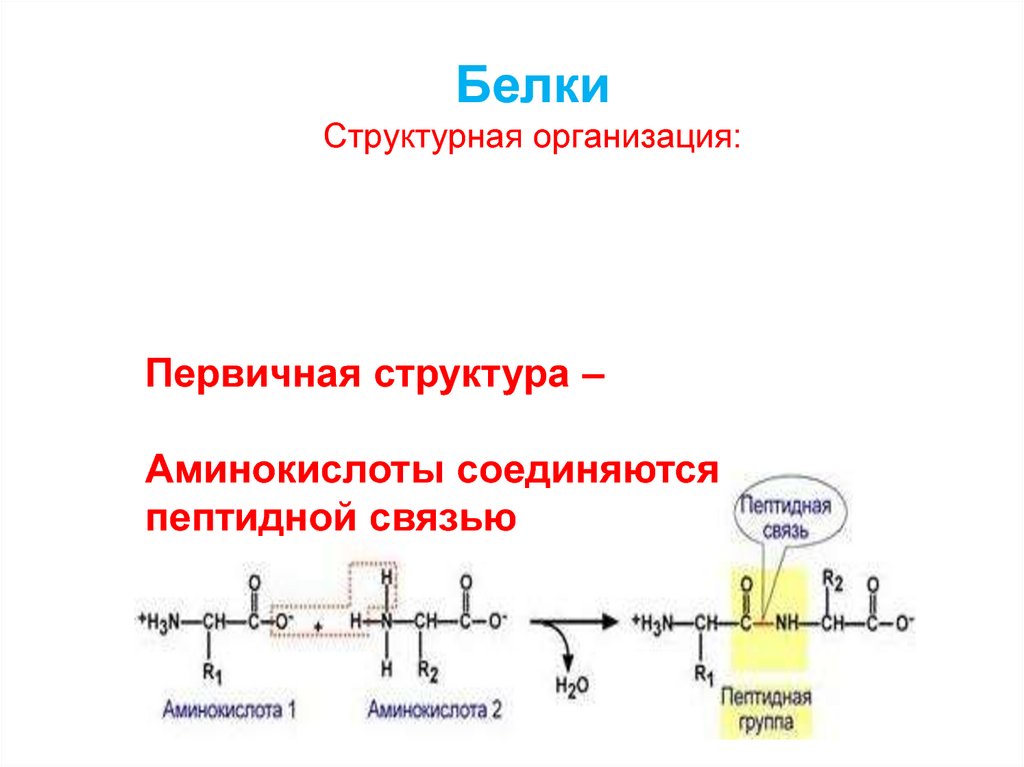
10. Белки Структурная организация: - Первичная структура - Вторичная структура - Третичная структура - Четвертичная структура
11.
Первичнаяструктура –
аминокислоты
соединяются
пептидной связью
12. Белки Структурная организация:
Первичная структура –Аминокислоты соединяются
пептидной связью
13. Аминокислоты соединяются пептидной связью
14. Вторичная структура. α-спираль
15. Вторичная структура. β-конформация
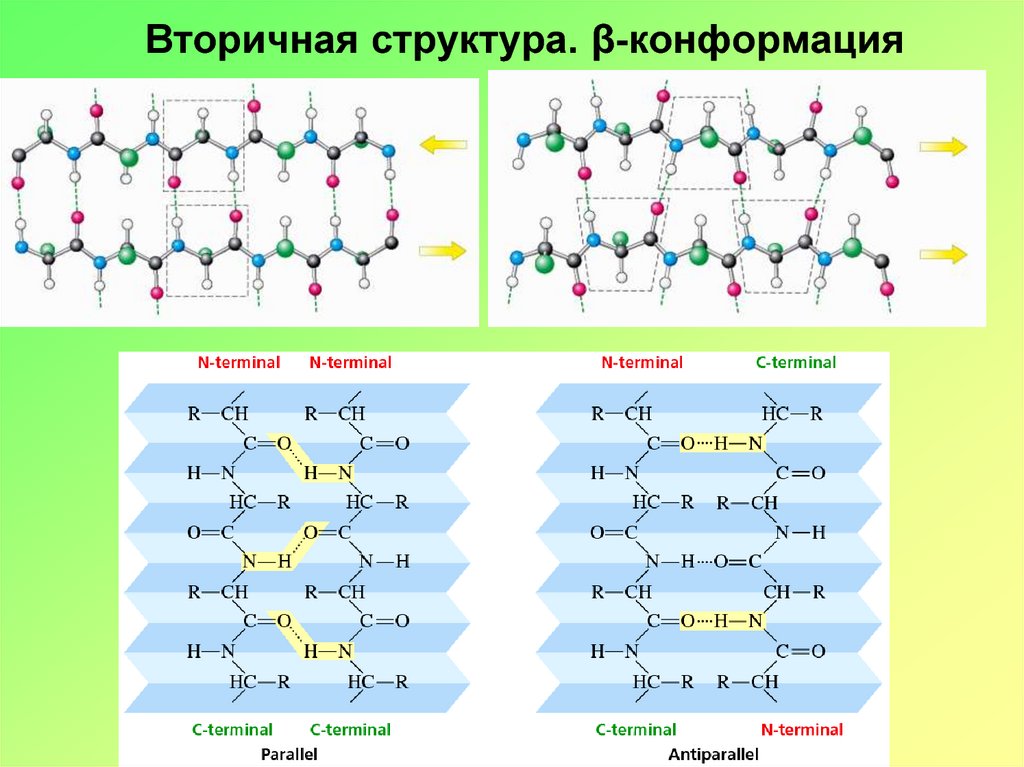
16. Супервторичная структура (домены)
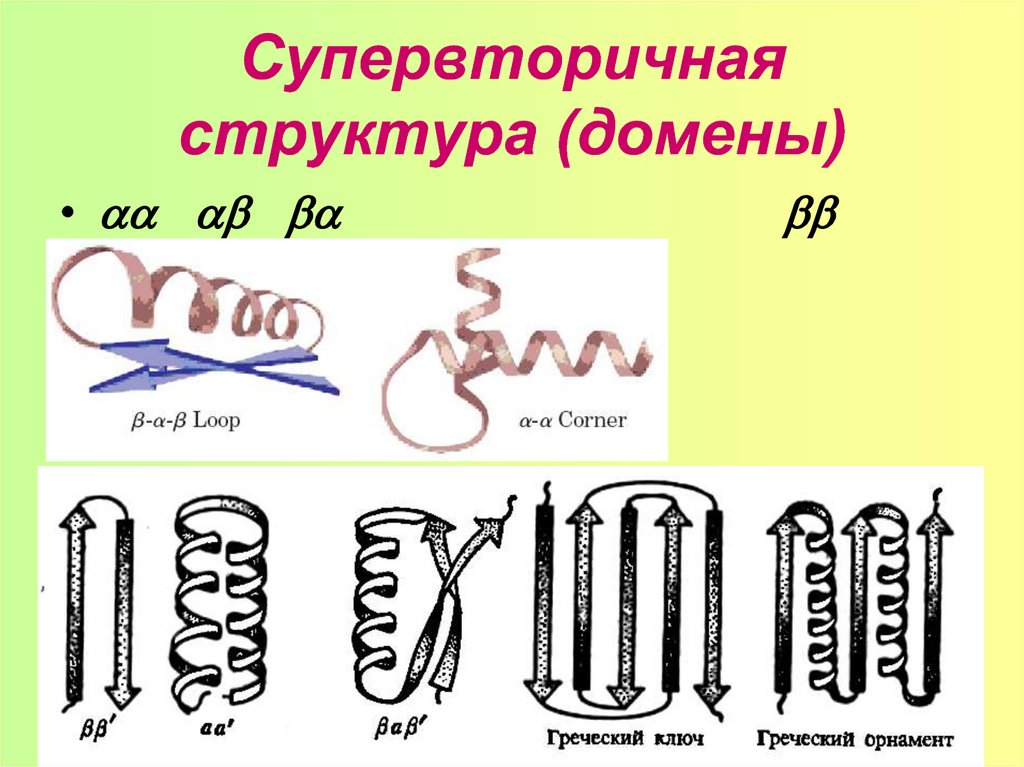
•17. Вторичная структура. Коллагеновая спираль
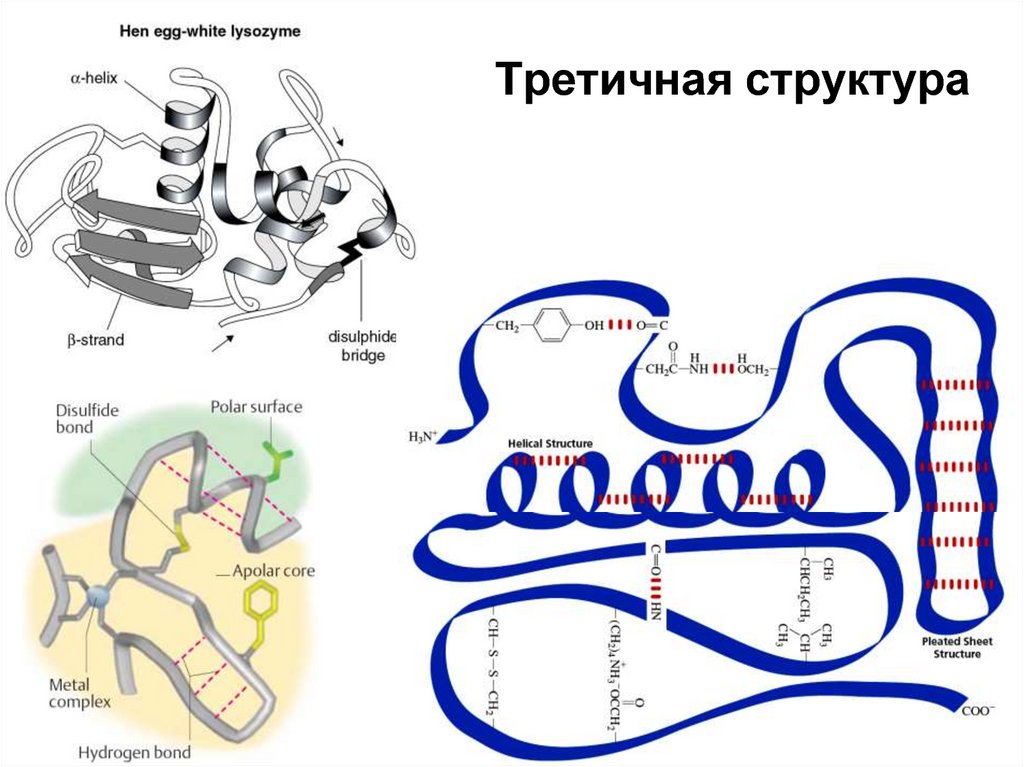
18. Третичная структура
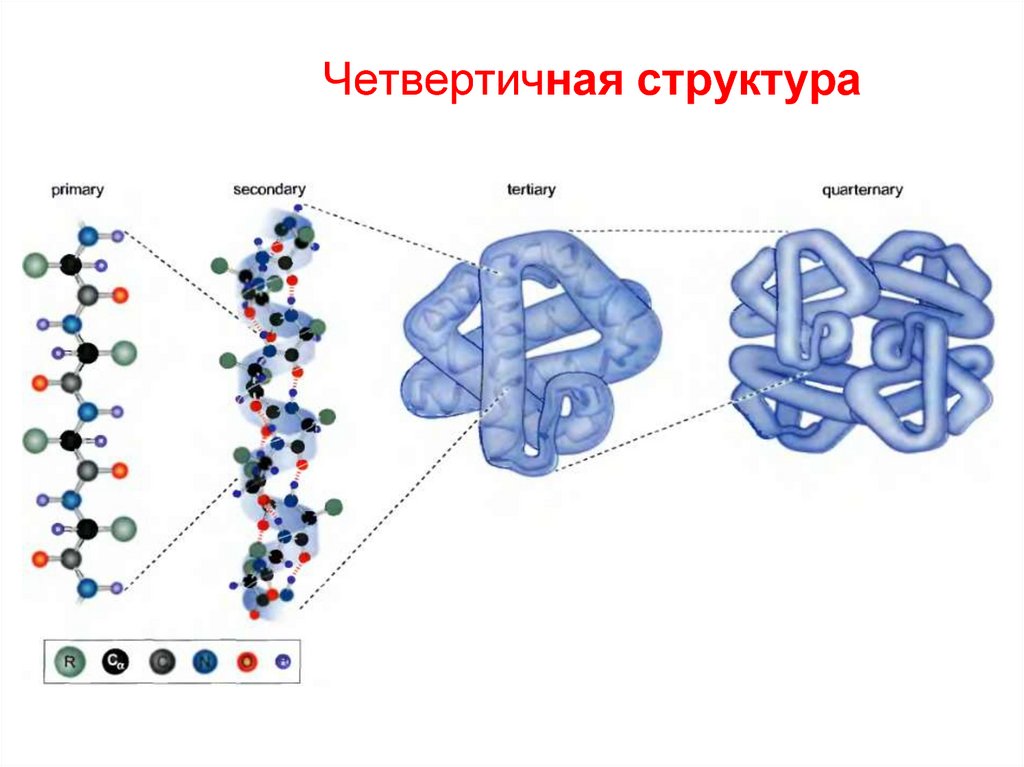
19. Четвертичная структура
20. Белки: классификация, основанная на трёхмерной структуре
Белки:
классификация, основанная
на трёхмерной структуре
• 1.Глобулярные: l/d<10 (~3-5), растворимые в
воде
l
d
• 2. Фибриллярные: l/d>10 (~80-150),
нерастворимые в воде
• 3. Промежуточные: фибриллярные, но
растворимые в воде
21. Классификация белков. По составу или степени сложности
Простые1. Альбумины и
глобулины
2. Гистоны и
протамины
3. Глютелины и
проламины
4. Протеиноиды
(склеропротеины)
Сложные
1.Хромопротеины
2.Фосфопротеины
3.Липопротеины
4. Гликопротеины
5. Нуклеопротеины
6. Металлопротеины
22. Классификация белков
по форме молекул (глобулярные или фибриллярные);по молекулярной массе (низкомолекулярные, высокомолекулярные и др.);
по химическому строению (наличие или отсутствие небелковой части);
по выполняемым функциям (транспортные, защитные, структурные белки и
др.);
по локализации в клетке (ядерные, цитоплазматические, лизосомальные и
др.);
по локализации в организме (белки крови, печени, сердца и др.);
по возможности адаптивно регулировать количество данных белков: белки,
синтезирующиеся с постоянной скоростью (конститутивные), и белки, синтез
которых может усиливаться при воздействии факторов среды
(индуцибельные);
по продолжительности жизни в клетке (от очень быстро обновляющихся
белков, с Т1/2 менее 1 ч, до очень медленно обновляющихся белков,
Т1/2 которых исчисляют неделями и месяцами);
по схожим участкам первичной структуры и родственным функциям
(семейства белков).
23. Простые белки
Простой белок – это белок, построенныйисключительно из остатков α-аминокислот
(при гидролизе распадающийся исключительно
на аминокислоты ),
не требующий для функционирования наличия
небелковых простетических групп.
По растворимости в солевых растворах и воде,
условно подразделяются на несколько групп:
глобулины,
альбумины,
гистоны,
протамины,
глютелины,
проламины.
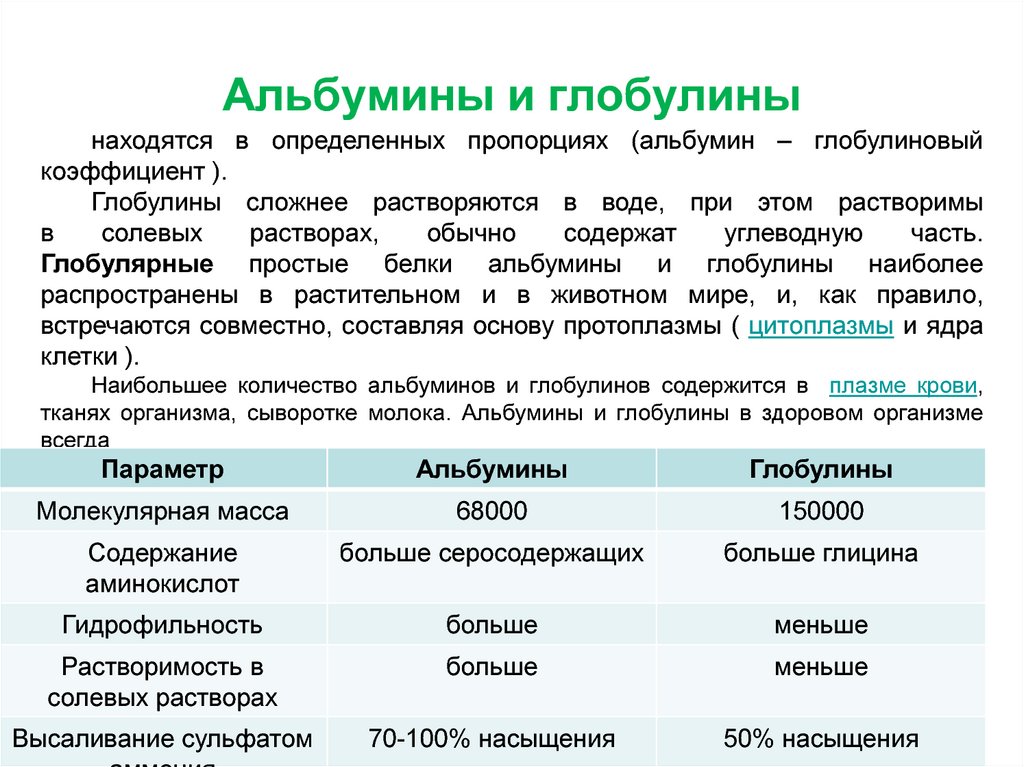
24. Альбумины и глобулины
Глобулярные простые белки альбумины и глобулины наиболеераспространены в растительном и в животном мире, и, как правило,
встречаются
совместно,
составляя
основу
протоплазмы
( цитоплазмы и ядра клетки ).
Наибольшее количество альбуминов и глобулинов содержится в плазме
крови, тканях организма, сыворотке молока. Альбумины и глобулины
в здоровом организме всегда находятся в определенных пропорциях
(альбумин – глобулиновый коэффициент ).
Глобулины сложнее растворяются в воде, при этом растворимы
в солевых растворах, обычно содержат углеводную часть.
Параметр
Альбумины
Глобулины
Молекулярная масса
68000
150000
Содержание
аминокислот
больше серосодержащих
больше глицина
Гидрофильность
больше
меньше
Растворимость в
солевых растворах
больше
меньше
Высаливание сульфатом
70-100% насыщения
50% насыщения
25. Альбумины и глобулины
находятся в определенных пропорциях (альбумин – глобулиновыйкоэффициент ).
Глобулины сложнее растворяются в воде, при этом растворимы
в
солевых
растворах,
обычно
содержат
углеводную
часть.
Глобулярные простые белки альбумины и глобулины наиболее
распространены в растительном и в животном мире, и, как правило,
встречаются совместно, составляя основу протоплазмы ( цитоплазмы и ядра
клетки ).
Наибольшее количество альбуминов и глобулинов содержится в плазме крови,
тканях организма, сыворотке молока. Альбумины и глобулины в здоровом организме
всегда
Параметр
Альбумины
Глобулины
Молекулярная масса
68000
150000
Содержание
аминокислот
больше серосодержащих
больше глицина
Гидрофильность
больше
меньше
Растворимость в
солевых растворах
больше
меньше
Высаливание сульфатом
70-100% насыщения
50% насыщения
26. Гистоны и протамины
Глобулярные простые белки гистоны и протамины являются наиболее простымибелками, характерной особенностью которых является слабощелочные свойства
растворов. Данный факт обусловлен наличием в составе гистонов и протаминов
значительного количества диаминокарбоновых кислот –
аргинина , лизина и гистидина.
Гистоны – низкомолекулярные белки с высоким содержанием в молекуле
остатков лизина и аргинина, что обусловливает их основные свойства; содержат 2035% основных аминокислот, (белки протамины – 50-80%, в связи с чем, протамины
проявляют более щелочные свойства, нежели гистоны).
Характерным признаком протаминов является то, они имеют большую
молекулярную массу, в сравнении с другими простыми белками. Протамины
отличаются еще более высоким содержанием аргинина (до 85 %), и, как и гистоны,
образуют устойчивые ассоциаты с нуклеиновыми кислотами, выступая в качестве
репрессорных и регуляторных белков – составной части нуклеопротеинов.
Гистоны и протамины в значительных количествах содержатся в зобной железе,
в икре и сперме рыб, в селезенке. Названия представителей этих простых белков
происходят от источника их получения: протамины, выделенные из скумбрии, так и
называются – скумбрин; из молоки сельди – клупеином; из молок семги – сальмин.
Гистоны и протамины входят в состав сложных белков в частности
нуклеопротеиновых ядер.
27. Гистоны и протамины
ПараметрГистоны
Протамины
Молекулярная
масса
11 000-24 000
4 000-12 000
Содержание
основных
аминокислот
(Арг, Лиз, Гис)
20-35%
50-80%
28. Глютелины и проламины
Глобулярные простые белки глютелины и проламины – белки растительногопроисхождения, характеризующиеся высоким содержанием аминокислот пролина и
глутаминовой кислоты.
Глютелины на 45 % состоят из глутаминовой кислоты, растворяются
в разбавленных кислотах и щелочах, тогда как в воде и разбавленных солевых
растворах не растворяются.
Представителями данного класса простых белков является оризенин (белок риса)
и глютелин (белок кукурузы).
Глютелины отличаются от проламинов более высоким содержанием гликокола,
аргинина, гистидина. По аминокислотному составу белки глютелины сбалансированы
лучше, чем белки проламины
Проламины, как и глютелины, не растворяются в воде, однако хорошо
растворяются в 50-90 % этиловом спирте, состоят на 30-45 % из глутаминовой кислоты
и на 15% из пролина.
К проламинам принадлежат глиадин (белок ржи и пшеницы), гордеин (белок
ячменя), зеин (белок кукурузы).
Глютелины и проламины составляют подавляющую массу белков зерновых
культур.
Эти белки, например, глиадин, в норме у человека расщепляются, но иногда при
рождении фермент, расщепляющий этот белок, отсутствует. Тогда этот белок
превращается в продукты распада, обладающие токсическим действием. Развивается
заболевание целиакия - непереносимость растительных белков.
29. Глютелины и проламины
ПараметрГлютелины
Проламины
Содержание
аминокислот
45% Глу
30-45% Глу, 15% Про
Растворимость в воде
и слабых солевых
растоворах
нет
нет
Хорошая
растворимость
растворы кислот и
щелочей
50-90% спиртовый
раствор
Представители
оризенин (белок риса)
и глютелин (белок
кукурузы)
глиадин (белок ржи и
пшеницы), гордеин
(белок ячменя), зеин
(белок кукурузы)
30. Белки протеиноиды (склеропротеины)
Фибриллярныепростые
белки
протеиноиды
(склеропротеины) – это белки мышечных тканей, кожных
покровов, костей, хрящей, волос.
Характерной особенностью данных белков является
высокая устойчивость к различным растворителям: они
не растворяются в воде, растворах нейтральных солей,
разбавленных кислотах и щелочах.
На протеиноиды не оказывают влияние ферменты,
поэтому при попадании в организм с пищей, данные белки
крайне плохо усваиваются.
Представителями протеиноидов (склеропротеинов)
является эластин, коллаген, кератины, фиброин.
31. Классификация белков
по форме молекул (глобулярные или фибриллярные);по молекулярной массе (низкомолекулярные, высокомолекулярные и др.);
по химическому строению (наличие или отсутствие небелковой части);
по выполняемым функциям (транспортные, защитные, структурные белки и
др.);
по локализации в клетке (ядерные, цитоплазматические, лизосомальные и
др.);
по локализации в организме (белки крови, печени, сердца и др.);
по возможности адаптивно регулировать количество данных белков: белки,
синтезирующиеся с постоянной скоростью (конститутивные), и белки, синтез
которых может усиливаться при воздействии факторов среды
(индуцибельные);
по продолжительности жизни в клетке (от очень быстро обновляющихся
белков, с Т1/2 менее 1 ч, до очень медленно обновляющихся белков,
Т1/2 которых исчисляют неделями и месяцами);
по схожим участкам первичной структуры и родственным функциям
(семейства белков).




















 biology
biology








