Similar presentations:
Простые белки
1.
ПРОСТЫЕ БЕЛКИПодготовил: Исакова Дарья,
Яковлева Виктория
2.
По химическому составуразличают:
-простые белки (протеины) -белки, состоящие тольк
о из аминокислот
-сложные белки (протеиды) Содержат белковую и неб
елковую (ионы металлов, липиды, углеводы и др.) ча
сть
3.
ПРОСТЫЕ БЕЛКИ.Построены из остатков аминокислот и при
гидролизе распадаются только на свободн
ые аминокислоты.
Группы:
Альбумины
Глобулины
Гистоны
Протамины
Проламины
Глютелины
Склеропротеины
4.
КОЛИЧЕСТВЕННОЕ СООТНОШЕНИЕБЕЛКОВЫХ ФРАКЦИЙ
Больше всего в крови альбумина.
В зависимости от доли белковой фракции, представлен
ной в сыворотке крови, они распределяются следующи
м образом (по убыванию):
•Альбумины – 55-65%.
•Гамма-глобулины – 12-22%.
•Бета-глобулины – 8-12%.
•Альфа-2-глобулины – 6-12%.
•Альфа-1-глобулины – 2-4%.
•Фибриноген – около 2%.
5.
АЛЬБУМИНЫ И ГЛОБУЛИНЫГлобулярные простые белки альбумины и
глобулины наиболее распространены в
растительном и в животном мире, и, как правило,
встречаются совместно, составляя основу
протоплазмы (цитоплазмы и ядра клетки ).
Наибольшее количество альбуминов и глобулинов
содержится в плазме крови, тканях организма,
сыворотке молока. Альбумины и глобулины в
здоровом организме всегда находятся в
определенных пропорциях. Альбумин занимает до 60%
в плазме крови от общего количества белков.
6.
АЛЬБУМИНАльбумин — это основной белок крови, вырабатываемый в печен
и человека. Альбумины выделяют в отдельную группу белков — так
называемые белковые фракции. Изменение соотношения отдельных б
елковых фракций в крови зачастую дают врачу более значимую инфо
рмацию, нежели просто общий белок. Определение альбумина исполь
зуется для диагностики заболеваний печени и
почек, ревматических, онкологических заболеваний .
Основными функциями являются:
•транспортная - за счет высокой связывающей способности выполняе
тся перенос с током крови гормонов, билирубина, жирных кислот;
•поддержание осмотического давления;
•обеспечение организма аминокислотами, которые входят в его состав
Поддержание нормального уровня альбумина – жизненно важная зада
ча для здоровья всего организма.
7.
СТРОЕНИЕ АЛЬБУМИНАСывороточный альбумин человека является одноцепочечным белком, состоя
щим из 585 аминокислотных остатков, и имеет молекулярную массу 66,5 кДа.
Его третичная структура сформирована при помощи 17 дисульфидных связе
й и имеет три домена.
На рисунке обозначено подразделение альбумина на домены (I-III) и субдомен
ы (А и В), а также примерная локализация центров I и II по Sudlow
8.
ГЛОБУЛИНЫГлобулины – широко распространённая группа глобулярных белко
в, обычно сопутствующая альбуминам. Глобулины имеют более вы
сокую молекулярную массу, чем альбумины. Глобулины слабокисл
ые или нейтральные белки.
К глобулинам относятся сывороточный, молочный, яичный, мышеч
ный и другие глобулины.
Глобулинов много в пищевых продуктах.
Основные функции:
-переносят гормоны, витамины и другие вещества
-защищают организм от вирусов, бактерий, токсинов, чужеродных
белков, вырабатывая на них антитела
-регулируют свертываемость крови
-связывают половые гормоны, лекарства, углеводы и другие вещест
ва
Глобулины вырабатываются печенью и иммунной системой.
9.
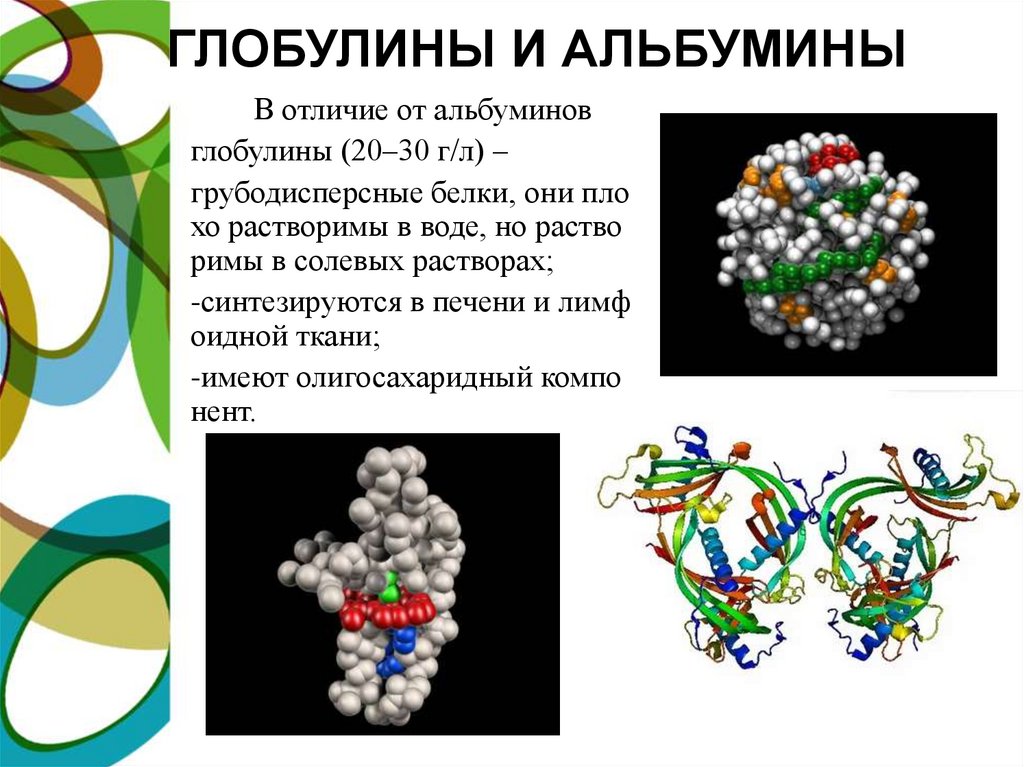
ГЛОБУЛИНЫ И АЛЬБУМИНЫВ отличие от альбуминов
глобулины (20–30 г/л) –
грубодисперсные белки, они пло
хо растворимы в воде, но раство
римы в солевых растворах;
-синтезируются в печени и лимф
оидной ткани;
-имеют олигосахаридный компо
нент.
10.
11.
ГИСТОНЫГистоны (от греч. histos - ткань) - тканевые белки многоклеточных
организмов, связанных с ДНК хроматина.
Это белки небольшой молекулярной массы (11000-24000);
Это относительно небольшие белки, содержащие не более 140 аминок
ислот. Они богаты основными аминокислотными остатками, поэтому и
меют чистый положительный заряд, который способствует их взаимоде
йствию с отрицательно заряженной нуклеиновой кислотой с образован
ием нуклеосом.
ФУНКЦИИ:
1) структурная и регуляторная. Состоит в стабилизации вторичной ст
руктуры ДНК, а также в поддержании структуры хроматина и хром
осом. Удаление некоторых фракций Гистона из хроматина нарушае
т связи между нитями нуклеогистона и ведет к частичному наруше
нию четвертичной и третичной структуры последнего.
2) Функция связана с их способностью подавлять синтез нуклеиновы
х к-т (как ДНК, так и РНК) на ДНК-матрице. Однако специфичнос
ть такого подавления невелика. Поэтому Г. служат лишь одним из з
веньев в системе регуляции синтеза нуклеиновых к-т
12.
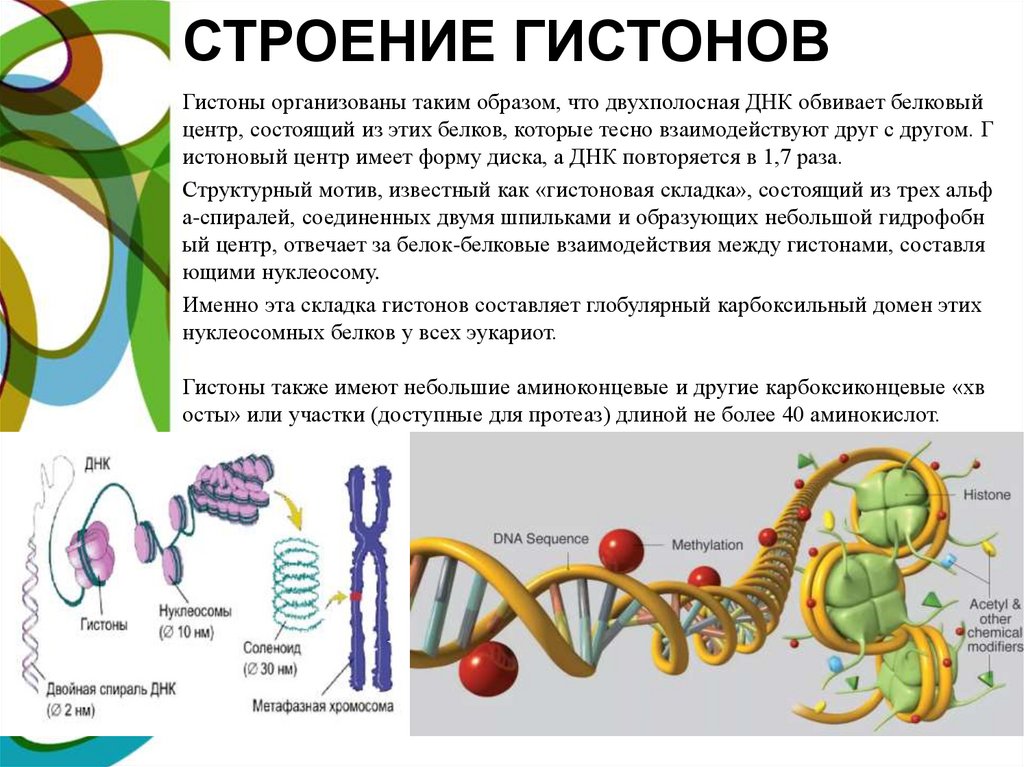
СТРОЕНИЕ ГИСТОНОВГистоны организованы таким образом, что двухполосная ДНК обвивает белковый
центр, состоящий из этих белков, которые тесно взаимодействуют друг с другом. Г
истоновый центр имеет форму диска, а ДНК повторяется в 1,7 раза.
Структурный мотив, известный как «гистоновая складка», состоящий из трех альф
а-спиралей, соединенных двумя шпильками и образующих небольшой гидрофобн
ый центр, отвечает за белок-белковые взаимодействия между гистонами, составля
ющими нуклеосому.
Именно эта складка гистонов составляет глобулярный карбоксильный домен этих
нуклеосомных белков у всех эукариот.
Гистоны также имеют небольшие аминоконцевые и другие карбоксиконцевые «хв
осты» или участки (доступные для протеаз) длиной не более 40 аминокислот.
13.
ПРОТАМИНЫПротамины – низкомолекулярные положительно заряженн
ые ядерные белки с резко выраженными основными свойст
вами (щелочные белки), с низкой молекулярной массой – 40
00–12000, содержат 60-85% аргинина.
Протамины являются составной частью многих важных сло
жных белков (нуклеопротеидов), входящих в состав клеточн
ых ядер. В ядрах клеток они находятся в комплексе с ДНК.
14.
СВОЙСТВА ПРОТАМИНА-Отсутствует денатурации при нагревании.
-Образуют соли с кислотами и комплексы с кислыми белками.
-Протамины хорошо растворяются в воде, кислой и нейтральной среде
и осаждаются в щелочных средах, не осаждаются при кипячении.
Протамины обнаружены в ядрах сперматозоидов у рыб.
(сальмин – семга, клупеин – сельдь, скумбрин – скумбрия).
Выполняют главным образом структурную функцию, поэтому и присутствуют в кле
тках не способных к делению.
Протамины служат для организации хроматина в ядрах сперматозоидов. В ядрах всех
других типов клеток (кроме сперматозоидов) ДНК ассоциирована с гистонами. Во вр
емя спермиогенеза гистоны удаляются из ядра, и ДНК связывается протаминами. Это
позволяет значительно плотнее конденсировать хроматин и уменьшить размер ядра с
перматозоида. В отличие от хроматина с участием гистонов, хроматин с участием про
таминов неактивен — в ядре сперматозоидов невозможны процессы транскрипции
15.
ГЛЮТЕЛИНЫ И ПРОЛАМИНЫГлобулярные простые белки глютелины и проламины – белк
и растительного происхождения, характеризующиеся высоким сод
ержанием аминокислот пролина и глутаминовой кислоты.
Глютелины на 45 % состоят из глутаминовой кислоты, раство
ряются в разбавленных кислотах и щелочах, тогда как в воде и раз
бавленных солевых растворах не растворяются.
Представителями данного класса простых белков является ор
изенин (белок риса) и глютелин (белок кукурузы).
Проламины, как и глютелины, не растворяются в воде, однак
о хорошо растворяются в 50-90 % этиловом спирте, состоят на 3045 % из глутаминовой кислоты и на 15% из пролина.
К проламинам принадлежат глиадин (белок ржи и пшеницы),
гордеин (белок ячменя), зеин (белок кукурузы).
Глютелины и проламины составляют подавляющую массу бел
ков зерновых культур.
16.
ПРЕДПОЛАГАЕТСЯ, ЧТО ОНИ ПРЕЖДЕ ВСЕГО ОБЕСПЕЧИВАЮТ ФИЗИОЛОГИЧЕСКУЮ ФУНКЦИЮ НЕРВНЫХ ВОЛОКОН.
17.
БЕЛКИ ПРОТЕИНОИДЫ(СКЛЕРОПРОТЕИНЫ)
Фибриллярные простые белки протеиноиды (склеропротеин
ы) – это белки мышечных тканей, кожных покровов, костей, хря
щей, волос.
Характерной особенностью данных белков является высока
я устойчивость к различным растворителям: они не растворя
ются в воде, растворах нейтральных солей, разбавленных кислот
ах и щелочах.
На протеиноиды не оказывают влияние ферменты, поэтому п
ри попадании в организм с пищей, данные белки крайне плохо ус
ваиваются.
Представители: коллаген – основной белок кожи, костей и хр
ящей, эластин – белок сухожилий и соединительной ткани, кера
тин – белок волос, шерсти, копыт, рогов и фиброин шелка.
18.
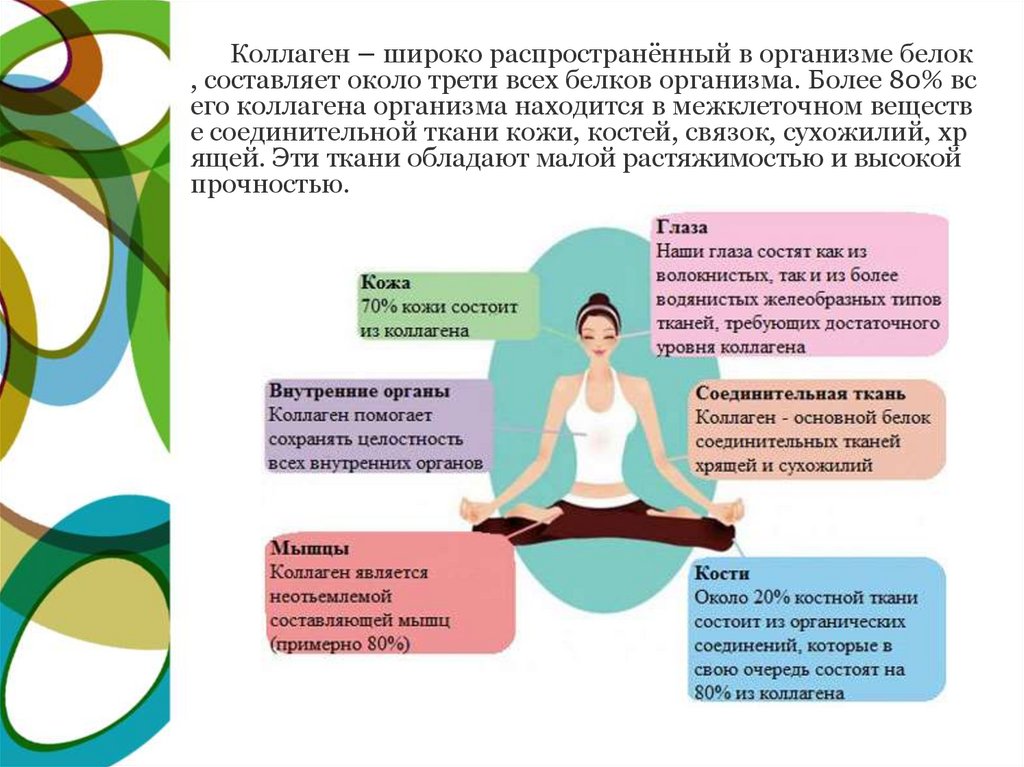
Коллаген – широко распространённый в организме белок, составляет около трети всех белков организма. Более 80% вс
его коллагена организма находится в межклеточном веществ
е соединительной ткани кожи, костей, связок, сухожилий, хр
ящей. Эти ткани обладают малой растяжимостью и высокой
прочностью.
19.
20.
ИНТЕРЕСНЫЙ ФАКТКОЛЛАГЕН
Коллаген, долго нагреваемый в воде при 56-1000С, пер
еходит в растворимый клей, или глютин (желати
н), который охлаждаясь, застывает и образует студень.
На этом свойстве желатина основано приготовление за
ливных блюд
21.
Эластин – основной белок эластических волокон, которые в больших количествах содержатся в межклеточном веще
стве таких тканей, как кожа, стенки кровеносных сосудов, свя
зки, лёгкие. Эти ткани обладают очень важными свойствами:
они могут растягиваться в несколько раз по сравнению с исхо
дной длиной, сохраняя при этом высокую прочность на разр
ыв, и возвращаться в первоначальное состояние после сняти
я нагрузки.
Эластичность связана с присутствием в эластине больш
ого количества межцепочечных сшивок при участии аминок
ислоты лизина.
22.
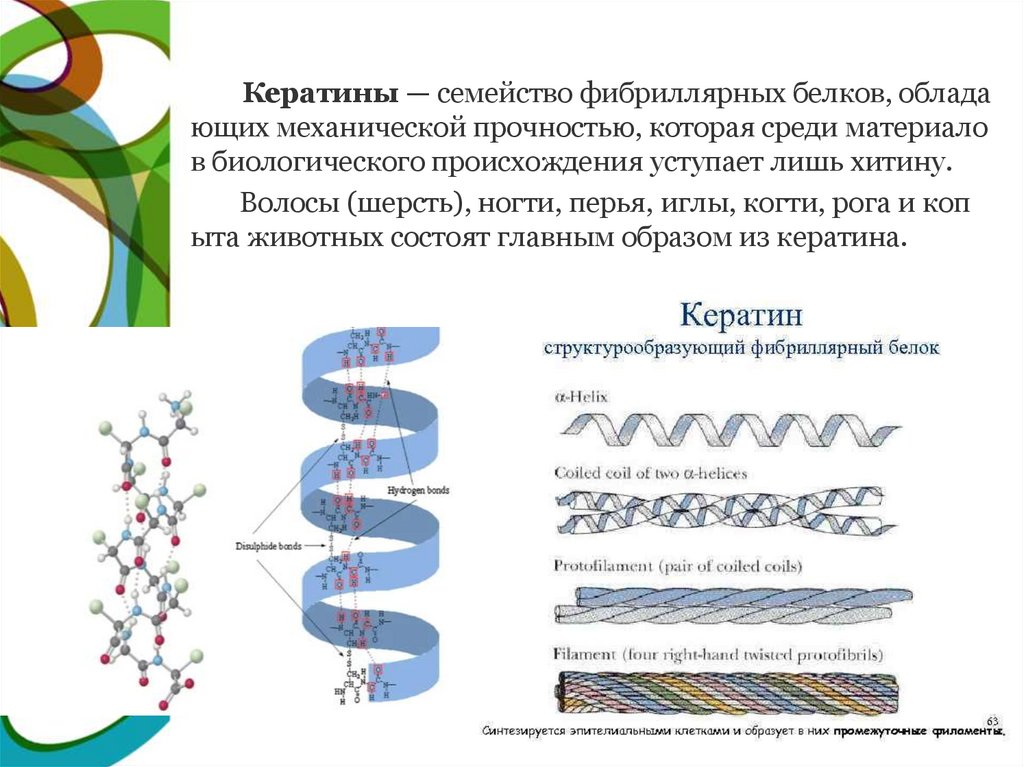
Кератины — семейство фибриллярных белков, обладающих механической прочностью, которая среди материало
в биологического происхождения уступает лишь хитину.
Волосы (шерсть), ногти, перья, иглы, когти, рога и коп
ыта животных состоят главным образом из кератина.
23.
СТРУКТУРА КЕРАТИНАКератины могут иметь α-структуру и β-структуру.
α-Кератин - структурный белок, построенный преимуществе
нно в виде α-спирали.
В β-кератинах три α-спирали объединяются в суперспираль.
Молекулы α-кератина ориентированы параллельно и соединен
ы дисульфидными связями (содержат много цистеина), что пр
идает прочность структуре.
24.
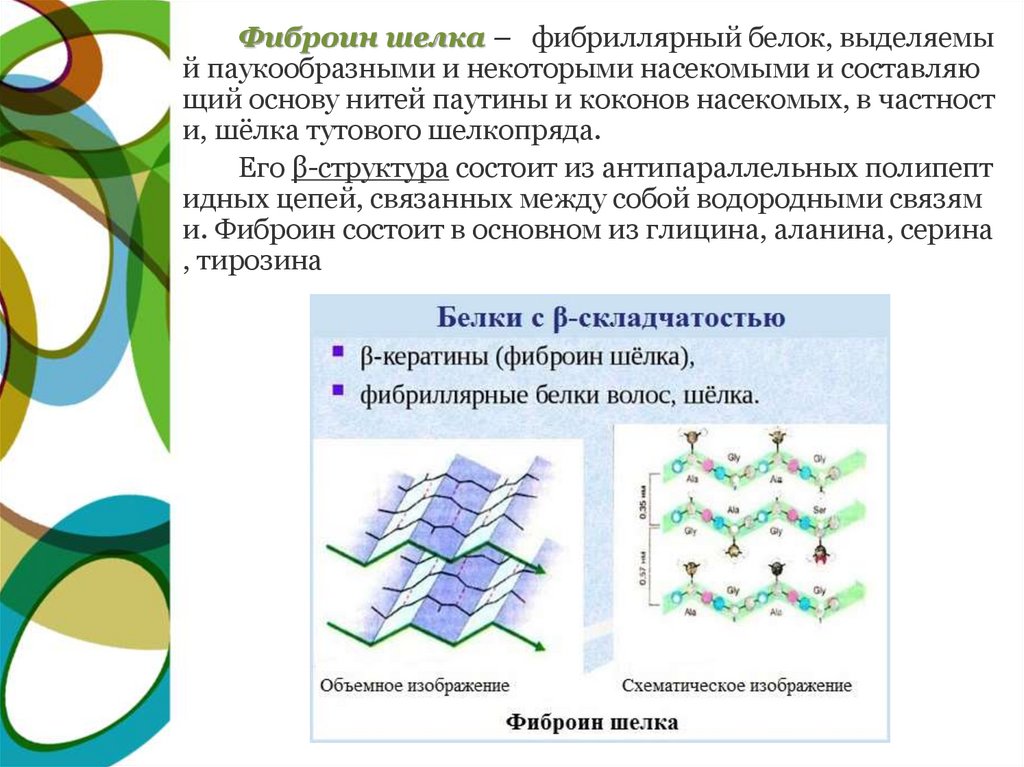
Фиброин шелка – фибриллярный белок, выделяемый паукообразными и некоторыми насекомыми и составляю
щий основу нитей паутины и коконов насекомых, в частност
и, шёлка тутового шелкопряда.
Его β-структура состоит из антипараллельных полипепт
идных цепей, связанных между собой водородными связям
и. Фиброин состоит в основном из глицина, аланина, серина
, тирозина


















 biology
biology








