Similar presentations:
Современная терапия неходжкинских лимфом - ритуксимаб
1.
Презентация на тему: Ритуксимаб - современнаятерапия неходжкинских лимфом.
Выполнила студентка 9 группы 5
курса лечебного факультета
Виноградова Р.С.
2.
Содержание презентации:1. Введение
2. История создания препарата
3. Торговое описание препарата
4. Физико-химическая характеристика препарата
5. Характеристика CD20-АГ
6. Фармакология
7. Показания к применению
8. Противопоказания к применению
9. Побочное действие препарата
10. Правила приготовления и хранения раствора
11. Стандартный режим дозирования
3.
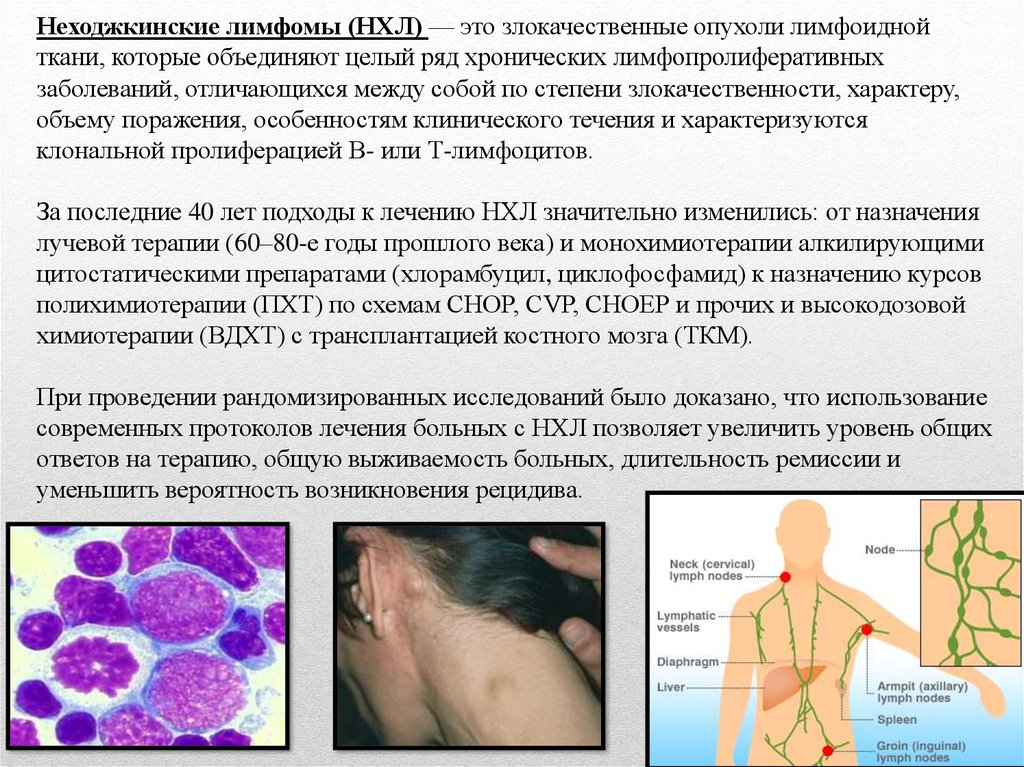
Неходжкинские лимфомы (НХЛ) — это злокачественные опухоли лимфоиднойткани, которые объединяют целый ряд хронических лимфопролиферативных
заболеваний, отличающихся между собой по степени злокачественности, характеру,
объему поражения, особенностям клинического течения и характеризуются
клональной пролиферацией В- или Т-лимфоцитов.
За последние 40 лет подходы к лечению НХЛ значительно изменились: от назначения
лучевой терапии (60–80-е годы прошлого века) и монохимиотерапии алкилирующими
цитостатическими препаратами (хлорамбуцил, циклофосфамид) к назначению курсов
полихимиотерапии (ПХТ) по схемам CHOP, CVP, СНОЕР и прочих и высокодозовой
химиотерапии (ВДХТ) с трансплантацией костного мозга (ТКМ).
При проведении рандомизированных исследований было доказано, что использование
современных протоколов лечения больных с НХЛ позволяет увеличить уровень общих
ответов на терапию, общую выживаемость больных, длительность ремиссии и
уменьшить вероятность возникновения рецидива.
4.
• Одним из современных достижений онкологии является применениелечебных моноклональных антител (МКАТ) в терапии НХЛ. Они воздействуют на
клетки-мишени, которые несут определенные антигены, и практически не
оказывают воздействия на другие клетки, органы и ткани.
• Одним из первых препаратов группы МКАТ, одобренных для лечения НХЛ, стал
препарат ритуксимаб.
• Препарат применяется в медицине с 1997 года для лечения В–клеточных
неходжскинских лимфом, а в последние годы – широкого круга аутоиммунных
заболеваний.
5.
История создания препарата• Ритуксимаб был разработан IDEC Pharmaceuticals под названием IDEC-С2В8.
• Патент США был выдан в 1998 году. На основе клинических испытаний по
безопасности и эффективности препарата, в 1997 году Ритуксимаб был одобрен
FDA США для лечения В-клеточной неходжкинской лимфомы, устойчивой к
другим режимам химиотерапии.
• Ритуксимаб в сочетании с химиотерапией CHOP (циклофосфамид,
гидроксидаунорубицин, онковин, винкристин, преднизолон), превосходит
CHOP в лечении диффузной лимфомы В-клеток и многих других В-клеточных
лимфом.
• В 2010 году препарат был одобрен Европейской Комиссией для
поддерживающего лечения после первоначального лечения фолликулярной
лимфомы.
• Ритуксимаб в настоящее время совместно выпускается на рынок компаниями
Biogen Idec и Genentech в США, Hoffmann-La Roche в Канаде и Европейском
союзе, Chugai Pharmaceuticals, Zenyaku Kogyo в Японии и AryoGen в Иране.
6.
7.
Ритуксимаб-Rituximabum (род. Rituximabi)Ритуксимаб (торговые названия Ритуксан, Мабтера и Zytux) представляет собой
химерное моноклональное антитело против белка CD20, который располагается на
поверхности В-клеток иммунной системы (малигнизированных и нормальных).
Ритуксимаб разрушает В-клетки и поэтому используется для лечения заболеваний,
которые характеризуются избыточным количеством В-клеток, гиперактивных В-клеток,
или дисфункциональных В-клеток, в том числе лимфомы, лейкозы, отторжения
трансплантата и аутоиммунные расстройства.
• Фармакологическая группа:
Противоопухолевый
иммуномодулирующий препарат.
Моноклональные антитела
8.
Торговое описание препарата• Прозрачная или слегка
опалесцирующая, бесцветная или
светло-желтого цвета жидкость.
• Применение: внутривенное
вливание, подкожное введение (с
2014 г.)
• Биодоступность 100%
(внутривенно)
• Период полураспада: от 30 до 400
часов (в зависимости от дозы и
продолжительности лечения)
• Экскреция: неопределенная: может
пройти фагоцитоз и катаболизм в
ретикулоэндотелиальной системе
9.
Физико-химическая характеристика препарата• Химерные антитела вырабатываются культурой суспензии
клеток млекопитающих (яичниками китайского хомяка)
и очищаются с помощью аффинной хроматографии
и ионообмена с применением особых процедур инактивации
и удаления вирусов.
• По структуре ритуксимаб относится к иммуноглобулинам
класса G1 (IgG1 каппа), его молекула содержит мышиные
вариабельные фрагменты легких и тяжелых цепей и
человеческий постоянный сегмент.
• Ритуксимаб состоит из 2 тяжелых цепей из 451 аминокислот
и 2 легких цепей из 213 аминокислот и имеет молекулярную
массу примерно 145 кД.
• Ритуксимаб имеет специфичность к CD20 антигену.
Аффинность ритуксимаба к CD20 антигену примерно 8 нМ.
10.
Характеристика CD20-АГCD20 — поверхностный антиген, который экспрессируется более чем на 90%
лимфоцитов, не исчезает и не трансформируется на неопластических клетках.
• Этот антиген является негликозилированным мембранным белком В-лимфоцитов с
молекулярной массой 35 кДа, участвующим во внутриклеточной передаче сигнала,
дифференцировании В-лимфоцитов и мобилизации кальциевых каналов.
• Этот антиген появляется как ранний маркер дифференцирования В-клеточной
линии и экспрессируется с разной антигенной плотностью как на нормальных, так
и на злокачественных популяциях В-лимфоцитов.
• Антитела против CD20-антигена были получены для применения как в
исследовательской работе, так и в практике терапии В-клеточных лимфом.
11.
Выбор CD20 молекулы в качестве мишени для моноклональных антител связан сособенностями дифференцировки В–клеток, которые в процессе созревания от
стволовых клеток в плазматические клетки проходят несколько последовательных
стадий, для каждой из которых характерна экспрессия определенных мембранных
молекул. Экспрессия CD20 наблюдается на мембране «ранних» и зрелых В–
лимфоцитов, но не стволовых, «ранних» пре–В, дендритных и плазматических клеток.
Поэтому их истощение не отменяет регенерацию пула В–лимфоцитов и не влияет на
синтез иммуноглобулинов плазматическими клетками.
• Кроме того, CD20 не высвобождается с
мембраны В–лимфоцитов в кровяное русло
и поэтому не блокирует взаимодействие
ритуксимаба с В–клетками, что
увеличивает эффективность терапии.
• Полагают, что способность ритуксимаба
элиминировать В–клетки реализуется за счет
нескольких механизмов, в том числе
комплемент–зависимой и антитело–
зависимой клеточной цитотоксичности, а
также индукции апоптоза
12.
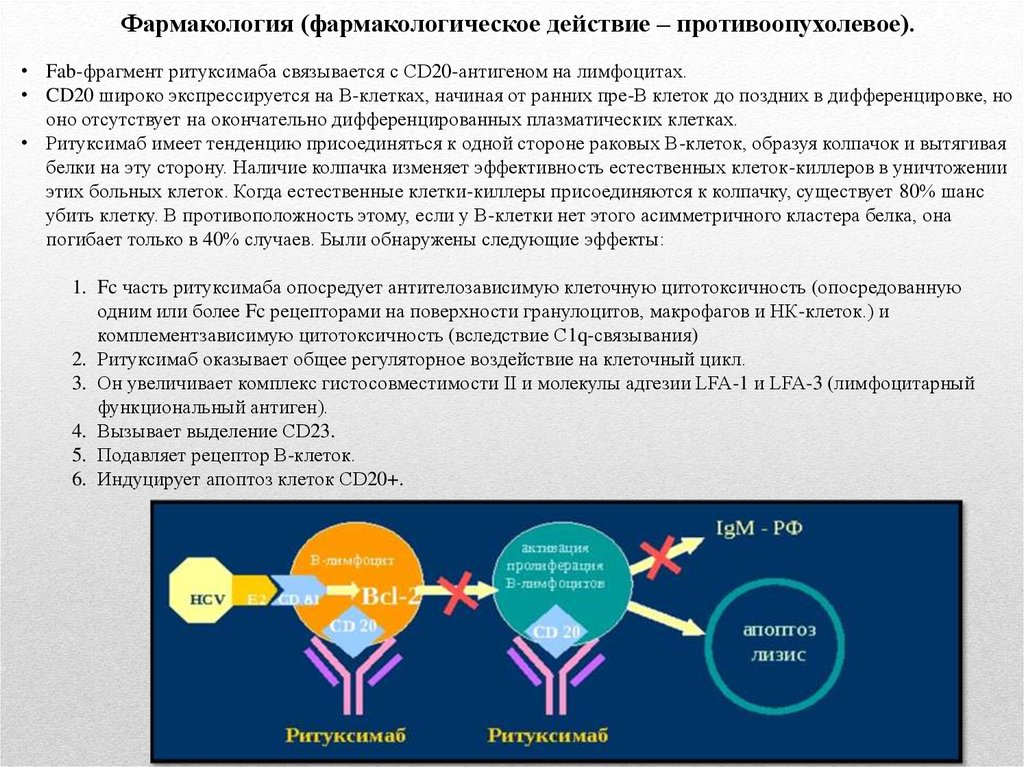
Фармакология (фармакологическое действие – противоопухолевое).• Fab-фрагмент ритуксимаба связывается с CD20-антигеном на лимфоцитах.
• CD20 широко экспрессируется на В-клетках, начиная от ранних пре-В клеток до поздних в дифференцировке, но
оно отсутствует на окончательно дифференцированных плазматических клетках.
• Ритуксимаб имеет тенденцию присоединяться к одной стороне раковых В-клеток, образуя колпачок и вытягивая
белки на эту сторону. Наличие колпачка изменяет эффективность естественных клеток-киллеров в уничтожении
этих больных клеток. Когда естественные клетки-киллеры присоединяются к колпачку, существует 80% шанс
убить клетку. В противоположность этому, если у В-клетки нет этого асимметричного кластера белка, она
погибает только в 40% случаев. Были обнаружены следующие эффекты:
1. Fc часть ритуксимаба опосредует антителозависимую клеточную цитотоксичность (опосредованную
одним или более Fc рецепторами на поверхности гранулоцитов, макрофагов и НК-клеток.) и
комплементзависимую цитотоксичность (вследствие C1q-связывания)
2. Ритуксимаб оказывает общее регуляторное воздействие на клеточный цикл.
3. Он увеличивает комплекс гистосовместимости II и молекулы адгезии LFA-1 и LFA-3 (лимфоцитарный
функциональный антиген).
4. Вызывает выделение CD23.
5. Подавляет рецептор В-клеток.
6. Индуцирует апоптоз клеток CD20+.
13.
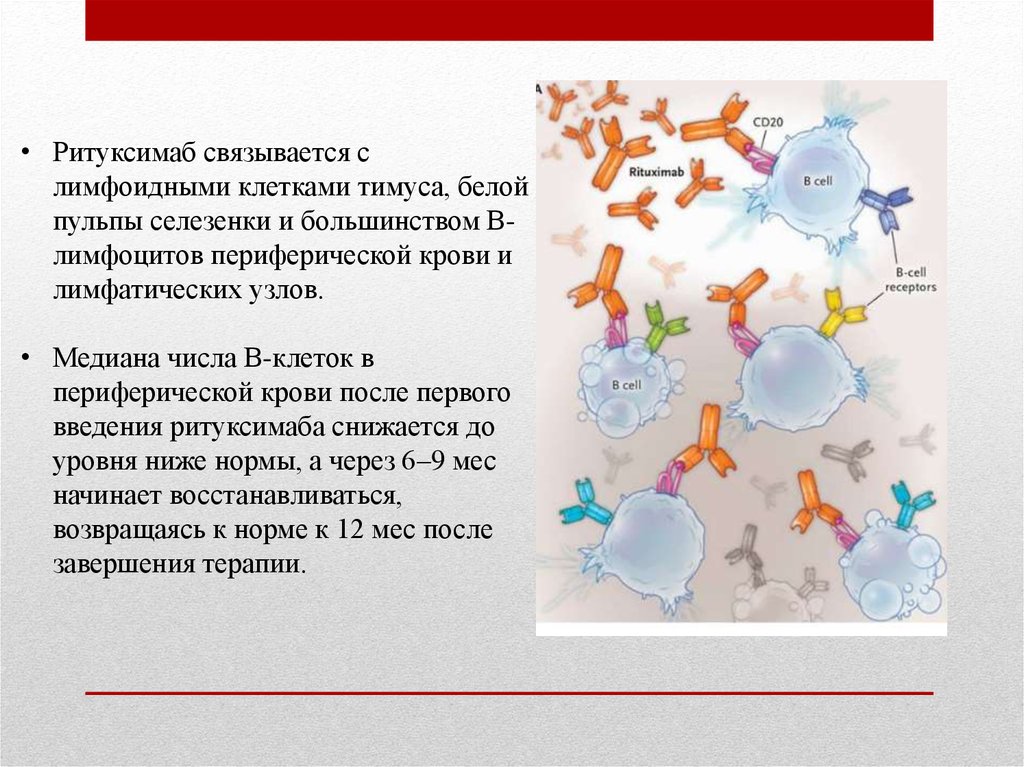
• Ритуксимаб связывается слимфоидными клетками тимуса, белой
пульпы селезенки и большинством Влимфоцитов периферической крови и
лимфатических узлов.
• Медиана числа B-клеток в
периферической крови после первого
введения ритуксимаба снижается до
уровня ниже нормы, а через 6–9 мес
начинает восстанавливаться,
возвращаясь к норме к 12 мес после
завершения терапии.
14.
Показания к применению препарата1. Неходжкинская лимфома:
— рецидивирующая или химиоустойчивая В-клеточная, CD20-положительная
неходжкинская лимфома низкой степени злокачественности или фолликулярная;
— фолликулярная лимфома III-IV стадии в комбинации с химиотерапией у ранее
нелеченных пациентов;
— фолликулярная лимфома в качестве поддерживающей терапии после ответа на
индукционную терапию;
— CD20-положительная диффузная В-крупноклеточная неходжкинская лимфома в
комбинации с химиотерапией по схеме CHOP.
2. Хронический лимфолейкоз:
— хронический лимфолейкоз в комбинации с химиотерапией у пациентов, ранее не
получавших стандартную терапию;
— рецидивирующий или химиоустойчивый хронический лимфолейкоз в комбинации с
химиотерапией.
15.
3. Ревматоидный артрит:— среднетяжелый и тяжелый ревматоидный артрит (активная форма) у
взрослых в комбинации с метотрексатом при непереносимости или
неадекватном ответе на текущие режимы терапии, включающие один или
более ингибиторов ФНОα, в т.ч. для торможения рентгенологически
доказанной деструкции суставов.
4. Гранулематоз с полиангиитом (гранулематоз Вегенера) и
микроскопический полиангиит
— тяжелые формы активного гранулематоза с полиангиитом
(гранулематоза Вегенера) и микроскопического полиангиита в комбинации
с ГКС.
Число В-клеток в периферической крови после первого введения препарата снижается
ниже нормы и начинает восстанавливаться у пациентов с гематологическими
злокачественными заболеваниями через 6 месяцев, достигая нормальных значений через
9-12 месяцев после завершения терапии.
16.
Побочные действия препаратаФатальные инфузионные реакции. Имеются сообщения о летальных исходах в течение
24 ч после инфузии ритуксимаба. Эти летальные случаи были следствием развития
комплекса инфузионных реакций, включая гипоксию, инфильтрацию легких, острый
респираторный дистресс-синдром, инфаркт миокарда, фибрилляцию желудочков или
кардиогенный шок. Примерно 80% фатальных инфузионных реакций наблюдались в
течение первой инфузии
Инфузионные реакции. У большинства в ходе первой инфузии в пределах 30–120 мин.,
исчезают после замедления или прерывания введения препарата и проведения
поддерживающих мероприятий в т.ч. в/в введений физиологического раствора,
дифенгидрамина и парацетамола: лихорадка и озноб/дрожь, тошнота, зуд,
ангионевротический отек, астения, гипотензия, головная боль, бронхоспазм, раздражение
в горле, ринит, крапивница, сыпь, рвота, миалгия, головокружение, гипертензия.
Инфекционные осложнения. Истощению пула B-клеток и уменьшению уровней
иммуноглобулинов в сыворотке.
17.
Реакции со стороны слизистых оболочек и кожи . Эти реакции включаютпаранеопластическую, синдром Стивенса-Джонсона, лихеноидный дерматит, везикулезнобуллезный дерматит, токсический эпидермальный некролиз. Начало проявления этих
реакций в отмеченных случаях варьировало от 1 до 13 нед после введения ритуксимаба.
Осложнения со стороны почек. Введение ритуксимаба иногда сопровождалось тяжелой
почечной токсичностью, включая ОПН. Частота развития почечной токсичности была
выше у больных с большим числом циркулирующих злокачественных лимфоцитов и при
высокой опухолевой нагрузке, а также у пациентов, которым при проведении клинических
испытаний одновременно назначали цисплатин.
Синдром лизиса опухоли. Ритуксимаб вызывает быстрый лизис доброкачественных и
злокачественных CD20-положительных клеток. Описано появление симптомов,
характерных для синдрома лизиса опухоли (острая почечная недостаточность,
гиперкалиемия, гипокальциемия, гиперурикемия, гиперфосфатемия), в течение 12–24 ч
после первой инфузии ритуксимаба.
18.
Сердечно-сосудистые нежелательные явления. Сердечно-сосудистые реакции 3-й и 4-йстепени тяжести включают гипотензию. Описаны редкие, фатальные случаи сердечной
недостаточности с развитием симптоматики спустя недели после начала лечения
ритуксимабом.
Легочная симптоматика. Усиление кашля, ринит, бронхоспазм, диспноэ, синусит.
Реактивация гепатита В. Сообщалось о реактивации вируса гепатита В с развитием
фульминантного гепатита, печеночной недостаточности и смерти у нескольких пациентов
с гематологической злокачественностью, получавших терапию ритуксимабом.
Иммунные/аутоиммунные нежелательные реакции. Сообщалось о таких реакциях, как
увеит, зрительный неврит у пациентов с системным васкулитом, плеврит у пациентов с
волчаночноподобным синдромом, сывороточная болезнь с полиартикулярным артритом и
васкулит с сыпью.
Менее общие наблюдавшиеся побочные эффекты (1-5 %). Ажитация, анорексия, артрит,
конъюнктивит, депрессия, диспепсия, эдема, гиперкинезия, гипертензия, гипестезия,
гипогликемия, боль в месте инъекции, инсомния, нарушение слезоотделения, недомогание,
раздражительность, неврит, нейропатия, парестезия, сонливость, вертиго, понижение
массы тела.
19.
Противопоказания к применению препарата1. гиперчувствительность к ритуксимабу, любому компоненту препарата
или белкам мыши;
2. острые инфекционные заболевания;
3. выраженный первичный или вторичный иммунодефицит;
4. тяжелая сердечная недостаточность (IV класс по классификации
NYHA) при ревматоидном артрите;
5. детский и подростковый возраст до 18 лет (эффективность и
безопасность не установлены);
6. беременность;
7. период грудного вскармливания;
Ограничения к применению:
Высокая опухолевая нагрузка (размеры очагов более 10 см), опухолевая инфильтрация
легких, легочная недостаточность в анамнезе, сердечно-сосудистые заболевания
(стенокардия, аритмия), нейтропения (менее 1500 клеток/мкл), тромбоцитопения (менее
75000 клеток/мкл), детский возраст (безопасность и эффективность применения у детей
не установлены).
20.
Правила приготовления и хранения раствораНеобходимое количество препарата набирают в асептических условиях и разводят до расчетной
концентрации (1-4 мг/мл) в инфузионном флаконе (пакете) с 0.9% раствором натрия хлорида
для инфузий или 5% раствором декстрозы (растворы должны быть стерильными и
апирогенными).
Т.к. препарат не содержит консервантов, приготовленный раствор необходимо использовать
немедленно.
Приготовленный инфузионный раствор физически и химически стабилен в течение 12 ч при
комнатной температуре или в течение не более 24 ч при температуре от 2° до 8°С.
Препарат вводят только в/в капельно, через отдельный катетер! Вводить препарат в/в струйно
или болюсно нельзя!
Рекомендуемая начальная скорость первой инфузии 50 мг/ч, в дальнейшем ее можно
увеличивать на 50 мг/ч каждые 30 мин, доводя до максимальной скорости 400 мг/ч.
Последующие инфузии можно начинать со скорости 100 мг/ч и увеличивать ее на 100 мг/ч
каждые 30 мин до максимальной скорости 400 мг/ч.
Коррекция дозы в ходе терапии
Снижать дозу ритуксимаба не рекомендуется. Если препарат вводится в комбинации с
химиотерапией, снижение дозы химиотерапевтических препаратов проводят в соответствии со
стандартными рекомендациями.
21.
Стандартный режим дозированияНеходжкинская лимфома низкой степени злокачественности или фолликулярная
Перед каждой инфузией препарата Мабтера необходимо проводить премедикацию
(анальгетик/антипиретик, например, парацетамол; антигистаминный препарат, например,
дифенгидрамин).
Если Мабтера применяется не в комбинации с химиотерапией, содержащей ГКС, то в состав
премедикации также входят ГКС.
Первоначальная терапия:
Монотерапия взрослых больных: 375 мг/м2 1 раз в неделю, в течение 4 недель.
В комбинации с химиотерапией по любой схеме: 375 мг/м2 в первый день цикла химиотерапии
после в/в введения ГКС в качестве компонента терапии, в течение:
— 8 циклов (цикл: 21 день) при схеме R-CVP (ритуксимаб, циклофосфамид, винкристин,
преднизолон);
— 8 циклов (цикл: 28 дней) при схеме R-MCP (ритуксимаб, митоксантрон, хлорамбуцил,
преднизолон);
— 8 циклов (цикл: 21 день) при схеме R-CHOP (ритуксимаб, циклофосфамид, доксорубицин,
винкристин, преднизолон); в случае достижения полной ремиссии после 4 цикла возможно
ограничиться 6 циклами;
— 6 циклов (цикл: 21 день) при схеме R-CHVP-Interferon (ритуксимаб, циклофосфамид,
доксорубицин, тенипозид, преднизолон+интерферон).
22.
Повторное применение в случае рецидива (у пациентов,ответивших на первый курс терапии): 375 мг/м2 1 раз в неделю, в
течение 4 недель.
Поддерживающая терапия (после ответа на индукционную
терапию):
— у ранее нелеченных пациентов: 375 мг/м2 1 раз в 2 месяца, не
более 2 лет (12 инфузий). При появлении признаков
прогрессирования заболевания терапию препаратом Мабтера следует
прекратить;
— при рецидивирующей или химиоустойчивой лимфоме: 375 мг/м2
1 раз в 3 месяца, не более 2 лет. При появлении признаков
прогрессирования заболевания терапию препаратом Мабтера следует
прекратить.
23.
Стандартный режим дозированияДиффузная В-крупноклеточная неходжкинская лимфома
• Перед каждой инфузией препарата Мабтера необходимо проводить
премедикацию (анальгетик/антипиретик, например, парацетамол;
антигистаминный препарат, например, дифенгидрамин).
• Если Мабтера применяется не в комбинации с химиотерапией,
содержащей ГКС, то в состав премедикации также входят ГКС.
• В комбинации с химиотерапией по схеме CHOP: 375 мг/м2 в первый день
каждого цикла химиотерапии после в/в введения ГКС, 8 циклов.
• Другие компоненты схемы CHOP (циклофосфамид, доксорубицин и
винкристин) вводят после назначения препарата Мабтера.
24.
Клинические исследованияВ исследования были включены больные (N=296) c рецидивирующей или резистентной к терапии
B-клеточной НХЛ низкой степени злокачественности.
Режимы дозирования были различными: больные получали ритуксимаб в дозе 375 мг/м2 в виде
в/в инфузий, проводимых с интервалом в одну неделю — 4 инфузии (N=166), либо 8 (N=37).
Клинически эти исследования также различались, как первоначальное лечение, первоначальное
лечение при большой опухолевой массе, повторное лечение.
Начальная терапия, 4 еженедельных введения.
Суммарная частота ремиссии составила 48%, полной ремиссии — 6%, частичной ремиссии —
42%. Медиана времени до начала ответа на терапию была 50 дней и медиана времени до
прогрессирования заболевания у больных, отвечающих на терапию, равнялась 11,2 мес. Связанные
с заболеванием признаки и симптомы (включая В-симптомы) присутствовали у 23% (39/166)
пациентов в начале исследования и исчезали у 64% (25/39) из этих пациентов.
Начальная терапия, 8 еженедельных введений.
суммарная частота ремиссии составила 57%, полной ремиссии — 14%, частичной ремиссии —
43%, медиана времени до прогрессирования заболевания у больных, отвечающих на терапию —
13,4 мес.
25.
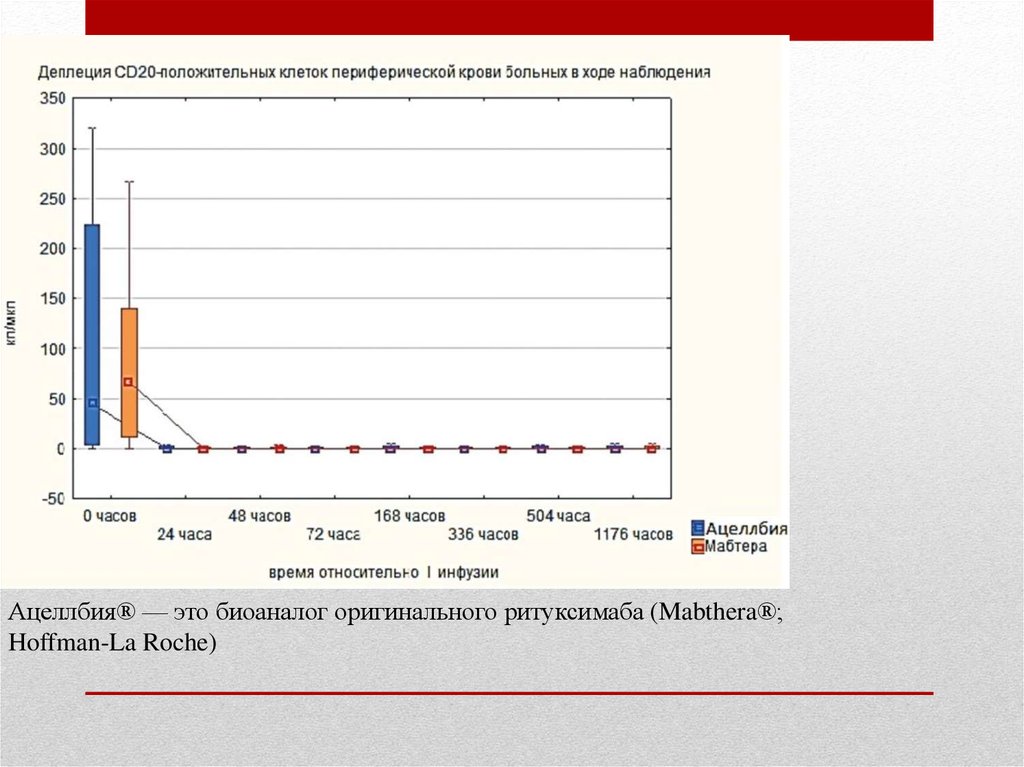
Ацеллбия® — это биоаналог оригинального ритуксимаба (Mabthera®;Hoffman-La Roche)
26.
27.
Спасибо за внимание !28.
https://druginfo.nlm.nih.gov/drugportal/name/Rituximab
https://toxnet.nlm.nih.gov/
https://www.ncbi.nlm.nih.gov/
https://www.pubmedhealth/
29.
Что делает Ритуксимаб? (пенсильвания)Это моноклональное антитело против молекулы CD20, расположенной на мембране В-лимфоцитов.
Ритуксимаб связывается с В-лимфоцитами и убивает их. Однако, при этом гибнут не только
аутореактивные лимфоциты, но и хорошие тоже. И получается, что препарат подавляет в организме
весь В-клеточный иммунитет.
А как сделать так, чтобы вырубить только ауто-реактивные лимфоциты, а нормальные не трогать?
До сих пор решения этой проблемы не было. Но скоро может появиться…chimeric antigen receptor
Вкратце, суть метода в том, что исследователь берет цитотоксический Т-лимфоцит и заменяет его
природный Т-клеточный рецептор на другую конструкцию, например так: то, что внутри Тлимфоцита – будет от Т-клеточного рецептора, а то, что снаружи – от моноклонального антитела
против определенной мишени.
Что это дает? Это позволяет «натравить» Т-лимфоцит на нативный антиген (представленный без
комплекса МНС), например, на рецептор В-лимфоцита специфичный против ауто-антигена.
Антитело – это растворимая форма В-клеточного рецептора, расположенного на мембране Вклетки. Если ты помнишь – каждый зрелый В- и Т-лимфоцит имеет рецепторы и способен
продуцировать антитела только против одной конкретной мишени. Например, против Dsg3. Значит,
чтобы победить болезнь – не нужно вырубать все В-лимфоциты, нужно убить только те, что несут
на своей мембране В-клеточный рецептор против Dsg3.
30.
Исследователи взяли цитотоксический Т-лимфоцит и создали конструкцию CAR-T,в которой внешняя часть бывшего Т-клеточного рецептора была заменена на
молекулу Dsg3, а внутренняя была изменена так, чтобы усилить цитотоксические
способности.
Что получилось? Получился Т-лимфоцит-убийца, который подманивает аутореактивный В-лимфоцит как будто бы молекулой Dsg3.
В-лимфоцит своими рецепторами против Dsg3 связывается с химерической
конструкцией измененного цитотоксического Т-лимфоцита, и далее Т-лимфоцит
делает то, для чего он предназначен – убивает В-лимфоцит.
*Ритуксимаб (Мабтера) 100 мг цена
1 упаковка- 890 евро
31.
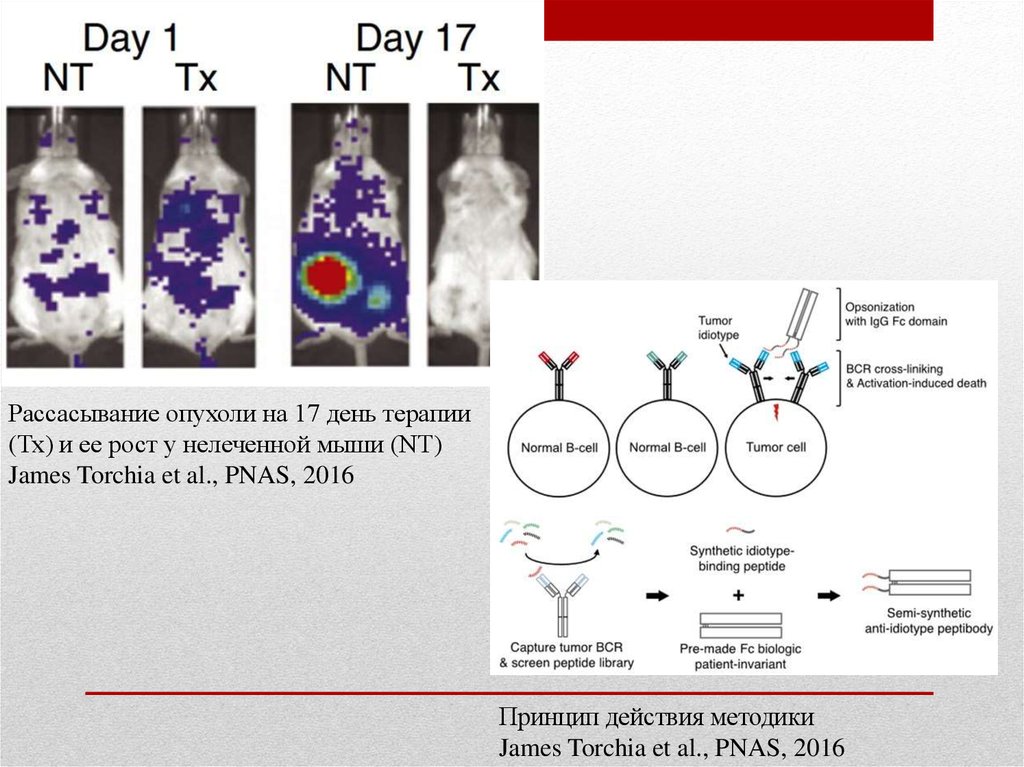
Персонализированная терапия излечила рак крови у мышейАмериканские ученые разработали новый метод прицельной персонализированной
терапии В-клеточных лимфом. Результаты их работы опубликованы в Proceedings of the
National Academy of Sciences.
Сотрудники Стэнфордского университета выбрали в качестве мишени для терапии
вариабельный участок В-клеточного рецептора, известный как идиотип. Он
высокоспецифичен для клеток опухоли и отличается от здоровых В-лимфоцитов. В то же
время, идиотип опухолевых клеток индивидуален для конкретного пациента, что делает
применение готовых моноклональных антител непрактичным.
Исследователи предложили определять структуру идиотипа у каждого пациента. Затем в
существующих библиотеках подбирается небольшой пептид со сродством к этому
идиотипу, который синтезируют химически. В это время у пациента забирают антитела и
отделяют от них неизменяемые фрагменты, способные к кристаллизации (Fc).
Синтезированный пептид химически связывают с Fc, получая высокоспецифическое в
отношении конкретной опухоли полусинтетическое пептидное антитело (peptibody).
32.
В ходе эксперимента in vitro пептидные антитела в течение 24 часов активировали вопухолевых клетках фермент апоптоза каспазу-3, что приводило к их гибели. Кроме
того, полусинтетические молекулы активировали фагоцитоз клеток опухоли
макрофагами, причем делали это более сильно и специфично, чем моноклональные
антитела к конкретному идиотипу и препарат ритуксимаб (моноклональное антитело к
В-лимфоцитарному антигену CD20).
Эксперимент на иммунодефицитных мышах с пересаженной человеческой лимфомой
показал, что период полувыведения пептидных антител из плазмы крови составляет
около 24 часов. Их четырехкратное введение с интервалом в сутки привело к полному
рассасыванию опухолей у всех животных, получивших терапию, при этом у мышей из
контрольной группы наблюдался интенсивный рост новообразований.
«Пептидные антитела втрое меньше обычных антител по молекулярной массе, что
обеспечивает их лучшее проникновение в ткани; они позволяют одной молекуле
содержать более двух антигенсвязывающих участков, что повышает авидность к
мишени», — пишут исследователи.
33.
Рассасывание опухоли на 17 день терапии(Тх) и ее рост у нелеченной мыши (NT)
James Torchia et al., PNAS, 2016
Принцип действия методики
James Torchia et al., PNAS, 2016
























 medicine
medicine